- Spätere Therapielinien bei Tumoren des Kopf-Hals-Bereichs
Trotz intensiver multimodaler Therapie kommt es bei ca. 30% der Patienten mit lokal fortgeschrittenen Plattenepithelkarzinomen des Kopf-Hals-Bereichs (LAHNSCC) zu Lokalrezidiven oder Fernmetastasierung (r/m HNSCC). In einigen Fällen besteht die Möglichkeit, die Patienten mit einer Salvage-Operation oder Re-Bestrahlung nochmals in kurativer Intention zu behandeln. Die Mehrheit der Patienten befindet sich jedoch in einer Palliativsituation.
Malgré un traitement multimodal intensif, une récidive locale ou une métastase à distance (HNSCC r/m) survient chez environ 30% des patients atteints d’un carcinome épidermoïde de la tête et du cou (LAHNSCC) localement avancé. Dans certains cas, il est possible de traiter à nouveau les patients par une chirurgie de sauvetage ou une ré-irradiation à visée curative. Cependant, la majorité des patients sont en situation de soins palliatifs.
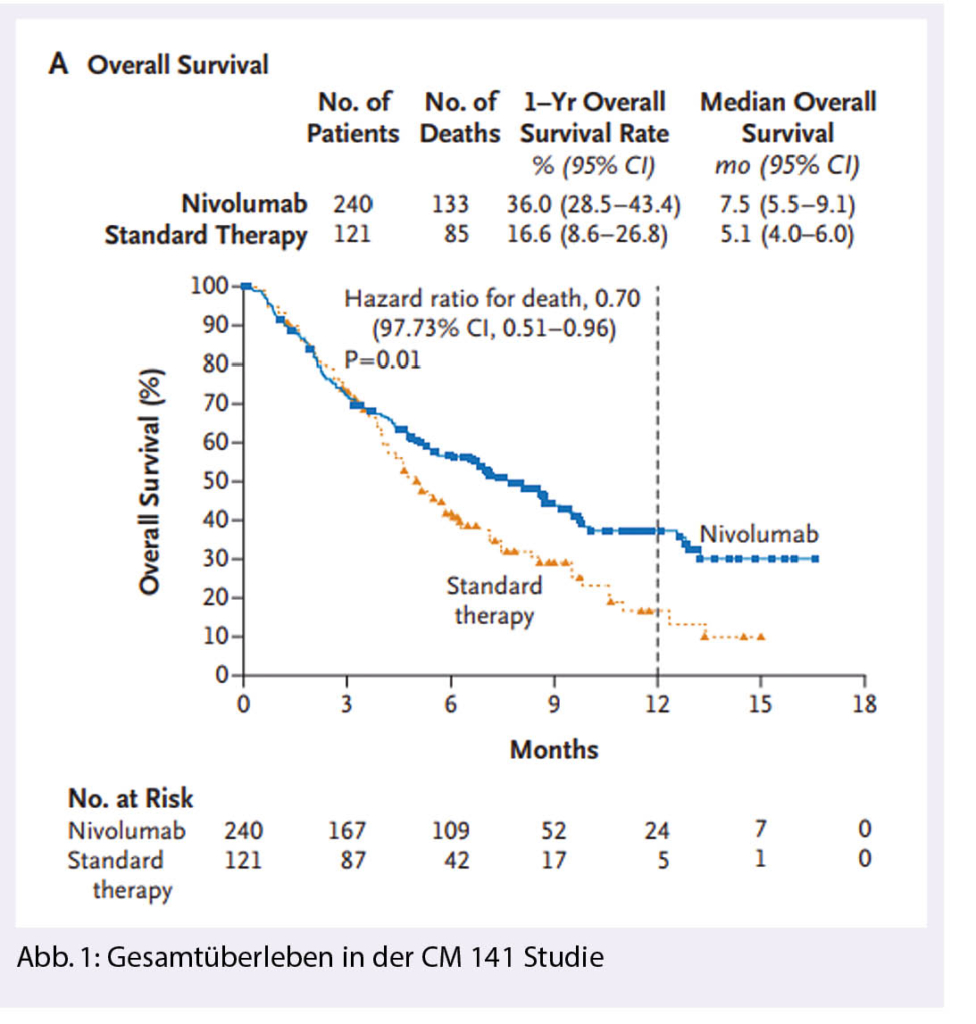
Die CHECKMATE 141 (CM 141) war die erste randomisierte Phase 3 Studie für Patienten mit r/m HNSCC und Progredienz innerhalb sechs Monate nach einer cisplatinhaltigen Erstlinien-Chemotherapie. Auch Patienten, welche innerhalb von 6 Monaten nach einer kurativ intendierten, cisplatinhaltigen Radiochemotherapie progredient waren, konnten eingeschlossen werden. Es handelte sich dabei um eine intensiv vorbehandelte Population. Die Patienten wurden im Verhältnis 2: 1 entweder in den Arm mit Nivolumab (3 mg/kg alle 2 Wochen) oder in den Standardarm (SOC) mit Docetaxel, Methotrexat oder Cetuximab nach Wahl des behandelnden Arztes randomisiert. Der primäre Endpunkt war das Gesamtüberleben (1).
Nivolumab-Arm (N) war im primären Endpunkt sowie in verschiedenen sekundären Endpunkten dem SoC Arm überlegen. Das mediane Überleben war im Nivolumab-Arm mit 7.5 Monaten höher als im Kontrollarm mit 5.1 Monaten, was bei einer hazard ratio (HR) von 0.70 (CI 0.51–0.96) und mit einem p-Wert von < 0.01 statistisch signifikant war. Das Gesamtüberleben nach einem Jahr war im N mehr als doppelt so hoch als im SoC (36% vs. 16.6%) (Abb. 1). Das Ansprechen war im N (13.3%) ebenfalls höher als im SoC (5.8%).
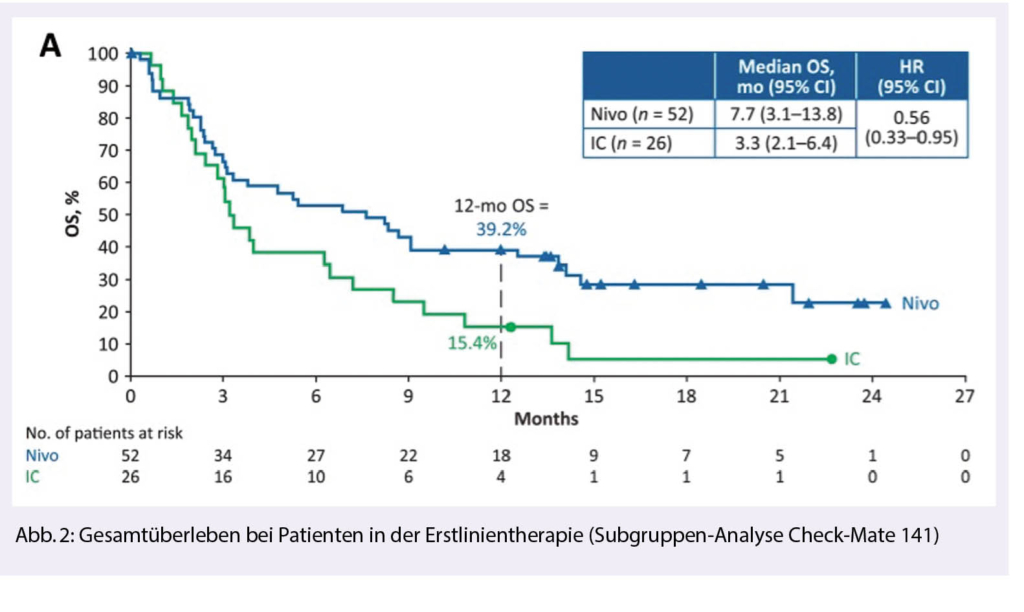
In Bezug auf das progressionsfreie Überleben bestand kein Unterschied zwischen den beiden Gruppen (2.0 vs. 2.3 Monate, HR 0.89 [CI 0.70-1.1], p 0.326). Die Patienten mit einer PD L-1 Expression von gleich oder mehr als 1% profitierten am meisten von einer Therapie mit Nivolumab. In dieser Gruppe betrug das mediane Überleben 8.7 Monate, verglichen mit 4.6 Monaten (HR 0.55, [95% CI, 0.36-0.83]) bei Patienten im Chemotherapie-Arm. Eine weitere Subgruppenanalyse zeigte, dass sowohl Patienten mit HPV-assoziierten als auch mit nicht HPV-assoziierten Tumoren von der Immuntherapie profitierten. In der späteren Subanalyse zeigte sich auch für die prognostisch sehr schlechte Population von Platin-resistenten Patienten eine Verbesserung des Gesamtüberlebens bei einer Therapie mit Nivolumab (2) (Abb. 2).
Aufgrund dieser Daten wurde Nivolumab im 2017 auch in der Schweiz als Therapie der Wahl für r/m HNSCC nach Progress nach einer platinhaltigen Therapie zugelassen. Zum Zeitpunkt der Zulassung war der Stellenwert von Checkpoint-Inhibitoren (CPI) in der Erstlinientherapie noch unbekannt, bzw. waren die entsprechenden Studien noch am Rekrutieren.
Seit der Publikation von Keynote 048-Studie im2019 und der Etablierung von Pembrolizumab als Monotherapie oder in Kombination mit der Chemotherapie in der Erstlinientherapie hat sich der Stellenwert von Nivolumab jedoch verändert (3). Nivolumab ist nun nur bei Patienten, die in der Erstlinientherapie Pembrolizumab nicht erhalten haben, eine Option. Das sind z.B. die Patienten mit einem CPS von < 1, bei denen es in der Erstlinientherapie kein Vorteil von P + C vs. E+C gibt und nach Extreme behandelt werden können. Die Patienten, die im Rahmen einer Studie im Standardarm Nach Extreme behandelt worden sind, gehören natürlich auch in diese Gruppe.
Keynote 040
Diese Phase 3 Studie hat ein ähnliches Design wie Checkmate141 gehabt (4). Die Patienten sind entweder in den Arm mit Pembrolizumab (P) oder in den Kontrollarm mit Therapie nach Wahl des behandelnden Arztes (SoC) randomisiert worden. Der primäre Endpunkt was das Gesamtüberleben. Im P Arm betrug das Überleben 8.4 und im SoC 6.9 Monate, was mit einer HR von 0.80 (95%, CI 0.65-0.98) und p = 0.061 signifikant war. Der Benefit war somit kleiner als in der Check Mate 141 Studie. Einer der Gründe dafür dürften die besseren Eigenschaften der Population in der Kontrollgruppe in KN040 sein. Im Vergleich zur Kontrollgruppe in der CM141 waren die Patienten in der KN040 weniger vorbehandelt und erhielten häufiger Docetaxel, welches als die wirksamste der drei Substanzen im SoC Arm gilt. Dazu erhielten mehr Patienten aus dem Kontrollarm der KN040 Studie in späteren Linien eine Therapie mit einem Checkpointinhibitor (CPI).
In der Patientengruppe mit CPS>50 zeigte sich jedoch eine deutliche Verbesserung des Gesamtüberlebens. Im P war das mediane Überleben 11.6 Monate (95%CI 8.3-19.5) und im SoC 6.6 (95% CI 4.8-9.2).
Swissmedic hat für Pembrolizumab bei platin-resistenten Patienten im Januar 2021 eine Zulassung für die Patienten mit einem CPS>50 erteilt. Bezüglich des Stellenwerts seit der Etablierung von CPI in der Erstlinie ist die Situation ähnlich wie bei Nivolumab jedoch mit zusätzlicher Einschränkung bzgl. des CPS.
Neben Nivolumab und Pembrolizumab sind bei platin-resistenten r/m HNSCC auch weitere Checkpoint-Inhibitoren untersucht worden. Der selektive anti-PD-L1 mAk Durvalumab ist in dieser Population in mehreren Studien geprüft worden.
HAWK war eine Phase 2 Studie für die Patienten mit einer PD-L1 Expression von > 25% (5). Der primäre Endpunkt war das Ansprechen. Sekundäre Endpunkte waren das Gesamtüberleben und das progressionsfreie Überleben. Die Patienten erhielten Durvalumab 10 mg/kg jede zweite Woche für maximal ein Jahr. Die Ansprechrate war 16.2% (95%CI: 9.9–24.4). Bei Patienten mit HPV assoziierten Tumoren waren die Ansprechraten mit 29.4% (95% CI, 15.1-47.5) höher als bei nicht HPV-assoziierten HNSCC (10.9%, 95% CI, 4.5-21.3). Das progressionsfreie Überleben war 2.1 Monate (95% CI: 1.9–3.7). Das mediane Überleben betrug 7.1 Monate (95% CI: 4.9–9.9).
CONDOR war eine randomisierte Phase 2 Studie für die Patienten mit platin-resistenten Rezidiven und tiefer PD-L1 Expression. Der primäre Endpunkt war auch hier das Ansprechen. Die Patienten sind in drei Arme im Verhältnis (2:1:1) randomisiert worden: Kombination von Durvalumab und dem anti-CTLA-4 Antikörper Tremelimumab (D + T); Durvalumab (D) Monotherapie und Tremelimumab Monotherapie (T). Im D + T Arm war die Dosis von Durvalumab 20 mg/kg und von Tremelimumab 1 mg/kg; verabreicht jede 4. Woche für 4 Zyklen. Danach erhielten die Patienten Durvalumab Monotherapie 10 mg/kg jede 2. Woche. Im D Arm war die Dosis 10 mg/kg. Im T Arm betrug die Dosis von Tremelimumab initial 10 mg/kg jede 4. Woche für insgesamt 7 Dosen, und danach jede 12. Woche für 2 Dosen.
Die Ansprechraten waren 7.8% im D + T Arm, 9.2% im D Arm und 1.6% im T Arm. Der primäre Endpunkt wurde somit nicht erreicht. Die Verträglichkeit war in allen drei Armen vergleichbar mit Grad 3–4 Toxizität vom 15.8%, 12.3% und 16.9% (6).
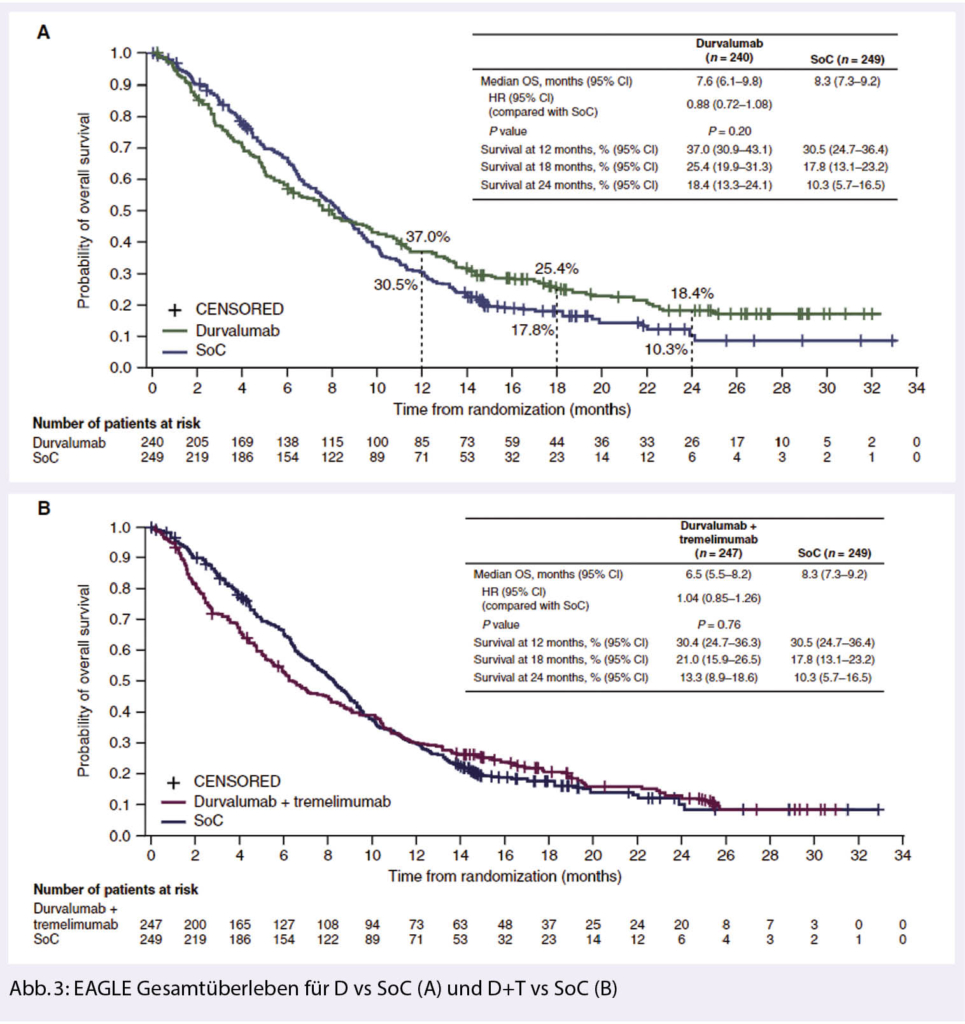
EAGLE war eine randomisierte Phase 3 Studie, die untersucht hat, ob eine Kombination von Durvalumab (D) und Tremelimumab (T) zu einer synergistischen Wirkung bei Patienten mit platin-vorbehandelten r/m HNSCC führt. Die Resultate dieser Phase 3 Studie sind vor kurzem publiziert worden (7). Insgesamt 736 Patienten wurden in drei Arme 1:1:1 randomisiert. In einem Arm erhielten die Patienten Durvalumab Monotherapie (10 mg/kg jede 2. Woche), im zweiten Arm Durvalumab in Kombination mit Tremelimumab (D 20 mg/kg und T 1mg/kg jede 4. Woche) und im Kontrollarm eine Monotherapie (Taxane, Methotrexat oder 5-FU). Primärer Endpunkt ist das Gesamtüberleben für D vs. SoC und für D+T vs. SoC.
Es zeigte sich kein statistisch signifikanter Unterschied im Gesamtüberleben weder für Durvalumab versus SoC (HR 0.88, 95%CI 0.72-1.08, p = 0.20) noch für die Kombination von D + T (HR 1.04 95%CI 0.85-1.26, p = 0.76) (Abb. 3).
Zusammenfassung: Therapieoptionen bei platin-resistenten r/m HNSCC
Seit der Etablierung von Pembrolizumab als Monotherapie oder Kombination mit Platin und 5FU in der Erstlinientherapie ist die Rolle von CPI in späteren Therapielinien eingeschränkt. Bei den Patienten, die in der Erstlinientherapie kein CPI erhielten, bleibt Nivolumab bei Progress Therapie der Wahl. Es kann sich z.B. um die Patienten handeln, die im Kontrollarm einer Studie behandelt worden sind; oder die Patienten mit Tumoren, die ein CPS< 1 haben und in der Erstlinie nach Extreme Schema behandelt werden. Bei CPI-naiven platinresistenen Patienten mit einem CPS> 50 ist neu in dieser Situation auch Pembrolizumab Monotherapie zugelassen.
Die Patienten, die während der kurativ intendierten Radiochemotherapie oder innerhalb von sechs Monate nach deren Abschluss ein Rezidiv erlitten haben, waren aus der KN 048 ausgeschlossen und haben in der CM141 von Nivolumab profitiert.
Somit besteht für die Patienten mit Progress nach Platin und CPI in der Erstlinientherapie für die späteren Therapielinien im Moment keine Standardbehandlung. Für die Patienten mit ECOG 0-1, die in der Erstlinie Pembrolizumab als Monotherapie erhalten haben, ist eine Behandlung nach Extreme Schema in der Zweitlinientherapie eine Option. Dazu kommen Taxane, 5FU, Capecitabine, Methotrexat, Cetuximab Monotherapie, Navelbine als Monosubstanzen oder Kombinationen in Frage.
Für sowohl platinsensitive wie auch platinresistente r/m HNSCC gilt jedoch, dass weitere Erkenntnisse bezüglich der prädiktiven Tumormarker dringend notwendig sind. Neben der Verlängerung des Überlebens ist eine Erhöhung des Ansprechens unbedingt nötig, um die Symptome, die bei diesen Patienten gravierend sein können, zu lindern und die Lebensqualität zu verbessern.
Klinische Studien und neue Therapieeinsätze bei platin-resistentem r/m HNSCC
SAKK 11/16 MVX-ONCO-1. In dieser Phase 2 Studie wird personalisierte Tumorvakzinierung bzw. zell-basierte, aktive Immuntherapie mit dem Medizinalprodukt MVX-ONCO-1 untersucht. Eine Metastase wird exzidiert, die Tumorzellen werden bestrahlt und anschliessend dem Patienten subkutan injiziert. Anschliessend werden die Kapseln (MVX-ONCO-1) mit genetisch modifizierten, GM-CSF-sezernierenden Zellen mehrmals subkutan platziert. Die immunmodulatorische Wirkung von GM-CSF stimuliert bzw. verstärkt die Immunantwort gegen die autologen bestrahlten Tumorzellen. Die Phase 1 Studie hat die Sicherheit der Methode geprüft und die Phase 2 Studie rekrutiert.
Die Kombination von Pembrolizumab und Lenvatinib bei verschiedenen Tumorentitäten wurde in einer Phase 1b/2 Basket-Studie mit insgesamt 137 Patienten untersucht. Davon waren 22 Patienten mit einem r/m HNSCC eingeschlossen. Andere Entitäten waren Nierenkarzinom, Endometriumkarzinom, Melanom, NSCLC und Urothelkarzinom.
Lenvatinib ist ein Multikinase-Inhibitor mit einer Wirkung auf vascular endothelial growth factor receptor (VEGFR). VEGF hat eine immunsuppressive Wirkung, welche durch die Stimulation von T-reg Lymphozyten und Verhinderung der Ausreifung von dendritischen Zellen erzielt wird. Die VGFR Inhibition durch Lenvatinib in Kombination mit Pembrolizumab soll zu einer verstärkten Tumorantwort führen. Von 22 Patienten mit HNSCC hat ein Patient eine komplette Remission erreicht, bei 9 Patienten zeigte sich ein partielles Ansprechen und bei 10 eine Krankheitsstabilisierung. Die häufigste Nebenwirkung war Hypothyroidismus (9).
Monalizumab ist ein first-in-class humanisierter IgG4 monokolonaler Antikörper, welcher NKG2A bindet. NKG2A ist auf den CD8+T-Zellen und NK Zellen exprimiert. Die Ergebnisse einer Phase Ib/II Studie mit Cetuximab in Kombination mit Monalizumab oder Placebo bei platin- und CPI-vorbehandelten Patienten sind am ESMO 2019 und am ASCO 2020 präsentiert worden. Die Ergebnisse zeigen die Ansprechraten von 27.5% und hohe Raten an klinischer Stabilisierung in der stark vorbehandelten Population. Medianes Überleben beträgt 8.5 Monate. Die Phase 3 Studie für die Patienten mit r/m HNSCC (Interlink-1) ist geplant (8, 10).
Eine Phase 1b/2a Studie mit der Kombination vom MEDIO457 mit Durvalumab bei HPV positiven r/m HNSCC wurde am ESMO2020 präsentiert. Es handelt sich um eine DNA Vakzine, welche aus drei Plasmiden, die HPV 16/18 Onkoproteine E6 und E7 exprimieren, besteht. Als molekulare Adjuvans fungiert IL-12. Im ersten Teil (run-in) wurden drei und in der anschliessender Kohorte 32 Patienten behandelt. Primäre Endpunkte waren Sicherheit und das objektive Ansprechen. Die häufigsten Nebenwirkungen waren Müdigkeit und Schmerzen an der Injektionsstelle. Das Ansprechen war 22%.
Seltene Tumore des Kopf-Hals-Bereichs
Nasopharynx-Ca (NPC)
Lokalisierte Stadien
Kurativ intendierte Standardtherapie des lokalisierten Nasopharynxkarzinoms (NPC) ist in frühen Stadien Radiotherapie und in lokal fortgeschrittenen Stadien (III und IVa) Radiochemotherapie mit Cisplatin 100 mg/m2 jede 3 Wochen. Der Stellenwert der neoadjuvanten Chemotherapie war lange unklar (11).
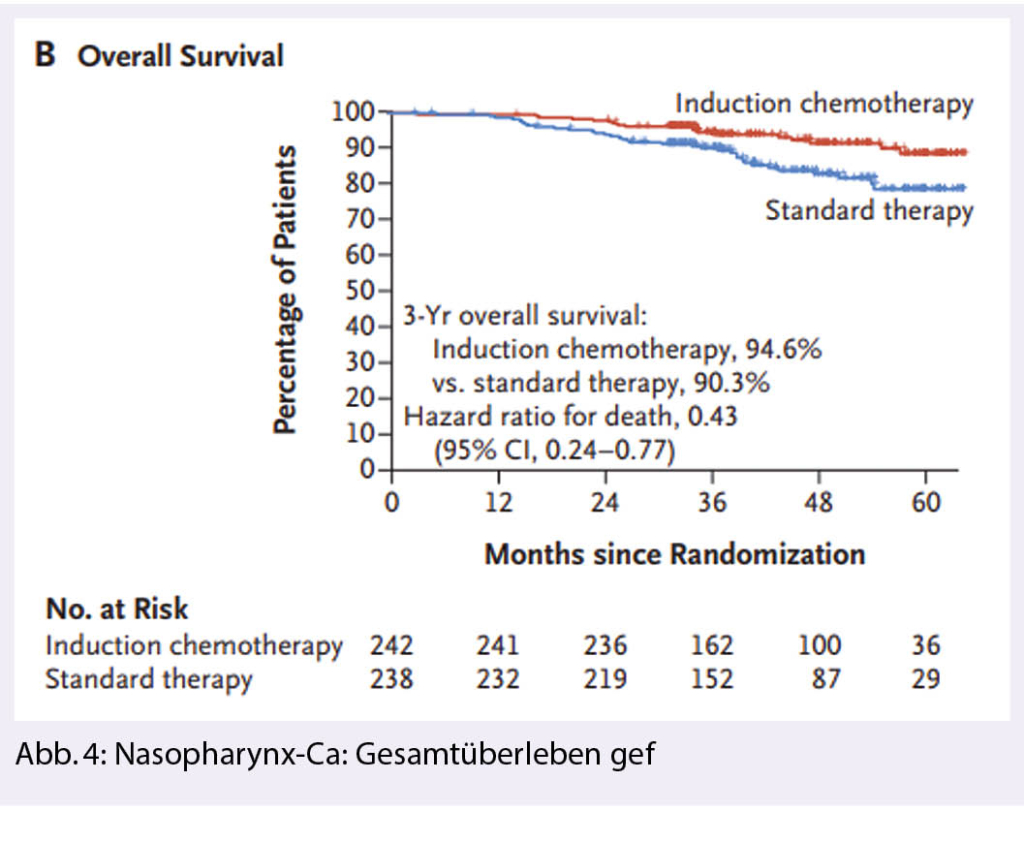
Die im Jahr 2020 publizierte Phase 3 Studie hat die Rolle der neoadjuvanten Chemotherapie als Teil der kurativ intendierten Behandlung von lokal fortgeschrittenen Stadien etabliert (12). Insgesamt480 Patienten mit lokal fortgeschrittenem NPC Stadium III und IVa wurden 1:1 randomisiert. Im Standardarm erhielten die Patienten eine Radiochemotherapie. Im Studienarm erhielten die Patienten vor der RCT zusätzlich drei Zyklen Induktionschemotherapie (IC) mit Cisplatin (80 mg/m2 d1) und Gemcitabine (1000 mg /m2 d1 + 8). Der primäre Endpunkt war rezidivfreies Überleben.
Im Studienarm haben 96.7% der Patienten die geplanten drei Induktionschemotherapiezyklen erhalten und 97.9% haben anschliessend konkomitierende RCT erhalten. Der Anteil von Patienten, die Cisplatindosis von mindestens 200 mg/m2 konkomitierend zu RT erhalten haben, war im IC Arm 79.9% und im Kontrollarm 95.8%.
Der Hauptendpunkt wurde erreicht. Die Resultate zeigten signifikante Verbesserung des rezidivfreien Überlebens (85.3% in IC vs. 76.5%; HR 0.51, 95%CI 0.34-0.77; p=0.001). Die objektive Ansprechrate nach 3 Zyklen IC war hoch (94.6%). Bei 13% der Patienten im Induktionsarm wurde Dosisreduktion vorgenommen, meistens aufgrund von hämatologischen Nebenwirkungen.
Nach drei Jahren waren 94.6 Patienten im Induktionsarm und 90.3 Patienten im Standardarm am Leben (HR 0.43 CI 0.24-0.77). Zu diesem Zeitpunkt waren 91.1% der Patienten im IC Arm und 84.4% im Kontrollarm am Leben ohne Fernmetastasen. Hingegen war der Anteil von Patienten, die nach drei Jahren am Leben und ohne Lokalrezidive waren, durch IC nicht verändert (91.8% vs. 91.0%) (Abb. 4).
Metastasiertes NPC
Bei metastasierendem NPC zeigte eine randomisierte Phase 3 Studie, dass das gleiche Schema (Cisplatin (80 mg/m2 d1 und Gemcitabine 1000 mg/m2 d1 und 8) einer Therapie mit Cisplatin und 5FU überlegen war (13). Der primäre Endpunkt, progressionsfreies Überleben, war im Cisplatin-Gemcitabine Arm signifikant länger als im Kontrollarm (7.0 Monate vs. 5.6 Monate, HR 0.55, CI 0.44-0.68, p < 0.0001) [You, 2020 #8024].
In der Zweitlinie werden Taxane, 5-FU, Capecitabine, Vinorelbine, Ifosfamid, Doxorubicin, Carboplatin, Oxaliplatin und Cetuximab eingesetzt, in Kombination oder als Monotherapie. Eine Standardtherapie existiert nicht. Immun-Checkpointinhibitoren zeigen in Basket-Studien versprechende Aktivität. Die Daten aus grösseren Studien werden erwartet.
Bei primär metastasiertem NPC verbessert RCT des Primärtumors zusätzlich zur palliativen Systemtherapie das Gesamtüberleben, wie eine randomisierte Phase 3 Studie zeigte. Die Patienten, bei welchen bereits bei der Diagnosestellung eines NPC Fernmetastasen vorhanden waren, wurden nach 3 Zyklen einer Chemotherapie mit Cisplatin und 5FU mit einer RCT behandelt. Der primäre Endpunkt, Verbesserung des Gesamtüberlebens, wurde erreicht. Nach 24 Monaten waren im Arm mit Chemotherapie/RCT
76.4% Patienten am Leben und im Arm ohne Radiotherapie 54.5%, was bei einem HR von 0.42 (95% CI, 0.23-0.77) und einem p = 0.004 signifikant war. Ebenfalls konnte das progressionsfreie Überleben verbessert werden (HR, 0.36; 95% CI, 0.23-0.57) (14).
Speicheldrüsenkarzinome
Systemtherapie hat in Behandlung von Speicheldrüsenkarzinomen eine Rolle vor allem in metastasierender Situation bzw. bei lokoregionären Rezidiven, die nicht mehr kurativ angegangen werden können. Die Chemotherapie hat eine limitierte Wirkung und längeres Ansprechen ist selten. Bei oligometastatischer Situation sollen Radiotherapie und Chirurgie im Rahmen von interdisziplinären Tumorboards diskutiert und eingesetzt werden.
Die gezielte Therapie hat einen Stellenwert vor allem bei Tumoren mit Her2-Amplifikation oder Überexpression, bzw. bei einer Expression von Androgenrezeptoren. Diese Eigenschaften sieht man am häufigsten in der Gruppe von Speichelgangkarzinomen (salivary duct cancer).
Bei Her2 exprimierenden Karzinomen zeigten die case reports bzw. kleine Serien bereits vor Jahren Wirksamkeit einer Therapie mit Trastuzumab als Monotherapie oder in Kombination mit Chemotherapie bei metastasierten Speicheldrüsekarzinomen.In den letzten Jahren wurden die Berichte publiziert, die Wirksamkeit von der dualen Her2-Blockade mit Trastuzumab und Pertuzumab bzw. deren Kombination mit Docetaxel gezeigt haben. Des Weiteren zeigten kleine Patientenserien die Wirksamkeit von Trastuzumab-Emtensine nach Progression unter Trastuzumab mit oder ohne Pertuzumab (15, 16, 17). Mehrere case reports haben ebenfalls das Ansprechen auf Androgenblokade gezeigt (18).
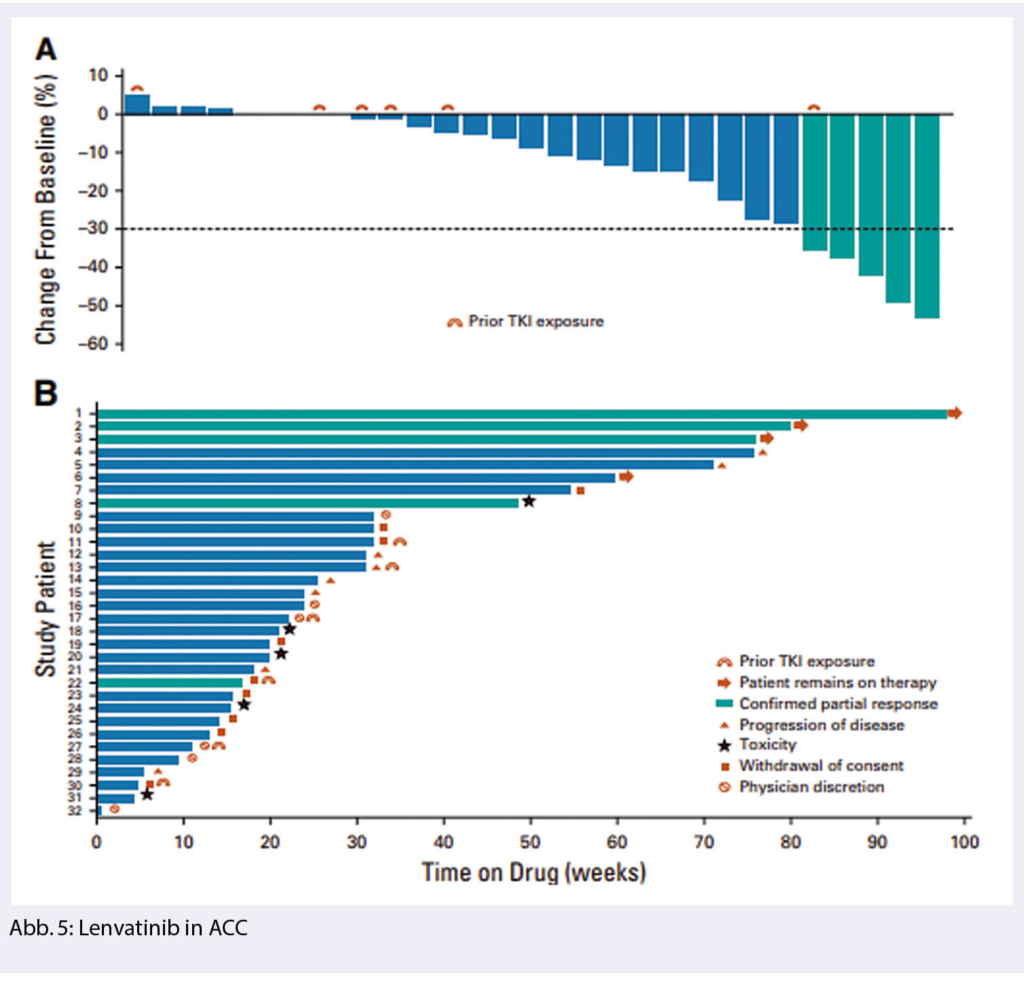
Adenoid-zystisches Karzinom (ACC) ist nach dem mukoepidermoid-Karzinom die zweithäufigste Gruppe und weist eine hohe Rate an Fernmetastasierung auf, die zum Teil spät (10-20 Jahre nach der Erstdiagnose) auftreten kann. Eine Standardtherapie in metastasierter Situation besteht nicht. Chemotherapie weist tiefe Ansprechraten auf. Resektion oder Radiotherapie der Lungenmetastasen wird häufig durchgeführt. Eine Phase 2 Studie mit Lenvatinib (24 mg po tgl.) bei 32 Patienten mit metastasiertem ACC und Progredienz nach mindestens einer Vortherapie zeigte ein partielles Ansprechen bei 5 Patienten (15.6%) und eine Krankheitsstabilisierung bei weiteren 24 Patienten (75%). Das mediane progressionsfreie Überleben war 17.5 Monate (19) (Abb. 5).
Eine weitere Studie bei mACC mit Axitinib vs. Placebo zeigte Verbesserung des progressionsfreien Überlebens, jedoch konnten auch Patienten, die nicht progredient waren, eingeschlossen werden, sodass die Daten schwierig zu interpretieren sind.
Sekretorisches Karzinom (mammary-analogue) (MASC) ist eine seltene Subgruppe von Speicheldrüsenkarzinomen bei welchen in praktisch allen Fällen eine ETV6 Translokation, meistens mit NTRK3, vorhanden ist. Für diese sehr seltene Krankheit bieten die NTRK Inhibitoren eine vielversprechende therapeutische Option. In der Studie im NEJM publizierten Studie mit verschiedenen Entitäten waren 11 Patienten mit MASC eingeschlossen. Zehn Patienten haben ein objektives Ansprechen gezeigt (20).
Copyright bei Aerzteverlag medinfo AG
Kantonsspital St. Gallen, Klinik für Hämatologie
und Onkologie und Brustzentrum
Rorschacherstrasse 95
9007 St. Gallen
Die Autorin deklariert Advisory board fees von BMS und MSD.
- Nach der Etablierung von Pembrolizumab in der Erstlinientherapie des r/m HNSCC besteht in den weiteren Therapielinien kein Standard. In Frage kommen Taxane, Platine, Navelbine, Methotrexat, Cetuximab und weitere Substanzen als Monotherapie oder in Kombination (zb nach Extreme-Schema). Kombinationen mit Cetuximab und Taxanen haben in der Schweiz keine Zulassung
- Bei lokal fortgeschrittenem Nasopharynx-Ca (Stadium III und IVa) ist neoadjuvante Chemotherapie mit drei Zyklen Cisplatin und Gemcitabine vor der definitiven Radiochemotherapie der Standard.
- In der Behandlung des r/m adenoid-zystischen Karzinoms (ACC) haben die Studien mit Lenvatinib bzw. mit Axitinib eine Wirkung gezeigt.
- Bei sekretorischem Karzinom (MASC), einer seltenen Subgruppe der Speicheldrüsekarzinome, sind im metastasierten Stadium NTRK Inhibitoren wirksam.
Messages à retenir
- Après la mise en place du pembrolizumab dans le traitement de première intention du HNSCC r/m, il n’existe plus de norme dans les autres lignes thérapeutiques. Les taxanes, le platine, le navelbine, le méthotrexate, le cétuximab et d’autres substances peuvent être utilisées en monothérapie ou en combinaison (par exemple selon le régime Extreme). Les combinaisons avec le cétuximab et les taxanes ne sont pas autorisées en Suisse.
- Dans le cas d’un cancer du nasopharynx localement avancé (stade III et IVa), la chimiothérapie néoadjuvante avec trois cycles de cisplatine et de gemcitabine avant la radiothérapie définitive est la norme.
- Dans le traitement du carcinome kystique adénoïde (CCA) r/m, des essais sur le lenvatinib et l’axitinib, respectivement, ont montré leur efficacité.
- Dans le carcinome sécrétoire (MASC), un rare sous-groupe de carcinomes des glandes salivaires, les inhibiteurs NTRK sont efficaces au stade métastatique.
1. Ferris RL, Blumenschein G, Jr., Fayette J et al. Nivolumab for Recurrent Squamous-Cell Carcinoma of the Head and Neck. N Engl J Med 2016.
2. Gillison ML, Blumenschein G, Jr., Fayette J et al. CheckMate 141: 1-Year Update and Subgroup Analysis of Nivolumab as First-Line Therapy in Patients with Recurrent/Metastatic Head and Neck Cancer. Oncologist 2018; 23: 1079-1082.
3. Burtness B, Harrington KJ, Greil R et al. Pembrolizumab alone or with chemotherapy versus cetuximab with chemotherapy for recurrent or metastatic squamous cell carcinoma of the head and neck (KEYNOTE-048): a randomised, open-label, phase 3 study. Lancet 2019; 394: 1915-1928.
4. Cohen EEW, Soulieres D, Le Tourneau C et al. Pembrolizumab versus methotrexate, docetaxel, or cetuximab for recurrent or metastatic head-and-neck squamous cell carcinoma (KEYNOTE-040): a randomised, open-label, phase 3 study. Lancet 2019; 393: 156-167.
5. Zandberg DP, Algazi AP, Jimeno A et al. Durvalumab for recurrent or metastatic head and neck squamous cell carcinoma: Results from a single-arm, phase II study in patients with >/=25% tumour cell PD-L1 expression who have progressed on platinum-based chemotherapy. Eur J Cancer 2019; 107: 142-152.
6. Siu LL, Even C, Mesía R et al. Safety and Efficacy of Durvalumab With or Without Tremelimumab in Patients With PD-L1-Low/Negative Recurrent or Metastatic HNSCC: The Phase 2 CONDOR Randomized Clinical Trial. JAMA Oncol 2019; 5: 195-203.
7. Ferris RL, Haddad R, Even C et al. Durvalumab with or without tremelimumab in patients with recurrent or metastatic head and neck squamous cell carcinoma: EAGLE, a randomized, open-label phase III study. Ann Oncol 2020; 31: 942-950.
8. Cohen R, Fayette J, Posner M et al. Abstract CT158: Phase II study of monalizumab, a first-in-class NKG2A monoclonal antibody, in combination with cetuximab in previously treated recurrent or metastatic squamous cell carcinoma of the head and neck (R/M SCCHN): Preliminary assessment of safety and efficacy. 2018; 78: CT158-CT158.
9. Taylor MH, Lee C-H, Makker V et al. Phase IB/II Trial of Lenvatinib Plus Pembrolizumab in Patients With Advanced Renal Cell Carcinoma, Endometrial Cancer, and Other Selected Advanced Solid Tumors. 2020; 38: 1154-1163.
10. Cohen RB, Lefebvre G, Posner MR et al. 1134P – Monalizumab in combination with cetuximab in patients (pts) with recurrent or metastatic (R/M) head and neck cancer (SCCHN) previously treated or not with PD-(L)1 inhibitors (IO): 1-year survival data. Annals of Oncology 2019; 30: v460.
11. Blanchard P, Lee A, Marguet S et al. Chemotherapy and radiotherapy in nasopharyngeal carcinoma: an update of the MAC-NPC meta-analysis. Lancet Oncol 2015; 16: 645-655.
12. Zhang Y, Chen L, Hu GQ et al. Gemcitabine and Cisplatin Induction Chemotherapy in Nasopharyngeal Carcinoma. N Engl J Med 2019; 381: 1124-1135.
13. Zhang L, Huang Y, Hong S et al. Gemcitabine plus cisplatin versus fluorouracil plus cisplatin in recurrent or metastatic nasopharyngeal carcinoma: a multicentre, randomised, open-label, phase 3 trial. Lancet 2016; 388: 1883-1892.
14. Huang T, Su N, Zhang X et al. Systemic chemotherapy and sequential locoregional radiotherapy in initially metastatic nasopharyngeal carcinoma: Retrospective analysis with 821 cases. Head Neck 2020; 42: 1970-1980.
15. Thorpe LM, Schrock AB, Erlich RL et al. Significant and durable clinical benefit from trastuzumab in 2 patients with HER2-amplified salivary gland cancer and a review of the literature. Head Neck 2017; 39: E40-E44.
16. Park JC, Ma TM, Rooper L et al. Exceptional responses to pertuzumab, trastuzumab, and docetaxel in human epidermal growth factor receptor-2 high expressing salivary duct carcinomas. Head Neck 2018; 40: E100-E106.
17. Swed BL, Cohen RB, Aggarwal C. Targeting HER2/neu Oncogene Overexpression With Ado-Trastuzumab Emtansine in the Treatment of Metastatic Salivary Gland Neoplasms: A Single-Institution Experience. JCO Precis Oncol 2019; 3.
18. Poxleitner P, Shoumariyeh K, Steybe D et al. Combined androgen deprivation therapy in recurrent androgen-receptor-positive salivary duct carcinoma – a case report and review of the literature. J Stomatol Oral Maxillofac Surg 2020; 121: 599-603.
19. Tchekmedyian V, Sherman EJ, Dunn L et al. Phase II Study of Lenvatinib in Patients With Progressive, Recurrent or Metastatic Adenoid Cystic Carcinoma. J Clin Oncol 2019; 37: 1529-1537.
20. Drilon A, Laetsch TW, Kummar S et al. Efficacy of Larotrectinib in TRK Fusion-Positive Cancers in Adults and Children. N Engl J Med 2018; 378: 731-739.
info@onco-suisse
- Vol. 11
- Ausgabe 1
- Februar 2021