- St. Galler Fortbildung Klinische Onkologie 2025
Die Organisatoren der 35. St. Galler Fortbildung Klinische Onkologie 2025 Prof. Dr. Christoph Driessen, PD Dr. Stefan Diehm und Prof. Dr. Dr. Markus Jörger konnten wiederum ein zahlreiches Publikum zur traditionellen Fortbildung im Kongresshotel Einstein begrüssen. Der folgende Bericht umfasst das Symposium zu gynäkologischen Tumoren und gibt einen Überblick über einige der Referate.
Bispezifische T-cell Engager bei soliden Tumoren

Prof. Mascha Binder, Chefärztin der Medizinischen Onkologie am Universitätsspital Basel, erläuterte zunächst das Prinzip der Präzisionsimmuntherapie mit Immun-Checkpoint-Inhibitoren, CAR-T-Zellen und TCR-modifizierten T-Zellen. Affinitätsoptimierte T-Zell-Rezeptoren können die Wirksamkeit der adoptiven T-Zell-Therapie erhöhen. Die Referentin stellte Afamitresgene autoleucel (afami-cel) vor, eine auf humane Leukozytenantigene beschränkte autologe T-Zelltherapie, die auf das Melanom-assoziierte Antigen A4 (MAGE-A4) abzielt, ein Krebs-/Testis-Antigen, das in verschiedenen soliden Tumoren in unterschiedlichen Mengen exprimiert wird. Explorative Analysen haben gezeigt, dass afami-cel Tumore infiltriert, einen Interferon-γ-gesteuerten Wirkmechanismus aufweist und adaptive Immunantworten auslöst.
CAR T-Zellen bei soliden Tumoren? Durchbruch durch Booster?
Ein neuer Ansatz, bei dem CAR T-Zellen mit seriellen mRNA-Impfstoffinjektionen kombiniert werden, ermöglicht eine robuste antineoplastische Aktivität bei Patienten mit Urogenitalkrebs und ebnet den Weg für eine vielversprechende neue zielgerichtete Behandlungsstrategie.
Präzisionsimmuntherapie mit bispezifischen T-Zell-Stimulatoren?
Als Beispiel nannte die Referentin Tebentafusp beim Aderhautmelanom. Tebentafustp hat eine 1 000 000-fach höhere Affinität zu GP-100 als der natürliche TCR. GP-100 ist typisch für Melanome und Aderhautmelanome. DLL3 wird sehr selektiv auf Tumorzellen beim kleinzelligen Lungenkrebs (SCLC) exprimiert und ist daher ein neues Target für einen T-Zell-Engager beim SCLC. Tarlatamab, das in der DeLLphi-301-Studie in einer Dosierung von 10 mg alle zwei Wochen verabreicht wurde, zeigte eine antitumorale Aktivität mit anhaltendem objektivem Ansprechen und vielversprechenden Überlebensergebnissen bei Patienten mit zuvor behandeltem SCLC. Es wurden keine neuen Sicherheitssignale beobachtet.
Die Referentin stellte den Fall einer 52-jährigen Patientin mit SCLC-Rezidiv vor. Die Diagnose SCLC-LD wurde im März 2021 gestellt, eine kombinierte Radiochemotherapie wurde im April 2021 und eine prophylaktische Ganzhirnbestrahlung im Juli desselben Jahres durchgeführt. Und eine konsolidierende Immuntherapie mit Atezolizumab. Im September CT mit partieller Remission (-68 %). Sept. 2023 neue Leberläsionen. Okt. Biopsie der Lebermetastasen, Histologie: SCLC, Nov. Aufnahme in die DeLLphi-303-Studie (Phase 1b-Studie zur Prüfung einer Therapie mit Tarlatamab in Kombination mit Carboplatin/Etoposid/PD-L1-Inhibitor bei SCLC-ED).
Nebenwirkungen von Tarlatamab: Zytokinfreisetzungssyndrom (CRS) 53 % (14 % G2+), mediane Zeit bis zum Auftreten 17h, am häufigsten im 1. Prophylaxe: Steroide / intravenöse Flüssigkeitszufuhr. Neutropenie (10 % G3+), neurologische Symptome: 70 % (11 % G3+), mediane Zeit bis zum Auftreten: 9 Tage, mediane Dauer: 5 Tage.
Zusammenfassung
Das Feld der bispezifischen T cell Engager ist in Bewegung –auch bei den soliden Tumoren. Sowohl intrazelluläre (TCR-Bindedomänen) als auch Membranantigene (Ak-Bindedomänen) können Targets sein. 2022 erfolgte die erste Zulassung für Tebentafusp beim Aderhautmelanom; Eine Zulassung beim kleinzelligen Lungenkrebs (SCLC)wird erwartet. Ähnlich wie bei CAR-T-Zellen bestimmt CRS und ICANS (Immune Effector Cell-Associated Neurotoxicity Syndrome) das klinische Nebenwirkungsmanagement.
Amyloidose
Abklärungs- und Therapiestandards
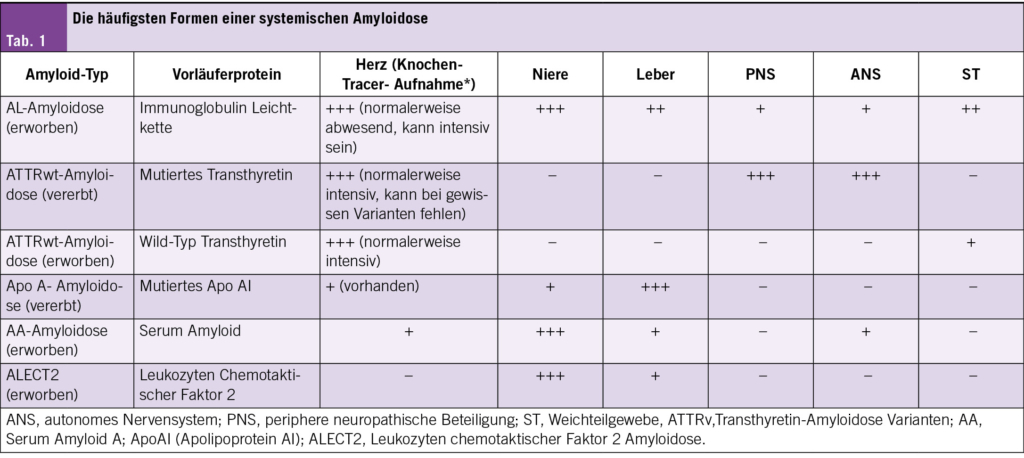
Die geläufigsten Formen der systemischen Amyloidose stellte KD Dr. Axel Rüfer, stellvertretender Chefarzt Hämatologie am Kantonsspital Luzern vor (Tab. 1).

Vorkommen bei Myelom, Waldenström Makroglobulinämie (IgM – assoziiert), IgD assoziierter Leichtketten- Amyloidose.
Eine Online-Umfrage unter 533 Teilnehmern, von denen 72 % an Leichtketten-Amyloidose (AL-Amyloidose) leiden, hat ergeben, dass die Diagnose einer Amyloidose schwierig ist. Die derzeitigen Therapien sind schwer verträglich und verbessern die Lebensqualität der meisten Patienten nicht wesentlich. Es besteht ein dringender Bedarf an gut verträglichen Therapien mit einem klaren therapeutischen Nutzen. Das Bewusstsein der Patienten für klinische Studien kann verbessert werden, zumal die Befragten eine hohe Bereitschaft zur Teilnahme signalisierten. Es gebe viele gute Gründe, an Amyloidose zu denken, so der Referent: „Weil eine frühe Diagnose das Gesamtüberleben verbessert, die Organfunktion schützt, mehr Therapieoptionen ermöglicht und zu einer besseren Lebensqualität führt.
Weil es validierte Biomarker gibt, die eine frühe Diagnose, eine risikoadaptierte Therapie und die Beurteilung des Ansprechens ermöglichen».
Wann besteht der Verdacht auf eine AL-Amyloidose und wann sollte mit der Diagnostik begonnen werden?
► Herzspezifische Zeichen einer AL-Amyloidose
▻ Diastolische Herzinsuffizienz
▻ Herzinsuffizienz mit erhaltener Ejektionsfunktion (HFpEF)
▻ Infiltrative Kardiomyopathie
► Nichtkardiale Zeichen einer AL-Amyloidose
▻ Nicht diabetische Proteinurie/nephrotisches Syndrom, periphere Ödeme
▻ Hepatomegalie (mit Cholestase)
▻ GI Motilitäts-Veränderungen, Diarrhoe
▻ Nichtdiabetische Neuropathie (aufsteigend, symmetrisch, kleine Fasern/axonal)
▻ Orthostatische Hypotonie, Synkope
▻ Fatigue
▻ Unbeabsichtigter Gewichtsverlust
Späte klinische Anzeichen der AL-Amyloidose:
Dehnung der Jugularvene, Schwellung der Submandibular-Drüse Makroglossie, periorbitale Purpura, Waschbäraugen, Mangel an Blutgerinnungsfaktor X.
Kardiale Amyloidose
90 % der kardialen Amyloidosen sind entweder AL-Amyloidosen oder ATTR-Amyloidosen (Transthyretin-Amyloidose) oder beides.
Seltene Formen sind:
► AApoAI, AII, AIV-Amyloidose
► AA-Amyloidose (Serum Amyloid A)
► AFib (Fibrinogen a)
► Isolierte Vorhof-Amyloidose
► Aβ2M (β2-Mikroglobulin)
► AGel (Gelsolin)
Die AL-Amyloidose ist ein Notfall.
ATTRwt = erworbene (Wildtyp, «senile, hohes Alter», 7. oder 8. Dekade)
ATTRv = vererbte Amyloidose (variant, «familiär» – oft mit Neuropathie; V1221: USA, Karibik, Afrika; V30M: Portugal. Schweden. Japan; T60A: UK, Irland
Klinischer Verdacht auf Amyloidose
Der erste Schritt in der diagnostischen Abklärung ist die Frage, ob eine monoklonale Gammopathie vorliegt. Dafür sollten eine Serumprotein-Elektrophorese (SPEP) mit Immunfixation (IF), eine Bestimmung der serumfreien Leichtketten (sFLC) sowie eine Urinimmunfixation durchgeführt werden. Diese Kombination stellt die höchste diagnostische Sensitivität sicher und verhindert, dass sFLC fälschlicherweise als normal eingestuft werden – ein Fehler, der in Studien dazu führte, dass bis zu sechs Prozent der amyloidogenen Klone übersehen wurden.
Fällt das Ergebnis positiv aus, erfolgt eine Knochenmarkuntersuchung mittels Zytologie und Histologie. Ist dieser Befund hingegen negativ, kann eine Tc-99m-Phosphat-Szintigraphie zur weiteren Abklärung durchgeführt werden. Dabei erlaubt der Perugini-Score eine Differenzierung zwischen einer Myokard- und einer Knochen-Tracer-Aufnahme.
Unabhängig vom initialen Befund sollten bestimmte Biomarker sowohl bei der Diagnosestellung als auch bei jedem Follow-up bestimmt werden. Dazu gehören NT-proBNP, Albuminurie und die alkalische Phosphatase. Die Gewebediagnostik spielt ebenfalls eine entscheidende Rolle. Während die Knochenmark-Zytologie und -Histologie eine diagnostische Sensitivität von 70 % aufweisen, kann eine subkutane Fettaspiration mit einer Sensitivität von 60 % erfolgen. Werden beide Methoden kombiniert, steigt die Trefferquote auf 89 %, weshalb eine gleichzeitige Durchführung empfohlen wird. Alternativ kann Gewebe aus der Speicheldrüse gewonnen werden, das eine Sensitivität von etwa 80 % aufweist. Darüber hinaus können auch weitere involvierte Organe wie die Niere – insbesondere zur Differenzierung von MIDO mittels Kongorot-Färbung –, das Herz oder das Nervensystem untersucht werden.
Zur endgültigen Bestimmung des Amyloid-Typs ist eine Typisierung aller Kongorot-positiven Gewebeproben notwendig, um die genaue Zusammensetzung der Proteinuntereinheiten zu identifizieren. Dies erfolgt in der Regel mittels Immunhistochemie. Sollte diese jedoch mehrdeutige Resultate liefern, kann ergänzend eine Massenspektrometrie durchgeführt werden.
Knochenmarkuntersuchung – immer mit FISH-Zytogenetik
Die Knochenmarkuntersuchung sollte stets in Kombination mit einer FISH-Zytogenetik durchgeführt werden, um genetische Aberrationen frühzeitig zu identifizieren. Im Median liegt das Knochenmarkplasmazell-Infiltrat bei etwa 10 %, wobei der gefährliche Zellklon oft mit kleinen B-Zellen assoziiert ist.
Eine Translokation t(11;14) tritt in 40 bis 50 % der Fälle auf und geht mit einem schlechteren Ansprechen auf Bortezomib und IMIDs einher. Dieser Nachteil kann jedoch durch eine hochdosierte Therapie in Kombination mit oralem Melphalan ausgeglichen werden. Eine 1q21-Gewinnung, die bei etwa 20 % der Patienten beobachtet wird, ist ebenfalls mit einer verminderten Wirksamkeit von oralem Melphalan verbunden.
Besonders Hochrisiko-Aberrationen wie die Translokation t(4;14) oder die Deletion 17p sind mit einer schlechteren Prognose assoziiert, treten jedoch nur in weniger als 10 % der Fälle auf.
Lokal fortgeschrittenes Rektumkarzinom

Prof. Ueli Güller, Chefarzt des Onkologie- und Hämatologiezentrums Thun-Berner Oberland, präsentierte die wichtigsten Erkenntnisse aus den neuesten Studien zum lokal fortgeschrittenen Rektumkarzinom. Seit rund 20 Jahren gibt es einen etablierten Standard of Care, doch mit den Worten „Wenn man nur einen Hammer hat, sieht alles wie ein Nagel aus“ wies er darauf hin, dass neue Studien innovative Therapieansätze bieten. Besonders relevant sind die Studien PRODIGE-23, PROSPECT, das Update der RAPIDO- und OPRA-Studien sowie die Forschung des Memorial Sloan Kettering Cancer Center (MSKCC) zum dMMR Rektumkarzinom.
Die PRODIGE-23-Studie untersuchte die neoadjuvante Chemotherapie mit FOLFIRINOX, gefolgt von Radiochemotherapie, Operation und adjuvanter Chemotherapie. Diese Strategie führte zu einer signifikanten Verbesserung aller Endpunkte, darunter das krankheitsfreie Überleben (DFS), das metastasenfreie Überleben (MFS) und das Gesamtüberleben (OS). Zudem zeigte sich ein positiver Trend in der Lebensqualität. Die Ergebnisse belegen, dass dieses Therapieschema eine überlegene Behandlungsoption im Vergleich zum klassischen Sauer-Regime darstellt, insbesondere bei gesunden Patienten.
In der PROSPECT-Studie wurde untersucht, ob eine neoadjuvante Therapie mit FOLFOX und nur selektiver Radiochemotherapie im Vergleich zum Sauer-Regime gleichwertig ist. Die Ergebnisse zeigten, dass dieses Therapieschema dem Sauer-Regime in Bezug auf DFS, OS und lokales Rezidivrisiko nicht unterlegen ist. Gleichzeitig wies es Vorteile in Bezug auf Lebensqualität, Darmfunktion und Sexualfunktion auf. Damit bietet es eine exzellente neue Therapieoption für Patienten mit intermediärem Risiko. Bei den meisten dieser Patienten kann sogar vollständig auf eine Radiochemotherapie verzichtet werden.
Die NCCN-Leitlinien 2023 (Version 5) empfehlen für Patienten ohne T4-Erkrankung eine 12- bis 16-wöchige Chemotherapie mit FOLFOX oder CAPEOX, gefolgt von einem erneuten Staging. Bei einer Tumorregression von mehr als 20 % erfolgt direkt die chirurgische Therapie mit anschliessender Überwachung (REC-10), inklusive Sigmoidoskopie und optionaler MRT. Falls die Tumorregression 20 % oder weniger beträgt, wird eine verlängerte Chemo- oder Radiotherapie mit Capecitabin, einer 5-FU-Infusion oder einer Kurzzeit-Radiotherapie empfohlen.
Die RAPIDO-Studie untersuchte ein alternatives Therapieschema für aggressivere Rektumkarzinome, lieferte jedoch gemischte Ergebnisse. Während die Therapie insgesamt gut verträglich war, zeigte sich eine signifikant höhere Lokalrezidivrate im Vergleich zur Sauer-Therapie. Besonders problematisch war das 5×5 Gy-Bestrahlungsschema, das nicht empfohlen wird. Stattdessen sollte eine Radiochemotherapie über 28 Fraktionen durchgeführt werden.
Die OPRA-Studie 2023 lieferte nach fünf Jahren Follow-up wichtige Erkenntnisse zur Organerhaltung bei Patienten mit Rektumkarzinom. Die Ergebnisse zeigten, dass eine Therapieabfolge mit initialer Radiochemotherapie, gefolgt von Chemotherapie, bessere Ergebnisse in Bezug auf den Organerhalt liefert als das umgekehrte Vorgehen. Damit hat sich der Organerhalt als vielversprechende neue Behandlungsoption für Patienten mit Rektumkarzinom etabliert.
Schliesslich wurde auch die PD-1-Blockade als vielversprechende Therapieoption für Patienten mit mismatch repair-defektem (dMMR) lokal fortgeschrittenem Rektumkarzinom thematisiert. Eine Studie von A. Cercek, vorgestellt auf dem ASCO-Kongress 2022, zeigte vielversprechende Ergebnisse für eine Therapie mit kurativer Intention.
Take Home message
PRODIGE 23: Verbessertes DFS MFS und OS vs. Sauer-Regime
PROSPECT: Radiochemotherapie kann bei der überwiegenden Mehrheit (>90 %) der Patienten mit intermediärem Risiko beim Rektumkarzinom vermieden werden
RAPIDO: CAVEAT: Lokalrezidiv signifikant höher als Sauer-Regime, 5 x 5 Gy: suboptimal für «hässliches» Rektumkarzinom
OPRA: Ziel Organerhalt: Radiochemotherapie → Chemotherapie >> Chemotherapie >> Chemotherapie → Radiochemotherapie
dMMR: keine Chemotherapie/Radiochemotherapie/OperationTherapie des fortgeschrittenen Pankreaskarzinoms im Jahre 2025
Therapie des fortgeschrittenen Pankreaskarzinom im Jahre 2025

Das Pankreaskarzinom ist eine systemische Erkrankung stellte Prof. Viviane Hess, Leitende Ärztin an der Klinik für Onkologie des Universitätsspitals Basel, fest.
Die epitheliale-mesenchymale Transition (EMT) erfolgt bereits im Stadium der intraepithelialen Neoplasien (PanIN). Sie ermöglicht es Krebszellen, während der Invasions-Metastasierungs-Kaskade funktionelle Anpassungen vorzunehmen. Als Reaktion auf EMT-fördernde Signale kann eine Subpopulation von Epithelzellen am invasiven Rand des Tumors ihre epithelialen Eigenschaften verlieren. In dem Masse, in dem sich diese Zellen weiter vom Hauptteil des Tumors ablösen, werden sie den epithelialen Signalen weniger ausgesetzt und nehmen in Gegenwart von EMT-Signalen, die von Stromazellen geliefert werden, mehr mesenchymale Eigenschaften an. Die metastabilen mesenchymalen Zellen sind für die Invasion in das umliegende Gewebe geeignet.
Ein medizinisches Conundrum sind die biologisch sehr frühen Anzeichen einer systemischen Erkrankung gegenüber der Chirurgie als einzige kurative Behandlungsoption.
Perioperatives Setting
► Borderline lokal fortgeschritten
► Biomarker?
► Oligometastatische Erkrankung
Metastasierendes Pankreaskarzinom
► Erstlinie
► Weitere Linien
► Neue Ansätze
FOLFIRINOX vs. Gemcitabin ergab ein medianes Gesamtüberleben (mOS) von 54 vs. 35 Monaten (p=0.003). Das Prozedere umfasst Systemtherapie, Re-Evaluation, Resektion und erneute Systemtherapie. Eine kurze (8 Wochen) neoadjuvante Therapie hatte einen signifikanten Überlebensvorteil im Vergleich zur sofortigen Operation. Diese Ergebnisse sprechen für den Einsatz einer kurzzeitigen neoadjuvanten Chemotherapie bei Patienten mit grenzwertig resektablem duktalen Adenokarzinom der Bauchspeicheldrüse.
Die perioperative Erkennung von tumorinformierter ctDNA ist in allen Krankheitsstadien möglich und steht in Zusammenhang mit den Überlebensaussichten der Patienten. In der Studie EXTEND unterstützte die Ergänzung der systemischen Therapie durch metastasenorientierte Therapie Patienten mit oligometastasiertem duktalen Adenokarzinom des Pankreas. Diese Ergebnisse rechtfertigen bestätigende Studien zur Verfeinerung der Behandlungsstrategie.
FOLFIRINOX ist eine etablierte Option für die Behandlung von Patienten mit metastasiertem Bauchspeicheldrüsenkrebs und gutem Leistungsstatus, wie die Studie PRODIGE 4 zeigte. Die NAPOLI 3-Studie ergab, dass die Erstlinienbehandlung mit NALIRIFOX bei therapienaiven Patienten mit metastasiertem duktalem Pankreasadenokarzinom eine klinisch bedeutsame und statistisch signifikante Verbesserung von OS und PFS im Vergleich zu Gemcitabin + Nab-Paclitaxel bewirkte.
Ein gBRCA-mutiertes Pankreasadenokarzinom zeigt eine hohe Ansprechrate und ein verlängertes progressionsfreies Überleben unter platinbasierter Chemotherapie. Diese Ergebnisse sind insbesondere für die neoadjuvante Behandlung und die Planung künftiger klinischer Studien relevant und unterstreichen die Wichtigkeit eines frühzeitigen Keimbahn-Tests bei diesen Patienten.
Erstlinientherapie
► FOLFIRINOX, Nalirifox, Gem-nP: vergleichbare Effizienz Cave: Real World Patientinnen sind nicht gleich Studienteilnehmerinnen: De-eskalation (mFOLFIRINOX, Dosis-Red., Gem, BSC)
► Lebenserwartung weiterhin kurz: early palliative care, individuelle Entscheide (Therapiepausen etc.)
► BRCA, PALB2 Testung (5-9 %): Platin (mFOLFIRINOX) erste Wahl – bei SD Olaparib erwägen
Neue Ansätze
► (Pan)RAS-Inhibitoren
► Claudin 18.2 (>75* % pos Zellen 27 %; Gem-nabPaclitaxel + Zolbetuximab (Phase I/II
► MDM2 Inhibitoren: Brightline-2 Studie (Bern, Genf) Boehringer Ingelheim
► Mikrobiome/ Nutrition: Tryptophan-Metabolismus (Indol-3Essigsäure (3-IAA) Serumwert) assoziiert mit Ansprechen
► Vakzinen:
o Personalisierte Neoantigen mRNA-Vakzine (Autogene Cevumeran) + Atezolizumab
o Dendritische Zell-Vakzine + Nivolumab (CHUV)
o Phase Ib: KISIMA-2 + Immunstimulation bei KRAS C12D/G12V mutierten Patienten (Boehringer Ingelheim)
► AMG 193 bei MTAP (Methylthioadenosinphosphorylase)-Null Patienten (metastasierend oder lokal fortgeschritten, Bern, St. Gallen, Zürich.
Kosten und klinischer Benefit in der Onkologie

Über die Kostenentwicklung im Gesundheitswesen, die Bestimmung von Benefit, Bestimmung und Bewertung Kosten-Nutzen-Verhältnis, wie breit/umfassend soll die Bewertung sein? und den Fortschritt in der Onkologie: Nutzengewinn mit Kollateralschäden? sprach Prof. Matthias Schwenkglenks vom Institut für Pharmazeutische Medizin (ECPM) der Universität Basel.
Der Referent zog das Fazit, dass die Kosten- und Preisentwicklung im Gesundheitswesen zunehmend problematisch ist – besonders in der Onkologie, wo die Ausgaben oft noch stärker steigen als in anderen medizinischen Bereichen. Diese Entwicklung stellt die solidarischen Finanzierungssysteme in Europa vor große Herausforderungen. Insbesondere hohe Kosten für neue Behandlungen können in bestimmten Fällen sogar die Finanzierung etablierter Therapien gefährden.
Die Bewertung des tatsächlichen Nutzens neuer Therapien gestaltet sich komplex. Während klinische Studien eine zentrale Grundlage darstellen, sind sie allein nicht ausreichend, um den Benefit einer Behandlung vollständig zu bestimmen. Von besonderem Interesse ist die Real-World-Effectiveness, also die tatsächliche Wirksamkeit einer Therapie im klinischen Alltag. Allerdings erschweren kurze Beobachtungszeiträume eine fundierte Einschätzung zusätzlich.
Alle derzeit verwendeten Systeme zur Nutzenbewertung haben ihre Schwächen. So sind QALYs (Quality-Adjusted Life Years) wenig individuell und eignen sich eher für gesundheitspolitische Entscheidungen als für die Beurteilung einzelner Patienten. Multikriterien-Ansätze hingegen haben ihre eigenen Herausforderungen, etwa bei der Bewertung von Scoring-Systemen, der Gewichtung einzelner Faktoren und der möglichen Überlappung von Kriterien.
Ein möglicher Beitrag der Forschung könnte darin liegen, möglichst transparente und objektive Informationen bereitzustellen. Diese könnten als Grundlage für eine gemeinsame Lösungssuche zwischen den verschiedenen Akteuren im Gesundheitssystem dienen.
Dosierung in der Onkologie

Prof. Dr. Dr. Markus Joerger, Leitender Arzt Onkologie und Leiter der Medizinischen Onkologie und Hämatologie am Kantonsspital St. Gallen, referierte über verschiedene Dosierungsstrategien in der Onkologie. Dabei ging er unter anderem auf die allometrische Skalierung anhand der Körperoberfläche (BSA) bei der Verabreichung von Chemotherapeutika ein. Für endokrine und molekular-zielgerichtete Therapien wird hingegen häufig eine Flat-Dose, also eine fixe Dosierung, angewendet. Monoklonale Antikörper werden in der Regel basierend auf dem Körpergewicht dosiert. Auch Checkpoint-Inhibitoren kommen oftmals in Form einer Flat-Dose zum Einsatz.
Dosierung von Antikrebsmedikamenten / BSA, Körpergewicht
Die Dubois-Formel zur Berechnung der Körperoberfläche (BSA) wurde bereits 1916 auf Basis von nur neun Personen entwickelt. Sie lautet:BSA = Gewicht (kg)0.425 × Grösse (cm)0.725 × 0.007184.
In der pädiatrischen Onkologie wurde die BSA-basierte Dosierung um 1950 eingeführt. Allerdings gilt die Du Bois-Formel als unzuverlässig bei einer BSA unter 1.3 m². Die allometrische Dosis-Extrapolation, also die Übertragung von Tierdaten auf den Menschen, bildet nach wie vor einen Grundpfeiler der Dosierungsentwicklung.
Dosisfindungsstudien mit Krebsmedikamenten gelten als aktueller Standard. Dabei ergeben sich jedoch Herausforderungen: Seltene oder kumulative Toxizitäten werden oft unterschätzt oder überschätzt. Eine solche Überschätzung der kumulativen Toxizität war ein zentraler Auslöser für die Initiative «Project Optimus» der US-amerikanischen Zulassungsbehörde FDA.
Die systemische Arzneimittelexposition wird von zahlreichen Faktoren beeinflusst: Alter, Geschlecht, Schwangerschaft, Laktation, körperliche Aktivität, Umweltfaktoren wie Sonneneinstrahlung und Luftdruck, sowie physiologische und pathologische Zustände wie Infektionen, Organfunktionen (Leber, Niere), Immunstatus oder Ernährung. Auch das Verhalten (z. B. Rauchen, Alkoholkonsum, Fasten) sowie genetische Variationen spielen eine Rolle. Zusätzlich beeinflussen pharmakokinetische Prozesse wie Absorption, Verteilung, Metabolismus und Exkretion (ADME) sowie die Therapietreue (Compliance) die Arzneimittelwirkung erheblich.
Pharmakokinetik beschreibt, was der Körper mit einem Arzneimittel macht – also dessen Aufnahme, Verteilung, Verstoffwechselung und Ausscheidung über die Zeit. Demgegenüber steht die Pharmakodynamik, die untersucht, was das Arzneimittel im Körper bewirkt – etwa die Bindung an Rezeptoren und die daraus resultierenden Wirkungen. Die Pharmakokinetik beeinflusst dabei wesentlich den Beginn, die Dauer und die Intensität der pharmakodynamischen Effekte.
Die klassische BSA-basierte Dosierung der Chemotherapie ist unter Kritik geraten, da sie der hohen interindividuellen Variabilität der ADME-Prozesse nicht gerecht wird. Studien zeigen, dass eine Flat-Dose hinsichtlich der pharmakokinetischen Variabilität nicht unterlegen ist. Zudem befinden sich bei konventioneller Dosierung über 55 % der Patienten ausserhalb des gewünschten Expositionsbereichs.
Das Therapeutische Drug Monitoring (TDM) kann dabei helfen, die Dosierung individueller zu gestalten – insbesondere bei Wirkstoffen mit enger therapeutischer Breite, signifikanter interindividueller PK-Variabilität und validierten Zielparametern. Voraussetzung dafür sind u. a. etablierte Bioassays, klare klinische Endpunkte und eine ausreichend lange Therapiedauer. TDM trägt dazu bei, das Sicherheitsprofil zu verbessern, Toxizitäten zu vermeiden und die klinische Wirksamkeit zu erhöhen.
Ein virtueller Fall zeigte eine interindividuelle PK-Variabilität von 35 %. Dabei wurde die minimal effektive Exposition (MEE) auf zwei Drittel der maximal tolerierten Exposition (MTE) festgelegt. Der therapeutische Index, also das Verhältnis zwischen toxischer Dosis (TD50) und effektiver Dosis (ED50), dient als Mass für das Nutzen-Risiko-Verhältnis eines Arzneimittels – je höher, desto besser. Die optimale biologische Dosis (OBD) beschreibt den besten Kompromiss zwischen Wirksamkeit und Verträglichkeit.
Ein Beispiel hierfür ist eine randomisierte Dosierungsstudie zu Sotorasib: Die Vergleichsdosen von 960mg vs. 240mg pro Tag zeigten ähnliche Ansprechraten (ORR 33 % vs. 25 %), jedoch geringere schwere Nebenwirkungen (TEAE 37 % vs. 33 %) in der niedriger dosierten Gruppe.
Bei Patienten mit Organdysfunktionen ist eine individualisierte Dosierung besonders wichtig. Die Leber wandelt Medikamente durch Enzyme (u.a. CYP450) in besser ausscheidbare Substanzen um. Wiederholte Medikamentengaben können zur Enzyminduktion und somit zur Toleranzentwicklung führen. In der Niere erfolgt die Ausscheidung wasserlöslicher Verbindungen. Die Clearance (CL) – also das pro Zeiteinheit vom Wirkstoff gereinigte Plasmavolumen – ergibt sich aus dem Verhältnis von Dosis zur Fläche unter der Konzentrations-Zeit-Kurve (AUC).
TDM ist insbesondere sinnvoll, wenn bei der ersten Gabe eine hohe Unsicherheit besteht. Hier könnten genetische Faktoren (Genotyp), phänotypische Merkmale oder gar eine Testdosis in die Überlegungen einbezogen werden.
Fazit
Die maximal verträgliche Dosis (MTD) ist nicht zwangsläufig die optimale biologische Dosis (OBD). Das FDA-Projekt «Optimus» zielt darauf ab, das Verständnis für die OBD zu verbessern. TDM bietet eine Möglichkeit zur Individualisierung der Dosierung, etwa bei Wirkstoffen wie 5-FU (CIV), Paclitaxel (alle drei Wochen) oder Imatinib (CML), bei denen Evidenz der Stufe I vorliegt. Für Medikamente wie hochdosiertes Busulfan, Methotrexat oder Imatinib bei GIST existiert Evidenz der Stufe IIB.
Die Umsetzung individualisierter Dosierungen in den ursprünglichen Zulassungsverfahren bleibt eine Herausforderung. Dennoch ermöglicht ein vertieftes Verständnis der Pharmakologie eine gezieltere Dosierung – insbesondere bei Patienten mit Organfunktionsstörungen oder erhöhtem Risiko für dosislimitierende Komplikationen. In der geriatrischen Onkologie sowie in der Gender-Medizin ist dieses Prinzip bislang noch nicht etabliert.
Highlights Medizinische Onkologie 2024

Die Highlights des onkologischen Jahres 2024 präsentierte Prof. Oliver Gautschi, Luzern. Ein besonderer Fokus lag auf dem Einsatz von Checkpoint-Inhibitoren in kurativer Therapiestrategie bei verschiedenen soliden Tumoren.
Bereits vor 2024 publizierte Studien:
► Melanom (Stadium III): Perioperative Therapie (S1801)
► Kutanes Plattenepithelkarzinom: Neoadjuvante Therapie
► Kolorektales Karzinom mit MMRd: Neoadjuvante Therapie (NICHE1)
► NSCLC (Stadium II–III): Neoadjuvante Therapie mit Nivolumab + Chemo (CM816)
► Ösophaguskarzinom: Adjuvante Therapie (CM577)
► NSCLC (Stadium III): Konsolidierung nach Radiochemotherapie (PACIFIC)
Neue Daten im Jahr 2024:
► Melanom (Stadium III): Duale neoadjuvante Therapie (NADINA)
► Kolonkarzinom mit MMRd: Duale neoadjuvante Therapie (NICHE2/3)
► MSI-high Magenkarzinom: Duale neoadjuvante Therapie (INFINITY)
► Triple-negatives Mammakarzinom: Perioperative Therapie (KN522)
► Harnblasenkarzinom: Adjuvante Therapie (NIAGRA)
► Nierenzellkarzinom: Adjuvante Therapie (KN564)
► SCLC (Stadium III): Konsolidierung nach Radiochemotherapie (ADRIATIC)
Studien im Detail
NADINA: Bei resektablem, makroskopischem Melanom im Stadium III zeigte die neoadjuvante Kombination aus Ipilimumab und Nivolumab – gefolgt von Operation und einer an das Ansprechen angepassten adjuvanten Therapie – ein signifikant verlängertes ereignisfreies Überleben im Vergleich zur Standardstrategie (Operation + adjuvantes Nivolumab). Die Hazard Ratio für Progression, Rückfall oder Tod lag bei 0.32 (99.9 % KI: 0.15–0.66).
ASCO-Update / Dostarlimab: In einer einarmigen Phase-II-Studie erhielten Patienten mit lokal fortgeschrittenem, mismatch-reparatur-defizientem Rektumkarzinom eine Monotherapie mit Dostarlimab (500mg alle 3 Wochen, bis zu 8 Monate). Nach einem Jahr zeigten alle 42 Teilnehmenden ein vollständiges klinisches Ansprechen (cCR = 100 %). Es war keine zusätzliche Chemotherapie, Bestrahlung oder Operation nötig.
NIAGRA: Bei Patienten mit Harnblasenkarzinom führte die perioperative Gabe von Durvalumab plus neoadjuvanter Chemotherapie zu einer signifikanten Verbesserung von ereignisfreiem Überleben und Gesamtüberleben gegenüber der Chemotherapie allein.
KN564: Pembrolizumab als adjuvante Therapie nach Resektion eines klarzelligen Nierenzellkarzinoms mit hohem Rückfallrisiko senkte das Sterberisiko um 38% im Vergleich zu Placebo. Auch das krankheitsfreie Überleben wurde signifikant verlängert.
KN522: Bei Patientinnen mit frühem triple-negativem Mammakarzinom verbesserte die neoadjuvante Kombination aus Pembrolizumab und Chemotherapie, gefolgt von adjuvantem Pembrolizumab, das Gesamtüberleben signifikant im Vergleich zur neoadjuvanten Chemotherapie allein.
CM816: Für resektables NSCLC (nicht-kleinzellig) zeigte die neoadjuvante Kombination aus Nivolumab und Chemotherapie Vorteile hinsichtlich ereignisfreiem Überleben und pathologischem Komplettansprechen gegenüber der alleinigen Chemotherapie – ohne Beeinträchtigung der Operationsdurchführbarkeit oder erhöhtes Risiko für Nebenwirkungen.
CM77T: Die perioperative Behandlung mit Nivolumab bei resektablem NSCLC verbesserte das ereignisfreie Überleben signifikant. Neue Sicherheitssignale wurden nicht beobachtet.
KN671: Bei frühem NSCLC führte eine neoadjuvante Kombination aus Pembrolizumab und Chemotherapie, gefolgt von Operation und adjuvanter Pembrolizumab-Gabe, zu einer signifikanten Verbesserung von ereignisfreiem Überleben, pathologischem Ansprechen und Komplettremission. Das Gesamtüberleben unterschied sich jedoch (noch) nicht signifikant.
PACIFIC-2: Die gleichzeitige Gabe von Durvalumab und Radiochemotherapie bei inoperablem NSCLC verbesserte die Therapieergebnisse nicht signifikant gegenüber Radiochemotherapie allein. Unerwünschte Ereignisse führten bei ca. 25 % zum Abbruch der Durvalumab-Therapie, meist innerhalb der ersten vier Monate. Konsolidierendes Durvalumab bleibt jedoch Standard nach CRT-Versagen.
ADRIATIC: Durvalumab als Konsolidierung nach concurrent Chemoradiotherapie (cCRT) verbesserte signifikant Gesamtüberleben (OS) und progressionsfreies Überleben (PFS) bei Patienten mit begrenztem kleinzelligem Lungenkarzinom (LS-SCLC). Das Sicherheitsprofil entsprach dem bekannten Schema.
Fazit
► PD-L1-Inhibition «in kurativer Absicht» ist heute in vielen soliden Tumorentitäten Standard.
► Das kurative Potenzial variiert je nach Indikation.
► Ein klarer Trend geht hin zur neoadjuvanten Immuntherapie.
Herausforderungen
► Unterschiedliche Studienergebnisse, trotz ähnlicher Wirkstoffe und Designs
► Unklare Rolle von Biomarker-basierten und dualen Checkpoint-Inhibitionen
► Patientenselektion erfolgt bislang nur bei wenigen Tumoren (z.B. MMRd, MSI, PD-L1)
► Der Zusatznutzen adjuvanter Therapie oder dualer Inhibition ist noch nicht abschliessend geklärt
► Kombination mit Strahlentherapie kann potenziell negative Effekte haben, wohingegen eine gleichzeitige Chemotherapie bisher keine Nachteile zeigte.
riesen@medinfo-verlag.ch