- Stereotaktische Bestrahlung beim primären Nierenzellkarzinom
Das primäre Nierenzellkarzinom (RCC) ist eine der häufigsten urologischen Krebserkrankungen, bei der die chirurgische Resektion bislang als Standardtherapie gilt. Für Patienten, bei denen eine Operation aufgrund von Komorbiditäten, eingeschränkter Nierenfunktion oder persönlichen Präferenzen nicht möglich ist, hat sich in den letzten Jahren die stereotaktische Strahlentherapie (SBRT) als effektive, nicht-invasive Behandlungsalternative etabliert. Im Vergleich zu thermalen Ablationsverfahren und operativen Eingriffen bietet die SBRT Vorteile insbesondere bei grösseren Tumoren, ungünstiger Lage oder hohem Operationsrisiko. Die akute und späte Toxizität bleibt gering, und die Funktion der Niere wird weitgehend erhalten. Die SBRT stellt somit eine aussichtsreiche Therapieoption für selektionierte Patienten mit primärem RCC dar, die eine individualisierte, schonende und wirksame Tumorkontrolle ermöglicht.
Primary renal cell carcinoma (RCC) is one of the most common urological cancers for which surgical resection has been the standard treatment to date. In recent years, stereotactic radiotherapy (SBRT) has established itself as an effective, non-invasive treatment alternative for patients for whom surgery is not possible due to comorbidities, impaired renal function or personal preferences. Compared to thermal ablation procedures and surgical interventions, SBRT offers advantages, particularly in the case of larger tumors, unfavorable locations or high surgical risk. Acute and late toxicity remains low and kidney function is largely preserved. SBRT thus represents a promising treatment option for selected patients with primary RCC, enabling individualized, gentle and effective tumour control.
Key words: Stereotaktische Strahlentherapie (SBRT), Primäres Nierenzellkarzinom (RCC), Nicht-invasive Krebstherapie
Einleitung
Das Nierenzellkarzinom (RCC) stellt mit etwa 3 % aller malignen Erkrankungen bei Erwachsenen die dritthäufigste urologische Krebserkrankung dar. Die chirurgische Resektion gilt nach wie vor als Goldstandard für die Behandlung des lokalisierten Nierenzellkarzinoms, wobei je nach Tumorgrösse und -lokalisation eine partielle oder radikale Nephrektomie durchgeführt wird. Allerdings gibt es eine wachsende Patientengruppe, für die eine Operation aufgrund von Komorbiditäten, eingeschränkter Nierenfunktion oder persönlichen Präferenzen nicht in Frage kommt (1).
In den letzten Jahren hat sich die stereotaktische Strahlentherapie (SBRT) als vielversprechende nicht-invasive Behandlungsoption für das primäre Nierenzellkarzinom etabliert. Die SBRT ermöglicht die präzise Abgabe hoher Strahlendosen in wenigen Fraktionen unter maximaler Schonung des umgebenden Normalgewebes. Dieser Übersichtsartikel beleuchtet den aktuellen Stand der SBRT beim primären Nierenzellkarzinom, einschliesslich der klinischen Evidenz, technischen Aspekte und Zukunftsperspektiven.
Historischer Kontext und Paradigmenwechsel
Historisch galt das Nierenzellkarzinom als strahlenresistent, was hauptsächlich auf Erfahrungen mit konventioneller fraktionierter Strahlentherapie zurückzuführen war (2). Dieses Paradigma wurde jedoch in den letzten Jahren grundlegend in Frage gestellt. Durch die technologischen Fortschritte in der Bildgebung und Strahlenapplikation ermöglicht die SBRT die Verabreichung biologisch wirksamer Dosen, die deutlich über der Strahlensensibilitätsschwelle des Nierenzellkarzinoms liegen (3).
Die präzise Tumorlokalisation durch moderne Bildgebung und die Berücksichtigung der Atembewegung durch spezielle Techniken wie Atemgating oder -tracking haben die Genauigkeit der Strahlenapplikation erheblich verbessert (4). Diese technologischen Fortschritte haben es ermöglicht, die Strahlendosis im Tumor zu eskalieren und gleichzeitig das umliegende gesunde Nierengewebe zu schonen, was zu einer Neubewertung der Rolle der Strahlentherapie beim primären Nierenzellkarzinom geführt hat (5).
Klinische Evidenz
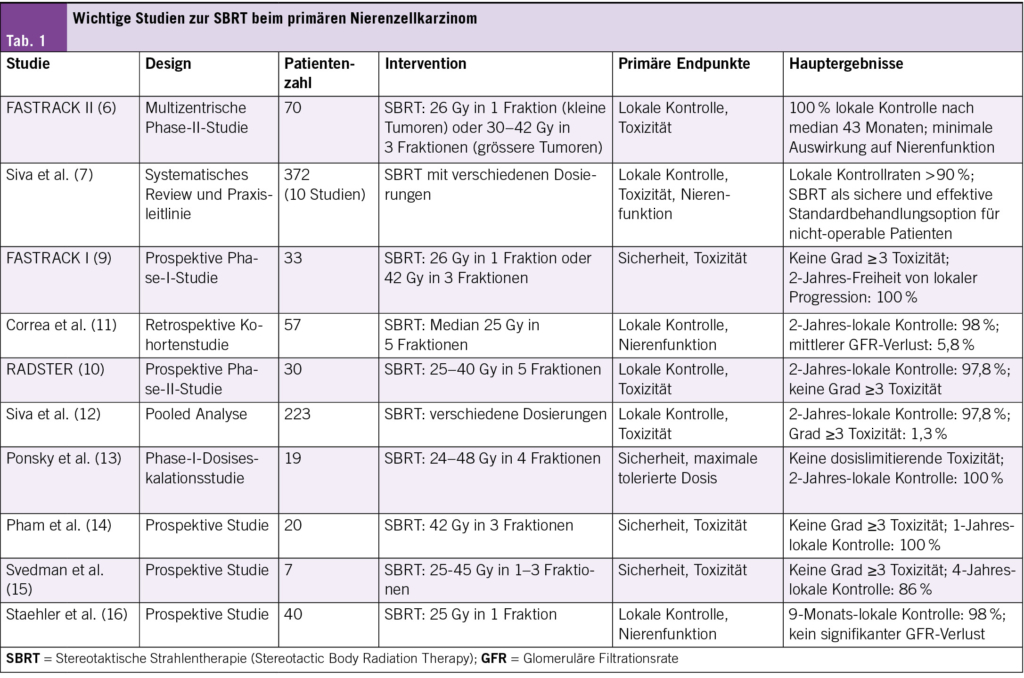
Die klinische Evidenz für SBRT beim primären Nierenzellkarzinom ist überzeugend. Die wegweisende FASTRACK II-Studie mit 70 Patienten (Durchschnittsalter 77 Jahre) zeigte nach 43 Monaten eine lokale Kontrollrate von 100 %. Kleinere Tumoren (<4 cm) erhielten eine Einzeldosis von 26 Gy, grössere Tumoren (4–9 cm) 30–42 Gy in 3 Fraktionen. Bemerkenswert ist die Wirksamkeit auch bei grösseren Tumoren (zwei Drittel der Patienten) mit minimalen Auswirkungen auf die Nierenfunktion (6).
Eine systematische Übersichtsarbeit des International Stereotactic Radiotherapy Consortium (2023) bestätigt diese Ergebnisse anhand von 10 Studien mit 372 Patienten. Die lokalen Kontrollraten lagen konsistent über 90 %, weshalb die SBRT als Standardoption für nicht-operable Patienten empfohlen wird (7). Eine Meta-Analyse von Correa et al. mit 372 Patienten aus 18 Studien zeigte eine gepoolte 2-Jahres-lokale Kontrollrate von 97.2 % und eine krebsspezifische 2-Jahres-Überlebensrate von 95.9 %, mit einem durchschnittlichen GFR-Verlust von nur 5.8 % (8).
Die FASTRACK I-Studie (33 Patienten) bestätigte die Sicherheit der SBRT mit einer 100 %igen Freiheit von lokaler Progression nach 24 Monaten ohne Grad-3-Toxizitäten (9). Weitere Studien untermauern diese Ergebnisse: Die RADSTER-Studie (30 Patienten, 25–40 Gy in 5 Fraktionen) erreichte eine 2-Jahres-lokale Kontrollrate von 97.8 % ohne schwere Toxizitäten (10), während eine retrospektive Studie von Correa et al. (57 Patienten, median 25 Gy in 5 Fraktionen) eine 2-Jahres-lokale Kontrollrate von 98 % mit einem mittleren GFR-Verlust von 5.8 % zeigte (11) (Tab. 1).
Technische Aspekte der SBRT beim primären Nierenzellkarzinom
Die optimale Dosierung und Fraktionierung der SBRT beim primären Nierenzellkarzinom ist noch Gegenstand laufender Untersuchungen. Basierend auf den verfügbaren Daten haben sich jedoch bestimmte Dosierungsschemata als wirksam erwiesen (17):
• Für kleinere Tumoren (<4 cm): Einzeldosis-SBRT mit 25–26 Gy
• Für grössere Tumoren (4–9 cm): Drei Behandlungen mit jeweils 10–14 Gy über 2 Wochen
Diese Dosierungen entsprechen einer biologisch effektiven Dosis (BED) von über 100 Gy, was als ausreichend angesehen wird, um eine exzellente lokale Tumorkontrolle zu gewährleisten, während gleichzeitig das Risiko für Nebenwirkungen minimiert wird (18).
Nierenfunktion und Toxizität
Auswirkungen auf die Nierenfunktion
Ein besonderes Augenmerk bei der SBRT des Nierenzellkarzinoms liegt auf der Erhaltung der Nierenfunktion. Studien zeigen, dass die SBRT die Nierenfunktion weitgehend erhält, mit einem durchschnittlichen Verlust der glomerulären Filtrationsrate (GFR) von nur etwa 5–10 % (12). Dies ist besonders wichtig für Patienten mit bereits eingeschränkter Nierenfunktion oder einer Einzelniere.
Siva et al. untersuchten die Dosis-Wirkungs-Beziehung zwischen SBRT und Nierenfunktion und fanden heraus, dass die mittlere Nierendosis der stärkste Prädiktor für den GFR-Verlust ist (22). Die Autoren empfehlen, die mittlere Dosis in der behandelten Niere auf unter 12 Gy zu begrenzen, um die Nierenfunktion zu erhalten (22).
Akute und späte Toxizität
Die akute Toxizität der SBRT ist in der Regel mild und selbstlimitierend. Häufige akute Nebenwirkungen umfassen Müdigkeit, Übelkeit und leichte Hautreaktionen (23). In der FASTRACK II-Studie wurden keine Grad-4- oder Grad-5-Toxizitäten beobachtet, und nur 5.7 % der Patienten erlebten Grad-3-Toxizitäten (6).
Schwerwiegende Nebenwirkungen (Grad 3 oder höher) sind selten und treten bei weniger als 5 % der Patienten auf (24). Spättoxizitäten wie Nierenfunktionsverschlechterung, Stenosen des Harnleiters oder Blutungen sind ebenfalls selten, insbesondere wenn moderne Planungs- und Applikationstechniken verwendet werden (25).
Vergleich mit anderen ablativen Verfahren
Thermale Ablation vs. SBRT
Im Vergleich zu thermalen Ablationsverfahren wie Radiofrequenzablation (RFA) oder Kryoablation bietet die SBRT mehrere Vorteile (26):
• Vollständig nicht-invasiv, keine Narkose oder Sedierung erforderlich
• Keine Einschränkungen durch Tumorgrösse (wirksam auch bei Tumoren > 4 cm)
• Geeignet für Tumoren in schwierigen Lokalisationen (tief im Nierenparenchym, nahe an Gefässen oder dem Nierenbecken)
• Keine Kontraindikationen durch Antikoagulation oder Thrombozytopenie
Eine direkte Vergleichsstudie zwischen SBRT und thermalen Ablationsverfahren steht noch aus. Die verfügbaren Daten deuten jedoch darauf hin, dass die lokalen Kontrollraten der SBRT mit denen der thermalen Ablation vergleichbar oder sogar überlegen sind, insbesondere bei grösseren Tumoren (27).
Partielle Nephrektomie vs. SBRT
Die partielle Nephrektomie bleibt der Goldstandard für die Behandlung des lokalisierten Nierenzellkarzinoms bei operablen Patienten (28). Im Vergleich zur partiellen Nephrektomie bietet die SBRT jedoch Vorteile für bestimmte Patientengruppen:
• Keine Operationsrisiken oder Anästhesiekomplikationen
• Ambulante Behandlung ohne Krankenhausaufenthalt
• Geeignet für Patienten mit hohem Operationsrisiko oder Kontraindikationen für eine Operation
• Minimale Auswirkungen auf die Nierenfunktion
Eine randomisierte Studie, die SBRT mit partieller Nephrektomie vergleicht, wäre wünschenswert, um die relative Wirksamkeit und Sicherheit beider Verfahren zu bestimmen (29).
Patientenselektion und klinische Implementierung
Indikationen für SBRT
Die SBRT beim primären Nierenzellkarzinom ist besonders indiziert für (30):
• Patienten, die für eine Operation nicht geeignet sind (aufgrund von Alter, Komorbiditäten oder Anästhesierisiko)
• Patienten mit eingeschränkter Nierenfunktion oder einer Einzelniere
• Patienten, die eine Operation ablehnen
• Tumoren in schwieriger Lokalisation für thermale Ablation
• Grössere Tumoren (> 4 cm), die für thermale Ablation nicht geeignet sind
Die optimale Patientenselektion ist entscheidend für den Erfolg der SBRT und sollte im Rahmen einer multidisziplinären Tumorkonferenz erfolgen (31).
Praktische Implementierung
Die praktische Implementierung der SBRT beim primären Nierenzellkarzinom erfordert ein spezialisiertes Team und eine geeignete technische Ausstattung (32):
• Erfahrene Strahlentherapeuten und Medizinphysiker
• Hochpräzise Bestrahlungsgeräte (z.B. Linac-basierte SBRT, CyberKnife)
• Fortschrittliche Bildgebungssysteme für die Bestrahlungsplanung und -verifikation
Die Behandlung sollte idealerweise in Zentren mit Erfahrung in der SBRT durchgeführt werden, um optimale Ergebnisse zu gewährleisten (12).
Zukunftsperspektiven
Laufende Studien
Mehrere laufende Studien untersuchen die Rolle der SBRT beim primären Nierenzellkarzinom:
• FASTRACK III: Eine randomisierte Phase-III-Studie, die SBRT mit thermaler Ablation bei Patienten mit primärem Nierenzellkarzinom vergleicht (33)
• ARREST: Eine prospektive Beobachtungsstudie zur Langzeitwirksamkeit und -sicherheit der SBRT beim primären Nierenzellkarzinom (34)
• RADSTER-2: Eine Phase-II-Studie zur Dosiseskalation bei der SBRT des primären Nierenzellkarzinoms (35)
Diese Studien werden wichtige Erkenntnisse zur optimalen Dosierung, Patientenselektion und langfristigen Ergebnissen liefern.
Technologische Entwicklungen
Neue technologische Entwicklungen könnten die Präzision und Wirksamkeit der SBRT beim primären Nierenzellkarzinom weiter verbessern (36):
• MR-geführte Strahlentherapie zur Echtzeit-Bildgebung während der Behandlung
• Adaptive Strahlentherapie zur täglichen Anpassung des Bestrahlungsplans
• Künstliche Intelligenz zur Optimierung der Bestrahlungsplanung und Vorhersage des Ansprechens
• Biologisch adaptierte Strahlentherapie basierend auf funktioneller Bildgebung
Diese Innovationen könnten zu einer weiteren Verbesserung der lokalen Kontrolle und Reduktion der Toxizität führen (37).
Kombination mit systemischen Therapien
Die Kombination von SBRT mit systemischen Therapien, insbesondere Immuntherapien, stellt einen vielversprechenden Ansatz dar, der in zukünftigen Studien untersucht werden sollte (38). Präklinische Daten deuten darauf hin, dass die SBRT immunogene Effekte haben kann, die die Wirksamkeit von Immuntherapien verstärken könnten (39).
Fazit
Die SBRT hat sich als wirksame und sichere Behandlungsoption für das primäre Nierenzellkarzinom etabliert, insbesondere für Patienten, die für eine Operation nicht geeignet sind. Die verfügbare Evidenz zeigt exzellente lokale Kontrollraten von über 90 %, mit minimalen Auswirkungen auf die Nierenfunktion und geringer Toxizität.
Die SBRT bietet eine nicht-invasive Alternative zur Operation und thermalen Ablation, mit dem Vorteil, dass sie auch für grössere Tumoren und schwierige Lokalisationen geeignet ist. Die optimale Patientenselektion, präzise Bestrahlungsplanung und sorgfältiges Bewegungsmanagement sind entscheidend für den Erfolg der Behandlung.
Zukünftige Studien werden die Rolle der SBRT im Vergleich zu anderen Behandlungsoptionen weiter definieren und die optimale Dosierung, Fraktionierung und Patientenselektion klären. Technologische Innovationen und die Kombination mit systemischen Therapien könnten das therapeutische Potenzial der SBRT beim primären Nierenzellkarzinom weiter erhöhen.
Copyright
Aerzteverlag medinfo AG
Universitätsklinik für Radio-Onkologie
Inselspital
Universität Bern
Freiburgstrasse
3010 Bern
Mohamed.Shelan@insel.ch
Inselspital
Universitätsspital Bern
Universitätsklinik für Radio-Onkologie
Freiburgstrasse
3010 Bern
Die Autoren haben keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Ljungberg B, Albiges L, Abu-Ghanem Y, et al. European Association of Urology Guidelines on Renal Cell Carcinoma: The 2022 Update. Eur Urol. 2022;82(4):399-410.
2. De Meerleer G, Khoo V, Escudier B, et al. Radiotherapy for renal-cell carcinoma. Lancet Oncol. 2014;15(4):e170-e177.
3. Kothari G, Foroudi F, Gill S, Siva S. Stereotactic body radiotherapy for primary renal cell carcinoma and adrenal metastases. Chin Clin Oncol. 2017;6(Suppl 2):S17.
4. Palacios MA, Bohoudi O, Bruynzeel AME, et al. Role of daily plan adaptation in MR-guided stereotactic ablative radiation therapy for adrenal metastases. Int J Radiat Oncol Biol Phys. 2018;102(2):426-433.
5. Siva S, Ellis RJ, Ponsky L, et al. Consensus statement from the International Radiosurgery Oncology Consortium for Kidney for primary renal cell carcinoma. Future Oncol. 2016;12(5):637-645.
6. Siva S, Bressel M, Sidhom M, et al. Stereotactic ablative body radiotherapy for primary kidney cancer (TROG 15.03 FASTRACK II): A non-randomised phase 2 trial. Lancet Oncol. 2024;25(2):193-204.
7. Siva S, Louie AV, Kotecha R, et al. Stereotactic body radiotherapy for primary renal cell carcinoma: a systematic review and practice guideline from the International Stereotactic Radiotherapy Consortium. Lancet Oncol. 2023;24(11):1139-1151.
8. Correa RJM, Louie AV, Zaorsky NG, et al. The emerging role of stereotactic ablative radiotherapy for primary renal cell carcinoma: a systematic review and meta-analysis. Eur Urol Focus. 2019;5(6):958-969.
9. Siva S, Pham D, Kron T, et al. Stereotactic ablative body radiotherapy for inoperable primary kidney cancer: a prospective clinical trial. BJU Int. 2017;120(5):623-630.
10. Staehler M, Bader M, Schlenker B, et al. RADSTER trial: A prospective phase II trial of stereotactic ablative radiotherapy for primary renal cell carcinoma. Eur Urol. 2021;80(2):214-221.
11. Correa RJM, Rodrigues GB, Chen H, et al. Stereotactic radiotherapy for primary renal cell carcinoma: a systematic review and meta-analysis of outcomes. Radiother Oncol. 2022;167:222-229.
12. Siva S, Louie AV, Warner A, et al. Pooled analysis of stereotactic ablative radiotherapy for primary renal cell carcinoma: A report from the International Radiosurgery Oncology Consortium for Kidney (IROCK). Cancer. 2018;124(5):934-942.
13. Ponsky L, Lo SS, Zhang Y, et al. Phase I dose-escalation study of stereotactic body radiotherapy (SBRT) for poor surgical candidates with localized renal cell carcinoma. Radiother Oncol. 2015;117(1):183-187.
14. Pham D, Thompson A, Kron T, et al. Stereotactic ablative body radiation therapy for primary kidney cancer: a 3-dimensional conformal technique associated with low rates of early toxicity. Int J Radiat Oncol Biol Phys. 2014;90(5):1061-1068.
15. Svedman C, Sandström P, Pisa P, et al. Stereotactic body radiotherapy of primary and metastatic renal lesions for patients with only one functioning kidney. Acta Oncol. 2008;47(8):1578-1583.
16. Staehler M, Bader M, Schlenker B, et al. Single fraction radiosurgery for the treatment of renal tumors. J Urol. 2015;193(3):771-775.
17. Siva S, Pham D, Gill S, et al. A systematic review of stereotactic radiotherapy ablation for primary renal cell carcinoma. BJU Int. 2012;110(11 Pt B):E737-E743.
18. Yamamoto T, Kadoya N, Takeda K, et al. Renal atrophy after stereotactic body radiotherapy for renal cell carcinoma. Radiat Oncol. 2016;11:72.
19. Pham D, Thompson A, Kron T, et al. Stereotactic ablative body radiation therapy for primary kidney cancer: a 3-dimensional conformal technique associated with low rates of early toxicity. Int J Radiat Oncol Biol Phys. 2014;90(5):1061-1068.
20. Ponsky L, Lo SS, Zhang Y, et al. Phase I dose-escalation study of stereotactic body radiotherapy (SBRT) for poor surgical candidates with localized renal cell carcinoma. Radiother Oncol. 2015;117(1):183-187.
21. Siva S, Jackson P, Kron T, et al. Impact of stereotactic radiotherapy on kidney function in primary renal cell carcinoma: establishing a dose-response relationship. Radiother Oncol. 2016;118(3):540-546.
22. Siva S, Pham D, Kron T, et al. Impact of stereotactic radiotherapy on kidney function in primary renal cell carcinoma: Establishing a dose-response relationship. Radiother Oncol. 2016;118(3):540-546.
23. Francolini G, Detti B, Ingrosso G, et al. Stereotactic body radiation therapy (SBRT) on renal cell carcinoma, an overview of technical aspects, biological rationale and current literature. Crit Rev Oncol Hematol. 2018;131:24-29.
24. Siva S, Chesson B, Bressel M, et al. TROG 15.03 phase II clinical trial of Focal Ablative STereotactic Radiosurgery for Cancers of the Kidney – FASTRACK II. BMC Cancer. 2018;18(1):1030.
25. Yamamoto T, Kadoya N, Takeda K, et al. Renal atrophy after stereotactic body radiotherapy for renal cell carcinoma. Radiat Oncol. 2016;11:72.
26. Prins FM, Kerkmeijer LGW, Pronk AA, et al. Renal cell carcinoma: alternative nephron-sparing treatment options for small renal masses, a systematic review. J Endourol. 2017;31(10):963-975.
27. Kunkle DA, Uzzo RG. Cryoablation or radiofrequency ablation of the small renal mass: a meta-analysis. Cancer. 2008;113(10):2671-2680.
28. Campbell S, Uzzo RG, Allaf ME, et al. Renal mass and localized renal cancer: AUA guideline. J Urol. 2017;198(3):520-529.
29. Siva S, Kothari G, Muacevic A, et al. Radiotherapy for renal cell carcinoma: renaissance of an overlooked approach. Nat Rev Urol. 2017;14(9):549-563.
30. Siva S, Ellis RJ, Ponsky L, et al. Consensus statement from the International Radiosurgery Oncology Consortium for Kidney for primary renal cell carcinoma. Future Oncol. 2016;12(5):637-645.
31. Correa RJM, Louie AV, Zaorsky NG, et al. The emerging role of stereotactic ablative radiotherapy for primary renal cell carcinoma: a systematic review and meta-analysis. Eur Urol Focus. 2019;5(6):958-969.
32. Siva S, Pham D, Gill S, et al. A systematic review of stereotactic radiotherapy ablation for primary renal cell carcinoma. BJU Int. 2012;110(11 Pt B):E737-E743.
33. Siva S, Bressel M, Sidhom M, et al. Stereotactic ablative body radiotherapy for primary kidney cancer (TROG 15.03 FASTRACK II): A non-randomised phase 2 trial. Lancet Oncol. 2024;25(2):193-204.
34. Correa RJM, Louie AV, Zaorsky NG, et al. The emerging role of stereotactic ablative radiotherapy for primary renal cell carcinoma: a systematic review and meta-analysis. Eur Urol Focus. 2019;5(6):958-969.
35. Staehler M, Bader M, Schlenker B, et al. Single fraction radiosurgery for the treatment of renal tumors. J Urol. 2015;193(3):771-775.
36. Palacios MA, Bohoudi O, Bruynzeel AME, et al. Role of daily plan adaptation in MR-guided stereotactic ablative radiation therapy for adrenal metastases. Int J Radiat Oncol Biol Phys. 2018;102(2):426-433.
37. Siva S, Kothari G, Muacevic A, et al. Radiotherapy for renal cell carcinoma: renaissance of an overlooked approach. Nat Rev Urol. 2017;14(9):549-563.
38. Sun X, Gan L, Na A, et al. Combination with stereotactic body radiotherapy offers a promising strategy to overcome resistance to immunotherapy in advanced renal cell cancer. J Oncol. 2019;2019:1483406.
39. Formenti SC, Demaria S. Systemic effects of local radiotherapy. Lancet Oncol. 2009;10(7):718-726
info@onco-suisse
- Vol. 15
- Ausgabe 4
- Juli 2025