- Swiss Melanoma Guidelines: Was ist neu?
Die Behandlung des Malignen Melanoms unterliegt einem stetigen Wandel mit vielen Neuerungen, die seit den zuletzt publizierten Schweizer Guidelines (2016) Einzug in den klinischen Alltag finden sollten. Es ist wichtig, klare und praxisnahe Richtlinien für die niedergelassenen Kollegen aber auch andere Fachbereiche zu formulieren, die mit dieser Entität in Berührung kommen, um möglichst eine einheitliche, evidenz-basierte Behandlung schweizweit anzustreben. Wir möchten die wichtigsten Neuerungen im folgenden Artikel zusammenfassen.
The treatment of malignant melanoma is subject to constant change with many innovations that should find their way into everyday clinical practice since the last published Swiss guidelines in 2016. It is important to formulate clear and practical guidelines for colleagues in private practice as well as other specialist areas that come into contact with this entity in order to strive for standardized, evidence-based treatment throughout Switzerland. We would like to summarize the most important new features in the following article.
Key Words: Malignant, Melanoma, guidelines, Switzerland, update
Die WHO-Klassifikation des Melanoms wurde an neue Erkenntnisse, welche durch molekulare Sequenzierungen gewonnen wurden, angepasst und ergänzt (1).
Neu wird der Begriff des low-CSD (low cumulative sun damage melanoma) für das SSM (superficial spreading melanoma) verwendet. Das high-CSD schliesst desmoplastische Melanome und das Lentigo maligna Melanom (LMM) ein. Zudem wurde das Konzept des Melanocytoms eingeführt, welches molekular dezidierte Subtypen einschliesst und die Entität des Spitz-Melanocytoms welcher den atypischen Spitz-Tumor ersetzt, einführt. Diese neuen Subtypen haben aufgrund ihrer molekularen Unterschiede wichtige Implikationen im Hinblick auf die Prognose, Nachsorge und Behandlung.
Bezüglich chirurgischer Exzision wird darauf hingewiesen, dass die diagnostische Biopsie eine Beurteilung der Gesamtdicke der Läsion zulassen sollte, mit kleinem Randsaum. Die pathologische Beurteilung sollte durch ein erfahrenes Institut erfolgen.
Die empfohlenen Sicherheitsabstände bleiben gleich, jedoch ist die Empfehlung für den Sicherheitsabstand beim Vorliegen eines Melanoma in situ mindestens 5mm (Tab. 1).
Neoadjuvante Systemtherapie
Interessant sind die Entwicklungen im Hinblick auf die neoadjuvante Immuntherapie. Es wird vermutet, dass bei der neoadjuvanten Anwendung von Checkpoint-Inhibitoren eine höhere Anzahl von T-Zell-Populationen bereits im Tumorbett aktiviert wird und somit eine bessere Wirkung am Primarius und in eventuell vorhandenen Mikrometastasen erzielt werden kann. Zwei randomisierte Phase-2-Studien führten zu einer frühen Berücksichtigung eines neoadjuvanten Ansatzes, gefolgt von einer «practice changing» Phase-III-Studie, welche die neoadjuvante Immuntherapie als neuen Behandlungsstandard für Patienten im Stadium III und tastbaren oder bestätigten Lymphknotenmetastasen etabliert (2-4).
Während in der SWOG-S1801-Studie die Monotherapie mit Pembrolizumab über drei Zyklen vor der Operation evaluiert wurde, untersuchte die NADINA-Studie die Kombination aus Ipilimumab und Nivolumab. Die 2024 im New England Journal of Medicine veröffentlichte randomisierte Phase-III-NADINA-Studie überprüfte die Kombination mit Ipilimumab und Nivolumab über zwei Zyklen vor der Operation mit adjuvanter Weiterführung bei nicht ansprechenden oder bei partieller Remission im Vergleich zu einer direkten Operation mit anschliessender adjuvanter Immuntherapie. Nicht nur ein signifikanter Vorteil für das ereignisfreie Überleben (EFS), sondern auch ein Unterschied in der mittleren Überlebenszeit von 8 Monaten (P<0,001) konnte gezeigt werden (4). Deswegen muss die neoadjuvante Immuntherapie bei Patienten im Stadium III mit tastbaren oder vergrösserten und bestätigten Lymphknotenmetastasen vor der definitiven Operation im interdisziplinären Tumorboard evaluiert werden. Renommierte Experten weltweit setzen sich für die Umsetzung dieses Ansatzes ein (5).
Sentinel-Lymphknoten
Die Indikationen für die Durchführung des Sentinel-Lymphknotens bleiben gleich. Dieser ist empfohlen bei einer Breslow-Tumordicke von 0.8 mm oder grosser oder bei Vorliegen einer Exulzeration (pT1b). Dies selbstverständlich bei klinisch negativen, regionären Lymphknoten. Die prognostische Bedeutung bleibt hoch, auch wenn aufgrund aktueller Daten die Notwendigkeit einer regionären Lymphonodektomie zu Recht hinterfragt wird. Ein korrektes Staging ist im Hinblick auf die Evaluation der adjuvanten Therapie wichtig.
Zu beachten gilt es, dass die pathologische Aufarbeitung der Sentinel-Lymphknoten aufwändig ist und diverse Kriterien aufgeführt gehören: die genaue Lokalisation der Metastase (subkapsulär, parenchymal oder beides), der Abstand der Metastase von der Kapsel, die maximale Dimension der Metastase und das Vorhandensein von extranodalem Befall. Die maximale Dimension ist ebenfalls wichtig in Bezug auf die Indikation zur adjuvanten Therapie.
Bei Vorhandensein von Melanom Zellen im Sentinel-Lymphknoten, wird nicht mehr routinemässig eine Komplettierungs-Lymonodektomie (CLND) empfohlen. Dies, da zwei wichtige Studien (DeCoG & MSLT-II) zwar eine tiefere Lokal Rezidivrate für Letztere zeigen konnten, jedoch keine Verbesserung des Gesamtüberlebens bei doch in Kauf zu nehmender höherer Morbidität, gegenüber alleiniger Observation mit regelmässigen sonographischen Verlaufskontrollen und sequenzieller CLND (2, 3). Nach Diskussion an einem interdisziplinären Tumorboard, soll vor allem die adjuvante Therapie diskutiert werden.
Bei Vorhandensein von klinisch oder radiologisch nachgewiesenen oder vermuteten Lymphknotenmetastasen ist die Therapeutische Lymphonodektomie (TLND) unverändert indiziert. Dies, nach vorangegangenem Staging mittels PET-CT oder Kontrastmittel-CT und einem Schädel-MRI. Die Therapeutische Lymphonodektomie soll die Totalität des befallenen Lymphknotenareals beinhalten und als en-bloc Dissektion erfolgen. Eine gezielte Lymphknotenexzision (node-picking) ist nicht empfohlen.
Adjuvante Systemtherapie
Über Jahre waren Interferone für die adjuvante Therapie zugelassen und deren Indikation kontrovers diskutiert worden. Diese werden, nach Einzug der Immun-Checkpoint-Inhibitoren und der zielgerichteten Therapie in Form der Tyrosin-Kinase-Inhibitoren, nicht mehr angewendet.
Für Stadien III und IV besteht eine Indikation für eine adjuvante Therapie nach Besprechung am interdisziplinären Tumorboard. Es besteht einerseits die Möglichkeit der Immuntherapie (Checkpoint-Inhibitor in Monotherapie), welche bevorzugt Anwendung findet. Bei BRAF mutierten Melanomen kann auch die Kombinationsbehandlung eines BRAF & MEK-Inhibitors zur Anwendung kommen (4,5). Deshalb ist eine molekulare Untersuchung vor der Tumorboard-Besprechung Voraussetzung.
Bei Patienten mit BRAF-Mutation sollte die Entscheidung möglichst personalisiert erfolgen unter Berücksichtigung des Toxizitätsprofils, der Begleiterkrankungen, des Alters und der Lebensqualität sowie eines künftigen Kinderwunsches.
Für Stadien IIIA mit einer Tumorlast im Sentinel-Lymphknoten von < 1 mm wird eine adjuvante Systemtherapie nicht routinemässig empfohlen. Bei der kleinen Untergruppe von Patienten im Stadium IIIA mit höherem Rückfallrisiko (SLNB > 1 mm) sollte eine adjuvante Behandlung im Rahmen klinischer Studien erwogen werden. Gibt es keine klinische Studie, kann eine adjuvante Behandlung nach ausgewogener Diskussion über Risikominderung und Langzeittoxizität mit dem Patienten diskutiert werden.
Für die Stadien II ist eine adjuvante Systemtherapie grundsätzlich nicht empfohlen, wobei diese Fälle auch am Tumorboard besprochen werden sollten, um einen Einschluss in laufenden Studien zu ermöglichen. Eine ausgewogene Evaluierung des Nutzen-Risikos ist in allen Fällen durchzuführen und das Potenzial für Langzeit-Toxizitäten mit den Patient/-innen zu diskutieren. Ganz aktuell hat Swissmedic für die Stadien IIB und C Pembrolizumab zugelassen, jedoch ist eine Listung auf der Spezialitätenliste noch nicht erfolgt.
Lokalisiertes und loco-regionäres Melanom
Bei resektabler oder oligometastasierter Erkrankung sollte ein chirurgischer Eingriff angeboten werden. Vor allem, wenn er mit einer akzeptablen und begrenzten Morbidität einhergeht. Eine adjuvante Behandlung sollte geprüft werden, nach Besprechung am interdisziplinären Tumorboard in Bezug auf eine Radiotherapie bzw. Systemtherapie.
In selektionierten Fällen, die unter Immuntherapie ansprechen, aber eine lokalisierte Progression zeigen, kann eine chirurgische Resektion erwogen werden, wenn eine vollständige Resektion als sinnvoll erachtet wird. Im palliativen Kontext kann eine Chirurgie bei metastasierter Erkrankung eine wirksame palliative Behandlungsoption sein.
Strahlentherapie
Verschiedene Studien konnten eine gute Wirksamkeit der Strahlentherapie in Bezug auf eine lokale Kontrolle zeigen. Abhängig von Lokalisation und Patientenpräferenz kann diese als Alternative bei inoperablen Tumoren oder bei älteren Patienten mit hoher Komorbidität angeboten werden. Insbesondere bei Lentigo-Maligna ist eine primäre, definitive Bestrahlung eine etablierte Option mit hervorragenden Kontrollraten. Weiterhin kann die Radiotherapie in den palliativen Situationen zur lokalen Kontrolle und zur Schmerzbehandlung eingesetzt werden.
Adjuvante Strahlentherapie
Für eine Strahlentherapie des primären Tumorbettes im postoperativen, adjuvanten Setting gibt es kaum Daten, ausser für das desmoplastische Melanom, welches eine höhere lokale Rezidivrate aufweist. Eine postoperative Bestrahlung der beteiligten Lymphabflusswege nach Lymphonodektomie führt generell zu einer signifikanten Verbesserung der regionalen Tumorkontrolle, jedoch ohne Auswirkung auf das Überleben. Es ist jedoch mit einer Zunahme an Toxizität (Lymphödeme, Fibrose) verbunden. Diese sollte deshalb am interdisziplinären Tumorboard besprochen werden.
Palliative Strahlentherapie
Palliative perkutane Strahlentherapie von unkontrollierten Knochenmetastasen führt bei den meisten Patienten zu signifikanter Schmerzlinderung. Eine palliative perkutane Strahlentherapie von destabilisierenden Skelettmetastasen führt innerhalb von 3-6 Monaten zu einer Rekalzifizierung und Stabilisierung des betroffenen Knochens. Aus diesem Grunde wird eine palliative Strahlentherapie sowohl für symptomatische als auch für asymptomatische, aber kritische Knochenmetastasen empfohlen.
Oligometastatische Erkrankung
Für extrakranielle oligometastatische Erkrankung zeigen Studien potenzielle Vorteile in Krankheitskontrolle und Überleben durch stereotaktische, ablative Radiotherapie (SABR) im Vergleich zur Standardbehandlung, obwohl spezifische Studien für malignes Melanom fehlen. Die Kombination von SABR mit Immuntherapie ist sicher, aber Vorsicht ist bei gleichzeitiger BRAF-Hemmung geboten. Aufgrund begrenzter Daten für Melanome wird die Einbeziehung dieser Patienten in laufende Studien stark empfohlen.
Systemtherapie bei fortgeschrittenen Stadien
Bei der systemischen Behandlung von Melanomen mit Immun-Checkpoint-Inhibitoren haben Phase-3-Studien gezeigt, dass Anti-PD1-Monotherapien (Pembrolizumab, Nivolumab) oder die Kombination aus Anti-PD1 (Nivolumab) und Anti-CTLA4 (Ipilimumab) für nicht resektable oder metastasierte Melanome eine Standarderstlinientherapie darstellen. Die Checkmate 067-Studie ergab, dass die mediane Gesamtüberlebenszeit (OS) bei der Kombination von Ipilimumab und Nivolumab 72,1 Monate, bei Nivolumab allein 36,9 Monate und bei Ipilimumab-Monotherapie 19,9 Monate beträgt (9). In der Keynote 006-Studie war das mediane OS bei Pembrolizumab 32,7 Monate und bei Ipilimumab 15,9 Monate (10). Die Kombination aus Nivolumab und dem Anti-LAG3-Antikörper Relatlimab zeigte eine längere mediane progressionsfreie Überlebenszeit im Vergleich zu Nivolumab allein (10,1 vs. 4,6 Monate) (11). Allerdings ist die Nivolumab-Ipilimumab-Kombination mit einer höheren Rate an schweren immunbezogenen Nebenwirkungen verbunden.
Biomarker, um Patienten zu identifizieren, die von einer Kombinationstherapie profitieren, sind bisher nicht etabliert. Die Therapieentscheidung zwischen Anti-PD1-Monotherapie und Nivolumab-Ipilimumab sollte auf prognostischen Markern wie Vorhandensein von Hirnmetastasen, hohen LDH-Werten, ECOG-Status und Komorbiditäten basieren. Ipilimumab-Nivolumab wird bevorzugt bei asymptomatischen Hirnmetastasen und hohen LDH-Werten empfohlen. Bei Patienten mit vorbestehenden Autoimmunerkrankungen sollte eine multidisziplinäre Teamberatung erfolgen. Im Gegensatz zu früher stellen Autoimmunerkrankungen per se nicht zwingend Kontraindikationen für eine Checkpoint-Inhibitor-Therapie dar.
Bei BRAF-mutiertem Melanom zeigten drei Kombinationen von BRAF/MEK-Inhibitoren (Vemurafenib-Cobimetinib, Dabrafenib-Trametinib, Encorafenib-Binimetinib) eine Verbesserung der PFS und OS im Vergleich zur BRAF-Inhibitor-Monotherapie (12, 13). Bei Bedarf auf ein rasches Ansprechen bzw. eine hohe Ansprechrate kann bei BRAF-mutierten Patienten die Kombination der oben genannten erfolgen. Ansonsten bildet auch hier die Immuntherapie die empfohlene erste Linie. Die Kombination von Atezolizumab, Vemurafenib und Cobimetinib kann bei Patienten mit BRAF-mutiertem Melanom, die für eine ICI-Kombinationsbehandlung ungeeignet sind, in Erwägung gezogen werden, bzw. als Salvage-Therapie im weiteren Verlauf der Erkrankung.
Zweitlinienbehandlung
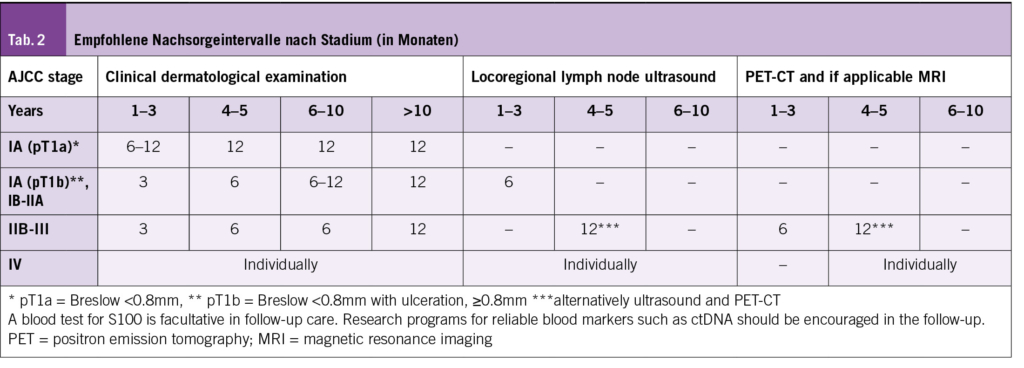
Ipilimumab-Nivolumab wird als bevorzugte Zweitlinientherapie nach Anti-PD(L)1-Inhibitoren für BRAF-nicht-mutierte Melanome dar und für BRAF-mutierte Patienten nach einer Kombinationsbehandlung mit einem BRAF- und MEK-Inhibitor empfohlen. T-VEC, eine onkolytische Virustherapie, ist für die lokale Behandlung von nicht resezierbarem Stadium IIIB-IIID-M1a Melanom zugelassen. Vor allem bei gut zugänglichen, oberflächlichen Lymphknotenmetastasen und kutanen Metastasen gilt T-VEC als gute Option. Die klassische, anti-neoplastische Chemotherapie wird bei metastasiertem Melanom seltener oder als letzte Option angesehen. Dacarbazin und Temozolomid, die am häufigsten verwendeten Wirkstoffe, zeigen jedoch nur eine kurze Wirkung und eine begrenzte Verbesserung des Gesamtüberlebens. Chemotherapie hat weiterhin einen Stellenwert bei prognostisch schlechten Melanomen, z.B. bei Patienten mit einer hohen LDH und refraktärer Erkrankung (Tab. 2).
Copyright
Aerzteverlag medinfo AG
SEELAND CANCER CENTER
Tumorzentrum – Biel
Hans-Hugi Strasse 3
2502 Biel
Der Autor hat keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
- WHO-Klassifikation: Aktualisierung mit neuen Begriffen wie «low-CSD» für SSM, Einführung des Melanocytom-Konzepts und Ersetzung des atypischen Spitz-Tumors durch Spitz-Melanocytome.
- Chirurgische Exzision und Sentinel-Lymphknoten: Wichtigkeit einer vollständigen diagnostischen Biopsie und Beibehaltung der Indikationen für Sentinel-Lymphknoten-Biopsie bei bestimmten Tumordicken.
- Komplettierungs-Lymonodektomie: Empfehlung gegen routinemässige Komplettierungs-Lymonodektomie bei Melanomzellen im Sentinel-Lymphknoten zugunsten individueller Therapieentscheidungen.
- Adjuvante Systemtherapie: Ersetzung von Interferonen durch Immun-Checkpoint-Inhibitoren und Tyrosin-Kinase-Inhibitoren, insbesondere bei BRAF-mutierten Melanomen.
- Neoadjuvante und lokalisierte Therapien: Neoadjuvante Immuntherapie bietet Vorteile, chirurgische Eingriffe sind bei resektablen Fällen indiziert und Strahlentherapie wird für lokale Kontrolle oder Palliation eingesetzt.
1. WHO blue book: classification of skin tumours 5th edition.
2. Reijers ILM, Menzies AM, van Akkooi ACJ, Versluis JM, van den Heuvel NMJ, Saw RPM, et al. Personalized response-directed surgery and adjuvant therapy after neoadjuvant ipilimumab and nivolumab in high-risk stage III melanoma: the PRADO trial. Nat Med. 2022;28(6):1178-88.
3. Patel SP et al. Neoadjuvant–Adjuvant or Adjuvant-Only Pembrolizumab in Advanced Melanoma. N Engl J Med 2023;388:813-823
4. Blank CU et al. Neoadjuvant Nivolumab and Ipilimumab in Resectable Stage III Melanoma. N Engl J Med 2024;391:1696-1708
5. Hauschild A et al. Neoadjuvant or perioperative therapy for melanoma metastasis in clinical practice: an international survey. Lancet Oncol 2025;26(1):12-14.
6. Faries MB, Thompson JF, Cochran AJ, Andtbacka RH, Mozzillo N, Zager JS, et al. Completion Dissection or Observation for Sentinel-Node Metastasis in Melanoma. N Engl J Med. 2017;376(23):2211-22.
7. Leiter U, Stadler R, Mauch C, Hohenberger W, Brockmeyer NH, Berking C, et al. Final Analysis of DeCOG-SLT Trial: No Survival Benefit for Complete Lymph Node Dissection in Patients With Melanoma With Positive Sentinel Node. J Clin Oncol. 2019;37(32):3000-8.
8. Eggermont AMM, Blank CU, Mandala M, Long GV, Atkinson V, Dalle S, et al. Adjuvant Pembrolizumab versus Placebo in Resected Stage III Melanoma. N Engl J Med. 2018;378(19):1789-801.
9. Long GV, Hauschild A, Santinami M, Atkinson V, Mandala M, Chiarion-Sileni V, et al. Adjuvant Dabrafenib plus Trametinib in Stage III BRAF-Mutated Melanoma. N Engl J Med. 2017;377(19):1813-23.
10. Wolchok JD, Chiarion-Sileni V, Gonzalez R, Grob JJ, Rutkowski P, Lao CD, et al. Long-Term Outcomes With Nivolumab Plus Ipilimumab or Nivolumab Alone Versus Ipilimumab in Patients With Advanced Melanoma. J Clin Oncol. 2022;40(2):127-37.
11. Robert C, Ribas A, Schachter J, Arance A, Grob JJ, Mortier L, et al. Pembrolizumab versus ipilimumab in advanced melanoma (KEYNOTE-006): post-hoc 5-year results from an open-label, multicentre, randomised, controlled, phase 3 study. Lancet Oncol. 2019;20(9):1239-51.
12. Tawbi HA, Schadendorf D, Lipson EJ, Ascierto PA, Matamala L, Castillo Gutierrez E, et al. Relatlimab and Nivolumab versus Nivolumab in Untreated Advanced Melanoma. N Engl J Med. 2022;386(1):24-34.
13. Ascierto PA, McArthur GA, Dreno B, Atkinson V, Liszkay G, Di Giacomo AM, et al. Cobimetinib combined with vemurafenib in advanced BRAF(V600)-mutant melanoma (coBRIM): updated efficacy results from a randomised, double-blind, phase 3 trial. Lancet Oncol. 2016;17(9):1248-60.
14. Dummer R, Ascierto PA, Gogas HJ, Arance A, Mandala M, Liszkay G, et al. Encorafenib plus binimetinib versus vemurafenib or encorafenib in patients with BRAF-mutant melanoma (COLUMBUS): a multicentre, open-label, randomised phase 3 trial. Lancet Oncol. 2018;19(5):603-15.
info@onco-suisse
- Vol. 15
- Ausgabe 2-3
- Mai 2025