- Von BCG zur Next-Generation-Therapie: Fortschritt beim nicht-muskelinvasiven Blasenkarzinom
Nicht-muskelinvasiver Blasenkrebs (NMIBC) macht rund 75 % aller Blasenkrebs-Neudiagnosen aus und ist durch hohe Rückfall- und relevante Fortschreitungsraten gekennzeichnet. Trotz der etablierten transurethralen Resektion der Blasentumoren (TURB) und intravesikaler Bacillus-Calmette-Guérin-Instillation (BCG) bestehen Limitationen, insbesondere bei BCG-Versagen, -Unverträglichkeit und eingeschränkter Verfügbarkeit. Die radikale Zystektomie bleibt eine wirksame Salvage-Option, ist jedoch mit hoher Morbidität und funktionellen Einbussen verbunden. Seit 2014 ermöglicht die US-amerikanische Arzneimittelbehörde FDA Zulassungen über einarmige Phase-II-Studien für Patienten mit BCG-Versagen. Seither wurden organerhaltende Ansätze wie virale und nicht-virale Immuntherapeutika, Antikörper-Wirkstoff-Konjugate, photodynamische Verfahren und intravesikale Freisetzungssysteme entwickelt. Präparate wie Nadofaragen Firadenovec (Adstiladrin™), N-803 plus BCG (Anktiva™) und Kombinationen mit Immun-Checkpoint-Inhibitoren zeigen vielversprechende Ergebnisse. Diese Fortschritte eröffnen effektive, funktions- und organerhaltende Therapiealternativen beim NMIBC.
Non-muscle-invasive bladder cancer (NMIBC) accounts for around 75% of all new bladder cancer diagnoses and is characterized by high recurrence and progression rates. Despite the established transurethral resection of bladder tumors (TURB) and intravesical Bacillus Calmette-Guérin (BCG) instillation, there are limitations, particularly in cases of BCG failure, intolerance, and limited availability. Radical cystectomy remains an effective salvage option, but is associated with high morbidity and functional impairment. Since 2014, the US Food and Drug Administration (FDA) has allowed approvals based on single-arm phase II studies for patients with BCG failure. Since then, organ-preserving approaches such as viral and non-viral immunotherapies, antibody-drug conjugates, photodynamic therapies, and intravesical delivery systems have been developed. Preparations such as nadofaragen firadenovec (Adstiladrin™), N-803 plus BCG (Anktiva™), and combinations with immune checkpoint inhibitors are showing promising results. These advances open up effective, function- and organ-preserving treatment alternatives for NMIBC.
Keywords: Nicht-muskelinvasiver Blasenkrebs (NMIBC), Intravesikale Immun- und Gentherapien, Organerhaltende Therapieinnovationen
Einführung
Der nicht-muskelinvasive Blasenkrebs (NMIBC) repräsentiert etwa 75 % aller Neuerkrankungen an Urothelkarzinomen der Harnblase und ist durch hohe Rezidiv- (50–70 %) sowie relevante Progressionsraten zum muskelinvasiven Karzinom (MIBC) oder zur metastasierten Erkrankung (bis zu 30 % bei T1 Tumoren) charakterisiert. Die risikoadaptierte Kombination aus transurethraler Resektion (TUR-B) und adjuvanter intravesikaler Instillationstherapie mit Bacillus Calmette-Guérin (BCG) beim intermediate- (IR) und high-risk (HR) NMIBC gilt seit Jahrzehnten als therapeutischer Standard. Allerdings zeigt sich in bis zu 40 % der Fälle ein Therapieversagen; zusätzlich ist bei rund 20 % der Patienten ein Abbruch aufgrund von Nebenwirkungen erforderlich.
Die radikale Zystektomie stellt zwar eine onkologisch wirksame Salvage-Option dar, ist jedoch mit substanzieller Morbidität und oft relevanter Beeinträchtigung der Lebensqualität assoziiert. Der ausgeprägte Wunsch vieler Patienten nach Organerhalt sowie die seit 2012 bestehenden globalen Engpässe in der BCG-Verfügbarkeit unterstreichen den dringenden Bedarf an effektiven und alternativen organerhaltenden Therapiestrategien.
Während initiale therapeutische Innovationen primär auf das BCG-unresponsive (BCGu)(1) NMIBC fokussierten, adressieren neuere Wirkstoffe zunehmend auch BCG-naive HR und IR NMIBC. Parallel rückt die invasive Therapiedeeskalation bei niedriggradigen Tumoren (LG), welche etwa 50 % aller NMIBC ausmachen, zunehmend in den Fokus. Angesichts der Limitationen repetitiver TUR-B – einschliesslich kumulativer Morbidität mit potentiellem Funktionsverlust – gewinnen daher bei den LG Tumoren Konzepte wie chemotherapeutische oder immunologische Ablationsstrategien an Bedeutung (2).
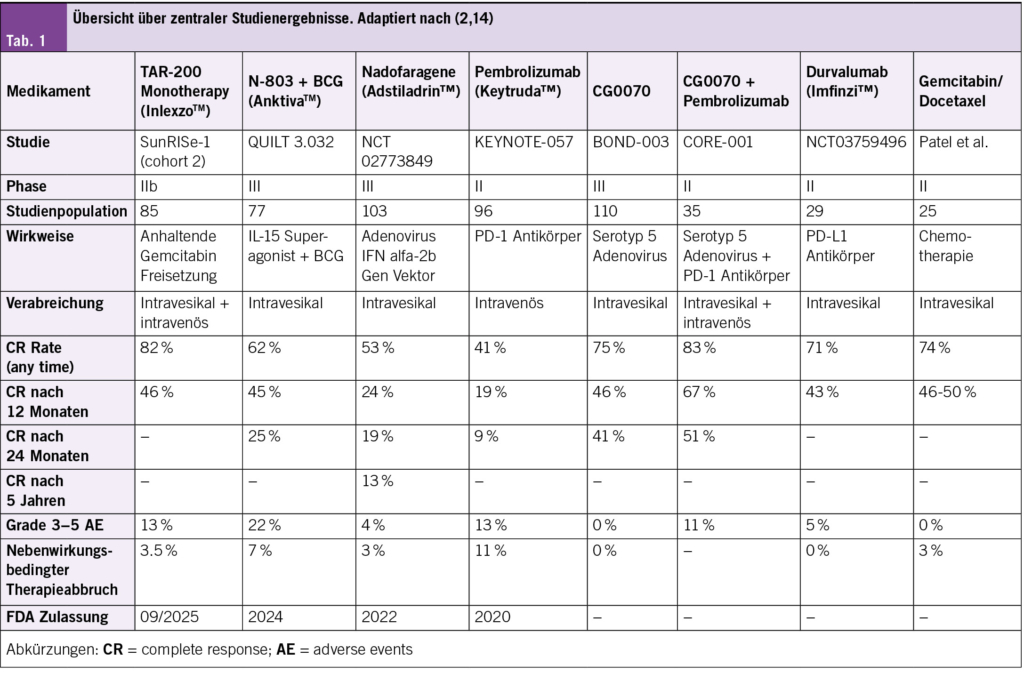
Im Folgenden werden vielversprechende therapeutische Ansätze vorgestellt, die das Management des NMIBC revolutionieren können. Eine Übersicht zentraler Studienergebnisse findet sich in Tabelle 1. Eine schematische Darstellung der Subklassen neuer intravesikaler Medikamente bietet Abbildung 1.
Neue intravesikale Medikamente
Intravesikale Immunotherapien
Die virale Gentherapie stellt einen vielversprechenden Ansatz zur Steigerung der Wirksamkeit intravesikaler Behandlungen dar, indem rekombinante Proteine mittels viraler Vektoren direkt in urotheliale Zellen eingebracht werden. Nadofaragen-Firadenovec (Adstiladrin™), ein rekombinanter Adenovirus, der für den Transport und die intrazelluläre Produktion des Gens Interferon alfa-2b konstruiert wurde, war die erste solche Therapie, die im Jahre 2022 von der FDA mit 3 und 12 Monats complete -response-Raten (CR) von 53 % und 24 % zur Behandlung von BCGu NMIBC mit Carcinoma in situ (CIS) zugelassen wurde (3). Im Jahr 2024 wurden die Fünfjahresdaten publiziert, wobei nach 57 Monaten immer noch 13 % der Patienten kein high-grade (HG) Rezidiv erlitten.
Eine weitere vielversprechende virale Therapie stellt Cretostimogene Grenadenorepvec (CG0070) dar, ein modifizierter Adenovirus, der darauf ausgelegt ist, maligne Blasenzellen mit defizienter oder mutierter Expression des Retinoblastom-Tumorsuppressorgens gezielt anzugreifen. In der Phase-III-Studie BOND-003 Studie konnte CG007 eine CR nach einem Jahr von 46 % bei BCGu NMIBC Patienten mit CIS +/- HG Ta/T1 erreichen. Im Rahmen der Phase-3-PIVOT-006 sowie Phase-2-CORE-008-Studien wird CG0070 weiter untersucht.
Ein nichtvirales Therapieverfahren ist Nogapendekin Alfa-inbakicept (N-803) (AnktivaTM), ein Interleukin-15 Superagonist, der zusammen mit BCG intravesikal appliziert wird. N-803 wirkt über eine Verstärkung der Aktivierung natürlicher Killerzellen und T-Zellen. Im Rahmen der QUILT 3.032 Studie erreicht N-803 in Kombination mit BCG eine CR von 45 % nach 12 Monaten und wurde in einem beschleunigten Verfahren im April 2024 durch die FDA zugelassen (4), neuerdings auch in Kombination mit dem rekombinanten BCG VPM1002BC (5), im Falle, dass nicht genügend BCG Tice in den US zur Verfügung stehen sollte.
Über eine synergistische Stimulation der angeborenen sowie der adaptiven Immunantwort wirkt das nicht eiweisshaltige und nichtvirale, ebenfalls intravesikal verabreichte DNA Plasmid Detalimogene Voraplasmid (EG-70), wobei über Aktivierung des RIG-I Rezeptor natürliche Killerzellen stimuliert werden und IL-12 zu einer T-Zell abhängigen Zytokinantwort führt. Erste Resultate der Phase-II-LEGEND-Studie können bei einer CR nach 6 Monaten von 60 % als vielversprechend gewertet werden.
Die intravesikale Verabreichung von Durvalumab (Imfinzi™) wurde im Rahmen einer Phase II Studie bei BCG failure Patienten durch die Hellenic GU Cancer Group untersucht und erreichte eine CR nach 12 Monaten von 39 % (6).
Intravesikale Photodynamische Therapien
Belzupacap sarotalocan (bel-sar, AU-011) ist ein Konjugat aus Nanopartikeln des Humanen Papillomavirus (HPV-NPs) und wirkt über Infrarotlicht aktivierbare fluoreszendierende Tinte IR-700. Nach Injektion in die Tumorbasis bindet HPV-NP an Heparansulfatierte Proteoglykane, welche durch die Tumorzellen überexprimiert werden. Über Infrarotlicht erfolgt die Aktivierung von IR-700 mit Freisetzung freier Sauerstoffradikale mit Schädigung der Tumorzellmembranen. Zudem führt HPV-NP zusätzlich zu einer Immunreaktion. Im Rahmen einer Phase-I-Studie (NCT05483868) konnte bei vier von fünf Patienten mit einem IR-NMIBC in der TUR-B, die sieben bis zwölf Tage nach der Applikation durchgeführt wurde, kein vitales Tumorgewebe mehr nachgewiesen werden.
Über die Freisetzung freier Sauerstoffradikale wirkt ebenfalls TLD-1433, welches nach intravesikaler Instillation durch die Überexpression des Transferrin Rezeptors vermehrt in Tumorzellen aufgenommen und mittels 520nm Laser aktiviert wird. In einer Phase-II-Studie (NCT03945162) konnte in der BCGu Gruppe eine CR von 38 % nach 12 Monaten erreicht werden.
Neue intravesikale Chemotherapien/Chemotherapien mit prolongierter Wirkstoffadhärenz/ADC
Die sequenzielle intravesikale Kombinationstherapie mit Gemcitabin und Docetaxel (GemDoce) hat als alternative off-label Behandlungsoption für Patientinnen und Patienten als Ersatz für BCG oder mit BCGu NMIBC zunehmend an Bedeutung gewonnen. Gem/Doce, das die zytotoxischen und antitumoralen Eigenschaften beider Wirkstoffe nutzt, wurde zunächst als Salvage-Therapie beim BCGu eingesetzt, wobei hier CR-Raten von 57 % nach 12 Monaten erreicht werden können (7).
In retrospektiven Studien scheint Gem/Doce zumindest gleichwertig wie BCG zu wirken, und da Gemcitabin alleine beim BCGu NMIBC der BCG Re-Induktion überlegen ist, ist zu erwarten, dass Gem/Doce möglicherweise noch besser wirkt. Resultate der aktuell laufenden randomisierten BRIDGE-Studie, welche BCG versus GemDoce in BCG-naiven Patienten untersucht, sind frühestens 2030 zu erwarten (8).
Bei Oncofid-P-B handelt es sich um ein neues, wasserlösliches Konjugat aus Hyaluronsäure und dem Zytostatikum Paclitaxel zur intravesikalen Administration. Die spezifische Bindung der Hyaluronsäure an den auf Blasentumorzellen überexprimierten CD44-Rezeptor erlaubt eine selektive Paclitaxel-Aufnahme und eine 800-fach erhöhte intrazelluläre Konzentration gegenüber der alleinigen intravesikalen Applikation von Paclitaxel. In der Phase-I-Studie konnte beim BCGu NMIBC eine CR von 40 % nach 15 Monaten erreicht werden. Aktuell wird Oncofid-P-B im Rahmen der Phase-III-Studie Orion-BC untersucht.
UGN-102 (VesiGel™) ist eine Mitomycin-haltige reverse-thermal-Gel-Formulierung, die gekühlt flüssig ist und sich bei Körpertemperatur verfestigt. Dadurch verlängerte sich die intravesikale Wirkstoffexposition von 1–2 Stunden auf 4–6 Stunden. Es handelt sich hierbei um einen neuartigen Verabreichungsmechanismus für einen in der Blasenkrebstherapie bereits etablierten Wirkstoff. Im Rahmen der Phase-III-ENVISION-Studie wurde die primäre Chemoablation von LG NMIBC untersucht. Eine CR nach 15 Monaten konnte bei 61 % der Patienten beobachtet werden.
Phase-I-Studien mit reverse-thermal Hydrogel welche Imiquimod (TLR-7 Agonist) (UGN-201) und Zalifrelimab (CTLA-4 Antikörper) (UGN-301) enthalten, laufen aktuell.
Das Antikörper-Wirkstoff-Konjugat (ADC) Enfortumab / Vedotin (EV) hat die Therapie des lokal fortgeschrittenen, nicht resezierbaren sowie metastasierten Urothelkarzinomes revolutioniert. Die intravesikale Verabreichung von EV bei BCGu NMIBC wird im Rahmen der Phase-I-Studie EV-104 untersucht. Ergebnisse, mit Ausnahme der Tolerabilität und zum Sicherheitsprofil, welche keine unerwünschten Arzneimittelwirkungen ≥Grad 3 zeigten, sind aktuell noch ausstehend.
Intravesikale Wirkstofffreisetzungssysteme
TAR-200 (InlexzoTM) stellt eine neuartige und innovative intravesikale Applikation beim NMIBC dar. Die Platzierung des TAR-200 Devices in der Harnblase erfolgt transurethral im Rahmen eines ambulanten Eingriffs und ermöglicht eine kontinuierliche, über 3 Wochen dauernde lokale Freisetzung von Gemcitabin ohne Notwendigkeit der wiederholten Katheterinstillation. Dieses System adressiert zentrale Limitationen bisheriger intravesikaler Behandlungen, wie kurze Verweilzeiten von 1–2 Stunden und anschliessendes Entleeren der Blase, was eine gleichmässige und langanhaltende Exposition gegenüber dem Wirkstoff verhindert. Die Sicherheit und Wirksamkeit von TAR-200 in verschiedenen Settings des NMIBC – sowohl als Monotherapie als auch in Kombination mit Immuncheckpoint-Inhibitoren – werden im Rahmen des randomisierten SunRISe-Studienprogramms untersucht. In der Kohorte 2 (TAR-200 Monotherapie, CIS +/- papillary disease) der Ende Juli publizierten Phase-2b-Studie SunRISe-1 erreichte TAR-200 eine Gesamt-CR von 82.4 % und eine CR von 45.9 % nach 12 Monaten bei einer medianen Responsedauer von 25.8 Monaten. Therapiebedingte Nebenwirkungen ≥ Grad III traten bei 12.9 % der Patienten auf, ein Therapieunterbruch war bei 31.8 % notwendig, nebenwirkungsbedingt musste die Therapie bei 3.5 % der Patienten abgebrochen werden (9). Anfang Semptember 2025 wurde TAR-200 durch die FDA zur Behandlung von BCGu NMIBC mit CIS +/- papilläre Tumoren zugelassen.
Den gleichen Prinzipien wie TAR-200 folgt TAR-210, wobei hier eine kontinuierliche Freisetzung des Pan-FGFR3 Tyrosin Kinase Inhibitors Erdafitinib erfolgt. Die Evaluation erfolgt im Rahmen der Phase-3-MoonRISe-1 Studie beim IR NMIBC bei Patienten mit einer FGFR3-Alteration. Als Vergleichsarm dient allerdings nicht BCG als aktuelle Standardtherapie, sondern eine intravesikale Chemotherapie mit Mitomycin oder Gemcitabin.
Systemische Therapien / Kombinationstherapien
2020 wurde Pembrolizumab (Keytruda™) als intravenöse Immuncheckpoint-Inhibitor (ICI) Therapie basierend auf den Resultaten der Keynote-057-Studie zur Behandlung des BCGu NMIBC als erstes Medikament aufgrund einer nicht randomisierten Phase-2-Studie durch die FDA zugelassen. Die relativ geringe CR von 19 % nach 12 Monaten und die vergleichsweise hohe Toxizität unterstrich allerdings den Bedarf einer Therapieweiterentwicklung. Eine Reihe von Studien untersucht die Kombinationstherapie zwischen systemischem ICI und intravesikalem BCG in verschiedenen Settings des NMIBC.
Pembrolizumab wird aktuell im Rahmen der Keynote-676-Studie in Kombination mit BCG untersucht. Die Kohorte A vergleicht die Kombinationstherapie gegenüber der alleinigen Fortführung der BCG-Therapie bei HG-Rezidiv/Persistenz nach adäquater BCG-Induktion beim HG-NMIBC (papillary disease +/- CIS). Kohorte B vergleicht die alleinige BCG-Therapie gegenüber der Therapie mit Pembrolizumab + BCG mit voller und reduzierter Erhaltungstherapie bei BCG-naiven Patienten. Resultate werden in naher Zukunft erwartet.
Die ALBAN-Studie untersucht die Kombination des PD-L1-Inhibitors Atezolizumab (Tecentriq™) in Kombination mit BCG bei BCG-naiven Patienten. Resultate werden nicht vor 2028 erwartet.
Kürzlich wurden im Nature Medicine die Resultate der CREST Studie veröffentlich, welche die subkutane Verabreichung von Sasanlimab (anti-PD1 Antikörper) mit intravesikalem BCG (Induktion (I) + Erhaltung (M) (Arm A) oder nur Induktion (Arm B)) mit der alleinigen BCG-Therapie (Arm C) beim BCG-naiven HR-NMIBC verglich. In Bezug auf das eventfreie Überleben (high-grade Rezidiv, Progression, CIS Persistenz, Tod) zeigte der Interventionsarm A ein 7.3 % geringeres Risiko gegenüber dem Vergleichsarm C (10). Dies bei einer allerdings 4.6x höheren Rate an Grad ≥ III Nebenwirkungen (6.3 % (BCG I&M) vs. 29.1 % (Sasanlimab + BCG I&M)). Wird Sasanlimab nur mit einer BCG-Induktion ohne Erhaltung verabreicht, zeigte sich kein signifikanter Unterschied gegenüber der BCG-Monotherapie mit Induktion und Erhaltung.
Über das praktisch gleiche, dreiarmige Studiendesign verfügte die POTOMAC-Studie, wobei als ICI Durvalumab fungiert. Gemäss einer kürzlich veröffentlichten Pressemitteilung des Herstellers zeigt eine Interim-Analyse ein «statistisch signifikantes und klinisch relevantes längeres krankheitsfreies Überleben» im Interventionsarm. Daten wurden bisher noch nicht veröffentlicht (11).
Kombinationstherapien von ICI und viralen Gentherapien wurden im Rahmen der CORE-001-Studie (Pembrolizumab + GC0070) beim BCGu NMIBC sowie im Rahmen der ABLE-22-Studie (Pembrolizumab + Nadofaragen-Firadenovec) untersucht. Während in der publizierten Phase-II-Studie CORE-001-Studie eine CR nach 24 Monaten von 51.4 % erreicht werden konnte, sind die Resultate der ABLE-22-Studie noch ausstehend.
Die multi-arm, multi-stage Studie ADAPT-BLADDER untersucht die Kombination von intravenösem Durvalumab mit BCG, Radiotherapie, Gem/Doce allein oder in zusätzlicher Kombination mit Tremelimumab (CTLA-4 Inhibitor) (Imjudo™). Erste Resultate der Kohorte 4 (Durvalumab + GemDoce) wurden am diesjährigen ASCO GU Meeting präsentiert, eine CR konnte nach 12 Monaten in knapp 70 % der 37 Patienten beobachtet werden.
Die systemische Verabreichung von Erdafitinib (Balversa™) beim BCGu NMIBC mit FGFR-Alteration wurde im Rahmen der THOR-2-Studie im Vergleich zu einer intravesikalen Chemotherapie mit Mitomycin C oder Gemcitabin untersucht. Nach einem Jahr betrug das rezidivfreie Überleben in der Interventionsgruppe 77 % vs. 41 %. Aufgrund von Nebenwirkungen mussten allerdings 29 % der Patienten der Interventionsgruppe die Therapie abbrechen, gegenüber 0 % in der Vergleichsgruppe.
Ein möglicherweise revolutionärer Therapieansatz könnte die Anwendung von Nanorobotern darstellen. So konnte im Mausmodell eine Reduktion des Tumorvolumens um 90 % nach einmaliger Instillation von mit Harnstoff betriebenen Nanorobotern beobachtet werden. Die Nanoroboter werden in die Blase instilliert und bewegen sich dann durch Verstoffwechselung des sich im Urin befindlichen Harnstoffes selbständig in Richtung Urothel. Aus bisher noch nicht geklärten Gründen findet im Tumorgewebe eine deutlich höhere Anreicherung statt. Die Zerstörung des Tumorgewebes findet über sich auf der Oberfläche der Nanoroboter befindliche Radioisotope statt (12).
Radiotherapie beim NMIBC
Während sich die Radiotherapie beim MIBC im Rahmen der Trimodaltherapie als fester Therapiebestandteil etablieren konnte, könnte sie in Zukunft auch vermehrt beim NMIBC zum Einsatz kommen. Basierend auf den Resultaten des 2024 veröffentlichten Phase-II-Protokolls NRG Oncology/RTOG 0926 fand sie bereits als Bestandteil der Trimodaltherapie bei rezidivierenden T1 NMIBC Eingang in die NCCN-Guidelines. Die kürzlich eröffnete Nachfolgestudie NRG-GU014 vergleicht die Radiotherapie nach vorausgehender TUR-B beim rezidivierenden T1 NMIBC in Kombination mit einer systemischen Chemotherapie mit einer systemischen ICI-Therapie mit Pembrolizumab. Weitere Studien, welche die Radiotherapie im Setting des NMIBC untersuchen, sind die beiden Phase-II-Studien PREVERT und HOPE-04 sowie die Kohorte 3 der Phase-I-Studie ADAPT-BLADDER.
Zusammenfassung
Die Therapielandschaft des NMIBC befindet sich derzeit in einem tiefgreifenden Wandel. Bis zum Jahr 2020 standen als adjuvante Therapien fast ausschliesslich BCG und intravesikale Chemotherapien zur Verfügung. Erste FDA-Zulassungen von, Nadofaragen-Firadenovec , TAR-200 und CG0070 plus BCG (alle beim BCGu NMIBC) unterstreichen diesen Wandel und haben das Therapiespektrum substanziell erweitert. Bisher wurden diese Substanzen bis auf Pembrolizumab, welches als Monotherapie keinen überzeugenden Therapie-Effekt hat, in der Schweiz noch nicht zugelassen. Eine Vielzahl weiterer innovativer Wirkstoffe mit dem Potential, die Therapie des NMIBC weiter zu verbessern, befindet sich aktuell in verschiedenen Studienphasen in Erprobung. Nebst der Entwicklung neuer Therapien wird in Zukunft auch der Validierung prädiktiver Biomarker ein hoher Stellenwert zukommen, um effizient und kosteneffektiv die optimale Therapie für betroffene Patienten zu finden.
Copyright
Aerzteverlag medinfo AG
Klinik für Urologie
Luzerner Kantonsspital
Spitalstrasse
6000 Luzern 16
Klinik für Urologie
Universitätsspital Basel
Spitalstrasse 21
4031 Basel
Die Autoren haben keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
- Hohe Rezidiv- und Progressionsraten beim NMIBC sowie BCG-Versagen und -Unverträglichkeit erfordern neue Therapiekonzepte. Der Wunsch nach Blasenerhalt und die BCG-Knappheit verstärken den Bedarf an effektiven, organerhaltenden Alternativen zur radikalen Zystektomie.
- Eine Vielzahl innovativer intravesikaler Immun- und Chemotherapien befindet sich in unterschiedlichen Stadien der klinischen Prüfung. Dazu zählen virale Gentherapien wie Nadofaragen-Firadenovec und CG0070, Immunmodulatoren wie N-803 sowie kombinierte Chemotherapeutika wie Gemcitabin/Docetaxel.
- Medikamentenhaltige Reverse-Thermal-Gele und intravesikale Medikamentenapplikationssysteme wie UGN-102 und TAR-200 ermöglichen eine verlängerte Medikamentenexposition. Diese neuen Technologien haben das Potential herkömmliche intravesikale Therapien zu verbessern.
- Kombinationstherapien mit Immuncheckpoint-Inhibitoren werden intensiv untersucht. Erste Resultate in Kombination mit BCG zeigen Vorteile, welche aber gegen die stark erhöhten Nebenwirkungen der Kombinationstherapie versus BCG alleine abgewogen werden müssen.
- Zukünftige Therapieansätze wie nanotechnologische Plattformen oder hochspezifische Wirkstofffreisetzungssysteme (z. B. FGFR-gerichtetes TAR-210) könnten die Behandlung weiter revolutionieren. Erste präklinische und klinische Daten sind vielversprechend, ihre Rolle im Therapiestandard bleibt jedoch durch weitere Studien zu evaluieren.
1. Bacillus-Calmette-Guérin-Unresponsive-Nonmuscle-Invasive-Bladder-Cancer–Developing-Drugs-and-Biologics-for-Treatment-Guidance-for-Industry.
2. Filon M, Schmidt B. New Treatment Options for Non–Muscle-Invasive Bladder Cancer. Am Soc Clin Oncol Educ Book. Januar 2025;45(2):e471942.
3. Boorjian SA, Alemozaffar M, Konety BR, Shore ND, Gomella LG, Kamat AM, u. a. Intravesical nadofaragene firadenovec gene therapy for BCG-unresponsive non-muscle-invasive bladder cancer: a single-arm, open-label, repeat-dose clinical trial. The Lancet Oncology. Januar 2021;22(1):107–17.
4. Chamie K, Chang SS, Kramolowsky E, Gonzalgo ML, Agarwal PK, Bassett JC, u. a. IL-15 Superagonist NAI in BCG-Unresponsive Non–Muscle-Invasive Bladder Cancer. NEJM Evidence [Internet]. Januar 2023 [zitiert 21. Januar 2025];2(1). Verfügbar unter: https://evidence.nejm.org/doi/10.1056/EVIDoa2200167
5. Rentsch CA, Thalmann GN, Lucca I, Kwiatkowski M, Wirth GJ, Strebel RT, u. a. A Phase 1/2 Single-arm Clinical Trial of Recombinant Bacillus Calmette-Guérin (BCG) VPM1002BC Immunotherapy in Non–muscle-invasive Bladder Cancer Recurrence After Conventional BCG Therapy: SAKK 06/14. European Urology Oncology. April 2022;5(2):195–202.
6. Fragkoulis C, Bamias A, Gavalas N, Tzannis K, Fragiadis E, Pinitas A, u. a. Intravesical Administration of Durvalumab for High-risk Non–muscle-invasive Bladder Cancer: A Phase 2 Study by the Hellenic GU Cancer Group. European Urology. Januar 2025;S0302283824027854.
7. Chevuru PT, McElree IM, Mott SL, Steinberg RL, O’Donnell MA, Packiam VT. Long-term follow-up of sequential intravesical gemcitabine and docetaxel salvage therapy for non-muscle invasive bladder cancer. Urologic Oncology: Seminars and Original Investigations. März 2023;41(3):148.e1-148.e7.
8. McElree IM, Steinberg RL, Mott SL, O’Donnell MA, Packiam VT. Comparison of Sequential Intravesical Gemcitabine and Docetaxel vs Bacillus Calmette-Guérin for the Treatment of Patients With High-Risk Non–Muscle-Invasive Bladder Cancer. JAMA Netw Open. 28. Februar 2023;6(2):e230849.
9. Daneshmand S, Van Der Heijden MS, Jacob JM, Guerrero-Ramos F, Bögemann M, Simone G, u. a. TAR-200 for Bacillus Calmette-Guérin–Unresponsive High-Risk Non–Muscle-Invasive Bladder Cancer: Results From the Phase IIb SunRISe-1 Study. JCO [Internet]. 30. Juli 2025 [zitiert 4. August 2025]; Verfügbar unter: https://ascopubs.org/doi/10.1200/JCO-25-01651
10. Shore ND, Powles TB, Bedke J, Galsky MD, Palou Redorta J, Ku JH, u. a. Sasanlimab plus BCG in BCG-naive, high-risk non-muscle invasive bladder cancer: the randomized phase 3 CREST trial. Nat Med [Internet]. 31. Mai 2025 [zitiert 2. Juni 2025]; Verfügbar unter: https://www.nature.com/articles/s41591-025-03738-z
11. Imfinzi regimen demonstrated statistically significant and clinically meaningful improvement in disease-free survival for high-risk non-muscle-invasive bladder cancer in POTOMAC Phase III trial [Internet]. 2025 [zitiert 6. Juni 2025]. Verfügbar unter: https://www.astrazeneca.com/media-centre/press-releases/2025/imfinzi-improved-dfs-in-early-bladder-cancer.html
12. Simó C, Serra-Casablancas M, Hortelao AC, Di Carlo V, Guallar-Garrido S, Plaza-García S, u. a. Urease-powered nanobots for radionuclide bladder cancer therapy. Nat Nanotechnol. April 2024;19(4):554–64.
13. Grobet-Jeandin E, Rouprêt M, Seisen T. Novel intravesical therapies and delivery systems for the management of bladder cancer. Current Opinion in Urology. Januar 2025;35(1):19–27.
14. Ghodoussipour S, Bivalacqua T, Bryan RT, Li R, Mir MC, Palou J, u. a. A Systematic Review of Novel Intravesical Approaches for the Treatment of Patients with Non–muscle-invasive Bladder Cancer. European Urology. April 2025;S030228382500123X.
info@onco-suisse
- Vol. 15
- Ausgabe 7
- Dezember 2025