- Wenn Informationen zensiert werden
Grosse randomisierte klinische Phase 3 Studien bilden normalerweise die Evidenzgrundlage einer informierten Entscheidung beim individuellen Patienten. Durch das Zensieren von fehlenden Endpunkt-Ereignissen aus verschiedensten Gründen werden jedoch die Ergebnisse der Studien möglicherweise entscheidend beeinflusst, indem die zensierten Patienten zum Zeitpunkt der letzten «Erfassung ohne Ereignis» die Kaplan-Meyer Kurven nicht mehr beeinflussen können. Hier wird an Beispielen gezeigt, wann solche Zensierungen problematisch sind und die Interpretation der Studiendaten wesentlich beeinflussen können, falls sie überhaupt realisiert werden.
Les grands essais cliniques randomisés de phase 3 fournissent généralement la base factuelle permettant de prendre une décision éclairée chez les patients individuels. Cependant, la censure des événements manquants pour diverses raisons peut avoir un impact significatif sur les résultats des études en empêchant les patients censurés d’influencer les courbes de Kaplan-Meyer au moment du dernier recensement «sans événement». Des exemples sont donnés ici pour montrer quand une telle censure est problématique et peut influencer de manière significative l’interprétation des données de l’étude, si elle est mise en œuvre.
Aussagekräftige Studien sind die Grundlage für eine informierte Entscheidung. Bei randomisierten Studien ist der primäre Endpunkt in der Regel ein time to event Endpunkt, das heisst die Zeit bis zum Auftreten eines Ereignisses von Interesse wird zwischen den Studienarmen verglichen. Ereignisse von Interesse können Todesfälle sein (Gesamtüberleben, overall survival), Krankheitsprogression (Progressions-freies Überleben, progression free sruvival), Auftreten von Schmerzen etc. Die mediane Zeit bis zum Auftreten des entsprechenden Ereignisses wird mit der Kaplan-Meier-Methode geschätzt und visuell in Kaplan-Meier-Kurven dargestellt. Die zu vergleichenden Kurven beginnen jeweils zum Zeitpunkt der Randomisierung des einzelnen Patienten. Auf der x-Achse ist die Beobachtungszeit aufgetragen und auf der y-Achse der Anteil von Patienten* vermerkt, welcher kein Ereignis von Interesse hat. Im Prinzip fällt die Kurve im Verlauf der Zeit dann jeweils etwas ab, wenn ein Ereignis aufgetreten ist. Der Verlauf der zu vergleichenden Kurven bestimmt, vereinfacht gesagt, letztlich auch die Hazard Ratio (HR). Diese ist ein Mass für die relative Wahrscheinlichkeit in den beiden Therapiearmen für das Auftreten eines Ereignisses über die Zeit, wobei gilt, dass je näher die HR bei 1 liegt, desto kleiner der Unterschied ist.
Wenn nun ein Patient kein Ereignis von Interesse erlebt bzw. unbekannt ist, wann und ob ein solches aufgetreten ist, wird der Patient zensiert (censored) zum letzten Zeitpunkt an dem gesichert ist, dass kein Ereignis von Interesse vorlag. Ab dem Zeitpunkt der Zensierung trägt der entsprechende Patient nicht mehr zum weiteren Verlauf (Abfall) der Kaplan-Meier-Kurve bei. Dies ist grundsätzlich unproblematisch, sofern der Grund für das Zensieren unabhängig von der Studienintervention ist und in beiden Armen etwa gleich häufig auftritt. Dies kann zum Beispiel der Fall sein, wenn es einem Patienten an seiner Feriendestination so gut gefällt, dass er entscheidet gleich dort zu bleiben und somit «lost to follow-up» ist, und dann nicht mehr klar ist, ob er noch am Leben ist. Im Falle einer Studie mit dem primären Endpunkt Gesamtüberleben würde dieser Patient zum Zeitpunkt der letzten Konsultation zensiert.
Was geschieht nun in einer Studie mit dem primären Endpunkt radiologisch Progressions-freies Überleben (radiographic progression free survival, rPFS), wenn ein Patient die Studienbehandlung beispielsweise wegen Toxizität abbricht? Üblicherweise wird auch ein solcher Patient zum letzten Zeitpunkt zensiert, an dem radiologisch keine Progression dokumentiert wurde. Eine Zensierung würde in einer Studie mit rPFS als Endpunkt auch geschehen, wenn der Patient seine Einwilligung zur weiteren Studienteilnahme zurückzieht, eine andere Therapie beginnt und auch wenn lediglich eine klinische Progression vorliegt, welche aber nicht radiologisch dokumentiert ist.
Wie erwähnt, ist eine wichtige Annahme beim Zensieren, dass die Wahrscheinlichkeit für das Auftreten eines Ereignisses von Interesse gleich gross ist bei zensierten Patienten wie bei in der Studie verbleibenden Patienten (das Risiko für eine Tumorprogression also nicht höher oder tiefer ist) und dass das Zensieren in beiden Armen gleich verteilt ist (1). Sind diese Annahmen nicht erfüllt, spricht man von informativem Zensieren (informative censoring). Dieses steht dem Sinn der Randomisierung entgegen, da das Progressions-freie Übeleben nun nicht mehr in repräsentativen Populationen analysiert wird, welche gemäss Zufallsprinzip einer unterschiedlichen Intervention zugeteilt wurden. Informatives Zensieren führt entsprechend zu einem Bias und wenn das Zensieren häufiger im experimentellen Arm ist (z. B. wegen Toxizitäten), kann es sein, dass die PFS Analyse zu einem falschen Eindruck von klinischem Nutzen führt. Das Ausmass dieses Bias ist dabei proportional zum Anteil der Patienten, welche informativ zensiert wurden. Eine Re-Analyse von 28 onkologischen Studien hat zum Beispiel gezeigt, dass Patienten, welche informativ zensiert wurden, ein etwa 30% höheres Progressionsrisiko hatten wie die gesamte Studienpopulation (2).
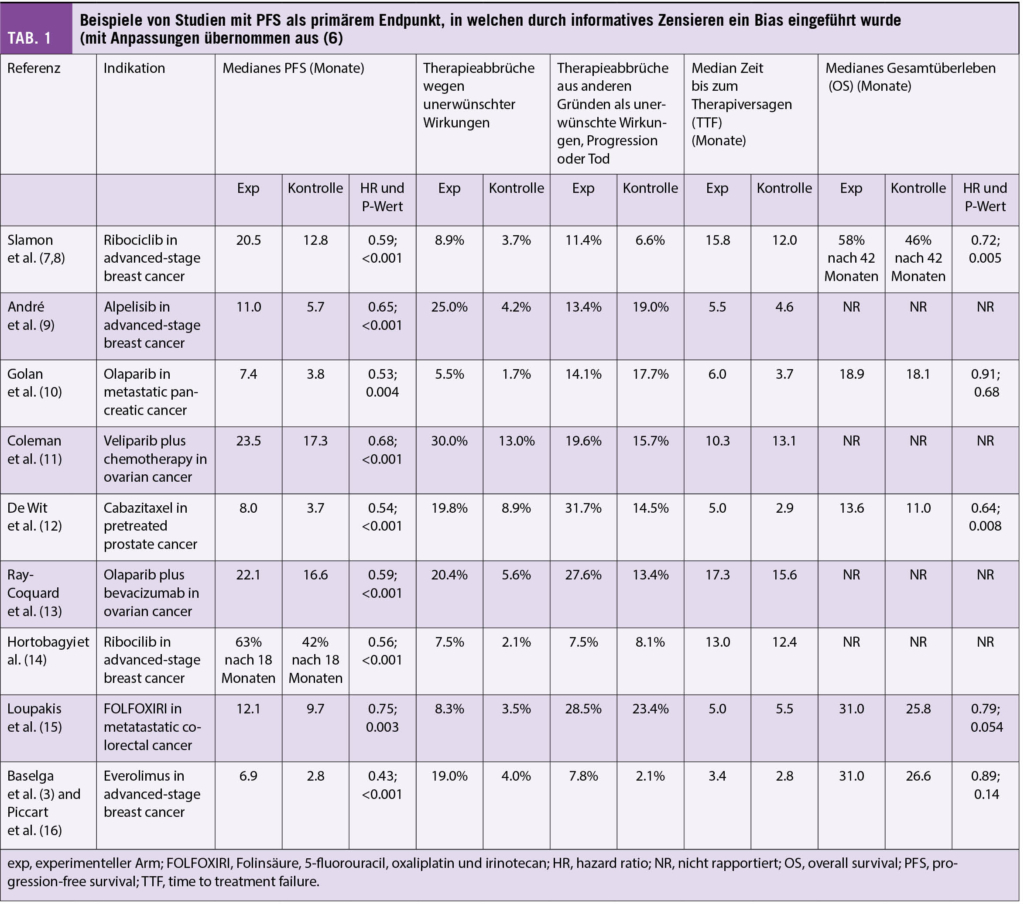
Folgendes Beispiel illustriert die konkreten Implikationen: In der Studie BOLERO-2 wurde bei Frauen mit Hormon-Rezeptor positivem metastasiertem Mamakarzinom die Ergänzung von Everolimus bzw. Placebo zum Aromatasehemmer Exemestan verglichen. Der primäre Endpunkt der Studie war das Progressions-freie Überleben, welches als 6.9 Monate für Everolimus plus Exemestan bzw. 2.8 Monate für Placebo plus Exemestan berichtet wurde (HR 0.43, p<0.001) (3). In dieser Studie haben im experimentellen Arm 4x mehr Frauen wegen unerwünschten Wirkungen die Therapie abgebrochen oder ihre Einwilliung zur Studienteilnahme zurückgezogen (24% vs. 6%) und wurden zensiert. Betrachtet man solche Therapieabbrüche zusätzlich zur Krankheitsprogression nicht als Therapieerfolg, beträgt die mediane Zeit bis zum Therapieversagen (time to treatment failure, TTF) 3.4 Monate für Everolimus plus Exemestan bzw. 2.3 Monate für Placebo plus Exemestan (HR 0.68, p<0.001) (4). Andere Beispiele finden sich in der Tabelle 1.
Was gibt es für Möglichkeiten, um informatives Zensieren zu erkennen und dessen Einfluss einschätzen zu können? Zunächst: Bei Studien mit Gesamtüberleben als primärem Endpunkt besteht das Problem nicht. Da dieser Endpunkt (neben sorgfältig untersuchter Lebensqualität) letztlich für den Patienten den bedeutsamsten Endpunkt darstellt, sollten Studien entsprechend geplant werden. Bei Studien mit anderen Endpunkten kann gelegentlich bereits visuell eine ungleiche Verteilung von Zensierungsmarkern in den Kaplan-Meier-Kurven bemerkt werden (meist kleine Kreise oder senkrechte Striche). In diesem Fall lohnt sich ein Blick auf die Raten für discontinuation because of adverse events. Wünschenswert wäre dann neben den numbers at risk unterhalb der Kaplan-Meier-Kurven auch die Angabe der Anzahl zensierter Patienten. In einer guten Publikation sollte zudem ausgewiesen werden, wie häufig Zensierung aus welchen Gründen in den beiden Interventionsgruppen vorkam. In der kürzlich publizierten Studie PROfound, welche Olaparib beim metastasierten Kastrations-resistenten Prostatakarzinom untersucht hat, wurden die Zensierungsraten aus anderen Gründen wie lost to follow-up z. B. im Appendix ausgewiesen (und betrugen in der den primären Endpunkt rPFS definierenden Population 29% im Olaparib-Arm bzw. 13% im Vergleichsarm) (5). Des Weiteren wäre auch nach Therapieabbruch die tatsächliche Nachverfolgung inklusive Bildgebung gemäss Protokoll sinnvoll sowie in Ergänzung zur PFS-Analyse auch eine TTF-Analyse wünschenswert (siehe Beispiel oben). Hilfreich bei der Einschätzung der Relevanz von informativem Zensieren wäre auch die Berechnung und Veröffentlichung von best und worst case Szenarien, in denen angenommen wird, dass bei zensierten Patienten nie bzw. sofort ein Progressionsereignis aufgetreten ist. Auch andere statistische Verfahren können helfen, den durch informatives Zensieren bewirkten Bias besser zu verstehen.
Zusammenfassend kann festgehalten werden, dass informatives Zensieren bei Studien mit Progressions-freiem Überleben als primärem Endpunkt zu einer Überschätzung der Therapiewirkung für den Interventionsarm führt, in welchem das Zensieren gehäuft ist. Bei Gesamtüberleben als primärem Studienendpunkt besteht dieses Problem nicht.
Anmerkung: Der vorliegende Text ist angelehnt an den Artikel «Informative censoring – a neglected cause of bias in oncology trials». (A. J. Templeton et al. Nature Reviews Clinical Oncology 2020 Jun; 17(6):327-328. doi: 10.1038/s41571-020-0368-0)
Copyright bei Aerzteverlag medinfo AG
Medizinische Onkologie, St. Claraspital, Basel, Schweiz;
St. Clara Forschung, Basel, Schweiz;
Medizinische Fakultät, Universität Basel, Basel, Schweiz
Arnoud.Templeton@claraspital.ch
Tumorzentrum St. Claraspital
4016 Basel
Thomas.Schmid@claraspital.ch
Arnoud Templeton: Honorare: Astellas; Advisory board: MSD, Astellas, BMS (Inst), MSD (Inst), Janssen (Inst), Roche (Inst), Sanofi (Inst); Kongress-/Reiseunterstützung: Sanofi, Janssen, Ipsen, Roche.
Thomas Schmid: Keine
- Informatives Zensieren geschieht, wenn die Wahrscheinlichkeit für das Auftreten eines Ereignisses von Interesse (Endpunkt) bei zensierten Patienten nicht gleich hoch ist wie bei in der Studie verbleibenden
Patienten und das Zensieren in beiden Armen ungleich verteilt ist. - Informatives Zensieren spielt keine Rolle beim Endpunkt Gesamtüberleben.
- Bei Studien mit Progressions-freiem Überleben als primärem Endpunkt führt informatives Zensieren zu einer Überschätzung der Therapiewirkung des Interventionsarms, in welchem das Zensieren gehäuft ist.
Messages à retenir
- La censure informative se produit lorsque la probabilité de survenance d’un événement d’intérêt (critère d’évaluation) chez les patients censurés n’est pas la même que chez les patients restant dans l’étude et que la censure est inégalement répartie dans les deux bras.
- La censure informative n’est pas pertinente pour le critère de survie globale.
- Dans les études dont le principal critère d’évaluation est la survie sans progression, la censure informative conduit à une surestimation de l’effet thérapeutique du bras d’intervention dans lequel la censure est fréquente.
1. Ranganathan P, Pramesh CS. Censoring in survival analysis: Potential for bias. Perspect Clin Res 2012;3:40.
2. Stone AM, Bushnell W, Denne J, et al. Research outcomes and recommendations for the assessment of progression in cancer clinical trials from a PhRMA working group. Eur J Cancer 2011;47:1763-71.
3. Baselga J, Campone M, Piccart M, et al. Everolimus in postmenopausal hormone-receptor-positive advanced breast cancer. N Engl J Med 2012;366:520-9.
4. Templeton AJ, Ace O, Amir E, et al. Influence of censoring on conclusions of trials for women with metastatic breast cancer. Eur J Cancer 2015;51:721-4.
5. de Bono J, Mateo J, Fizazi K, et al. Olaparib for Metastatic Castration-Resistant Prostate Cancer. The New England journal of medicine 2020;382:2091-102.
6. Templeton AJ, Amir E, Tannock IF. Informative censoring – a neglected cause of bias in oncology trials. Nat Rev Clin Oncol 2020;17:327-8.
7. Slamon DJ, Neven P, Chia S, et al. Phase III Randomized Study of Ribociclib and Fulvestrant in Hormone Receptor-Positive, Human Epidermal Growth Factor Receptor 2-Negative Advanced Breast Cancer: MONALEESA-3. J Clin Oncol 2018;36:2465-72.
8. Slamon DJ, Neven P, Chia S, et al. Overall Survival with Ribociclib plus Fulvestrant in Advanced Breast Cancer. N Engl J Med 2020;382:514-24.
9. Andre F, Ciruelos E, Rubovszky G, et al. Alpelisib for PIK3CA-Mutated, Hormone Receptor-Positive Advanced Breast Cancer. N Engl J Med 2019;380:1929-40.
10. Golan T, Locker GY, Kindler HL. Maintenance Olaparib for Metastatic Pancreatic Cancer. Reply. N Engl J Med 2019;381:1492-3.
11. Coleman RL, Fleming GF, Brady MF, et al. Veliparib with First-Line Chemotherapy and as Maintenance Therapy in Ovarian Cancer. N Engl J Med 2019;381:2403-15.
12. de Wit R, de Bono J, Sternberg CN, et al. Cabazitaxel versus Abiraterone or Enzalutamide in Metastatic Prostate Cancer. N Engl J Med 2019;381:2506-18.
13. Ray-Coquard I, Pautier P, Pignata S, et al. Olaparib plus Bevacizumab as First-Line Maintenance in Ovarian Cancer. N Engl J Med 2019;381:2416-28.
14. Hortobagyi GN, Stemmer SM, Burris HA, et al. Ribociclib as First-Line Therapy for HR-Positive, Advanced Breast Cancer. N Engl J Med 2016;375:1738-48.
15. Loupakis F, Cremolini C, Masi G, et al. Initial therapy with FOLFOXIRI and bevacizumab for metastatic colorectal cancer. N Engl J Med 2014;371:1609-18.
16. Piccart M, Hortobagyi GN, Campone M, et al. Everolimus plus exemestane for hormone-receptor-positive, human epidermal growth factor receptor-2-negative advanced breast cancer: overall survival results from BOLERO-2dagger. Ann Oncol 2014;25:2357-62.
info@onco-suisse
- Vol. 10
- Ausgabe 6
- Oktober 2020