- Diagnostic du cancer de la prostate – Le test Stockholm3
Le cancer de la prostate est la tumeur la plus fréquente chez les hommes en Suisse. Le dépistage précoce a pour objectif la détection sélective des cancers de la prostate nécessitant un traitement afin de permettre des thérapies curatives tout en évitant les surdiagnostics. Le test PSA est un outil de dépistage largement utilisé, mais il présente certaines limites. L’imagerie par résonance magnétique multiparamétrique (IRMmp) a amélioré la précision diagnostique, mais elle est coûteuse et nécessite beaucoup de ressources. Dans le cadre d’un parcours diagnostique structuré, les biomarqueurs, tels que le test Stockholm3, constituent un complément utile à la stratification des risques dans le dépistage précoce. Sur la base des protéines plasmatiques, des marqueurs génétiques et des paramètres cliniques, Stockholm3 calcule un score de risque individuel pour la présence d’un cancer de la prostate nécessitant un traitement. Cela permet de réduire le nombre de biopsies et d’examens IRM multiparamétrique inutiles, tout en garantissant une détection comparable des cancers significatifs.
Prostate cancer remains the most common malignancy among men in Switzerland. The focus of early detection lies on selectively identifying clinically significant prostate cancer (csPCa), to enable curative treatments while avoiding overdiagnosis. Although prostate-specific antigen is widely used for screening, it has well-known limitations. Multiparametric magnetic resonance imaging (mpMRI) has improved diagnostic accuracy but is costly and user dependent. Biomarkers, such as the Stockholm3 test, could be a valuable addition to a structured diagnostic pathway for early detection of PCa. By combining plasma protein levels, genetic markers, and clinical variables, Stockholm3 reliably estimates the risk for csPCa. This enables a significant reduction in unnecessary biopsies and mpMRIs, while maintaining a comparable detection rate of significant cancers.
Keywords: Cancer de la prostate, Dépistage précoce; Stockholm3; PSA; Biomarqueurs
Introduction
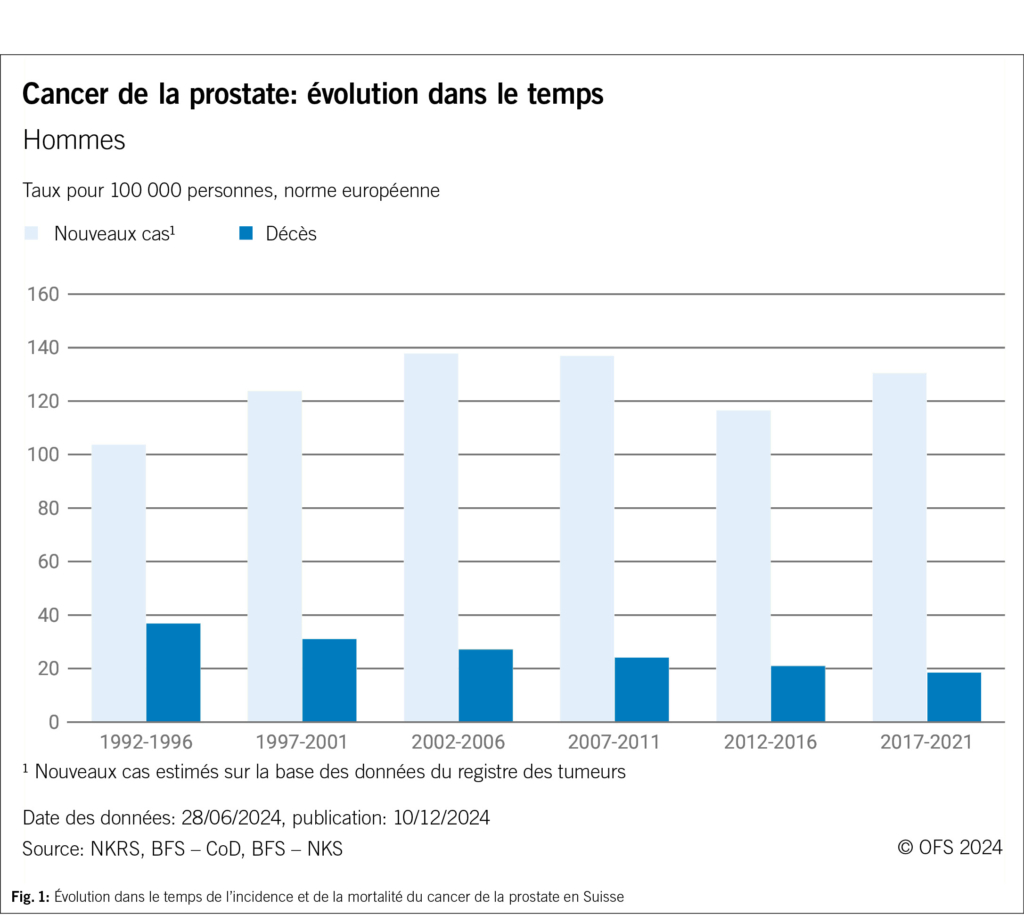
Avec 7800 nouveaux cas par an (période 2017–2021) (Fig. 1), le cancer de la prostate (PCa) est le cancer le plus fréquent chez les hommes en Suisse. Malgré des progrès significatifs dans le traitement et une baisse continue de la mortalité au cours des trois dernières décennies, cette maladie reste la deuxième cause de décès par cancer chez les hommes, après le cancer du poumon (1). Il existe actuellement en Suisse des programmes organisés de dépistage précoce du cancer du sein, du côlon et du col de l’utérus. En ce qui concerne le cancer de la prostate, aucune initiative comparable n’a encore été mise en œuvre à l’échelle nationale, malgré les efforts des experts (2).
L’objectif du dépistage précoce du cancer de la prostate est d’identifier à temps les cancers de la prostate nécessitant un traitement (score de Gleason ≥ 7a ou groupe de grade ISUP ≥ 2) pour lesquels il existe des options thérapeutiques curatives. Dans le même temps, il est important d’éviter les surdiagnostics et les interventions inutiles chez les hommes dont les tumeurs ne nécessitent pas de traitement, en particulier ceux dont le score de Gleason est de 6 ou dont le groupe de grade ISUP est de 1. Ces tumeurs ne nécessitent généralement pas de traitement, mais leur détection est associée à des contraintes psychologiques, sociales et économiques considérables (3).
Dès le début des années 1990, l’antigène prostatique spécifique (PSA) s’est imposé comme un outil de dépistage du cancer de la prostate, dans le but de réduire la mortalité liée à cette maladie (4). Cependant, son utilisation s’est avérée limitée dans un contexte populationnel en raison de sa faible spécificité. Il y avait un nombre disproportionné de résultats faussement positifs, de biopsies prostatiques normales et de détection de cancers ne nécessitant pas de traitement. Tout cela a suscité des doutes légitimes quant à l’utilité du dépistage par PSA.
Un changement de paradigme s’est produit au début des années 2010 avec l’avènement de l’imagerie par résonance magnétique multiparamétrique (IRMmp) de la prostate. Cela a conduit à une réduction notable des biopsies inutiles et des diagnostics de PCa insignifiants, et donc à un meilleur rapport bénéfice/risque du dépistage précoce.
Bien que la mpIRM soit sans rayonnement, elle reste gourmande en ressources et dépendante des appareils et des examinateurs. De plus, le stress psychosocial pour les hommes entre le dosage du PSA, l’IRM et la communication des résultats ne doit pas être sous-estimé. Comme de nombreux hommes ne présentent pas de carcinome significatif, un triage pré-IRM semble judicieux pour une stratégie de dépistage précoce ciblée et efficace. Avec le test Stockholm3 (STHLM3), disponible en Suisse depuis 2023, il existe désormais un test prometteur et validé qui a le potentiel de réduire le nombre d’IRM inutiles par rapport au diagnostic basé sur le PSA.
Le PSA, pilier du diagnostic du cancer de la prostate
L’utilisation clinique du PSA a constitué une avancée décisive dans la détection du cancer de la prostate. Bien qu’il soit peu coûteux et facilement disponible, ce paramètre présente des faiblesses diagnostiques considérables: outre le cancer de la prostate, l’hyperplasie prostatique, la prostatite, les infections urinaires ou les stimuli mécaniques peuvent entraîner une élévation du taux. À l’inverse, un faible taux de PSA ne permet pas d’exclure avec certitude un cancer agressif . Divers dérivés du PSA, tels que le PSA libre (fPSA), le quotient fPSA/PSA ou l’indice de santé prostatique (PHI), ont été développés au fil des ans afin d’améliorer la pertinence diagnostique, avec un succès parfois modéré.
Deux études notables, l’étude PLCO (Prostate, Lung, Colorectal and Ovarian Cancer Screening Trial) (5) et l’étude ERSPC (European Randomized Study of Screening for Prostate Cancer) (6), ont examiné de plus près l’utilisation du PSA dans le cadre du dépistage et sont parvenues à des conclusions différentes en 2009: L’étude américaine PLCO, menée auprès de 76 693 hommes, a montré une incidence accrue du cancer de la prostate (risque relatif [RR] 1.22; intervalle de confiance [IC] à 95 % 1.16–1.29), mais aucune modification de la mortalité (RR 1.13; IC à 95 % 0.75–1.70) (5). En raison d’une contamination importante du groupe témoin – environ 90 % des hommes ont subi au moins un test PSA –, l’étude est aujourd’hui considérée comme méthodologiquement limitée et n’est plus déterminante pour l’évaluation du dépistage par PSA (7). Néanmoins, les résultats de l’étude PLCO ont eu une influence déterminante sur les recommandations formulées à l’époque en matière de dépistage précoce du cancer de la prostate.
Dans le cadre de l’étude ERSPC, qui a porté sur plus de 180 000 participants dans huit pays européens, les hommes de la cohorte de dépistage se sont vu proposer un dosage du PSA environ tous les 4 ans. Le groupe témoin n’a pas bénéficié de cette mesure. Celle-ci a entraîné une baisse significative de la mortalité spécifique au cancer de la prostate d’environ 20 % dans le groupe de dépistage (RR 0.80; IC à 95 % 0.65–0.98) après 9 ans (6). Au cours d’un suivi plus long, cet effet s’est amplifié de manière continue et le nombre d’hommes atteints d’une maladie métastatique a également diminué (8).
La publication des résultats de l’étude a donné lieu à un débat continu sur l’utilité du dépistage par dosage du PSA. La U. S. Preventive Services Task Force a d’abord émis un avis négatif à ce sujet en 2012 (9), mais l’a révisé en 2018: pour les hommes âgés de 55 à 69 ans, le comité recommande désormais un dépistage basé sur une décision individuelle après consultation médicale, mais souligne l’importance de préférences éclairées. Le dépistage n’est toujours pas recommandé pour les hommes âgés de 70 ans et plus, car les dommages potentiels l’emportent sur les avantages en raison de l’espérance de vie limitée (10).
En Suisse, les recommandations relatives au dépistage précoce du cancer de la prostate étaient hétérogènes: alors que le Swiss Medical Board, aujourd’hui dissous, déconseillait en principe le dépistage par dosage du PSA en 2011, la Société suisse d’urologie (SSU) se prononce, dans sa prise de position de 2012 toujours en vigueur, en faveur d’un dosage du PSA comme option de dépistage précoce chez les hommes âgés de 50 à 70 ans après information individuelle. Cette position nuancée se retrouve également dans les directives actuelles des sociétés savantes internationales (11, 12). Dans le cadre du «Plan européen de lutte contre le cancer», l’UE a récemment ajouté le dépistage structuré du cancer de la prostate au catalogue des programmes de dépistage potentiels à l’échelle européenne. Dans ce contexte, la SGU a décidé lors de son assemblée générale 2023 de participer activement à l’élaboration d’un programme de dépistage précoce fondé sur des données probantes et dont la qualité est garantie.
L’importance de l’IRM
L’IRM multiparamétrique de la prostate permet une détection hautement sensible et spécifique des lésions suspectes de carcinome, ce qui rend possible une biopsie ciblée de la tumeur. À l’heure actuelle, les données disponibles, y compris dans le cadre d’un dépistage basé sur la population, sont extrêmement convaincantes: Nordström et al. ont montré qu’une stratégie de diagnostic basée sur l’IRM conduit à un taux de détection plus élevé des tumeurs nécessitant un traitement, tout en réduisant les biopsies inutiles et les surdiagnostics, par rapport à une biopsie standard basée sur le PSA (13). En conséquence, les directives internationales recommandent de réaliser une IRM multiparamétrique avant la première biopsie en cas de taux de PSA élevé (11, 14). Cependant, cet examen est limité par le fait qu’il nécessite des ressources importantes, qu’il est coûteux et que son interprétation diagnostique dépend de l’expérience du radiologue, ce qui rend difficile son utilisation dans le cadre d’un programme de dépistage à grande échelle.
Concept du test Stockholm3
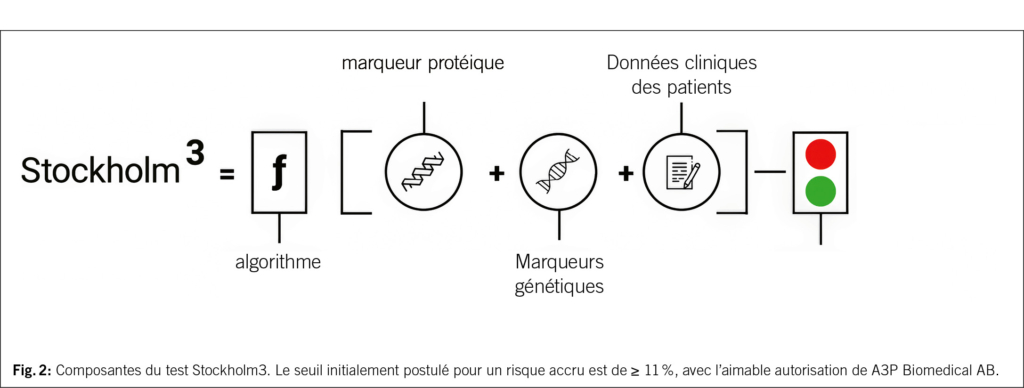
Le test Stockholm3 a été développé en 2015 à l’Institut Karolinska de Stockholm et vise à identifier les cancers de la prostate nécessitant un traitement avec une précision diagnostique supérieure à celle du PSA seul. Le test repose sur un algorithme mathématique complexe qui combine cinq protéines sériques, plus de 60 marqueurs génétiques (polymorphismes nucléotidiques simples, SNP) et des informations cliniques (âge, antécédents familiaux, biopsies antérieures et traitement médicamenteux par un inhibiteur de la 5-alpha-réductase) dans un score de risque (Fig. 2). Le résultat est une évaluation individuelle du risque de présence d’un cancer de la prostate nécessitant un traitement, le seuil initialement recommandé pour un diagnostic plus approfondi étant fixé à une valeur ≥ 11 %.
Le choix des protéines et des marqueurs génétiques pour le test Stockholm3 a été effectué sur la base d’analyses de cohortes approfondies et d’études d’association pangénomiques. Pour la composante protéique, outre la PSA totale et libre, la kallikréine 2 humaine (hK2), MIC-1 (cytokine inhibitrice des macrophages 1) et la MSMB (bêta-microséménoprotéine) ont été sélectionnés comme prédicteurs. La composante génétique du test se compose de 60 SNP qui ont pu être associés de manière significative au risque de cancer de la prostate dans de grandes cohortes européennes (15).
Validation et pouvoir prédictif du test Stockholm3
L’étude STHLM3 initiale (2015), qui comptait plus de 58 000 participants suédois et qui avait alors été réalisée sans IRM, avait déjà démontré la supériorité du test par rapport au PSA. Il convient de noter que, conformément aux priorités du système de santé suédois, l’objectif n’était pas d’obtenir un taux de détection plus élevé, mais d’améliorer l’efficacité en réduisant les biopsies inutiles. Conformément à cette intention, le test Stockholm3 a été calibré de manière à présenter une sensibilité aussi élevée que le taux de PSA. En effet, pour un taux de détection identique des cancers nécessitant un traitement, le test a permis de réduire de 44 % le nombre de biopsies réalisées. Il est intéressant de noter qu’un nombre important de cancers significatifs ont été détectés dans la fourchette PSA de 1.5 à 3.0 μg/l (15).
En 2021, l’étude de suivi STHLM3-MRI a été menée auprès de 12 750 hommes. Conformément à la pratique clinique établie entre-temps, le test Stockholm3 a été combiné à une IRM. Selon la valeur seuil choisie (11 % ou 15 %), l’utilisation du test chez les hommes présentant un taux de PSA > 3.0 μg/l a permis d’augmenter le taux de détection des carcinomes cliniquement significatifs de 18 % ou de réduire le nombre d’IRM nécessaires de 36 % (13).
En raison d’influences génétiques spécifiques à la population, la transférabilité des résultats du test Stockholm3 a été validée dans des cohortes indépendantes (pas de cohortes de dépistage) en dehors de la Scandinavie. Malgré l’hétérogénéité des populations étudiées, la performance diagnostique du test a pu être confirmée. Dans une étude menée par Elyan et al. auprès de 342 hommes d’Allemagne et de Suisse présentant un taux de PSA élevé, le test Stockholm3 a montré une meilleure différenciation des carcinomes nécessitant un traitement par rapport au PSA seul. En appliquant un seuil de 11 %, environ un quart des biopsies auraient pu être évitées, avec seulement une légère diminution du taux de détection (16). Tilki et al. ont examiné 405 patients allemands et ont comparé le test Stockholm3 au calculateur de risque de cancer de la prostate de Rotterdam. Avec un seuil de 15 %, environ 50 % des biopsies auraient pu être évitées, tandis que 92 % des cancers de la prostate nécessitant un traitement auraient continué à être détectés (17).
Le test a acquis une pertinence mondiale et une validation multiethnique dans l’étude SEPTA de 2024. Cette étude multicentrique menée sur une cohorte américaine ethniquement diversifiée a montré que le test Stockholm3 présente une sensibilité équivalente à celle du test PSA, mais entraîne un taux significativement plus faible de biopsies inutiles. Sa supériorité s’est manifestée dans tous les groupes ethniques étudiés, ce qui plaide en faveur d’une large applicabilité clinique (18).
Enfin, l’utilisation du test Stockholm3 comme outil de suivi d’un dépistage (un concept de base du dépistage précoce) a été étudiée dans le cadre d’une analyse secondaire de l’étude STHLM3-MRI mentionnée précédemment. Discacciati et al. ont vérifié si le test Stockholm3 pouvait être réutilisé 2 à 3 ans après un dépistage négatif afin d’éviter des IRM inutiles et de maintenir la détection des cancers de la prostate nécessitant un traitement. Dans l’étude, un seuil de 15 % a notamment entraîné une réduction significative de 41 % du nombre d’IRM réalisées, avec un nombre comparable de cancers nécessitant un traitement détectés (19). Le test Stockholm3 semble donc également donner de bons résultats dans le cadre d’un dépistage répété.
Valeurs seuils de 11 % vs 15 %
Deux valeurs seuils pertinents ont été établis pour l’application clinique du test Stockholm3: un risque de 11 % et un risque de 15 % de cancer de la prostate cliniquement significatif. Un valeur seuil de 11 % présente un taux de détection des cancers significatifs supérieur de 18 à 23 % à celui du test PSA et convient particulièrement à un dépistage précoce individualisé en fonction des préférences des patients informés (13, 20). La valeur seuil plus stricte de 15 % réduit le nombre d’IRM et de biopsies inutiles tout en garantissant un taux de détection élevé des tumeurs pertinentes. L’étude danoise PRIMA a validé cette valeur seuil de manière prospective et a montré qu’elle permettait d’économiser environ 26 % des IRM sans passer à côté de cancers significatifs (20). Le choix individuel du seuil permet ainsi une adaptation flexible aux objectifs cliniques tels que la sécurité diagnostique ou l’allocation des ressources. Pour un dépistage à grande échelle basé sur la population, les auteurs de cet article considèrent toutefois que seule la valeur seuil de 15 % est appropriée.
Algorithme possible pour la détection précoce
Sur la base des données mentionnées, la question se pose de savoir à quoi pourrait ressembler un programme de dépistage précoce optimisé. La réflexion suivante s’impose: le test PSA est peu coûteux, bien connu et disponible comme test de routine dans la plupart des laboratoires suisses – des conditions idéales pour son utilisation comme test de triage initial dans le cadre du dépistage précoce du cancer de la prostate. Des études montrent que lorsque les valeurs de PSA sont inférieures à 1.5 μg/l, le risque de cancer de la prostate cliniquement significatif est négligeable. Environ 65 % des hommes (toutes tranches d’âge confondues) se situent dans cette zone à faible risque et ne nécessitent pas d’examens complémentaires au moment du test (21).
À partir d’un valeur seuil de 1.5 μg/l, le risque de cancer de la prostate nécessitant un traitement augmente continuellement. Un concept préconisé prévoit, en cas de taux de PSA ≥ 1.5 μg/l, de recourir à un deuxième test réflexe, tel que le test Stockholm3. Cela entraîne des coûts supplémentaires, mais permet une plus grande précision diagnostique. Afin d’éviter les doubles consultations et les retards, il est recommandé de prélever simultanément le sang pour le PSA et un éventuel test supplémentaire lors de la même consultation. Si le taux de PSA est ≥ 1.5 μg/l, le test supplémentaire est effectué. Seul un deuxième résultat anormal déclenche l’orientation vers une IRM multiparamétrique et, le cas échéant, une biopsie au cours du suivi.
Copyright
Aerzteverlag medinfo AG
Cet article est une traduction de «der informierte arzt – die informierte ärztin» 07_2025
Clinique d’urologie
Hôpital universitaire de Zurich
Frauenklinikstrasse 10
8091 Zurich
Clinique d’urologie
Hôpital universitaire de Zurich
Frauenklinikstrasse 10
8091 Zurich
Ashkan Mortezavi a reçu des honoraires de consultation de la part d’A3P Biomedical. Julian Baumkirchner n’a aucun conflit d’intérêts en rapport avec cet article.
- Le cancer de la prostate est le cancer le plus fréquemment diagnostiqué chez les hommes en Suisse. L’objectif de détecter précocement les cancers nécessitant un traitement tout en évitant les interventions invasives inutiles est toutefois ambitieux.
- Malgré sa grande popularité, le test PSA présente des faiblesses diagnostiques significatives.
- L’IRM multiparamétrique de la prostate offre une grande sensibilité, mais elle est coûteuse en ressources, dépend de l’examinateur et peut entraîner des situations stressantes inutiles chez les hommes en bonne santé.
- Le test Stockholm3 constitue un complément fondé sur des preuves au diagnostic classique du cancer de la prostate. La perspective d’éviter des biopsies et des examens IRM inutiles plaide en faveur de son utilisation dans le cadre d’un algorithme de diagnostic structuré.
- En Suisse, le test Stockholm3 est disponible depuis 2023 et peut être facilement réalisé aussi bien par un médecin généraliste que
1. Données sur le cancer [Internet]. Office fédéral de la statistique / Centre national d’enregistrement du cancer; 2024 [consulté le 13 mai 2025]. Disponible à l’adresse: https://www.bfs.admin.ch/bfs/de/home/statistiken/gesundheit/gesundheitszu- stand/krankheiten/krebs/daten.html
2. Würnschimmel C, Menges D, Kwiatkowski M, Sigg S, Prause L, Mattei A, et al. Prostate cancer screening in Switzerland: a literature review and consensus statement from the Swiss Society of Urology. Swiss Med Wkly 2024;154:3626.
3. Eggener SE, Berlin A, Vickers AJ, Paner GP, Wolinsky H, Cooperberg MR. Low-Grade Prostate Cancer: Time to Stop Calling It Cancer. J Clin Oncol 2022;40(27):3110–4.
4. Catalona WJ, Smith DS, Ratliff TL, Dodds KM, Coplen DE, Yuan JJJ, et al. Mesure de l’antigène prostatique spécifique dans le sérum comme test de dépistage du cancer de la prostate. N Engl J Med 1991; 324(17): 1156-61.
5. Andriole GL, Crawford ED, Grubb RL, Buys SS, Chia D, Church TR, et al. Résultats en termes de mortalité d’un essai randomisé sur le dépistage du cancer de la prostate. N Engl J Med 2009; 360(13): 1310-9.
6. Schröder FH, Hugosson J, Roobol MJ, Tammela TLJ, Ciatto S, Nelen V, et al. Dépistage et mortalité par cancer de la prostate dans une étude européenne randomisée. N Engl J Med 2009; 360(13): 1320-8.
7. Shoag JE, Mittal S, Hu JC. Réévaluation des taux de dépistage par dosage du PSA dans l’essai PLCO. N Engl J Med 2016; 374(18): 1795-6.
8. Schröder FH, Hugosson J, Roobol MJ, Tammela TLJ, Zappa M, Nelen V, et al. Dépistage et mortalité par cancer de la prostate: résultats de l’étude européenne randomisée sur le dépistage du cancer de la prostate (ERSPC) après 13 ans de suivi. The Lancet 2014;384(9959):202
pean Randomised Study of Screening for Prostate Cancer (ERSPC) après 13 ans de suivi. The Lancet 2014; 384(9959): 2027-35.
9. Moyer VA, U.S. Preventive Services Task Force. Dépistage du cancer de la prostate: déclaration de recommandation de l’U.S. Preventive Services Task Force. Ann Intern Med 2012; 157(2): 120-34.
10. US Preventive Services Task Force, Grossman DC, Curry SJ, Owens DK, Bibbins-Domingo K, Caughey AB, et al. Dépistage du cancer de la prostate: déclaration de recommandation de l’US Preventive Services Task Force. JAMA 2018; 319(18): 1901-13.
11. Directives de l’EAU. Édition présentée lors du congrès annuel de l’EAU à Madrid en 2025. Arnhem, Pays-Bas: Bureau des directives de l’EAU; 2025. ISBN 978-94-92671-29-5.
12. Wei JT, Barocas D, Carlsson S, Coakley F, Eggener S, Etzioni R, et al. Détection précoce du cancer de la prostate: directive AUA/SUO Partie I: dépistage du cancer de la prostate. J Urol 2023; 210(1): 46-53.
13. Nordström T, Discacciati A, Bergman M, Clements M, Aly M, An- nerstedt M, et al. Dépistage du cancer de la prostate à l’aide d’une combinaison de prédiction des risques, d’IRM et de biopsies ciblées de la prostate (STHLM3-MRI): un essai prospectif, basé sur la population, randomisé, ouvert et de non-infériorité. Lancet Oncol 2021;22(9):1240–9.
14. Wei JT, Barocas D, Carlsson S, Coakley F, Eggener S, Etzioni R, et al. Détection précoce du cancer de la prostate: directive AUA/SUO partie II: considérations relatives à la biopsie de la prostate. J Urol 2023;210(1):54–63.
15. Grönberg H, Adolfsson J, Aly M, Nordström T, Wiklund P, Brandberg Y, et al. Dépistage du cancer de la prostate chez les hommes âgés de 50 à 69 ans (STHLM3): une étude diagnostique prospective basée sur la population. Lancet Oncol 2015; 16(16): 1667-76.
16. Elyan A, Saba K, Sigle A, Wetterauer C, Engesser C, Püschel H, et al. Validation prospective multicentrique du test Stockholm3 dans une cohorte d’Europe centrale. Eur Urol Focus 2024;10(4):620–6.
17. Tilki D, Rejek N, Nohe F, Haese A, Graefen M, Thederan I. Validation externe du Stockholm3 dans une cohorte clinique allemande rétrospective. Eur Urol Focus 2024; S2405-4569(24)00129-9.
la gazette médicale
- Vol. 14
- Ausgabe 7
- Dezember 2025