- Encéphalite auto-immunitaire et troubles cognitifs
Les encéphalites auto-immunes sont des maladies rares mais traitables qui se manifestent par un tableau associant généralement troubles cognitifs, psychiatriques, crises épileptiques et autres manifestations neurologiques. Le diagnostic est difficile chez la personne âgée, en raison d’une présentation clinique et biologique moins « inflammatoire ». Le diagnostic repose sur l’IRM cérébrale, la ponction lombaire et la mise en évidence d’anticorps antineuronaux dans le sang et/ou le liquide céphalo-rachidien, et un traitement immunosuppresseur précoce est essentiel.
Autoimmune encephalitis is a rare but treatable disease and usually presents with cognitive and psychiatric symptoms, seizures and other neurological manifestations. Diagnosis is difficult in the elderly because of a less „inflammatory“ clinical and biological presentation. Diagnosis is based on brain MRI, lumbar puncture and the detection of antineuronal antibodies in the serum and/or cerebrospinal fluid, and early immunosuppressive treatment is essential.
Key Words: autoimmune encephalitis, cognitive/psychiatric symptoms, immunosuppression
Introduction
Chez les patients présentant des troubles neurocognitifs, il est essentiel de chercher les causes réversibles et traitables. Les encéphalites auto-immunes peuvent se présenter sous forme d’ une atteinte cognitive. Elles ont une prévalence estimée de 13.7/100’000 habitants (1), représenteraient jusqu’ à 20 % des troubles neurocognitifs chez les patients jeunes (<45 ans) (2) et entre 4 et 46 % des démences rapidement progressives (3). L’ âge médian est très variable, variant de 21 ans pour l’ encéphalite à anti-NMDAR à 64 ans pour celle à anti-LGI1 (4,5).
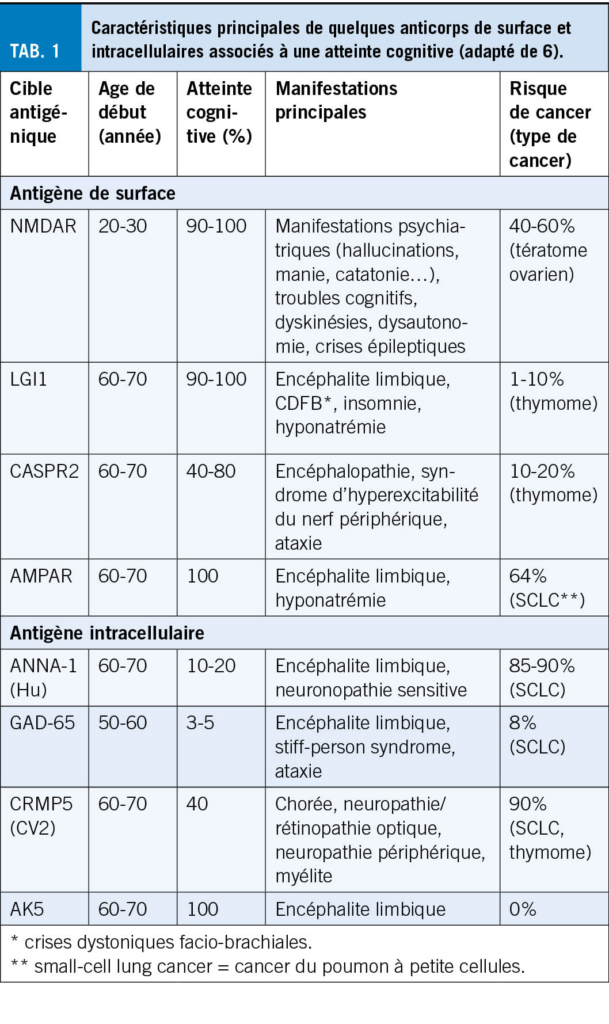
Il existe deux types d’ encéphalites auto-immunitaires, selon la cible de l’ anticorps dans la cellule : 1) des protéines à la surface membranaire des neurones (récepteur de surface/synaptique), par exemple les anti-NMDAR, LGI1 ou 2) des antigènes intracellulaire, dit « onconeuronaux », par exemple AK5, GAD-65 (tab. 1). Dans les encéphalites à anti-récepteur de surface, l’ anticorps détecté est pathogénique et perturbe directement les fonctions neuronales; les symptômes sont en général réversibles, reflétant une meilleure réponse à l’ immunothérapie (4,5). Au contraire, les encéphalites associées à des anticorps ciblant des protéines intracellulaires sont principalement des syndromes paranéoplasiques ; l’ anticorps détecté est un reflet de la réponse immunitaire, sans être pathogénique en soi. Ces syndromes sont responsables de tableaux cliniques très variés, avec en général une mauvaise réponse à l’ immunothérapie. Plus récemment, des cas d’ encéphalite immune ont été décrits après traitements oncologiques par inhibiteur des checkpoints immunitaire, dont l’ apparition peut être retardée, parfois jusqu’ à 1 année après l’ arrêt de la thérapie (7).
Présentation clinique
Présentation cognitive
La présentation cognitive est fréquente, souvent sous la forme d’ une « encéphalite limbique », avec une atteinte prédominant sur le versant mnésique antérograde et parfois associée à des manifestations psychiatriques (anxiété). La progression est généralement subaiguë (semaines à mois), remplissant les critères d’ une démence rapidement progressive (démence apparu en <12 mois après le début des troubles cognitifs). Dans une étude récente, 39 % des sujets avec encéphalite à anti-LGI1, NMDAR et GABABR remplissaient les critères de démence, parmi lesquels 76 % ceux d’ une démence rapidement progressive. Le tableau neuropsychologique permet difficilement de distinguer une encéphalite auto-immune d’ une atteinte neurodégénérative. Les formes à anti-LGI1 et GABABR semblent associées à une atteinte visuo-spatiale et exécutive prédominante, similaire au tableau de la démence à corps de Lewy, alors que dans les formes à anti-NMDAR seraient plutôt associées à une atteinte langagière et comportementale, au même titre qu’ une démence fronto-temporale (8).
Manifestations associées
Les crises épileptiques, focales ou généralisées, sont fréquentes et souvent précoces. On peut retrouver typiquement des crises focales d’ origine mésiotemporale, dont les manifestations sont difficiles à reconnaitre (sensation épigastrique ascendante, sensation de déjà-vu, hallucinations olfactives etc.). Les crises dystoniques facio-brachiales, épisodes fréquents (jusqu’ à 40-50x/j) de contractions musculaires brèves facio-brachiales ipsilatérales, sont pathognomoniques de l’ encéphalite à anti-LGI1, et peuvent parfois précéder les troubles cognitifs (5).
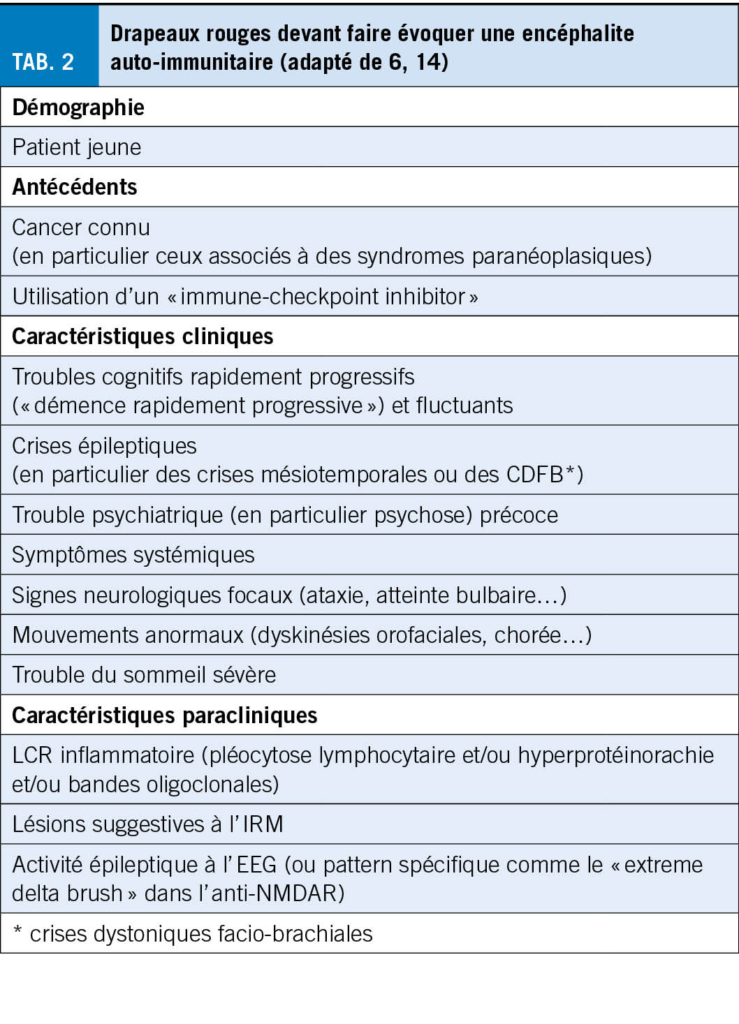
Les manifestations psychiatriques sont fréquentes, en particulier dans l’ encéphalite à anti-NMDAR avec des troubles psychotiques et une catatonie (4). Des mouvements anormaux sont rencontrés, comme les dyskinésies orofaciales dans l’ anti-NMDAR ou la chorée dans l’ anti-CRMP5/CV2 (4, 9). Le tableau 2 résume les caractéristiques anamnestiques, cliniques et paracliniques suggestives d’ une encéphalite auto-immune.
Examens complémentaires
En cas de suspicion d’ encéphalite auto-immune, le bilan complémentaire doit comprendre une IRM cérébrale injectée, un bilan sanguin, une analyse du LCR et la recherche d’ anticorps antineuronaux dans le sang et le LCR. Une recherche de néoplasie sous-jacente doit être discutée.
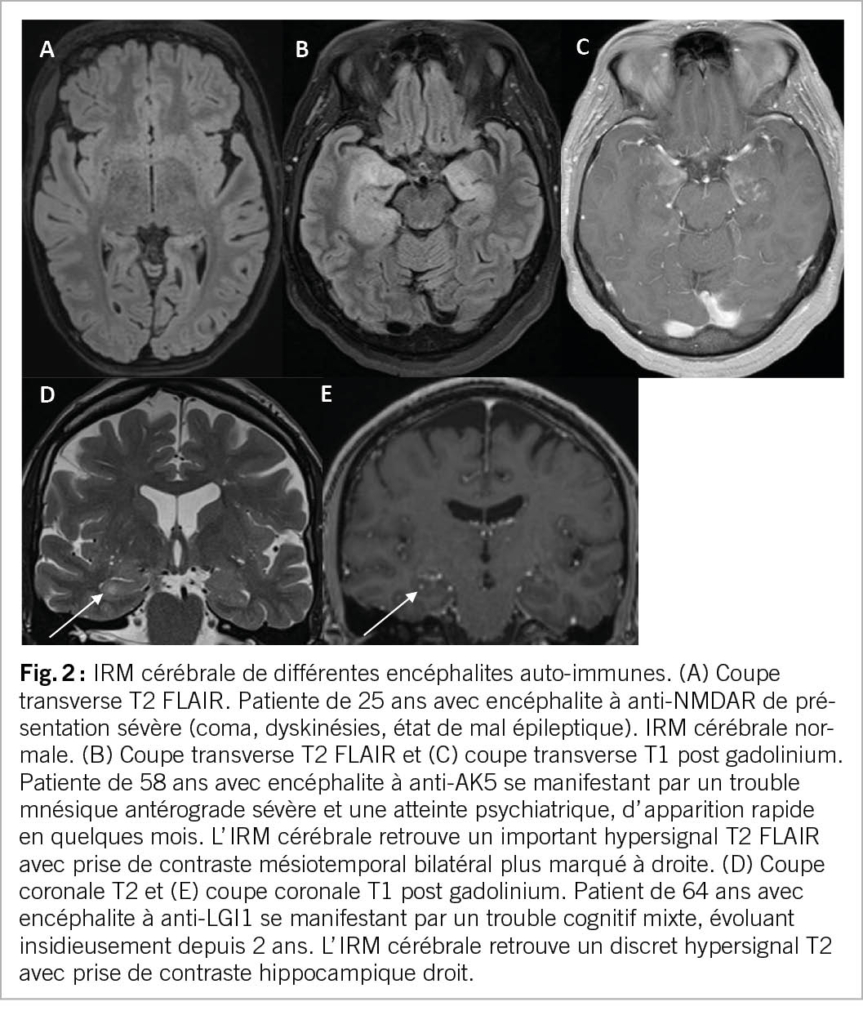
L’ atteinte radiologique est variable selon l’ anticorps incriminé, avec une IRM qui peut être normale, comme dans la moitié des cas d’ anti-NMDAR (Fig. 1A) (4). En cas d’ encéphalite limbique comme celle à anti-LGI1, l’ IRM cérébrale peut trouver un hypersignal T2 FLAIR de la région mésiotemporale uni- ou bilatéral, parfois associées à une tuméfaction et prise de contraste hippocampique (Fig. 1B-E) (5). Ce tableau radiologique n’est cependant pas spécifique, et peut se voir dans des encéphalites infectieuses (HSV-1), des gliomes ou des états de mal épileptiques. D’ autres images ont été décrites, comme des atteintes multifocales, une atteinte des ganglions de la base ou une atteinte diencéphalique. L’ IRM permettra également d’ exclure des diagnostics alternatifs, comme une atteinte infectieuse, tumorale ou une maladie à prion.
Le bilan biologique de base comprend un bilan hématologique, métabolique, infectieux et immunologique. La présence d’ une hyponatrémie évoque une encéphalite à anti-LGI1 (5). L’ analyse du LCR doit comporter les analyses de routine (répartition cellulaire, protéines, glucose, quotient d’ albumine, recherche de bandes oligoclonales), des recherches infectieuses, une cytologie et une cytométrie de flux. Selon le contexte, le dosage des marqueurs phospho-tau, total-tau et Abeta 42 peut être effectué en cas de suspicion de maladie d’ Alzheimer, et le RT-QuIC pour l’ évaluation d’ une maladie à prions. Dans le LCR, on peut trouver une pléocytose lymphocytaire légère à modérée, une hyperprotéinorachie et parfois une synthèse intrathécale d’ immunoglobuline. Un LCR normal n’ exclut cependant pas une encéphalite auto-immune.
La recherche des anticorps antineuronaux permet de confirmer le diagnostic d’ encéphalite auto-immune puis de guider le traitement et la recherche oncologique. Les anticorps doivent être cherchés avant l’ introduction d’ une immunothérapie, dans le sang et le LCR. La sensibilité de ces anticorps est plus élevée pour certains dans le sang (ex : anti-LGI1) ou d’ autres dans le LCR (ex : anti-NMDAR) (10). L’ absence d’ anticorps retrouvé n’ exclut pas le diagnostic d’ encéphalite auto-immune (formes séronégatives).
L’ électroencéphalogramme (EEG) peut montrer des signes aspécifiques d’ encéphalopathie et parfois un caractère irritatif expliquant les phénomènes épileptiques. Il permet d’ exclure un état de mal épileptique. Certains signes peuvent orienter vers une étiologie, comme l’ « extreme delta brush » présents jusqu’ à chez 30% des patients avec encéphalite à anti-NMDAR (11). L’ EEG peut également retrouver des arguments pour d’ autres étiologies comme celui d’ une maladie de Creutzfeldt-Jakob (12).
Prise en charge
Dès qu’ une encéphalite auto-immune est suspectée, la prise en charge s’ articule en deux phases ; la recherche de néoplasie et le traitement immunomodulateur. La recherche de néoplasie se fait au moment du diagnostic, lors de rechute et est répétée durant 5 ans, une néoplasie pouvant s’ exprimer des années après l’ encéphalite (13). Si un cancer est retrouvé, son traitement permet parfois de maitriser à lui seul l’ encéphalite.
Le traitement immunomodulateur doit être le plus précoce possible et débuté dès une étiologie infectieuse exclue, sans attendre la positivité d’ un anticorps. Plusieurs études récentes ont montré qu’ un retard dans l’ introduction de l’ immunothérapie influence le pronostic fonctionnel et le risque de rechute (14). Un traitement de phase aiguë (méthylprednisolone à haute dose, immunoglobulines intraveineuses, plasmaphérèses, rituximab, cyclophosphamide) puis d’ un traitement de maintenance (corticothérapie dégressive, rituximab, azathioprine, mycophenolate mofetil) est recommandé. Le traitement sera adapté en fonction de l’ anticorps retrouvé, des comorbidités du patient, de la sévérité et du risque de récidive de l’ encéphalite (15).
Difficultés diagnostiques et thérapeutiques chez la personne âgée
Les encéphalites auto-immunes expriment moins de caractéristiques inflammatoires chez la personne âgée, avec moins de signe inflammatoire à l’ IRM cérébrale ou dans le LCR (16). Le diagnostic peut être encore plus difficile lorsque les biomarqueurs de démence du LCR sont anormaux. Dans une étude récente, presque 50% des patients avec encéphalites auto-immunes (LGI1, GABABR et NMDAR) se manifestant par des démences avaient des anomalies des biomarqueurs du LCR suggestive d’ une maladie neurodégénérative (8).
Les traitements immunosuppresseurs sont associés à des effets secondaires potentiellement problématique chez la personne âgée. Les glucocorticoïdes au plus ou moins long cours entrainent un risque d’ ostéoporose, d’ hypertension artérielle, de troubles digestifs et d’ infections entre autres. Les immunosuppresseurs d’ épargne corticostéroïdes, en particulier le rituximab, sont également associés à un risque infectieux accru dont une augmentation du risque d’ infection sévère à SARS-CoV-2 (17). Au vu d’ une présentation de la maladie moins « inflammatoire », probablement en lien avec l’ immunosénescence, on pourrait également suspecter une moins bonne réponse à l’ immunothérapie chez la personne âgée (18).
Copyright Aerzteverlag medinfo AG
Médecin assistant
Service de neurologie, Département des neurosciences cliniques
Centre hospitalier universitaire vaudois et Université de Lausanne
Rue du Bugnon 46
CH-1011 Lausanne
Valentin.Loser@chuv.ch
Professeure associée et médecin associée
Service de neurologie, Département des neurosciences cliniques
Centre hospitalier universitaire vaudois et Université de Lausanne
Rue du Bugnon 46
CH-1011 Lausanne
Caroline.Pot-Kreis@chuv.ch
Les auteurs de cet article ne déclarent aucun conflit d’ intérêt.
◆ Les encéphalites auto-immunes sont des causes rares mais traitables de démence. Ce diagnostic doit être évoqué particulièrement en cas de démence chez un patient jeune, de forme rapidement progressive ou en cas de symptômes neurologiques associés, en particulier des crises épileptiques. Le diagnostic est plus difficile chez la personne âgée, en raison d’une présentation clinique et paraclinique moins « inflammatoire ». Le diagnostic repose sur plusieurs examens, en particulier le dosage des anticorps antineuronaux qui doit se faire dans le sang et le LCR. Ceci souligne l’importance d’une évaluation neurologique des patients présentant des démences, en particulier en cas d’atypie.
1. Dubey D, Pittock SJ, Kelly CR, et al. Autoimmune encephalitis epidemiology and a comparison to infectious encephalitis. Ann Neurol 2018;83:166–77.
2. Kelley BJ, Boeve BF, Josephs KA. Young-onset dementia: demographic and etiologic characteristics of 235 patients. Arch Neurol. 2008 Nov;65(11):1502-8.
3. Anuja P, Venugopalan V, Darakhshan N, et al. Rapidly progressive dementia: an eight year (2008–2016) retrospective study. PLoS One 2018; 13: e0189832.
4. Dalmau J, Armangué T, Planagumà J, et al. An update on anti-NMDA receptor encephalitis for neurologists and psychiatrists: mechanisms and models. Lancet Neurol. 2019;18(11):1045-1057.
5. van Sonderen A, Thijs RD, Coenders EC, et al. Anti-LGI1 encephalitis: Clinical
syndrome and long-term follow-up. Neurology. 2016 Oct 4;87(14):1449-1456.
6. Banks SA, Sechi E, Flanagan EP. Autoimmune encephalopathies presenting as dementia of subacute onset and rapid progression. Ther Adv Neurol Disord. 2021 Mar 19;14:1756286421998906.
7. Sechi E, Markovic SN, McKeon A, et al. Neurologic autoimmunity and immune checkpoint inhibitors: Autoantibody profiles and outcomes. Neurology. 2020 Oct 27;95(17):e2442-e2452.
8. Bastiaansen AEM, van Steenhoven RW, de Bruijn MAAM, et al. Autoimmune Encephalitis Resembling Dementia Syndromes. Neurol Neuroimmunol Neuroinflamm. 2021 Aug 2;8(5):e1039.
9. Vernino S, Tuite P, Adler CH, et al. Paraneoplastic chorea associated with CRMP-5 neuronal antibody and lung carcinoma. Ann Neurol 2002; 51: 625–630
10. Budhram A, Leung A, Nicolle MW, Burneo JG. Diagnosing autoimmune limbic encephalitis. CMAJ. 2019 May 13;191(19):E529-E534.
11. Schmitt SE, Pargeon K, Frechette ES, Hirsch LJ, Dalmau J, Friedman D. Extreme delta brush: a unique EEG pattern in adults with anti-NMDA receptor encephalitis. Neurology. 2012;79(11):1094-1100.
12. Wieser HG, Schindler K and Zumsteg D. EEG in Creutzfeldt–Jakob disease. Clin Neurophysiol 2006; 117: 935–951.
13. Titulaer MJ, Soffietti R, Dalmau J, et al. Screening for tumours in paraneoplastic syndromes: report of an EFNS task force. Eur J Neurol. 2011 Jan;18(1):19-e3.
14. López-Chiriboga AS, Flanagan EP. Diagnostic and Therapeutic Approach to Autoimmune Neurologic Disorders. Semin Neurol. 2018 Jun;38(3):392-402.
15. Abboud H, Probasco JC, Irani S, et al. Autoimmune encephalitis: proposed best practice recommendations for diagnosis and acute management. J Neurol Neurosurg Psychiatry. 2021 Jul;92(7):757-768.
16. Escudero D, Guasp M, Ariño H, et al. Antibody-associated CNS syndromes without signs of inflammation in the elderly. Neurology. 2017 Oct 3;89(14):1471-1475.
17. Andersen KM, Bates BA, Rashidi ES et al. Long-term use of immunosuppressive medicines and in-hospital COVID-19 outcomes: a retrospective cohort study using data from the National COVID Cohort Collaborative. Lancet Rheumatol. 2022 Jan;4(1):e33-e41.
18. Wang Y, Dong C, Han Y, Gu Z, Sun C. Immunosenescence, aging and successful aging. Front Immunol. 2022 Aug 2;13:942796.
la gazette médicale
- Vol. 12
- Ausgabe 2
- März 2023