- Gestion des comorbidités chez les personnes âgées avec troubles neurocognitifs majeurs
Les comorbidités jouent un rôle central dans la trajectoire des personnes atteintes de trouble neurocognitif majeur, en accélérant le déclin cognitif et en augmentant les risques de complications aiguës. Leur prise en charge exige une adaptation raisonnée des objectifs thérapeutiques: prévenir les décompensations, limiter les risques iatrogènes et préserver la qualité de vie. Cette revue propose une synthèse actualisée des données et recommandations disponibles, mettant en évidence la nécessité d’ individualiser les décisions selon la fragilité et les préférences du patient avec troubles neurocognitifs majeurs. L’ évaluation gériatrique globale s’ impose comme un outil transversal et central pour guider ces choix. En analysant quatre pathologies fréquentes – l’ hypertension artérielle, la dyslipidémie, la fibrillation auriculaire et le diabète – cet article fournit des repères pratiques pour une médecine prudente et centrée sur la personne.
Comorbidities play a central role in the clinical trajectory of individuals living with dementia, accelerating cognitive decline and increasing the risk of acute complications. Their management requires a reasoned adaptation of therapeutic goals: preventing decompensations, minimizing iatrogenic risks, and preserving quality of life. This review provides an up-to-date synthesis of available evidence and guidelines, highlighting the need to individualize decisions based on patient frailty and preferences. Comprehensive geriatric assessment is as a cross-cutting, essential tool to guide these choices. By examining four common conditions – hypertension, dyslipidemia, atrial fibrillation, and diabetes – this article offers practical guidance for a cautious and patient-centered approach.
Keywords: dementia, comorbidities, frailty, comprehensive geriatric assessment
Introduction
Les comorbidités cardiovasculaires et métaboliques telles que l’ hypertension artérielle (HTA), la dyslipidémie, la fibrillation atriale (FA) et le diabète jouent un rôle clé dans la trajectoire des troubles neurocognitifs majeurs (1). Facteurs de risque cardio-vasculaires, elles deviennent avec l’ âge des comorbidités associées, aggravant la dépendance, la morbidité et le recours aux soins (2). Ce constat reflète un changement de paradigme: si le contrôle de ces facteurs reste central en prévention, leur prise en charge chez les patients déjà atteints de trouble neurocognitif majeur nécessite une réorientation des objectifs de soins, centrés sur la qualité de vie et la prévention des complications. Dans ce contexte, l’ évaluation gériatrique globale permet d’ individualiser ces décisions en fonction de la fragilité et des autres syndromes gériatriques (3, 4). Cet article propose une synthèse des recommandations récentes sur la prise en charge de l’ HTA, de la dyslipidémie, de la FA et du diabète chez les personnes âgées atteintes de trouble neurocognitif majeur.
Hypertension artérielle
L’ HTA est un facteur de risque bien établi tant pour les événements cardiovasculaires que pour le développement de troubles cognitifs. Une HTA présente à l’ âge moyen est associée à un risque accru de déclin cognitif, tandis qu’ à un âge plus avancé, c’ est l’ hypotension qui semble davantage liée à une atteinte cognitive (4,5). Chez les personnes âgées de plus de 75 ans, un profil tensionnel modérément élevé est parfois associé à une meilleure fonction cognitive (6). À l’ inverse, de grandes variations tensionnelles sont corrélées à une augmentation conjointe de la morbi-mortalité cardiovasculaire et du déclin cognitif (6, 7). La revue de quatre grandes études d’ intervention portant sur l’ HTA et ses effets sur la cognition met en évidence des résultats hétérogènes, ne permettant pas de conclure de manière formelle à l’ efficacité d’ un traitement antihypertenseur pour ralentir la progression d’ un trouble neurocognitif (8).
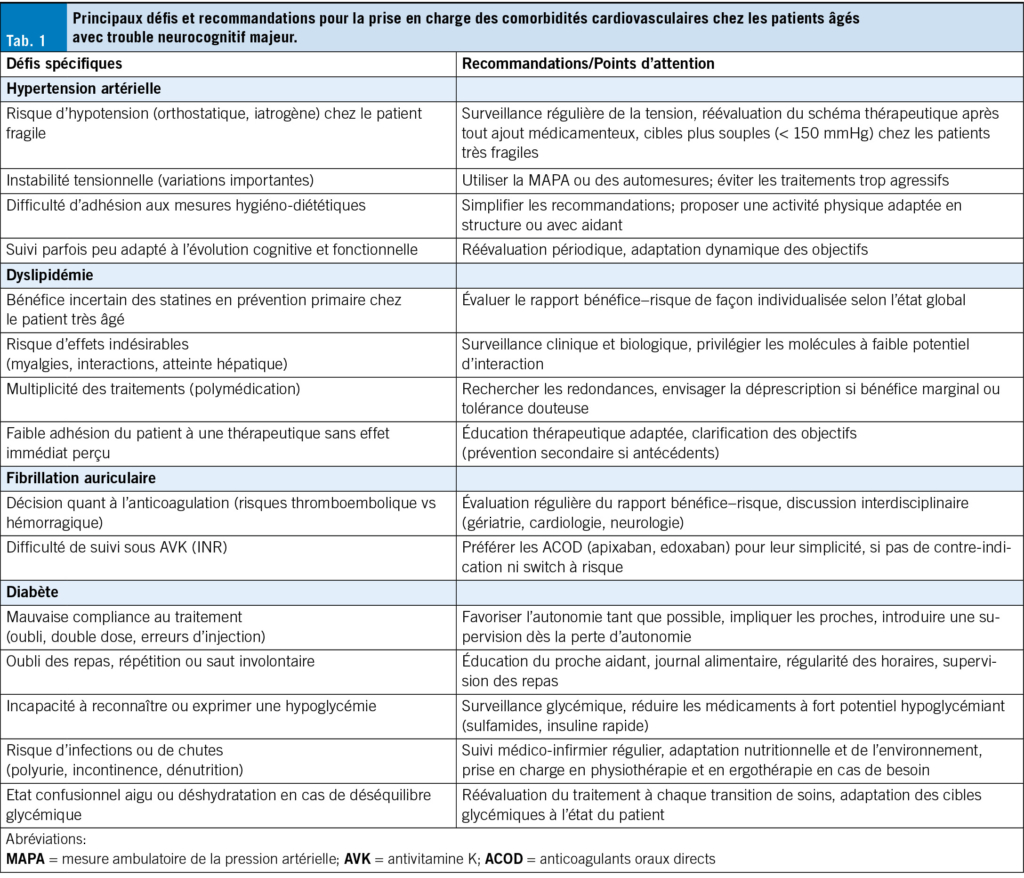
Ce tableau contrasté rend les décisions cliniques particulièrement délicates, d’ autant plus qu’ il n’ existe actuellement aucune recommandation spécifique et consensuelle pour les patients atteints de trouble neurocognitif majeur. Dans les recommandations internationales, c’ est avant tout la présence de fragilité – utilisée comme critère principal de stratification – qui guide l’ adaptation des objectifs tensionnels (9). L’ évaluation gériatrique globale permet ici de mieux cerner la sévérité de la fragilité, mais aussi la fonctionnalité, les comorbidités et la charge médicamenteuse.
Une mesure ambulatoire de la pression artérielle sur 24 heures (MAPA) ou des automesures sont recommandées pour établir le diagnostic. Chez les patients présentant un trouble neurocognitif mineur ou un trouble neurocognitif majeur au stade débutant, les cibles tensionnelles restent comparables à celles de la population générale, avec une pression artérielle systolique (PAS) visée entre 120 et 140 mmHg. Une monothérapie à faible dose est privilégiée, en débutant par la dose minimale efficace et en augmentant progressivement d’ abord la posologie puis le nombre de molécules, si nécessaire, sans dépasser une trithérapie. Chez les patients très fragiles ou dépendants, une cible plus souple (< 150 mmHg) est proposée, avec possibilité de réduction ou d’ arrêt du traitement en cas d’ hypotension orthostatique ou de PAS < 130 mmHg (3).
La prise en charge repose en premier lieu sur les mesures hygiéno-diététiques: activité physique adaptée à poursuivre le plus longtemps possible, alimentation équilibrée, sevrage tabagique et alcoolique. Les traitements de première intention incluent les inhibiteurs calciques dihydropyridines, les inhibiteurs de l’ enzyme de conversion (IEC) et les antagonistes des récepteurs de l’ angiotensine II (ARA-II), auxquels un diurétique à faible dose peut être associé si besoin. Les autres classes (bêtabloquants, alpha-bloquants, etc.) ne sont utilisées qu’ en cas d’ indication spécifique, comme une cardiopathie ischémique.
La réévaluation régulière du traitement est essentielle pour ajuster les objectifs à l’ évolution cognitive et fonctionnelle (Tab. 1). Chaque modification thérapeutique ou événement intercurrent (ex.: ajout de psychotropes ou d’ un alpha-bloquant prostatique) doit alerter sur le risque d’ hypotension et motiver une réévaluation du schéma thérapeutique (10, 11).
Dyslipidémie
La dyslipidémie, en particulier l’ élévation du LDL-cholestérol, est impliquée dans les processus neurodégénératifs via plusieurs mécanismes physiopathologiques. Elle favorise l’ accumulation cérébrale de protéines β-amyloïdes, active les voies inflammatoires et altère la fonction endothéliale cérébrale, contribuant potentiellement à la survenue ou à l’ aggravation de la maladie d’ Alzheimer (9). En reconnaissance de ces liens, la Commission Lancet 2024 a intégré pour la première fois l’ augmentation du LDL comme facteur de risque modifiable de trouble neurocognitif majeur, en particulier lorsqu’ elle survient à partir de 40 ans (1).
Chez les personnes âgées, en particulier les plus fragiles, la relation entre le LDL-cholestérol et la mortalité apparaît moins linéaire. Une méta-analyse de la Cholesterol Treatment Trialists’ Collaboration a néanmoins confirmé l’ intérêt des statines après 75 ans, principalement en prévention secondaire, bien que l’ effet soit plus modeste qu’ à un âge plus jeune (13). En prévention primaire, les données demeurent limitées, en particulier chez les sujets très âgés et vulnérables, tandis que les effets indésirables – notamment musculaires, hépatiques ou liés aux interactions médicamenteuses – sont plus fréquents.
Chez les personnes vivant avec un trouble neurocognitif majeur, la décision d’ initier ou de poursuivre un traitement hypolipémiant doit être individualisée. Elle repose sur le stade évolutif de la maladie, l’ espérance de vie, la coexistence d’ autres syndromes gériatriques et les objectifs thérapeutiques, en particulier l’ amélioration ou le maintien de la qualité de vie. En prévention secondaire, la poursuite du traitement est le plus souvent justifiée. En prévention primaire, surtout au-delà de 80 ans, la décision doit s’ appuyer sur une évaluation gériatrique globale intégrant les dimensions fonctionnelles, cognitives et sociales (14). En pratique, une stratégie médicamenteuse n’ est généralement pas indiquée dans la majorité des cas.
Les recommandations de la Société Européenne de Cardiologie vont dans ce sens, en prônant une approche individualisée fondée sur l’ état de santé global, les préférences du patient et la balance bénéfice-risque (15). Lorsqu’ un traitement est jugé approprié chez une personne âgée fragile, il convient de privilégier les statines à faible potentiel d’ interactions médicamenteuses et à demi-vie courte, telles que la pravastatine. Une réévaluation régulière du traitement est indispensable, avec un recours à la déprescription en cas de tolérance limitée ou de bénéfice clinique incertain. Enfin, les mesures non pharmacologiques – notamment l’ activité physique adaptée et la prise en charge nutritionnelle – doivent être encouragées à tout âge, y compris chez les personnes atteintes de trouble neurocognitif majeur.
Fibrillation auriculaire
La FA est un facteur de risque bien documenté de trouble neurocognitif, par l’ intermédiaire de mécanismes convergents incluant les infarctus cérébraux, les micro-hémorragies, l’ hypoperfusion cérébrale chronique, l’ inflammation systémique, ainsi que l’ accumulation accrue de dépôts amyloïdes Aβ42 (16). Sa prévalence chez les personnes vivant avec une trouble neurocognitif majeur est estimée à environ 20 % (17). Pourtant, la prise en charge de la FA dans ce contexte reste mal codifiée, en grande partie à cause de l’ exclusion récurrente de ces patients des essais cliniques randomisés, malgré leur forte prévalence en gériatrie.
Les lignes directrices de la Société européenne de cardiologie (ESC) 2024 mettent en évidence la persistance d’ une sous-prescription des anticoagulants oraux (ACO) chez les patients présentant un trouble neurocognitif majeur, bien que l’ introduction des anticoagulants oraux directs (ACOD) ait contribué à améliorer cette tendance (18).
Cette population se caractérise par un profil complexe associant risque thromboembolique élevé et vulnérabilité accrue aux complications hémorragiques (19). L’ instauration d’ un traitement anticoagulant permet de prévenir les accidents vasculaires cérébraux (AVC) d’ origine cardioembolique et pourrait, selon certaines données, ralentir la progression du déclin cognitif (20, 21). Malgré des bénéfices cliniques bien établis, l’ anticoagulation est moins fréquemment initiée chez les patients atteints de trouble neurocognitif majeur que chez ceux du même âge sans troubles cognitifs (22–24).
Lorsque l’ anticoagulation est indiquée, les ACOD doivent être privilégiés pour leur simplicité d’ utilisation (posologie fixe, absence de surveillance INR, faible risque d’ interactions) et leur profil de sécurité supérieur aux antivitamines K (AVK), notamment concernant les hémorragies intracrâniennes (21–24). Parmi eux, l’ apixaban et l’ edoxaban semblent bénéficier d’ un meilleur profil de tolérance et d’ efficacité. Toutefois, une étude randomisée récente (25) a mis en évidence une augmentation des complications hémorragiques après un switch AVK–ACOD chez des patients âgés et fragiles. L’ ESC 2024 recommande donc de ne pas systématiquement remplacer un AVK bien toléré dans cette population (18).
La décision de poursuivre un traitement anticoagulant doit être réévaluée régulièrement, en tenant compte de la sévérité cognitive, de la qualité de vie, de l’ espérance de vie et du profil de comorbidités (3). L’ imagerie par Résonance Magnétique (IRM) cérébrale peut être utile en cas de doute étiologique, notamment pour détecter une angiopathie amyloïde cérébrale, qui représente une contre-indication potentielle à l’ anticoagulation. (26).
En cas de contre-indication, l’ antiagrégation plaquettaire n’ a pas démontré d’ efficacité dans la prévention des événements cardioemboliques et augmente le risque hémorragique (22, 23). Elle reste néanmoins indiquée en prévention secondaire en cas de maladie artérielle, notamment coronarienne, en plus du traitement hypolipémiant.
Une étude multicentrique (28) a évalué l’ edoxaban à dose réduite (15 mg/j) chez des patients de ≥ 80 ans jugés inéligibles aux doses standards. Elle a montré une réduction des événements thromboemboliques, au prix d’ un risque hémorragique accru (3.7 %/année, vs 2.3 %/année dans le groupe placebo) mais jugé acceptable. Enfin, lorsque l’ anticoagulation est contre-indiqué, la fermeture percutanée de l’ auricule gauche peut être envisagée, en concertation spécialisée (18).
Les recommandations internationales définissent clairement les critères d’ initiation de l’ anticoagulation (CHA₂DS₂-VASc ≥ 1), mais restent peu précises concernant les critères d’ arrêt. Chez la personne âgée, l’ obtention d’ un score élevé, notamment en raison du poids attribué à l’ âge, conduit à une indication dans la quasi-totalité des cas. Paradoxalement, bien que les patients présentant un trouble neurocognitif majeur soient globalement moins souvent anticoagulés, lorsque le traitement est instauré, il tend à être poursuivi jusqu’ à un stade très avancé de la maladie. Ainsi, en pratique, les anticoagulants sont fréquemment maintenus jusqu’ aux derniers mois de vie, y compris chez des patients institutionnalisés, dépendants pour toutes les activités de base et en phase terminale. Plusieurs facteurs peuvent expliquer cette faible fréquence de déprescription, malgré une balance bénéfice-risque défavorable en fin de vie: l’ absence de recommandations explicites concernant l’ arrêt des anticoagulants dans la démence avancée, la tendance à maintenir les traitements instaurés de longue date sans réévaluation formalisée, la crainte persistante des événements thromboemboliques, ainsi que les difficultés à engager des discussions sur les objectifs de soins avec les familles ou au sein des institutions (18).
L’ introduction des anticorps monoclonaux dirigés contre la protéine amyloïde, tels que le lecanemab, soulève de nouvelles questions cliniques chez les patients présentant à la fois une trouble neurocognitif majeur et une FA (28). Le lecanemab a récemment reçu l’ approbation de l’ Agence européenne des médicaments (EMA) pour le traitement des formes précoces de la maladie d’ Alzheimer, mais pas encore en Suisse (29). Son utilisation est associée à un risque accru d’ anomalies radiologiques liées à l’ amyloïde, notamment les formes hémorragiques (amyloid-related imaging abnormalities with hemorrhage, ARIA-H), en particulier chez les patients présentant une microangiopathie cérébrale ou recevant un traitement anticoagulant (30). En raison de ce risque, l’ EMA a formellement contre-indiqué l’ utilisation du lecanemab dans cette population, considérant que le risque hémorragique dépasse les bénéfices thérapeutiques potentiels (31).
Cette situation soulève des dilemmes concrets en pratique. D’ une part, les patients déjà sous anticoagulation pour une FA pourraient se voir exclus d’ un traitement par anticorps monoclonaux anti-amyloïde. D’ autre part, une personne atteinte de trouble neurocognitif majeur traitée par ce type de médicament qui développe une FA expose le clinicien à un arbitrage complexe entre le risque d’ accident thromboembolique en l’ absence d’ anticoagulation, et le risque d’ hémorragie cérébrale en cas de maintien du traitement combiné.
Diabète
Plus de 29 % des personnes âgées de 65 ans et plus sont atteintes de diabète (32). Parmi les personnes atteintes d’ un trouble neurocognitif majeur, la prévalence de diabète peut atteindre jusqu’ à 80 %. Une étude populationnelle prospective menée entre 2000 et 2016 a mis en évidence une augmentation conjointe de ces deux pathologies, avec une incidence annuelle de trouble neurocognitif majeur estimée à 2 % . Chez les sujets âgés, le diabète de type 2 prédomine nettement, tandis que le type 1 reste rare, en raison de sa survenue précoce et de son impact sur l’ espérance de vie (33).
La prise en charge du diabète chez les personnes avec un trouble neurocognitif majeur est particulièrement complexe. Les altérations cognitives, comportementales et fonctionnelles compromettent l’ observance thérapeutique et la capacité à reconnaître ou gérer les fluctuations glycémiques. Ces défis cliniques sont résumés dans le tableau 1. L’ objectif principal du traitement est la prévention des hypoglycémies, la réduction des complications, et l’ adaptation de la stratégie thérapeutique aux capacités fonctionnelles réelles, dans le cadre d’ une approche gériatrique globale visant à préserver la qualité de vie. Chez les personnes atteintes de troubles cognitifs légers ou de trouble neurocognitif majeur débutant, l’ objectif d’ HbA1c est < 8 %, avec une glycémie à jeun ciblée entre 5 et 8.3 mmol/l, et une glycémie au coucher entre 5.5 et 10 mmol/l . En cas de trouble neurocognitif majeur modérée à sévère, la cible d’ HbA1c est < 8.5 %, la glycémie à jeun entre 5.5 et 10 mmol/l, et la glycémie au coucher entre 8.3 et 13 mmol/l (34).
Les hypoglycémies sont fréquentes dans cette population, avec une prévalence de 33 % (30 % légères, 3 % sévères) (35). Elles peuvent se manifester par des signes neurologiques, psychiatriques, ou rester asymptomatiques, notamment la nuit. Leurs conséquences incluent les chutes (parfois compliquées de fractures) ainsi que des hospitalisations. Les causes sont multiples: apports alimentaires irréguliers, traitements hypoglycémiants – en particulier l’ insuline et les agents à demi-vie prolongée tels que les sulfamides et les glinides – dont l’ usage est risqué en cas d’ insuffisance rénale (36). Le risque est accru par des objectifs glycémiques inadaptés, une altération de la perception des symptômes ou des antécédents d’ épisodes sévères. Par ailleurs, le surtraitement reste fréquent chez les personnes âgées diabétiques de type 2 (37). Les variations d’ adhésion thérapeutique, les fluctuations des apports caloriques et les transitions de soins (hospitalisation, retour à domicile, entrée en EMS) peuvent déséquilibrer la glycémie, justifiant une réévaluation systématique à chaque changement de contexte.
Ce risque d’ hypoglycémie ne doit toutefois pas conduire à un sous-traitement. Une hyperglycémie chronique non contrôlée favorise les complications microangiopathiques (neuropathie, rétinopathie, néphropathie), les complications infectieuses (urinaires, respiratoires, cutanées) et peut altérer l’ état général du patient (38). Cliniquement, elle peut se manifester par une asthénie, une léthargie, un état confusionnel aigu, ainsi qu’ une diurèse osmotique (polyurie, nycturie), augmentant le risque de déshydratation chez les patients présentant un trouble neuro-
cognitif majeur.
Sur le plan thérapeutique, la metformine demeure le traitement de première intention chez le sujet âgé, sauf contre-indication. En cas de contrôle glycémique insuffisant, l’ ajout d’ un inhibiteur de la DPP-4 est recommandé pour son bon profil de tolérance. Les sulfamides et les glinides doivent être évités, en raison de leur potentiel hypoglycémiant. Les inhibiteurs de SGLT2 et les analogues du GLP-1 peuvent être envisagés pour leurs effets cardio-néphroprotecteurs, mais leur emploi requiert prudence en raison d’ effets indésirables plus fréquents chez les patients fragiles.
Des données récentes suggèrent également un possible effet neuroprotecteur des analogues du GLP-1. Une revue systématique parue en 2025 dans JAMA Neurology (n > 160 000) a mis en évidence une diminution du risque de trouble neurocognitif majeur, y compris de type Alzheimer, chez les patients traités par les analogues du GLP-1, comparativement à d’ autres antidiabétiques (39). Cependant, la perte de poids induite par les analogues du GLP-1 ne constitue pas un objectif pertinent chez les sujets âgés atteints de troubles neurocognitifs majeurs, en particulier aux stades modéré à avancé, en raison du risque élevé de dénutrition et de sarcopénie fréquemment associés aux pathologies neurodégénératives (38).
En cas d’ échec de la bithérapie orale, une insulinothérapie basale peut être introduite. Celle-ci peut être temporaire (épisode aigu) ou prolongée (échec des antidiabétiques oraux, contre-indication à la metformine, notamment en cas d’ insuffisance rénale sévère). Les analogues lents à injection unique quotidienne sont à privilégier, en débutant à 0.2–0.3 UI/kg/j, avec une majoration progressive de 2 UI tous les trois jours jusqu’ à stabilisation. La surveillance des glycémies capillaires – par le patient, l’ entourage formé ou un professionnel, selon le niveau cognitif – ou une mesure automatique en continu est indispensable jusqu’ à stabilisation et à chaque ajustement (40). Chez la personne âgée vivant avec une démence, le monitorage glycémique en continu s’ avère faisable et bien toléré, et pourrait contribuer à réduire les épisodes d’ hypoglycémie, tout en allégeant la charge de surveillance pour les aidants. En cas de contrôle insuffisant sous insuline basale, une injection d’ analogue rapide peut être ajoutée après le repas le plus hyperglycémiant, sous réserve d’ une prise alimentaire effective. Si le déséquilibre persiste, un schéma basale-bolus avec injections aux trois repas peut être envisagé, avec surveillance adaptée (38).
Quel que soit le schéma choisi, l’ efficacité et la tolérance doivent être réévaluées dans un délai de 3 à 6 mois, voire plus précocement en cas d’ événement clinique (hypoglycémie, hyperglycémie, intolérance). Il convient de tenir compte de l’ observance et d’ éviter l’ inertie thérapeutique, que ce soit pour déprescrire un traitement inadapté ou pour intensifier une prise en charge insuffisante (38).
Chez les personnes âgées diabétiques atteintes de trouble neurocognitif majeur, la prise en charge nutritionnelle vise à prévenir la dénutrition, maintenir l’ état général et limiter les complications métaboliques. Les régimes restrictifs sont déconseillés; l’ alimentation doit rester plaisante, avec un apport énergétique suffisant réparti sur trois repas et, si besoin, des collations. Un apport protéique de 1.0 à 1.2 g/kg/j est recommandé. Il faut assurer une hydratation adéquate et adapter les textures en cas de dysphagie. L’ implication des aidants et la réévaluation régulière de l’ état nutritionnel et fonctionnel sont essentielles pour ajuster les stratégies (41).
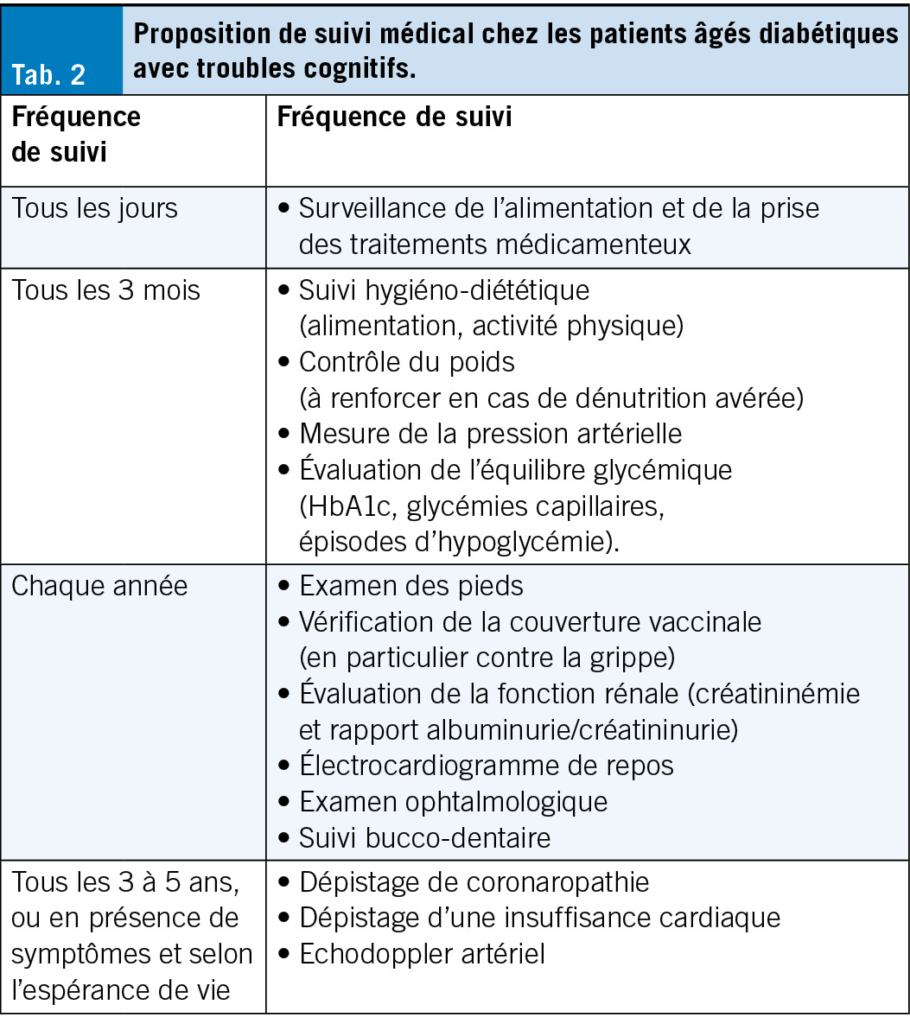
Le suivi du patient avec diabète peut être ajusté selon le contexte clinique, à l’ aide de la checklist présentée (Tab. 2). En situation de fin de vie, un assouplissement des objectifs glycémiques, la réduction de la surveillance invasive et la simplification maximale du traitement sont recommandés. Chez les patients atteints de diabète de type 1, la posologie et la fréquence des injections d’ insuline peuvent être diminuées, mais jamais interrompues (42).
Conclusion
La prise en charge des comorbidités cardiovasculaires et métaboliques chez les personnes âgées atteintes de trouble neurocognitif majeur exige un équilibre entre bénéfices attendus, risques iatrogènes et objectifs de soins centrés sur la personne. Les décisions thérapeutiques doivent s’ inscrire dans une démarche individualisée, éclairée par l’ évaluation gériatrique globale et guidée par les priorités du patient: maintien de l’ autonomie, qualité de vie, prévention des complications évitables. Dans ce contexte, la coordination interdisciplinaire, l’ implication des aidants et la réévaluation régulière des traitements jouent un rôle central. L’ approche gériatrique permet ainsi de réconcilier rigueur scientifique et pertinence clinique, en ajustant les stratégies thérapeutiques à la complexité et à la vulnérabilité propres à cette population.
Dr Rui Ribeiro da Costa 1*
Dre Marta Robino 1*
Pr Dina Zekry 2
Pr Christophe Graf 1
Dre Aline Mendes 1
*Les deux auteurs ont contribué de manière égale à cet article.
1 Service de Gériatrie et Réadaptation, Département de Réadaptation et Gériatrie, Hôpitaux Universitaires de Genève et Université de Genève, Rue Gabrielle-Perret-Gentil 4, 1211 Genève 14
2 Service de Medecine Interne de l’ Âgé, Département de Réadaptation et Gériatrie, Hôpitaux Universitaires de Genève et Université de Genève, Rue Gabrielle-Perret-Gentil 4, 1211 Genève 14
Copyright
Aerzteverlag medinfo AG
Service de Gériatrie et Réadaptation
Département de Réadaptation et Gériatrie
Hôpitaux Universitaires de Genève et Université de Genève
Rue Gabrielle-Perret-Gentil 4
1211 Genève 14
Service de Gériatrie et Réadaptation
Département de Réadaptation et Gériatrie
Hôpitaux Universitaires de Genève et Université de Genève
Rue Gabrielle-Perret-Gentil 4
1211 Genève 14
Les auteurs n’ ont pas déclaré de conflit d’ intérêts en rapport avec cet article.
- Les comorbidités cardiovasculaires et métaboliques (HTA, dyslipidémie, FA, diabète) sont à la fois des facteurs de risque et
des comorbidités associées aux troubles neurocognitifs majeurs. - L’ évaluation gériatrique globale permet d’ individualiser les
stratégies thérapeutiques, en tenant compte du stade cognitif, de l’ état fonctionnel, des comorbidités et des préférences du patient. - Certaines interventions thérapeutiques initialement justifiées
peuvent devenir inappropriées avec l’ évolution de la maladie: une réévaluation régulière du rapport bénéfice-risque est indispensable.
1. Livingston G, Huntley J, Liu KY, Costafreda SG, Selbæk G, Alladi S, Ames D, Banerjee S, Burns A, Brayne C, Fox NC, Ferri CP, Gitlin LN, Howard R, Kales HC, Kivimäki M, Larson EB, Nakasujja N, Rockwood K, Samus Q, Shirai K, Singh-Manoux A, Schneider LS, Walsh S, Yao Y, Sommerlad A, Mukadam N. Dementia prevention, intervention, and care: 2024 report of the Lancet standing Commission. Lancet. 2024 Aug 10;404(10452):572-628. doi: 10.1016/S0140-6736(24)01296-0. Epub 2024 Jul 31. PMID: 39096926.
2. Vargese SS, Jylhä M, Raitanen J, Forma L, Aaltonen M. Hospitalizations of the older adults with and without dementia during the last two years of life: the impact of comorbidity and changes from 2002 to 2017. Aging Clin Exp Res. 2025 Jan 21;37(1):25. doi: 10.1007/s40520-024-02918-0. PMID: 39833621; PMCID: PMC11753344.
3. Benetos A, Petrovic M, Strandberg T. Hypertension Management in Older and Frail Older Patients. Circ Res. 2019 Mar 29;124(7):1045-1060. doi: 10.1161/CIRCRESAHA.118.313236. PMID: 30920928.
4. Zekry D, Mendes A. Prise en charge des comorbidités chez les patients déments [Management of co-morbidities in demented patients]. Rev Med Suisse. 2016 Nov 9;12(538):1904-1906. French. PMID: 28696594.
5. Ou YN, Tan CC, Shen XN, Xu W, Hou XH, Dong Q, et al. Blood Pressure and Risks of Cognitive Impairment and Dementia: A Systematic Review and Meta-Analysis of 209 Prospective Studies. Hypertension. juill 2020;76(1):217 25.
6. Qiu C, Winblad B, Fratiglioni L. The age-dependent relation of blood pressure to cognitive function and dementia. Lancet Neurol. août 2005;4(8):487 99.
7. Ogliari G, Westendorp RGJ, Muller M, Mari D, Torresani E, Felicetta I, et al. Blood pressure and 10-year mortality risk in the Milan Geriatrics 75+ Cohort Study: role of functional and cognitive status. Age Ageing. nov 2015;44(6):932 7.
8. Alves C, Zekry D, Ponte B. Hypertension artérielle et démence : un lien complexe [Hypertension and dementia : A complex link]. Rev Med Suisse. 2021 Sep 15;17(750):1567-1570. French. PMID: 34528420.
9. Harrison JK, Van Der Wardt V, Conroy SP, Stott DJ, Dening T, Gordon AL, et al. New horizons: the management of hypertension in people with dementia. Age Ageing. nov 2016;45(6):740 6.
10. Mach F, Baigent C, Catapano AL, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias. Eur Heart J. 2020;41(1):111–188. doi:10.1093/eurheartj/ehz455
11. Kim K il. Optimal target blood pressure in older patients with hypertension. Cardiovasc Prev Pharmacother. 30 avr 2023;5(2):41 8.
12. Welsh TJ, Gordon AL, Gladman JRF. Treatment of Hypertension in People With Dementia: A Multicenter Prospective Observational Cohort Study. J Am Med Dir Assoc. sept 2019;20(9):1111 5.
13. Cholesterol Treatment Trialists’ (CTT) Collaboration. Efficacy and safety of statin therapy in older people: a meta-analysis. Lancet. 2019;393(10170):407–415. doi:10.1016/S0140-6736(18)31942-1
14. van der Ploeg, M.A., Floriani, C., Achterberg, W.P., Bogaerts, J.M.K., Gussekloo, J., Mooijaart, S.P., Streit, S., Poortvliet, R.K.E. and Drewes, Y.M. (2020), Recommendations for (Discontinuation of) Statin Treatment in Older Adults: Review of Guidelines. J Am Geriatr Soc, 68: 417-425. https://doi.org/10.1111/jgs.16219
15. Strandberg TE, Pitkälä KH. Statin therapy in the oldest old: Where do we stand? Eur J Intern Med. 2016;35:13–18. doi:10.1016/j.ejim.2016.08.009
16. Morley JE, Vellas B, van Kan GA, et al. Frailty consensus: a call to action. J Am Med Dir Assoc. 2013;14(6):392–397. doi:10.1016/j.jamda.2013.03.022
17. Varrias D, Saralidze T, Borkowski P, Pargaonkar S, Spanos M, Bazoukis G, et al. Atrial Fibrillation and Dementia: Pathophysiological Mechanisms and Clinical Implications. Biomolecules. 8 avr 2024;14(4):455.
18. Ouellet GM, Fried TR, Gilstrap LG, O’ Leary JR, Austin AM, Skinner JS, et al. Anticoagulant Use for Atrial Fibrillation Among Persons With Advanced Dementia at the End of Life. JAMA Intern Med. 1 août 2021;181(8):1121.
19. Van Gelder IC, Rienstra M, Bunting KV, Casado-Arroyo R, Caso V, Crijns HJGM, et al. 2024 ESC Guidelines for the management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J. 29 sept 2024;45(36):3314 414.
20. Friberg L, Andersson T, Rosenqvist M. Less dementia and stroke in low-risk patients with atrial fibrillation taking oral anticoagulation. Eur Heart J. 21 juill 2019;40(28):2327 35.
21. Madhavan M, Holmes DN, Piccini JP, Ansell JE, Fonarow GC, Hylek EM, et al. Association of frailty and cognitive impairment with benefits of oral anticoagulation in patients with atrial fibrillation. Am Heart J. mai 2019;211:77 89.
22. Kim D, Yang PS, Sung JH, Jang E, Yu HT, Kim TH, et al. Effectiveness and Safety of Anticoagulation Therapy in Frail Patients With Atrial Fibrillation. Stroke. juin 2022;53(6):1873 82.
23. Bhandari M, Pradhan A, Vishwakarma P, Di Renzo L, Iellamo F, Ali W, et al. Direct Oral Anticoagulant Use in Older Adults with Atrial Fibrillation: Challenges and Solutions. Eur Cardiol Rev. 20 févr 2025;20:e04.
24. on behalf of Grupo de trabajo de Riesgo vascular de la SEMI, Suárez Fernández C, Formiga F, Camafort M, Cepeda Rodrigo JM, Díez-Manglano J, et al. Antithrombotic treatment in elderly patients with atrial fibrillation: a practical approach. BMC Cardiovasc Disord. déc 2015;15(1):143.
25. Formiga F, Chivite D, Ariza-Solé A. Atrial fibrillation and cognitive impairment: some answers but many questions. Rev Esp Cardiol Engl Ed. nov 2020;73(11):869 70.
26. Joosten LPT, Van Doorn S, Van De Ven PM, Köhlen BTG, Nierman MC, Koek HL, et al. Safety of Switching from a Vitamin K Antagonist to a Non-Vitamin K Antagonist Oral Anticoagulant in Frail Older Patients with Atrial Fibrillation: Results of the FRAIL-AF Randomized Controlled Trial. Circulation. 27 août 2023;CIRCULATIONAHA.123.066485.
27. Charidimou A, Boulouis G, Frosch MP, Baron JC, Pasi M, Albucher JF, Banerjee G, Barbato C, Bonneville F, Brandner S, Calviere L, Caparros F, Casolla B, Cordonnier C, Delisle MB, Deramecourt V, Dichgans M, Gokcal E, Herms J, Hernandez-Guillamon M, Jäger HR, Jaunmuktane Z, Linn J, Martinez-Ramirez S, Martínez-Sáez E, Mawrin C, Montaner J, Moulin S, Olivot JM, Piazza F, Puy L, Raposo N, Rodrigues MA, Roeber S, Romero JR, Samarasekera N, Schneider JA, Schreiber S, Schreiber F, Schwall C, Smith C, Szalardy L, Varlet P, Viguier A, Wardlaw JM, Warren A, Wollenweber FA, Zedde M, van Buchem MA, Gurol ME, Viswanathan A, Al-Shahi Salman R, Smith EE, Werring DJ, Greenberg SM. The Boston criteria version 2.0 for cerebral amyloid angiopathy: a multicentre, retrospective, MRI-neuropathology diagnostic accuracy study. Lancet Neurol. 2022 Aug;21(8):714-725. doi: 10.1016/S1474-4422(22)00208-3. PMID: 35841910; PMCID: PMC9389452.
28. Akashi S, Oguri M, Ikeno E, Manita M, Taura J, Watanabe S, et al. Outcomes and Safety of Very-Low-Dose Edoxaban in Frail Patients With Atrial Fibrillation in the ELDERCARE-AF Randomized Clinical Trial. JAMA Netw Open. 23 août 2022;5(8):e2228500.
29. van Dyck CH, Swanson CJ, Aisen P, Bateman RJ, Chen C, Gee M, Kanekiyo M, Li D, Reyderman L, Cohen S, Froelich L, Katayama S, Sabbagh M, Vellas B, Watson D, Dhadda S, Irizarry M, Kramer LD, Iwatsubo T. Lecanemab in Early Alzheimer’ s Disease. N Engl J Med. 2023 Jan 5;388(1):9-21. doi: 10.1056/NEJMoa2212948. Epub 2022 Nov 29. PMID: 36449413.
30. Iacobucci G. Lecanemab: Experts criticise European Commission approval of Alzheimer’ s drug. BMJ. 2025 Apr 22;389:r796. doi: 10.1136/bmj.r796. PMID: 40262818.
31. Barakos J, Purcell D, Suhy J, Chalkias S, Burkett P, Marsica Grassi C, Castrillo-Viguera C, Rubino I, Vijverberg E. Detection and Management of Amyloid-Related Imaging Abnormalities in Patients with Alzheimer’ s Disease Treated with Anti-Amyloid Beta Therapy. J Prev Alzheimers Dis. 2022;9(2):211-220. doi: 10.14283/jpad.2022.21. PMID: 35542992.
32. American Diabetes Association Professional Practice Committee. 2. Diagnosis and Classification of Diabetes: Standards of Care in Diabetes-2025. Diabetes Care. 2025 Jan 1;48(Supplement_1):S27-S49. doi: 10.2337/dc25-S002. PMID: 39651986; PMCID: PMC11635041.
33. Alsharif AA, Wei L, Ma T, Man KKC, Lau WCY, Brauer R, Almetwazi M, Howard R, Wong ICK. Prevalence and Incidence of Dementia in People with Diabetes Mellitus. J Alzheimers Dis. 2020;75(2):607-615. doi: 10.3233/JAD-191115. PMID: 32310163.
34. LeRoith D, Biessels GJ, Braithwaite SS, Casanueva FF, Draznin B, Halter JB, Hirsch IB, McDonnell ME, Molitch ME, Murad MH, Sinclair AJ. Treatment of Diabetes in Older Adults: An Endocrine Society* Clinical Practice Guideline. J Clin Endocrinol Metab. 2019 May 1;104(5):1520-1574. doi: 10.1210/jc.2019-00198. PMID: 30903688; PMCID: PMC7271968.
35. Doucet J, Le Floch JP, Bauduceau B, Verny C; SFD/SFGG Intergroup. GERODIAB: Glycaemic control and 5-year morbidity/mortality of type 2 diabetic patients aged 70 years and older: 1. Description of the population at inclusion. Diabetes Metab. 2012 Dec;38(6):523-30. doi: 10.1016/j.diabet.2012.07.001. Epub 2012 Oct 10. PMID: 23062595.
36. Lega IC, Campitelli MA, Austin PC, Na Y, Zahedi A, Leung F, Yu C, Bronskill SE, Rochon PA, Lipscombe LL. Potential diabetes overtreatment and risk of adverse events among older adults in Ontario: a population-based study. Diabetologia. 2021 May;64(5):1093-1102. doi: 10.1007/s00125-020-05370-7. Epub 2021 Jan 25. PMID: 33491105.
37. Cariou B, Fontaine P, Eschwege E, Lièvre M, Gouet D, Huet D, Madani S, Lavigne S, Charbonnel B. Frequency and predictors of confirmed hypoglycaemia in type 1 and insulin-treated type 2 diabetes mellitus patients in a real-life setting: results from the DIALOG study. Diabetes Metab. 2015 Apr;41(2):116-25. doi: 10.1016/j.diabet.2014.10.007. Epub 2014 Nov 24. PMID: 25465273.
38. Biessels GJ, Despa F. Cognitive decline and dementia in diabetes mellitus: mechanisms and clinical implications. Nat Rev Endocrinol. 2018 Oct;14(10):591-604. doi: 10.1038/s41574-018-0048-7. PMID: 30022099; PMCID: PMC6397437.
39. Seminer A, Mulihano A, O’ Brien C, Krewer F, Costello M, Judge C, O’ Donnell M, Reddin C. Cardioprotective Glucose-Lowering Agents and Dementia Risk: A Systematic Review and Meta-Analysis. JAMA Neurol. 2025 Apr 7:e250360. doi: 10.1001/jamaneurol.2025.0360. Epub ahead of print. PMID: 40193122; PMCID: PMC11976645.
40. Donat Ergin B, Gadsby-Davis K, Mattishent K, Dhatariya K, Garner N, Hornberger M. Continuous Glucose Monitoring in Comorbid Dementia and Diabetes: The Evidence So Far. J Diabetes Sci Technol. 2024 Dec 18:19322968241301058. doi: 10.1177/19322968241301058. Epub ahead of print. PMID: 39691964; PMCID: PMC11653377.
41. Darmon P, Bauduceau B, Bordier L, Detournay B, Gourdy P, Guerci B, Jacqueminet S, Penfornis A, Philippe J, Scheen A, Thivolet C, Vidal-Trecan T. Prise de position de la Société Francophone du Diabète (SFD) sur les stratégies d’ utilisation des traitements anti-hyperglycémiants dans le diabète de type 2 – 2021. Médecine des Maladies Métaboliques. 2021;15(8):781-801. doi:10.1016/j.mmm.2021.10.014.
42. Diabetes, U. K. (2021). End of life guidance for diabetes care. London: DK.
la gazette médicale
- Vol. 14
- Ausgabe 5
- September 2025