- Prévention de la iatrogénie par mesure de la charge anticholinergique
Les médicaments à activité anticholinergique sont utilisés chez le patient âgé dans un large éventail d’ indications et sont associés à une palette d’ événements indésirables centraux et périphériques. L’ estimation de la charge anticholinergique sur la base d’ échelles permet d’ identifier les patients à risque et proposer des interventions sur la (dé)-prescription. Bien que toutes les échelles soient de qualité variable, leur utilisation dans la révison médicamenteuse est indispensable en prévention de la iatrogénie.
Drugs with anticholinergic activity are used in the older population in a wide range of indications and are associated with a variety of central and peripheral adverse events. Estimation of anticholinergic load on the basis of scales allows the identification of patients at risk and proposes interventions on (de)-prescription. Although all scales are of variable quality, their use in medication review is essential in preventing iatrogenicity.
Key Words: anticholinergic burden scale, adverse drug event, geriatric population, medication review
Les médicaments à activité anticholinergique : à risque chez le patient âgé
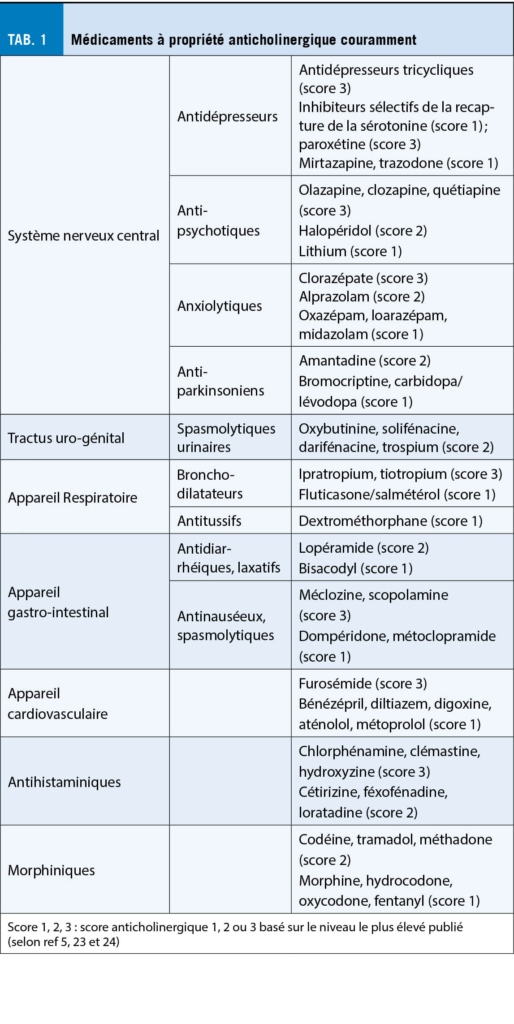
Les médicaments dits « à activité anticholinergique » comprennent des médicaments utilisés intentionnellement pour leur action anticholinergique (anti-ACh), comme l’ atropine, et d’ autres qui ne sont pas catégorisés comme des anti-ACh, tels les antihistaminiques, les antipsychotiques et certains antidépresseurs (tab. 1). D’ un point de vue pharmacologique, les médicaments anti-Ach sont des antagonistes muscariniques dont il existe cinq sous-types de récepteurs (1). Les récepteurs M2 et M3 se situent davantage dans la périphérie, comme le cœur et la vessie, et les récepteurs M1, M4 et M5 se retrouvent principalement dans le cerveau, où ils jouent un rôle crucial dans les fonctions cognitives et la mémoire (2).
Alors que les patients âgés sont largement exposés aux médicaments à activité anti-ACh, ceux-ci sont particulièrement susceptibles de subir leurs effets indésirables, notamment en raison de la diminution des fonctions rénales et hépatiques, d’ une augmentation de la perméabilité de la barrière hémato-encéphalique (BHE) et d’ une hypersensibilité anticholinergique qui accroît leur vulnérabilité (3-4). Les effets indésirables peuvent être périphériques (sécheresse buccale, atonie intestinale, rétention urinaire) et centraux (confusion, troubles de la mémoire, vertiges, chutes, insomnie) selon la capacité du médicament à passer la BHE (5). Une claire association entre ces médicaments et le délirium, les chutes, les troubles cognitifs et une mortalité accrue a été démontrée chez des patients âgés de 65 ans et plus (6-7). A noter que les résidents des maisons de retraite consomment beaucoup plus de médicaments anticholinergiques que les personnes âgées vivant à domicile et que la prescription augmente avec l’ admission à l’ hôpital (8-11).
Les différentes facettes de la mesure de l’ activité anticholinergique des médicaments
La quantification de l’ activité anticholinergique d’ un médicament peut être déterminée par plusieurs approches, dont la détermination in silico de la relation structure-activité sur les différents sous-types de récepteurs muscariniques, les analyses de liaisons aux récepteurs, tel que le SAA (serum radioreceptor anticholinergic activity assay) sur des échantillons de sang de patients, ou sur la base de la surveillance in vivo des effets indésirables induits par des médicaments anti-ACh (1). A l’heure actuelle 19 échelles de charge anticholinergique établies par des consensus d’ experts et basées sur ces différentes sources d’ information ont été développées au cours des dernières décennies pour guider la (dé)-prescription chez le patient âgé (12). Ces échelles attribuent généralement un score de 1 à 3 pour une faible et forte activité anticholinergique, respectivement, sur la base d’ une seule ou en combinant différentes approches de mesure, ce qui se traduit par une concordance faible à moyenne entre les différents échelles (corrélation de 0,60 à 0,82) (12). Une récente revue systématique a relevé des différences marquées dans la qualité de ces échelles, notamment en ce qui concerne la dose/concentration nécessaire à l’ effet antagoniste, le type de sous-récepteur le plus affecté, les aspects de lipophilie, de perméabilité de la BHE et la capacité à être transporté hors du cerveau par les pompes d’ efflux (PgP), qui ne sont pas systématiquement pris en considération (13). Parmi les 19 échelles évaluées, l’ échelle ACB (anticholinergic cognitive burden) (14) et le GABS (German anticholinergic burden scale) (15) ont atteint la meilleure évaluation globale, définie par la rigueur dans le développement de l’ échelle, la clarté de présentation et l’ applicabilité en clinique.
Bénéfice clinique des échelles de mesure de l’ activité anticholinergique des médicaments
La plupart des 19 échelles ont été validées en termes d’ efficacité clinique, en particulier pour la prédiction du risque de délirium, sur la cognition, les chutes et la mortalité (13). Globalement, les résultats indiquent une association positive, avec des évidences parfois contradictoires entre études, probablement en raison de leur qualité variable, de la grande hétérogénéité des populations étudiées et du design sous-optimal de la majorité d’ entre elles pour la détection des effets indésirables médicamenteux (13). Une seule méta-analyse évaluant l’ association entre la charge anticholinergique déterminée par les échelles ACB et ARS (Anticholinergic Risk Scale) et la mortalité toutes causes confondues a indiqué une tendance à une association positive malgré une hétérogénéité significative des études (16).
Les études récentes conduites dans diverses populations de patients indiquent qu’ un score cumulatif de 3 points et plus de charge anticholinergique mesuré avec n’ importe quelle échelle est l’ élément déterminant du risque de délirum, d’ une augmentation de la mortalité hospitalière et de la durée des séjours hospitaliers (17-19). Une étude de cohorte comparant la capacité prédictive de 19 échelles sur la mortalité et de la durée d’ hospitalisation indique qu’ une charge anticholinergique élevée à l’ admission (score≥3) était associée à une augmentation de 1,32 à 3,03 fois de la mortalité hospitalière par rapport une charge nulle ou faible (20). Parmi les 19 échelles étudiées, l’ Anticholinergic Toxicity Scale (ATS) (21) a montré l’ association la plus forte. Cette échelle a l’ avantage de mesurer l’ activité inhibitrice pour chaque sous-type de récepteur muscarinique et permet par conséquent une prédiction plus ciblée des effets indésirables (13).
Réduction du fardeau anticholinergique en prévention de iatrogénie
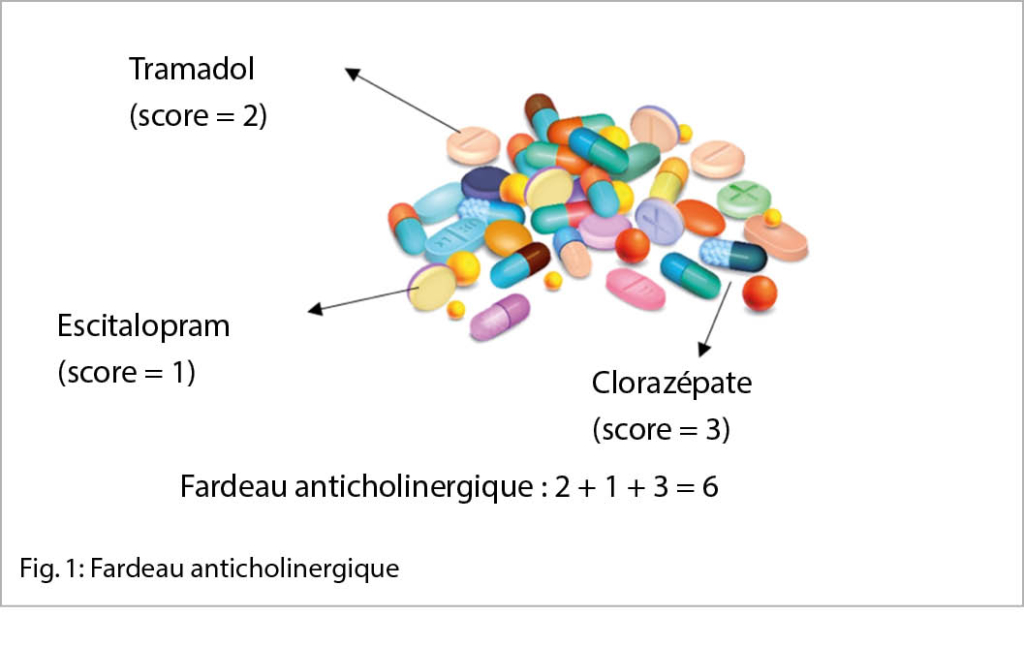
Le « fardeau anticholinergique » est défini comme l’ effet cumulatif de la prise d’ un ou de plusieurs médicaments susceptibles d’ induire des effets indésirables de l’ ACh (22). La première étape du calcul de la charge en ACh consiste à identifier tous les médicaments à activité anti-ACh, puis à additionner le score de chaque substance (fig. 1). Le score obtenu permet d’ identifier les patients présentant un risque élevé d’ effets indésirables. A noter toutefois que les échelles se basent sur une simple addition du score 1, 2 ou 3 de chaque médicament pour établir le fardeau anticholinergique global chez un patient polymédiqué sans qu’ aucun élément ne permette de déterminer si l’ effet anticholinergique cumulé peut se traduire par une simple addition des scores, comme c’ est généralement proposé.
En pratique clinique, nous recommanderions l’utilisation des échelles récentes comportant un plus large panel de médicament lors de toute révision médicamenteuse chez le patient âgé (13). Des articles de revue proposant des listes de médicaments avec leur score anti-ACh tirés de toutes les échelles, et des calculateurs (http://www.acbcalc.com/; https://medichec.com/; https://www.anticholinergicscales.es/) sont des sources d’information utiles et pratiques (5, 23-24). A l’ hôpital et dans les établissements de soins, l’ élaboration par une équipe interprofessionnelle de médecins, pharmacien.nes et infirmier.ères d’ une liste personnalisée de médicaments avec leur score anticholinergique offrant des conseils clairs sur les alternatives possibles aurait un impact positif sur la diminution du risque iatrogène lié aux effets sur le système cholinergique. L’ arrêt des médicaments ayant des propriétés anticholinergiques élevée à l’ admission pourrait être une intervention ciblée pour réduire la mortalité hospitalière et la durée de séjour (20).
Lors de la révision médicamenteuse, une attention particulière doit être portée sur les médicaments à haute activité anti-Ach (niveau 3)
ou si le cumul des médicaments conduit à une charge anticholinergique de 3 et plus. Les anti-ACh de niveau 3 sont à éviter dans la mesure du possible au profit de médicaments avec moins d’ effet anticholinergique ou être prescrit à la plus faible dose efficace et pour une courte durée, bien que l’ efficacité cette intervention n’ ait pas été formellement établie. Au sein d’ une même classe, des différences de tolérance important existent entre substances d’ un point de vue de leur tropisme vers le cerveau dépendant de leur lipophilie et de leur capacité à se fixer à la PgP. Les anti-ACh de niveau 2 doivent être prescrits avec prudence et nécessitent une évaluation des autres facteurs de risque du patient (troubles de la marche, insuffisance rénale, cognition, continence). Le risque des molécules de niveau 1 est plus faible mais devient élevé en présence d’ un cumul de substances à activité anti-ACh. En présence de symptômes susceptible d’ être mise en lien avec un effet anti-ACh potentiel, une révision médicamenteuse doit alors rechercher la prescription d’ une molécule à effet anti-ACh. Il convient de mentionner que les effets indésirables délétères sur le SNC dans la population vieillissante ne sont pas uniquement liés à la charge de l’ ACh, mais sont probablement multifactoriels. L’ ACh est l’ une des composantes à prendre en compte lors de l’ évaluation du risque d’ effets médicamenteux liés au SNC.
Conclusion
Bien qu’ aucune des échelles n’ apportent l’ ensemble des éléments nécessaires à l’ identification du risque lié à une charge anticholinergique élevée, ces échelles restent des outils simples, rapides et utiles pour mesurer le fardeau anticholinergique. Sa détermination par L’estimation de la charge anti-ACh est indispensable lors de la révision des traitements en raison des nombreux effets indésirables et la morbi-mortalité qui lui est associée.
Copyright Aerzteverlag medinfo
Centre de Recherche et d’ Innovation en Sciences Pharmaceutiques
Cliniques
Centre Hospitalier Universitaire et Université de Lausanne
Rue du Bugnon 17
1011 Lausanne
Chantal.Csajka@chuv.ch
pharmacienne diplômée
Service de Pharmacie, Département des Services Médicaux
Hôpital Cantonal de Baden
Im Ergel 1
5404 Baden
angela.lisibach@ksb.ch
pharmacienne-cheffe
Service de Pharmacie, Département des Services Médicaux
Hôpital Cantonal de Aarau
Tellstrasse 25
5001 Aarau
monika.lutters@ksa.ch
Les auteures déclarent n’ avoir aucun conflit d’ intérêt en rapport avec cet article.
◆ Il existe environ 19 échelles de mesure reconnues comme les seuls outils cliniquement utiles pour mesurer la charge anti-Ach au niveau central.
◆ Malgré certaines limitations, leur utilisation pour déterminer la charge anti-ACh cumulée de l’ensemble du traitement d’un patient est bénéfique dans la prévention de la iatrogénie, en particulier du délirium, des chutes, des troubles cognitifs et dans la diminution de la mortalité.
◆ Un score de charge anticholinergique cumulé de 3 points et plus est considéré comme élevé et doit être réduit en substituant des médicaments ayant une activité anti-ACh moindre.
◆ La détermination de la charge anti-ACh est recommandée en amont de toute prescription, lors d’une démarche de révision des traitements ou lors de la survenue d’un effet indésirable pouvant être expliqué par un effet anti-ACh comme, par exemple, une confusion, un trouble cognitif, une rétention urinaire, une chute.
1. de Leon J. Paying attention to pharmacokinetic and pharmacodynamic mechanisms to progress in the area of anticholinergic use in geriatric patients. Curr Drug Metab 2011 ; 12(7) : 635-46.
2. Abrams P, Andersson KE, Buccafusco JJ, Chapple C, de Groat WC, Fryer AD et al. Muscarinic receptors: their distribution and function in body systems, and the implications for treating overactive bladder. Br J Pharmacol 2006 ; 148(5) : 565-78.
3. Kersten H, Wyller TB. Anticholinergic Drug Burden in Older People’s Brain – How well is it measured? Basic Clin Pharmacol Toxicol 2014 ; 114 : 151-159.
4. Fox C, Richardson K, Maidment ID, Savva GM, Matthews FE, Smithard D et al. Anticholinergic medication use and cognitive impairment in the older population: the medical research council cognitive function and ageing study. J Am Geriatr Soc 2011 ; 59(8) : 1477-83
5. Csajka C, Bremond, Lang PO. Détecter et évaluar l’impact des médicaments anticholinergiques. Rev Med Suisse 2017 ; 13 : 1931-7
6. Ruxton K, Woodman RJ, AA Mangoni AA. Drugs with anticholinergic effects and cognitive impairment, falls and all-cause mortality in older adults: A systematic review and meta-analysis. Br J Clin Pharmacol 2015 ; 80(2) : 209-20.
7. Salahudeen MS, Duffull SB, Nishtala PS. Anticholinergic burden quantified by anticholinergic risk scales and adverse outcomes in older people: a systematic review. BMC Geriatr 2015; 15: 31.
8. Collamati A, Martone AM, Poscia A, Brandi V, Celi M, Marzetti E et al. Anticholinergic drugs and negative outcomes in the older population: from biological plausibility to clinical evidence. Aging Clin Exp Res 2016; 28(1) : 25-35.
9. Wawruch M, Macugova A, Kostkova L, Luha J, Dukat A, Murin J et al. The use of medications with anticholinergic properties and risk factors for their use in hospitalised elderly patients. Pharmacoepidemiol Drug Saf 2012 ; 21(2) : 170-6.
10. Haasum Y, Fastbom J, Johnell K. Institutionalization as a risk factor for inappropriate drug use in the elderly: a Swedish nationwide register-based study. Ann Pharmacother 2012; 46(3) : 339-46.
11. Tamura BK, Bell CL, Inaba M, Masaki KH. Outcomes of polypharmacy in nursing home residents. Clin Geriatr Med 2012 ; 28(2) : 217-36.
12. Lozano-Ortega G, Johnston KM, Cheung A, Wagg A, Campbell NL, Dmochowski RR, et al. A review of published anticholinergic scales and measures and their applicability in database analyses. Arch Gerontol Geriatr 2020; 87 : 103885.
13. Lisibach A, Benelli V, Ceppi MG, Waldner-Knogler K, Csajka C, Lutters M. Quality of anticholinergic burden scales and their impact on clinical outcomes: a systematic review. Eur J Clin Pharmacol 2021;77(2) : 147-162.
14. Campbell NL, Maidment I, Fox C, Khan B, Boustani M. The 2012 update to the anticholinergic cognitive burden scale. J Am Geriatr Soc 2013 ; 61 : S142-S3.
15. Kiesel EK, Hopf YM, Drey M. An anticholinergic burden score for German prescribers: score development. BMC Geriatr 2018 ; 18(1) : 239.
16. Ruxton K, Woodman RJ, Mangoni AA. Drugs with anticholinergic effects and cognitive impairment, falls and all-cause mortality in older adults: A systematic review and meta-analysis. Br J Clin Pharmacol 2015; 80 (2) : 209-220.
17. Vondeling AM, Knol W, Egberts TCG, Slooter AJC. Anticholinergic drug exposure at intensive care unit admission affects the occurrence of delirium. A prospective cohort study. Eur J Intern Med 2020; 78 : 121-126.
18. Landi F, Dell’Aquila G, Collamati A, Martone AM, Zuliani G, Gasperini B et al. Anticholinergic Drug Use and Negative Outcomes Among the Frail Elderly Population Living in a Nursing Home. J Am Med Dir Assoc 2014 ; 15(11) : 825-829.
19. Wolters AE, Zaal IJ, Veldhuijzen DS, Cremer OL, Devlin JW, van Dijk D, et al. Anticholinergic Medication Use and Transition to Delirium in Critically Ill Patients: A Prospective Cohort Study. Critical Care Medicine 2015 ; 43(9) : 1846-1852.
20. Lisibach A, Gallucci G, Beeler PE, Csajka C, Lutters M. High anticholinergic burden at admission associated with in-hospital mortality in older patients: A comparison of 19 different anticholinergic burden scales Basic Clin Pharmacol Toxicol 2022 ; 130 : 288–300.
21. Xu D, Anderson HD, Tao A, et al. Assessing and predicting drug-induced anticholinergic risks: an integrated computational approach. Ther Adv Drug Safn2017 ; 8(11) : 361-370.
22. Tune L.E. Anticholinergic effects of medication in elderly patients. J Clin Psychiatry 2001 ; 62 Suppl 21 : 11-4.
23. Duran CE, Azermai M, Vander Stichele RH. Systemmatic review of anticholinergic risk scales in older adults. Eur J Clin Pharmacol 2013 ; 69 : 1486-1496.
24. Salahudeen MS, Duffull SB, Nishtala PS. Anticholinergic burden quantified by anticholinergic risk scales and adverse outcomes in older people: a systematic review. BMC Geriatr 2015; 15:31.
la gazette médicale
- Vol. 11
- Ausgabe 3
- Mai 2022