- Traitement de la carence en fer durant la grossesse
La carence en fer, avec ou sans anémie, est un facteur de risque élevé de morbidité maternelle et infantile durant la grossesse. En raison de sa prévalence élevée et de la possibilité d’ intervenir, une carence en fer vaut la peine d’ être dépistée et traitée. La plupart des femmes ne disposent pas de réserves de fer suffisantes lors d’ une grossesse pour couvrir les besoins périnataux en fer de la mère et du fœtus. Le traitement martial permet de traiter de nombreux symptômes chez la mère et de protéger déjà in utero l’ enfant de conséquences graves. L’ intervention primaire en cas de carence en fer isolée est le fer oral, qui présente toutefois une forte intolérance pour une faible efficacité. Le fer parentéral se caractérise par une efficacité élevée et une bonne tolérance en général. Dans le diagnostic de la carence en fer, une valeur limite de ferritine de < 30 μg/L s’ est imposée comme un bon seuil pour définir la carence en fer. Un taux d’ hémoglobine < 110 G/L au premier et au troisième trimestre et < 105 G/L au deuxième trimestre est à considérer comme une anémie.
Iron deficiency and/or iron deficiency anemia complicate nearly 50 % of pregnancies globally, negatively impacting both maternal and fetal outcomes. Iron deficiency can cause a range of symptoms that range from aggravating to debilitating including fatigue, poor quality of life, pagophagia and restless legs syndrome. Iron deficiency and iron deficiency anemia are also associated with maternal complications including preterm labor, increased rates of cesarean delivery, postpartum hemorrhage and maternal death. Fetal complications include increased rates of low birth weight and small for gestational age newborns. Prenatal maternal anemia has also been associated with autism spectrum disorders in the neonate, although causality is not established. Iron deficiency in the newborn is associated with compromised memory, processing, and bonding, with some of these deficits persisting into adulthood. Despite the prevalence and consequences associated with iron deficiency in pregnancy, data show that it is routinely undertreated. Due to the physiologic changes of pregnancy, all pregnant individuals should receive oral iron supplementation. However, the bioavailability of oral iron is poor and it is often ineffective in preventing and treating iron deficiency. Likewise, it frequently causes gastrointestinal symptoms that can worsen quality of life in pregnancy. Intravenous iron formulations administered in a single or multiple dose series are now available. There is increasing data suggesting that newer intravenous formulations are safe and effective in the second and third trimesters and should be strongly considered in pregnant individuals without optimal response to oral iron repletion.
Keywords: Iron, Iron Deficiency, Anemia (Anaemia), symptoms, pregnancy, iron treatment, iron therapy
Introduction
La carence en fer est la carence en micronutriments la plus répandue dans le monde et, par conséquent, l’ anémie durant la grossesse est principalement due à une carence en fer. Selon les données de l’ OMS, la carence en fer et l’ anémie entraînent des complications dans environ 30 à 60 % des grossesses dans le monde. Durant la grossesse, près de 75 % des femmes enceintes souffrent d’ une carence en fer au troisième trimestre, si l’on se base sur une valeur seuil de ferritine de < 30 µg/L. Malgré la prévalence élevée et les effets négatifs de la carence en fer et de l’ anémie sur la morbidité maternelle et fœtale, la carence en fer est souvent sous-diagnostiquée et sous-traitée (1–3).
Bien que le diagnostic et le traitement de l’ anémie ferriprive durant la grossesse soient relativement simples, ils sont souvent négligés et/ou ne sont pas gérés de manière optimale par les gynécologues traitants. L’ un des problèmes liés au diagnostic de laboratoire de la carence en fer durant la grossesse est l’ absence de consensus dans la littérature, car les études disponibles utilisent des valeurs limites de ferritine non uniformes pour déterminer la carence en fer. L’ anémie ferriprive durant la grossesse est généralement définie comme une ferritine sérique < 15–30 µg/L et une hémoglobine < 110 G/L, la valeur < 110 G/L ne tenant pas compte de la valeur seuil inférieure physiologique de l’ hémoglobine au deuxième trimestre de 105 G/L. L’ utilisation d’ une valeur limite de ferritine < 30 µg/L augmente la sensibilité de la détection de la carence en fer, mais il manque des études sur les valeurs limites spécifiques à la grossesse (5, 10, 11).
On sait que les causes de la carence en fer sont multiples et dépendent de facteurs socio-économiques, des habitudes alimentaires, de l’ âge et de l’ origine de la femme enceinte, d’ une carence en fer pré-existante et de comorbidités, en particulier de maladies gastro-intestinales comme la maladie cœliaque ou la maladie de Crohn. 30 à 50 % des femmes présentent déjà une carence en fer avant la conception (6–8).
Conséquences de la carence en fer et de l’ anémie pour la femme enceinte et le fœtus
La carence en fer peut être asymptomatique ou provoquer des symptômes pénibles. Il s’ agit notamment de la fatigue, de l’ irritabilité («brain fog»), de l’ essoufflement, des maux de tête, de la chute des cheveux, de la baisse de la concentration, de la diminution des performances physiques et du syndrome des jambes sans repos. Ces symptômes sont souvent considérés comme normaux, tant par les femmes enceintes que par les gynécologues, car ils peuvent être attribués à des changements physiologiques survenus durant la grossesse. La carence en fer isolée ou latente (sans anémie) peut augmenter la morbidité maternelle en raison des risques d’anémie, d’hypertrophie placentaire et d’hypothyroïdie qui sont augmentés (13, 16, 17, 19, 23, 26).
En outre, le risque de travail prématuré et d’ accouchement prématuré est accru (9). L’ anémie ferriprive péri-partum est associée à un risque accru de dépression post-partum, de baisse de la qualité de vie, d’ anémie post-partum et de transfusion sanguine (21). Il est prouvé qu’ une carence en fer sévère augmente la morbidité fœtale et néonatale. Les connaissances issues de modèles animaux indiquent que la carence en fer pendant les phases critiques du développement fœtal entraîne des modifications du métabolisme cérébral, de la neurotransmission, de l’ épigénétique et de la myélinisation pendant les phases critiques du développement fœtal, qui se répercutent chez le nouveau-né. Des études cliniques récentes montrent que ces conséquences se produisent également chez l’ homme et qu’ il existe par exemple un lien entre la carence en fer et les troubles du spectre autistique et le déficit d’ attention chez les adolescents. La carence en fer maternelle entraîne de faibles réserves de fer fœtal et néonatal, avec les conséquences que cela implique (14, 15, 18, 27–31) (Fig. 1).
Screening de la carence en fer
Il n’ existe pas de consensus sur les protocoles de dépistage ou sur la réalisation systématique d’ un dépistage de la carence en fer durant la grossesse. Seules quelques organisations soutiennent le dépistage de la carence en fer isolée, car il existe peu d’ études démontrant une amélioration du risque par un traitement. En Angleterre, on recommande depuis peu un dépistage basé sur les risques, chez les femmes ayant des antécédents d’ anémie, les multipares, les grossesses multiples, les intervalles de grossesse courts, les végétariennes, les femmes présentant un risque élevé d’ hémorragie à la naissance et les femmes qui refusent les transfusions sanguines. L’ American College of OBGYN (ACOG) recommande un dépistage de l’ anémie et une supplémentation générale en fer chez les femmes enceintes. Selon l’ ACOG, le test de ferritine ne doit être effectué qu’ en cas d’ anémie, avec une valeur seuil de < 30 µg/L (OMS < 15 µg/L!) (Practice Bulletin 233, août 2021). Dans la lettre d’ experts de la SSGO (n° 77), nous recommandons le dosage de l’ hémoglobine et de la ferritine au cours du premier trimestre et aux alentours de 24–28 semaines de grossesse pour détecter les carences en fer et l’ anémie chez les femmes enceintes.
Traitement
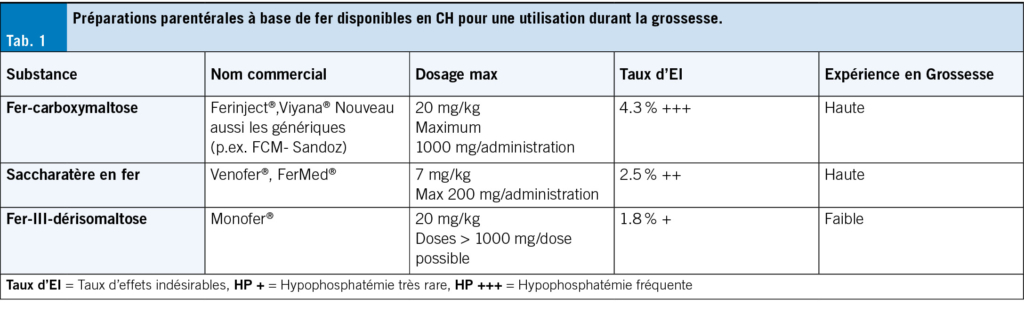
Plusieurs lignes directrices nationales recommandent une supplémentation orale générale en fer chez les femmes enceintes (ACOG, Centers of Disease Control, OMS). Celle-ci peut se faire quotidiennement ou en alternance tous les deux jours. Il a été démontré qu’ une prise orale de fer tous les deux jours augmente l’ absorption du fer tout en réduisant le taux d’ effets secondaires indésirables (4, 22). Il convient de choisir la dose de fer la plus faible possible par voie orale (environ 30 mg de fer élémentaire/dose), car les doses élevées entraînent l’ arrêt du traitement chez jusqu’ à 70 % des femmes, en raison des effets secondaires gastro-intestinaux. Il convient de noter que le fer oral constitue la seule option de traitement au premier trimestre. Il existe de nombreuses préparations orales à base de fer; en règle générale, les sels de fer II présentent un taux d’EI (effets indésirables) plus élevé que les complexes de fer III, par exemple. Selon des études, les bisglycinates de fer (composé amino-ferrique) présentent une bonne absorption et une bonne efficacité avec un faible taux d’EI (16, 25). À partir du deuxième trimestre, il existe des préparations intraveineuses à base de fer pour le traitement de l’anémie ferriprive, qui se sont avérées sûres et efficaces durant la grossesse. Contrairement au fer oral, seul le fer intraveineux convient au traitement des carences en fer et des anémies graves, en particulier lorsque nous souhaitons une efficacité à court terme (24, 25, 42–49). Les doses correspondent à celles utilisées chez les femmes non enceintes. Dans la plupart des cas, en Suisse, il est aujourd’hui possible d’utiliser des doses unitaires élevées, ce qui, en raison de la simplicité d’utilisation et de l’efficacité, entraîne également une grande satisfaction des patientes. Les préparations parentérales à base de fer les plus utilisées dans le monde sont le saccharate de fer, le dextran de fer de faible poids moléculaire (LMWD, Cave: PAS le dextran de poids moléculaire élevé!), le fer-carboxy-maltose (FCM), le ferumoxytol et le fer-III-dérisomaltose (24, 25). En ce qui concerne les réactions allergiques et les autres effets indésirables, les préparations sont comparables. Dans les études comparatives entre le fer parentéral et le fer oral, le taux d’EI est généralement plus élevé pour les préparations orales, principalement en raison des effets secondaires gastro-intestinaux. Selon les études disponibles, le fer-carboxymaltose présente le taux le plus élevé d’hypophosphatémie induite après perfusion, bien que les hypophosphatémies graves soient rares après des doses uniques. Dans une étude récemment publiée par le service d’obstétrique de l’Université de Genève, 3/22 femmes enceintes ont présenté une hypophosphatémie après carboxymaltose ferrique contre 1/22 femmes enceintes sous fer oral (13 contre 4 %). La différence n’ était pas significative et les nouveau-nés n’ ont pas présenté d’ hypophosphatémie dans le groupe carboxymaltose ferrique (49). Les préparations recommandées et les plus utilisées en Suisse sont présentées dans le Tab. 1. En cas de thérapie ferrique i.v., les directives recommandées par SWISSMEDIC doivent être respectées en général et en particulier durant la grossesse. De même, il convient de tenir compte des contre-indications telles que le premier trimestre, une infection bactérienne aiguë et un status après une anaphylaxie ou une réaction allergique grave après l’ administration de fer i.v. On estime que le risque de réaction anaphylactique est inférieur à 1 : 1000 avec les nouvelles préparations à base de fer.
Les indications pour l’ utilisation de fer parentéral sont l’ absence de réponse ou une réponse insuffisante au fer oral (augmentation de l’ Hb < 10G/L dans les 14 jours), l’ intolérance et la non-compliance à la prise de fer par voie orale, l’ absorption perturbée du fer (interventions bariatriques, maladies intestinales chroniques, maladie cœliaque), l’ anémie sévère pré-existante ou évolutive (surtout < < 90 G/L), la nécessité de corriger rapidement et efficacement l’ anémie en cas de facteurs de risque chez la femme enceinte (placenta praevia, risque hémorragique élevé, troubles de la coagulation, refus de sang étranger, status après atonie, etc.) (42, 43, 48).
Les préparations parentérales à base de fer sont également utilisées de manière standard en Suisse dans le post-partum, principalement pour traiter l’ anémie post-partum (Hb < 100G/L).
Copyright
Aerzteverlag medinfo AG
Traduction de info@gynécologie 01/2025
Gyn & Périnatal Zurich
Centre médical Hirslanden
Seefeldstrasse 214
8008 Zurich
C. Breymann donne des conférences et des formations pour CLS-Vifor Suisse et CLS-Vifor International et Pierre Fabre/ Robapharm Suisse. Il participe également à des publications sur les préparations à base de fer concernées
1. WHO/UNICEF/UNU. Iron deficiency anaemia: assessment, prevention and control, a guide for programme managers. World Health Organization Geneva Switzerland. 2001. WHO/NHD/01.3. In.
2. Lee AI, Okam MM. Anemia in pregnancy. Hematol Oncol Clin North Am. 2011;25(2):241–259, vii. [PubMed: 21444028] Murray C, Lopez AD. Global and regional cause-of-death patterns in 1990. Bulletin of the World Health Organization. 1994;72(3):447.
3. Osungbade KO, Oladunjoye AO. Preventive treatments of iron deficiency anaemia in pregnancy: a review of their effectiveness and implications for health system strengthening. J Pregnancy. 2012;2012:454601.
4. Zamani AR, Farajzadegan Z, Ghahiri A, KHADEMLOU M, Golshiri P. Effectiveness of twice weekly iron supplementation compared with daily regimen in reducing anemia and iron deficiency during pregnancy: a randomized trial in Iran. 2008.
5. Daru J, Allotey J, Peña-Rosas JP, Khan KS. Serum ferritin thresholds for the diagnosis of iron deficiency in pregnancy: a systematic review. Transfus Med. 2017;27(3):167–174.
6. Tang G, Lausman A, Abdulrehman J, et al. Prevalence of iron deficiency and iron deficiency anemia during pregnancy: a single centre Canadian study. Blood. 2019;134:3389.
7. Barton JC, Wiener HH, Acton RT, et al. Prevalence of iron deficiency in 62,685 women of seven race/ethnicity groups: The HEIRS Study. PLoS One. 2020;15(4):e0232125.
8. Campbell R, Wang H, Ahmed R. Risk Factors Contributing to Racial/Ethnic Disparities in Iron Deficiency in US Women. Current Developments in Nutrition. 2021;5(Supplement_2):725–725.
9. Ren A, Wang J, Ye RW, Li S, Liu JM, Li Z. Low first-trimester hemoglobin and low birth weight, preterm birth and small for gestational age newborns. Int J Gynaecol Obstet. 2007;98(2):124–128.
10. Read AJ, Waljee AK, Sussman JB, et al. Testing Practices, Interpretation, and Diagnostic Evaluation of Iron Deficiency Anemia by US Primary Care Physicians. JAMA Network Open. 2021;4(10):e2127827–e2127827.
11. Auerbach M, Abernathy J, Juul S, Short V, Derman R. Prevalence of iron deficiency in first trimester, nonanemic pregnant women. J Matern Fetal Neonatal Med. 2021;34(6):1002–1005.
12. Jaime-Perez JC, Herrera-Garza JL, Gomez-Almaguer D. Sub-optimal fetal iron acquisition under a maternal environment. Arch Med Res. 2005;36(5):598–602.
13. Scholl TO. Iron status during pregnancy: setting the stage for mother and infant. Am J Clin Nutr. 2005;81(5):1218s–1222s.
14. Kilbride J, Baker TG, Parapia LA, Khoury SA, Shuqaidef SW, Jerwood D. Anaemia during pregnancy as a risk factor for iron-deficiency anaemia in infancy: a case-control study in Jordan. Int J Epidemiol. 1999;28(3):461–468.
15. Kelly AM, MacDonald DJ, McDougall AN. Observations on maternal and fetal ferritin concentrations at term. Br J Obstet Gynaecol. 1978;85(5):338–343.
16. Elstrott B, Khan L, Olson S, Raghunathan V, DeLoughery T, Shatzel JJ. The role of iron repletion in adult iron deficiency anemia and other diseases. Eur J Haematol. 2020;104(3):153–161.
17. Bothwell TH. Iron requirements in pregnancy and strategies to meet them. Am J Clin Nutr. 2000;72(1 Suppl):257s–264s.
18. Colomer J, Colomer C, Gutierrez D, et al. Anaemia during pregnancy as a risk factor for infant iron deficiency: report from the Valencia Infant Anaemia Cohort (VIAC) study. Paediatr Perinat Epidemiol. 1990;4(2):196–204.
19. Gambling L, Danzeisen R, Gair S, et al. Effect of iron deficiency on placental transfer of iron and expression of iron transport proteins in vivo and in vitro. Biochem J. 2001;356(Pt 3):883–889. [PubMed: 11389698]
20. Soares NN, Mattar R, Camano L, Torloni MR. Iron deficiency anemia and iron stores in adultand adolescent women in pregnancy. Acta Obstet Gynecol Scand. 2010;89(3):343–349.
21. Juul SE, Derman RJ, Auerbach M. Perinatal iron deficiency: implications for mothers and infants. Neonatology. 2019;115(3):269–274.
22. Leonard AJ, Chalmers KA, Collins CE, Patterson AJ. Comparison of two doses of elemental iron in the treatment of latent iron deficiency: efficacy, side effects and blinding capabilities. Nutrients. 2014;6(4):1394–1405.
23. Yu X, Shan Z, Li C, et al. Iron deficiency, an independent risk factor for isolated hypothyroxinemia in pregnant and nonpregnant women of childbearing age in China. The Journal of Clinical Endocrinology & Metabolism. 2015;100(4):1594–1601.
24. Govindappagari S, Newman R, Burwick R. Iron-deficiency anemia in pregnancy and the role of intravenous iron. Contemporary OB/GYN Journal. 2021;66(07).
25. Auerbach M, James SE, Nicoletti M, et al. Results of the First American Prospective Study of Intravenous Iron in Oral Iron-Intolerant Iron-Deficient Gravidas. Am J Med. 2017;130(12):1402– 1407.
26. Zimmermann MB, Burgi H, Hurrell RF. Iron deficiency predicts poor maternal thyroid status during pregnancy. J Clin Endocrinol Metab. 2007;92(9):3436–3440.
27. Tran PV, Fretham SJ, Carlson ES, Georgieff MK. Long-term reduction of hippocampal brain- derived neurotrophic factor activity after fetal-neonatal iron deficiency in adult rats. Pediatr Res. 2009;65(5):493–498.
28. Tamura T, Goldenberg RL, Hou J, et al. Cord serum ferritin concentrations and mental and psychomotor development of children at five years of age. J Pediatr. 2002;140(2):165–170.
29. Lozoff B, Beard J, Connor J, Barbara F, Georgieff M, Schallert T. Long-lasting neural and behavioral effects of iron deficiency in infancy. Nutr Rev. 2006;64(5 Pt 2):S34–43; discussion S72–91.
30. McArdle HJ, Gambling L, Kennedy C. Iron deficiency during pregnancy: the consequences for placental function and fetal outcome. Proceedings of the Nutrition Society. 2014;73(1):9–15.
31. Wiegersma AM, Dalman C, Lee BK, Karlsson H, Gardner RM. Association of prenatal maternal anemia with neurodevelopmental disorders. JAMA psychiatry. 2019;76(12):1294–1304.
32. Shao J, Lou J, Rao R, et al. Maternal serum ferritin concentration is positively associated with newborn iron stores in women with low ferritin status in late pregnancy. J Nutr. 2012;142(11):2004–2009.
33. Moretti D, Goede JS, Zeder C, et al. Oral iron supplements increase hepcidin and decrease iron absorption from daily or twice-daily doses in iron-depleted young women. Blood. 2015;126(17):1981–1989.
34. Stoffel NU, von Siebenthal HK, Moretti D, Zimmermann MB. Oral iron supplementation in iron- deficient women: How much and how often? Molecular Aspects of Medicine. 2020;75:100865.
35. Tolkien Z, Stecher L, Mander AP, Pereira DI, Powell JJ. Ferrous sulfate supplementation causes significant gastrointestinal side-effects in adults: a systematic review and meta-analysis. PloS one. 2015;10(2):e0117383.
36. Neogi SB, Devasenapathy N, Singh R, et al. Safety and effectiveness of intravenous iron sucrose versus standard oral iron therapy in pregnant women with moderate-to-severe anaemia in India: a multicentre, open-label, phase 3, randomised, controlled trial. Lancet Glob Health. 2019;7(12):e1706–e1716.
37. Wong L, Smith S, Gilstrop M, et al. Safety and efficacy of rapid (1,000 mg in 1 hr) intravenous iron dextran for treatment of maternal iron deficient anemia of pregnancy. Am J Hematol. 2016;91(6):590–593.
38. Glaspy JA, Lim-Watson MZ, Libre MA, et al. Hypophosphatemia Associated with Intravenous Iron Therapies for Iron Deficiency Anemia: A Systematic Literature Review. Ther Clin Risk Manag. 2020;16:245–259.
39. Wolf M, Rubin J, Achebe M, et al. Effects of Iron Isomaltoside vs Ferric Carboxymaltose on Hypophosphatemia in Iron-Deficiency Anemia: Two Randomized Clinical Trials. JAMA. 2020;323(5):432–443
40. Froessler B, Collingwood J, Hodyl NA, Dekker G. Intravenous ferric carboxymaltose for anaemia in pregnancy. BMC Pregnancy and Childbirth. 2014;14(1):115.
41. Jose A, Mahey R, Sharma JB, et al. Comparison of ferric Carboxymaltose and iron sucrose complex for treatment of iron deficiency anemia in pregnancy- randomised controlled trial. BMC Pregnancy and Childbirth. 2019;19(1):54.
42. Kant S, Haldar P, Malhotra S, Kaur R, Rath R, Jacob OM. Intravenous ferric carboxymaltose rapidly increases haemoglobin and serum ferritin among pregnant females with moderate-to- severe anaemia: A single-arm, open-label trial. Natl Med J India. 2020;33(6):324–328.
43. Froessler B, Gajic T, Dekker G, Hodyl NA. Treatment of iron deficiency and iron deficiency anemia with intravenous ferric carboxymaltose in pregnancy. Arch Gynecol Obstet. 2018;298(1):75–82.
44. Karki NR, Auerbach M. Single total dose infusion of ferumoxytol (1020 mg in 30 minutes) is an improved method of administration of intravenous iron. Am J Hematol. 2019;94(9):E229–e231.
45. Khan H, May P, Kuo E, et al. Safety and efficacy of a single total dose infusion (1020 mg) of ferumoxytol. Ther Adv Hematol. 2021;12:20406207211006022.
46. Hansen R, Sommer VM, Pinborg A, et al. Intravenous ferric derisomaltose versus oral iron for persistent iron deficient pregnant women: a randomised controlled trial. Arch Gynecol Obstet. 2022.
47. Holm C, Thomsen LL, Norgaard A, Langhoff-Roos J. Single-dose intravenous iron infusion or oral iron for treatment of fatigue after postpartum haemorrhage: a randomized controlled trial. Vox Sang. 2017;112(3):219–228.
48. Daniilidis A, Panteleris N, Vlachaki E, Breymann C, Assimakopoulos E. Safety and efficacy of intravenous iron administration for uterine bleeding or postpartum anaemia: a narrative review. J Obstet Gynaecol. 2018;38(4):443–447. [
49. Fanny Schumacher 1, Francisca Barcos-Munoz 2, Margot Kunckler 1, Nicolas Vuilleumier 3 4, Begoña Martinez de Tejada. Newborn phosphocalcic metabolism after intravenous iron administration during pregnancy. J Matern Fetal Neonatal Med . 2024 Dec;37(1):2320671.
la gazette médicale
- Vol. 14
- Ausgabe 5
- September 2025