- Extrasystolie – ein weitverbreitetes Phänomen
Geschichte
Die erste dokumentierte Beschreibung intermittierender Rhythmusstörungen, die den regelmässigen Puls unterbrechen und mit ventrikulären Extrasystolen (VES) übereinstimmen könnten, stammt vom chinesischen Arzt Pien Ts’Io, der etwa 600 vor Christus lebte. Er stellte fest, dass diese Unregelmässigkeiten die normale Lebensspanne nicht beeinträchtigten, wenn sie gelegentlich auftraten, aber eine düstere Prognose nahelegten, wenn sie häufig aufträten (1). Die ersten dokumentierten Beobachtungen von unregelmässigen Herzschlägen gehen auf das 17. Jahrhundert zurück. Der englische Arzt und Anatom William Harvey veröffentlichte damals seine erste Arbeit über die Bewegung des Herzens und des Blutes, was das Verständnis des Blutkreislaufs revolutionierte. In Harvey’s Werk «Exercitatio Anatomica de Motu Cordis et Sanguinis in Animalibus» wurde die Theorie des Blutkreislaufs und der Herzfunktion erstmals publiziert. Seine Experimente wurden an Tieren durchgeführt (2). Einige Jahre später hat der französische Naturwissenschaftler und Philosoph René Descartes in seinem Werk «Traité de l’homme» medizinische Aspekte bezüglich Extrasystolie behandelt. Descartes sah das Herz als eine Art Pumpe, die das Blut in einem kontinuierlichen Kreislauf durch den Körper bewegt. Er betrachtete den Herzschlag als eine physikalische Aktivität, die durch die Bewegung der Muskeln im Herzen verursacht wird. Er erkannte, dass das Herz als Muskel durch elektrische Impulse gesteuert wird und dass Störungen in diesem System zu unregelmässigen Herzschlägen führen können, wobei Extrasystolen in seinem Werk als Beispiel für solche erwähnt wurden (3).
Im späten 19. und frühen 20. Jahrhundert wurde durch die Entwicklung der Elektrokardiographie (EKG) ein Durchbruch im Verständnis von Herzrhythmusstörungen erzielt. Das erste EKG vom menschlichen Herzen wurde im Mai 1887 von Augustus Waller am St. Mary’s Hospital in London mit einem Quecksilberkapillarelektrometer aufgezeichnet (4). Willem Einthoven, der Professor für Physiologie an der Universität Leiden in den Niederlanden war, begann seine Studien des EKGs mit dem Quecksilberkapillarelektrometer und verbesserte dessen Verzerrung mathematisch, sodass er schliesslich eine gute Darstellung des EKGs vor Beginn des 20. Jahrhunderts registrieren konnte (4). Im frühen 20. Jahrhundert wurde die erste Klassifikation von Extrasystolen vom britischen Kardiologen Sir Thomas Lewis entwickelt. In seiner Klassifikation unterscheidet er zwischen verschiedenen Arten von Extrasystolen basierend auf ihrer Herkunft und ihrem Einfluss auf den Herzrhythmus (5). Jahre später verfeinerten und erweiterten Bernard Lown und Samuel Levine die Klassifikation von Herzrhythmusstörungen, einschliesslich der Extrasystolen, und entwickelten die renommierte Lown-Klassifikation (6). Die moderne Praxis bewegt sich weg von starren Klassifikationen hin zu einem ganzheitlichen Ansatz, der neben strukturellen und symptomatischen Merkmalen die Last (Extrasystolen als Prozentsatz zur Gesamtheit der Herzschläge im Langzeit-EKG), Ursprungsort im Herzen sowie Trigger berücksichtigt.
Epidemiologie
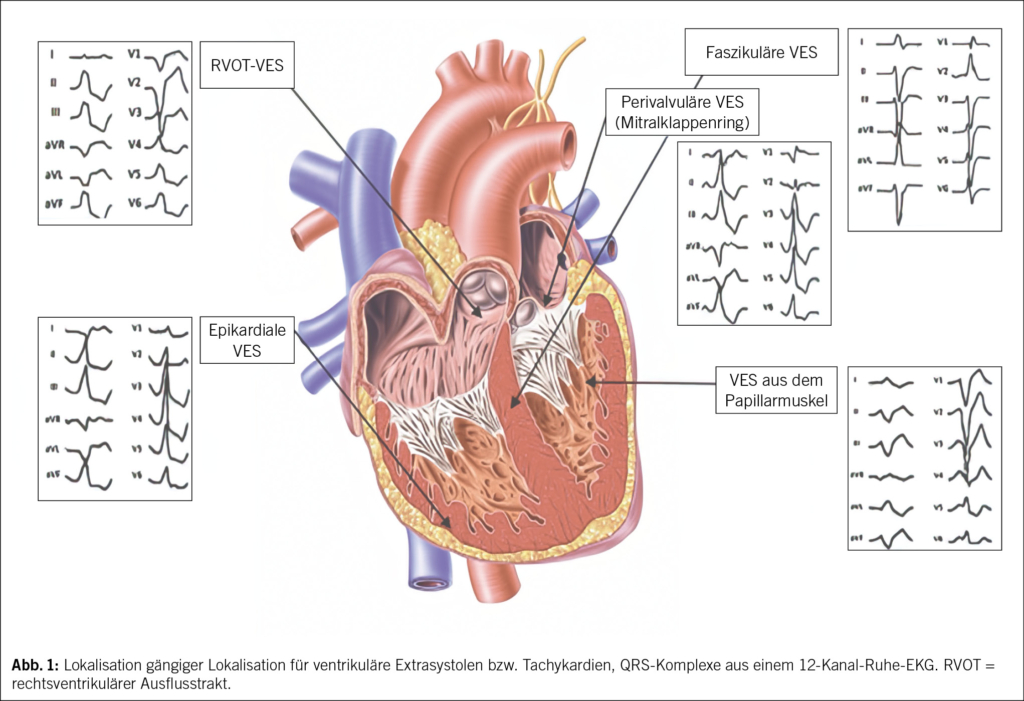
Supraventrikuläre Extrasystolen (SVES) sind sehr häufig und treten meist bei herzgesunden Personen auf (7). Die altersadjustierte Prävalenz von SVES im Ruhe-EKG über 15 Sekunden beträgt laut einer finnischen Studie mit 10 962 Probanden im Alter zwischen 30 und 59 Jahren 12 % bei Männern und 15 % bei Frauen (8). Diese Prävalenz steigt mit zunehmendem Alter an (9). Laut der Framingham-Studie von 1992 ist bei Männern ohne klinisch erkennbare koronare Herzkrankheit die zufällige Entdeckung von ventrikulären Arrhythmien mit einem zweifach erhöhten Risiko für die Gesamtmortalität sowie für Herzinfarkt oder Tod aufgrund einer koronaren Herzkrankheit verbunden (10). Die Studie von Hashimoto et al. aus dem Jahr 2023 zeigt, dass die SVES durch den Anstieg des Alters und des Body-Mass-Index beeinflusst werden, während die VES nur mit dem Anstieg des Alters verbunden waren (11). Die altersbereinigte Inzidenz symptomatischer VES ist bei Frauen allerdings höher als bei Männern (46 vs. 21 pro 100 000) (12). Bei ungefähr einem Drittel dieser Patienten kommt es zum Auftreten von nicht anhaltenden ventrikulären Tachykardien (NSVT) und/oder supraventrikulären Reentry-Tachykardien (SVT) (13). Der Ursprungsort idiopathischer VES liegt bei etwa 80 % im rechtsventrikulären Ausflusstrakt (RVOT) (13). Die Inzidenz des plötzlichen Herztodes durch das Auftreten von VES beträgt < 0.1 % pro Jahr (14). Sehr häufige Extrasystolen (> 10 % der QRS-Komplexe) können zu einer VES-induzierten Kardiomyopathie mit progredient abnehmender, systolischer, linksventrikulärer Funktion führen.
Pathophysiologie
Extrasystolen können durch eine Vielzahl von Faktoren ausgelöst werden, die sowohl physiologische als auch pathologische Ursachen haben. Das Auftreten von Extrasystolen bei Sportlern kann durch einen erhöhten Vagotonus oder durch funktionell-strukturelle Veränderungen im Bereich des rechtsventrikulären Ausflusstraktes erklärt werden (15). Eine neuere Studie aus dem Jahr 2023 zeigt, dass das Volumen des epikardialen Fettgewebes bei Patienten mit häufigen VES unabhängig von anderen Faktoren grösser war als bei Kontrollpatienten. Ein grosses extrakardiales Fettvolumen war unabhängig mit hoher Symptomlast durch VES assoziiert (16).
Diagnostik
Das erste und wichtigste Diagnosemittel zum Nachweis von SVES und VES ist die 12-Kanal-Ruhe-Elektrokardiographie (EKG), welche nebst der Diagnose auch Aufschluss über die Lokalisation des myokardialen Fokus der Extrasystole gibt und somit der Ursachenklärung beitragen kann.
In den meisten Fällen ist ein Langzeit-EKG notwendig, um einerseits eine Symptom-Rhythmus-Korrelation zur Diagnosestellung zu dokumentieren und andererseits die (S) VES-Last zu bestimmen. Ausserdem können über eine längere Aufzeichnungszeit allenfalls vorliegende, polymorphe Varianten aufgezeichnet werden. Obwohl das 24-Stunden-Holter-Monitoring lange Zeit als Goldstandard zur Bewertung der VES-Frequenz galt, haben neuere Erkenntnisse gezeigt, dass erhebliche tägliche Schwankungen auftreten können und dass möglicherweise bis zu sechs Tage Überwachung erforderlich sind, bevor die maximale tägliche VES-Last beobachtet wird. Im Allgemeinen ist ein einzelner tragbarer EKG-Patch wahrscheinlich ausreichend und am nützlichsten für diesen Zweck (23).
In der Familienanamnese sollten insbesondere eventuell vorliegende Kardiopathien oder plötzliche Todesfälle erfragt werden (17, 22).
Die Durchführung eines Belastungstests (Ergometrie) kann Sinn machen: Benigne Extrasystolen treten häufig in Ruhe auf und werden bei körperlicher Anstrengung weniger häufig (24). Unter Belastung gehäuft auftretende VES, insbesondere polymorphe, können Ausdruck einer myokardialen Ischämie sein und sollten je nach klinischem Kontext weiter abgeklärt werden.
Falls eine hohe VES-Last (> 5–10 %) besteht oder weitere kardiale Symptome bestehen, sollte zur weiteren Abklärung primär eine Doppler-Echokardiographie (17, 19) veranlasst werden. Um strukturelle Fragestellungen zu beantworten, ist die diagnostische Methode der ersten Wahl das Herz-MRI (17, 25) und sollte insbesondere in Betracht gezogen werden, wenn anhaltende ventrikuläre Tachykardien bestehen und/oder sich in der Echokardiographie Auffälligkeiten (z. B. eine reduzierte, ventrikuläre, systolische Funktion, Hinweise für eine arrhythmogene rechtsventrikuläre Kardiomyopathie [ARVC]) finden. Zu beachten ist, dass kardiale MRI-Bilder aufgrund von Gating-Schwierigkeiten bei unregelmässiger Herzfrequenz möglicherweise eingeschränkt interpretierbar sind. Das Herz-MRI kann hilfreich sein, um die Diagnose einer ARVC oder einer kardialen Sarkoidose stellen (23). Falls der klinische Verdacht auf eine koronare Herzkrankheit besteht, kann je nach klinischem Kontext eine nicht invasive Ischämietestung mittels Stress-MRI, Myokardperfusions-Szintigraphie oder Myokardperfusions-PET-CT des Herzens oder allenfalls direkt eine invasive Ischämietestung mittels Koronarangiographie erfolgen.
Therapie
Die Therapie von SVES und VES richtet sich primär nach der Ursache (strukturelle Herzerkrankung, systemische Erkrankungen, psychosomatische Störungen, Toxine etc.). Sekundär muss zwischen symptomatischer und prognostisch relevanter Therapie unterschieden werden. Viele der Empfehlungen basieren auf Expertenmeinungen und Registerdaten. Randomisierte, prospektive Studien fehlen (26).
SVES
Die Therapie von SVES richtet sich nach dem Schweregrad der Symptome und der zugrunde liegenden Ursache. Nach deren Behandlung reduziert sich die Anzahl der Extrasystolen meist (27, 28). Primär gilt es, eine Thyreopathie auszuschliessen. Anschliessend empfiehlt sich eine Überprüfung der Lebensweise hinsichtlich Kaffee-, Energiedrink-, Alkohol- und Drogenkonsum sowie Dauer und Häufigkeit stärkerer Stressphasen. Leichter Bewegungssport und Entspannungsübungen können die Häufigkeit von SVES, die nicht einer speziellen Erkrankung zugeordnet werden können, eindämmen.
Gesunde Patienten bedürfen bei Auftreten von SVES keinerlei Therapie. Im Falle eines Auftretens von paroxysmalen, supraventrikulären Tachykardien beziehungsweise intermittierendem Vorhofflimmern empfiehlt sich eine Guideline-konforme Therapie (19, 29), da sich Hinweise fanden, dass Patienten, die durch atriale Ektopie unter Symptomen leiden, eher ein subklinisches Vorhofflimmern entwickeln, welches in der Folge zu einem zerebrovaskulären Insult führen kann (17).
SVES sind äusserst selten therapiebedürftig. Da isolierte SVES keine erhöhte Mortalität mit sich bringen, ist ein allfälliger medikamentöser Therapieansatz in diesen Fällen reine Symptomkontrolle. In seltenen Fällen kann probatorisch, unter Berücksichtigung des Nebenwirkungspotenzials, die Anwendung eines initial tief dosierten Betablockers zur Anwendung kommen (29, 30).
VES
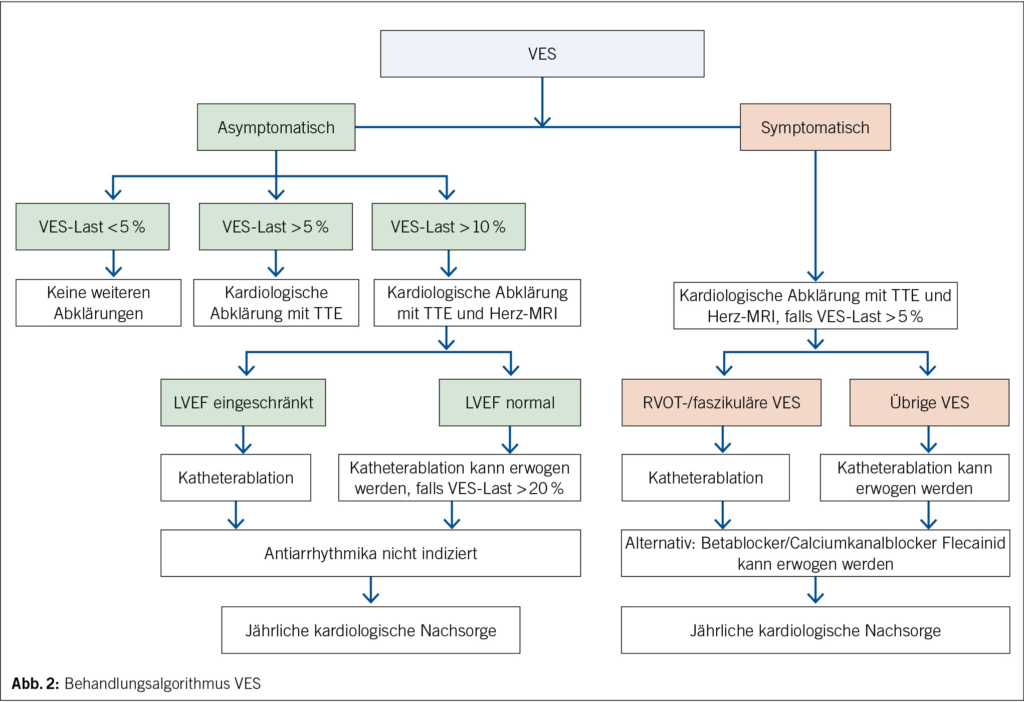
Die Wahl der Therapie bei VES hängt ab von der Symptomatik, der VES-Last, dem Typ der VES und insbesondere dem Vorhandensein einer strukturellen Herzerkrankung (23).
Daraus ergeben sich folgende Therapiekonzepte zur Behandlung von VES:
1. Keine Behandlung
Bei Beschwerdefreiheit, einer VES-Last < 5 % und Fehlen einer strukturellen Herzkrankheit ist keine Behandlung indiziert. Insbesondere müssen zufallsbefundlich nachgewiesene, asymptomatische VES nicht fachärztlich-kardiologisch abgeklärt werden (31). Oftmals besteht die entscheidende Unterstützung, die ein Arzt einem Patienten mit SVES oder VES in dieser Situation bieten kann, in einem beruhigenden Gespräch, wobei das Krankheitsbild und die oftmals normale Prognose erläutert werden können.
2. Lebensstiländerungen
Im Falle von symptomatischen Extrasystolen ohne zugrunde liegende Herzkrankheit ist als erster therapeutischer Schritt eine Änderung im Lebensstil angezeigt. Dazu gehören die Vermeidung von stimulierenden Substanzen wie Koffein und Nikotin, Stressbewältigung, ausreichende Flüssigkeitszufuhr und regelmässige körperliche Aktivität.
3. Behandlung der Grunderkrankung
Sollte eine Herzerkrankung vorliegen, so ist diese entsprechend zu therapieren (9, 20). Bei einem Auftreten von ≥ 2 VES im Ruhe-EKG sollte ein Langzeit-EKG zur Bestimmung der Symptomlast erfolgen. Bei einer VES-Last von > 5 % oder bei Herzinsuffizienzsymptomatik sollte eine kardiologische Abklärung mit initialer Doppler-Echokardiographie zum Ausschluss einer VES-induzierten Kardiopathie respektive einer strukturellen Herzerkrankung erfolgen. In diesen Fällen wird anschliessend ein Herz-MRI zum besseren strukturellen Verständnis und zur ätiologischen Zuordnung empfohlen. Bei fehlendem Ansprechen auf eine kardiale Resynchronisationstherapie sollten Katheterablation oder Antiarrhythmika in Betracht gezogen werden (32).
4. Medikamentöse Therapie
Entsprechend dem Schweregrad der Symptomatik ist als symptomatische Therapie die Verschreibung von Antiarrhythmika indiziert. Zum einen kann damit die Häufigkeit und zum anderen die Symptomlast reduziert werden. Die Empfehlungen in den ESC-Guidelines basieren auf kleinen, nicht placebokontrollierten Studien (32). Am besten eignen sich selektive Betablocker und Calciumkanalblocker des Verapamil-Typs, welche bei symptomatischen, idiopathischen, ventrikulären Extrasystolen als Erstlinientherapie empfohlen sind (IC-Empfehlung) (32). Jedoch sind die Auswirkungen dieser Medikamente auf die VES-Last moderat (33). Es ist zu beachten, dass Calciumkanalblocker vom Verapamil-Typ bei einer linksventrikulären Ejektionsfraktion (LVEF) < 35 % kontraindiziert sind (34). Hier empfehlen sich selektive Betablocker, wobei eine Wirksamkeit dokumentiert ist (30, 34, 35, 36, 37).
Flecainid ist in den ESC-Guidelines bei symptomatischen, idiopathischen VES als Zweitlinienpräparat empfohlen (IIa-Empfehlung) (38). Klasse-Ic-Antiarrhythmika wie Flecainid und Propafenon zeigen eine Wirksamkeit bei der Unterdrückung von VES (32, 38). Vorsicht ist bei Patienten mit signifikanter Koronararterienerkrankung geboten, aufgrund einer erhöhten Mortalität infolge ventrikulärer Tachykardien (38). Die Evidenz für Flecainid ist schwach. Klassischerweise sprechen VES aus dem RVOT gut auf Betablocker an, wobei faszikuläre VES Verapamil-sensibel sind (38). Folgende Antiarrhythmika sind in den ESC-Guidelines für die VES-Behandlung nicht erwähnt: Mexiletin (moderat wirksam) (39), Sotalol (wirksam) (39), Amiodaron (wirksam, insbesondere bei eingeschränkter LVEF) (39), Ajmalin (wirksam) (39). Für Dronedaron liegen keine wesentlichen klinischen Daten vor (32, 38, 39). Zudem wurden auch homöopathische Mittel zur Behandlung von Arrhythmien erforscht und als pflanzliche Alternative angewendet. Krzeminski und Chatterjee haben 1999 die Wirkung von Weissdornblättern (Crataegus oxyacantha) untersucht und ausgeprägte antiarrhythmische Eigenschaften sowie eine Verlängerung der Aktionspotenzialdauer und der Refraktärperiode festgestellt (40). Müller et al. haben im Tiermodell gezeigt, dass Weissdornextrakt die Aktionspotenzialdauer im Papillarmuskel beeinflusst, was auf eine schwache Klasse-I-ähnliche antiarrhythmische Wirkung hinweist (41). Des Weiteren fanden sie heraus, dass der Extrakt repolarisierende Kaliumströme in ventrikulären Myozyten blockiert, was darauf hinweist, dass Weissdornextrakt eine ähnliche Wirkung wie Klasse-III-Antiarrhythmika zeigt und eine potenziell wichtige Rolle bei der Modulation von Herzrhythmen spielen könnte (42).
5. Katheterablation
In den aktuellen ESC-Guidelines von 2022 ist die Katheterablation bei relevant symptomatischen Patienten mit VES aus dem RVOT oder aus dem linken Faszikel eine Erstlinienempfehlung (Klasse Ib) (32). In diesen Fällen besteht eine sehr gute Erfolgsquote mit tiefen Komplikationsraten. Bei asymptomatischen Patienten mit einer VES-Last > 20 % kann gemäss ESC-Guidelines eine Katheterablation evaluiert werden (Klasse-IIbB-Empfehlung) (32). In den US-amerikanischen Guidelines wird bei asymptomatischen Patienten mit erhaltener LVEF keine Katheterablation empfohlen. Bei eingeschränkter LVEF kann eine solche ab einer VES-Last > 10 % evaluiert werden. Es können nebst dem RVOT und dem linken Faszikel aber auch andere linksventrikuläre Foci für dieses Verfahren zugänglich sein. Im Falle von polymorphen VES ist die Erfolgsquote der Katheterablation meist deutlich eingeschränkt beziehungsweise meist nicht zielführend.
6. Akupunktur
Ein 2022 erschienenes Review mit Metaanalyse aus China, welches die Studienresultate aus fünf randomisierten, kontrollierten Studien mit Schein-Akupunktur-Prozeduren gegen echte Akupunkturen bei Patienten mit VES ohne ischämische oder strukturelle Herzerkrankungen erforschte, fand eine signifikante Reduktion der VES-Last. Die Nadeln wurden jeweils für 15 bis 30 Minuten angebracht, und die Behandlungsdauer lag bei vier Wochen. Wie sich eine Akupunktur verblinden lässt, konnte die Autorenschaft allerdings nicht befriedigend erläutern (43).
Prognose
SVES
Supraventrikuläre Extrasystolen galten bis vor wenigen Jahrzehnten als harmlose Arrhythmien (44, 45). Die Studie von Lin et al. aus dem Jahr 2015 zeigte, dass Patienten mit > 76 SVES pro Tag ein erhöhtes Risiko für Mortalität, kardiovaskuläre Hospitalisierung, Vorhofflimmern und Implantation eines Herzschrittmachers haben (46). In einer früheren Studie wurden bei gesunden Probanden mit einer SVES-Belastung von mehr als 720 Schlägen pro Tag während einer 6.3-jährigen Nachbeobachtung signifikant erhöhte Risiken für Tod, Schlaganfall und Vorhofflimmern festgestellt (27). Die Studie von Murakoshi aus dem Jahr 2015, durchgeführt während einer 14-jährigen Beobachtung von Gesundheitsuntersuchungen im Grundgesundheitssystem in Japan, ergab, dass SVES ein höheres Risiko für kardiovaskuläre Todesfälle haben (28). Die Präsenz von SVES wurde nach Anpassung an potenzielle kardiovaskuläre Risikofaktoren zu einem signifikanten Risikofaktor für Herz-Kreislauf-Erkrankungen. Darüber hinaus hatten SVES einen grösseren Einfluss auf die kardiovaskuläre Mortalität bei Frauen als bei Männern sowie auf Vorhofflimmern (28, 47). Die erweiterten Vorhofflimmern-Screenings bei Personen mit häufigen supraventrikulären Aktivitäten, insbesondere bei denen mit charakteristischen supraventrikulären Tachykardien, sind von zunehmender Bedeutung, um das Risiko der Entwicklung eines Vorhofflimmerns frühzeitig zu erkennen (47). Eine im Jahr 2013 durchgeführte Studie ergab, dass das Vorhandensein von häufigen SVES in Kombination mit einem hohen CHADS2-Score (heutzutage wird der CHA2DS2-VASc-Score verwendet) als bedeutsame Vorhersagefaktoren für das erstmalige Auftreten von Vorhofflimmern angesehen werden kann (48). Somit könnten eine frühzeitige Erkennung und Überwachung dieser Patienten allenfalls dazu beitragen, das Risiko für kardiovaskuläre Ereignisse zu verringern.
VES
Die Prognose bei VES wird in der Literatur kontrovers dargestellt: Ein wegweisender Artikel aus dem Jahr 1985 von Kennedy et al. beschrieb eine mittlere Nachbeobachtungszeit von sechseinhalb Jahren bei 70 asymptomatischen, gesunden Patienten, bei denen ventrikuläre Ektopie festgestellt wurde (49). Dabei wurde festgestellt, dass es im Vergleich zur Allgemeinbevölkerung keinen Unterschied in der Prognose gab. Es fanden sich allerdings Hinweise, dass gehäufte VES ein höheres Risiko für den Tod nach einem Herzinfarkt darstellen (49, 50). Später ergab die Untersuchung einer Kohorte des Multiple Risk Factor Intervention Trial (MRFIT), dass das Vorhandensein von VES auf einem Ruhe-EKG-Rhythmusstreifen von zwei Minuten bei scheinbar gesunden Probanden über einen Follow-up-Zeitraum von siebeneinhalb Jahren mit einem erhöhten Risiko für plötzlichen Tod verbunden war. Ähnliche Ergebnisse wurden bei scheinbar gesunden Probanden in der Framingham Heart Study beobachtet, wobei VES mit einem doppelten Anstieg des Risikos für Gesamtmortalität, Myokardinfarkt und kardialen Tod assoziiert waren. Diese Ergebnisse wurden aufgrund mangelnder strenger Massnahmen zur Ausschliessung zugrunde liegender Herzkrankheiten kritisiert und damit deren Aussagekraft vermindert (1, 10, 23, 51).
Bis in die 1980er-Jahre glaubte man entsprechend, dass ventrikuläre Extrasystolen ohne Hinweise auf eine strukturelle Herzerkrankung eine gute Prognose haben, selbst dann, wenn sie gehäuft auftraten (29, 52). Hiervon ist man allerdings abgekommen, und es muss differenziert betrachtet werden: Das maligne Potenzial gewisser VES-Formen ist heutzutage gängiges Wissen geworden. Insbesondere ist hier die Gefahr, polymorphe VES in ventrikuläre Tachykardien oder gar Kammerflimmern zu degenerieren, und das Risiko einer VES-induzierten Kardiomyopathie erwähnt (29). Gemäss einer Metaanalyse von Muser et al. aus dem Jahr 2021 in Basel mit fast 150 000 gesunden Probanden stellen Synkopen bei Patienten mit idiopathischen VES ein Warnsignal hinsichtlich polymorpher, ventrikulärer Tachykardien beziehungsweise Kammerflimmern dar. Solche Patienten bedürfen sicherlich einer kardiologischen Abklärung. Bei Fehlen einer strukturellen Herzerkrankung wird eine gute Langzeitprognose beschrieben (13). Patienten mit einer bereits bestehenden Herzinsuffizienz zeigen bei Auftreten von VES eine erhöhte Mortalität (17, 22). Bei Patienten mit einem frischen Myokardinfarkt besteht bei Auftreten von VES ein erhöhtes Risiko für Kammerflimmern (17, 19). Die Therapie mit Antiarrhythmika führt nicht zu einer Verbesserung der Lebenserwartung (17, 22).
Diskussion – das Wichtigste für die Praxis
Die supraventrikuläre Extrasystolie (SVES) ist ein häufiger und prinzipiell harmloser Befund und bedarf in der Regel keiner Behandlung oder Nachkontrolle. Gelegentlich können gehäufte SVES – insbesondere bei Patienten mit hohem kardiovaskulärem Risikoprofil – ein Hinweis für ein zugrunde liegendes Vorhofflimmern sein. In diesen Fällen sollte niederschwellig ein Langzeit-EKG durchgeführt werden. Nicht selten werden supraventrikuläre Extrasystolen für die betroffene Patientin als sehr störend und beängstigend empfunden. In diesen Fällen ist ein ausführliches Arzt-Patienten-Gespräch die erste und meist wichtigste Massnahme.
Mögliche Auslöser, insbesondere eine Schilddrüsenfehlfunktion und Lifestyle-Faktoren wie Koffein, Nikotin, Alkohol und Drogen, sollten ausgeschlossen werden. Sport, insbesondere dosiertes Ausdauertraining, kann helfen, einen aktivierten Sympatikotonus zu hemmen und die vegetative Balance zu optimieren. Dies ist auch dann besonders hilfreich, wenn empfundene supraventrikuläre Extrasystolen den Schlaf des Patienten stören. Auch Entspannungsverfahren wie die progressive Muskelrelaxation oder Yoga können dabei helfen, die Symptomlast der supraventrikulären Extrasystolie positiv zu beeinflussen (37, 53). Im Falle von Angststörungen sollte eine psychologische oder psychiatrische Betreuung erfolgen.
Die prognostische Implikation der ventrikulären Extrasystolie (VES) variiert enorm, insbesondere da eine ventrikuläre Extrasystolie Ausdruck einer ischämischen oder strukturellen Herzerkrankung sein kann (23, 38). Bei klinischen Hinweisen für eine solche sollte eine kardiologische Abklärung erfolgen. Asymptomatische Patienten mit einer VES-Last < 5 % müssen nicht abgeklärt werden (23). Bei Symptomen ohne zugrunde liegende Herzerkrankung hilft in vielen Fällen ein klärendes Gespräch über die prognostische Gutartigkeit der Extrasystolie.
Antiarrhythmika verbessern die Prognose nicht und stellen somit eine rein symptomatische Therapie dar. Jedes Antiarrhythmikum kann eine ventrikuläre Extrasystolie potenziell verschlimmern oder sogar maligne Rhythmusstörungen hervorrufen. Folglich sollte der Einsatz dieser Medikamente im individuellen, klinischen Kontext sorgfältig abgewogen werden. Asymptomatische oder oligosymptomatische Extrasystolien sollten nicht antiarrhythmisch behandelt werden. Zur symptomatischen Therapie von VES eignen sich selektive Betablocker speziell für VES aus dem RVOT und Calciumkanalblocker vom Verapamil-Typ für VES aus dem linken Faszikel. Die Katheterablation hat in den letzten Jahren an Bedeutung zugenommen und stellt in den aktuellen ESC-Guidelines von 2022 bei symptomatischer, idiopathischer, ventrikulärer Extrasystolie aus dem RVOT und dem linken Faszikel eine Erstlinientherapie dar (32, 38, 54).
Octavia Diaconu
Medbase AG, Schaffhausen
Christophe Wyss
HerzKlinik Hirslanden / Heart Clinic Zurich, Zürich
Raffael Ghenzi
HerzKlinik Hirslanden / Heart Clinic Zurich, Zürich
Klinik für Nuklearmedizin, Universitätsspital Zürich, Zürich
Historie
Manuskript eingegangen: 26.08.2024
Angenommen nach Revision: 26.02.2025
– HerzKlinik Hirslanden,
Witellikerstrasse 40
8032 Zürich
– Universität Zürich
Rämistrasse 71
8006 Zürich
christophe.wyss@hirslanden.ch
Die Autorenschaft hat keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Kalkreuth M. (2013) Das Handbuch der Langzeit-Elektrokardiographie
2. William Harvey (Author), Chauncey D. Leake (Translator), Anatomical Studies on the Motion of the Heart and Blood. Taschenbuch – Reproduktion, 1. Januar 1970
3. René Descartes, Traité de l’homme, ISBN-13978-2081206434, 29 août 2018
4. Barold SS. Willem Einthoven and the birth of clinical electrocardiography a hundred years ago. Card Electrophysiol Rev. 2003 Jan;7(1):99-104. doi: 10.1023/a:1023667812925. PMID: 12766530.
5. Lewis, T. (1920). The Mechanism and Graphic Registration of the Heart Beat. Shaw & Sons, Ltd., London.
6. Lown, B., Ganong, W. F., & Levine, S. A. (1952). The mechanism and classification of cardiac arrhythmias. New England Journal of Medicine, 247(2), 478–486. [DOI: 10.1056/NEJM195208142470702]
7. Waller, A. D. (1887). A Demonstration on Man of Electromotive Changes Accompanying the Heart’s Beat. Journal of Physiology, 8(5), 229–234. doi:10.1113/jphysiol.1887.sp000264
8. Reunanen et al., (1983). The Social Insurance Institution’s coronary heart disease study. Baseline data and 5-year mortality experience. Acta Medica Scandinavica. Supplementum. 1983;673:1-120. PMID: 6578675.
9. Greten H, Rinninger F, Greten T (2010) Innere Medizin. Georg Thieme Verlag Stuttgart 62
10. Bikkina M, Larson M G, Levy D. Prognostic implications of asymptomatic ventricular arrhythmias: the Framingham Heart Study. Ann Intern Med 1992117990–996. [PubMed] [Google Scholar]
11. Hashimoto K, Harada N, Kimata M, Kawamura Y, Fujita N, Sekizawa A, Ono Y, Obuchi Y, Takayama T, Kasamaki Y, Tanaka Y. (2023) Age-related reference intervals for ambulatory electrocardiographic parameters in healthy individuals. Front Cardiovasc Med. 2023 Mar 6; 10:1099157. doi: 10.3389/fcvm.2023.1099157. PMID: 36950291; PMCID: PMC10026132
12. Sirichand S., Killu A.M., Padmanabhan D., Hodge D.O., Chamberlain A.M., Brady P.A., Kapa S., Noseworthy P.A., Packer D.L., Munger T.M., et al. Incidence of Idiopathic Ventricular Arrhythmias. Circ. Arrhythmia Electrophysiol. 2017;10 doi: 10.1161/CIRCEP.116.004662.
13. Muser D, Tritto M, Mariani M V, di Monaco A, Compagnucci P, Accogli M, de Ponti R, Guarracini F, (2021) Diagnosis and Treatment of Idiopathic Premature Ventricular Contractions: A Stepwise Approach Based on the Site of Origin. Diagnostics (Basel) 11 (10) 1840
14. Ector J, Roca-Luque I. Extrasystoles in adults with congenital heart disease: treatment options. Herzschrittmacherther Elektrophysiol. 2021 Mar;32(1):48-53. English. doi: 10.1007/s00399-021-00739-6. Epub 2021 Jan 28. PMID: 33507368
15. Corrado D, Drezner JA, D’Ascenzi F, et al. (2020) How to evaluate premature ventricular beats in the athlete: critical review and proposal of a diagnostic algorithm, Br J Sports Med 2020;54:1142–1148.
16. Wang Z, Jiao S, Chen J, Guo H, Ren L, Sun L, Sun Y, Chen Y. (2023) The relationship between frequent premature ventricular complexes and epicardial adipose tissue volume. Front Endocrinol (Lausanne). 2023 Sep 26; 14:1219890. doi: 10.3389/fendo.2023.1219890. PMID: 37822598; PMCID: PMC10562624
17. Altmeyer Enzyklopädie E Book
18. Mandilaras G, Li P, Dalla-Pozza R, Haas NA, Oberhoffer FS. Energy Drinks and Their Acute Effects on Heart Rhythm and Electrocardiographic Time Intervals in Healthy Children and Teenagers: A Randomized Trial. Cells. 2022 Jan 31;11(3):498. doi: 10.3390/cells11030498. PMID: 35159306; PMCID: PMC8834195
19. Herold G et al. (2022) Innere Medizin. Herold Verlag 275 – 276
20. Haas, Nikolaus A. et al.: 2011Kinderkardiologie DOI: 10.1055/b-0034-63349 III Krankheitsbilder: 18 Herzrhythmusstörungen
21. van Aken H, Reinart K, Zimpfer M, Welte T et al. (2007) Intensivmedizin. Georg Thieme Verlag Stuttgart / New York 987
22. Kasper D L, Fauci A S, Hauser S L, et al. (2015) Harrison’s Principles of Internal Medicine. Mc Graw Hill Education 1489 – 1493
23. Marcus GM. (2020) Evaluation and Management of Premature Ventricular Complexes. Circulation. 2020 Apr 28;141(17):1404-1418. doi: 10.1161/CIRCULATIONAHA.119.042434. Epub 2020 Apr 27. PMID: 32339046
24. Crawford M.H., Bernstein S.J., P.C. Deedwania, et al (1999) ACC/AHA guidelines for ambulatory electrocardiography: executive summary and recommendations. a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee to Revise the Guidelines for Ambulatory Electrocardiography) Circulation, 100 (1999), pp. 886-893
25. Braun J, Müller- Wieland D (2022) Basislehrbuch Innere Medizin. Elsevier Urban und Fischer Verlag Deutschland 111 – 112
26. Conen D, Adam M, Roche F, Barthelemy JC, Felber Dietrich D, Imboden M, et al. Premature atrial contractions in the general population: frequency and risk factors. Circulation. 2012; 126:2302–8. 10.1161/CIRCULATIONAHA.112.112300
27. Binici Z, Intzilakis T, Nielsen OW, Kober L, Sajadieh A. Excessive supraventricular ectopic activity and increased risk of atrial fibrillation and stroke. Circulation. 2010;121:1904–1911.
28. Murakoshi N, Xu D, Sairenchi T, Igarashi M, Irie F, Tomizawa T, Tada H, Sekiguchi Y, Yamagishi K, Iso H, Yamaguchi I, Ota H, Aonuma K. Prognostic impact of supraventricular premature complexes in community-based health checkups: the Ibaraki Prefectural Health Study. Eur Heart J. 2015;36:170–178. [PubMed] [Google Scholar] [Ref list]
29. Ip JE, Lerman BB. Idiopathic malignant premature ventricular contractions. Trends Cardiovasc Med. 2018 May;28(4):295-302. doi: 10.1016/j.tcm.2017.11.004. Epub 2017 Nov 28. PMID: 29254831.
30. Muresan L, Cismaru G, Muresan C, Rosu R, Gusetu G, Puiu M, Mada RO, Martins RP. Beta-blockers for the treatment of arrhythmias: Bisoprolol – a systematic review. Ann Pharm Fr. 2022 Sep;80(5):617-634. doi: 10.1016/j.pharma.2022.01.007. Epub 2022 Jan 31. PMID: 35093388.
31. Gorenek B, Fisher JD, Kudaiberdieva G, Baranchuk A, Burri H, Campbell KB, et al (2020) Premature ventricular complexes: diagnostic and therapeutic considerations in clinical practice A state-of-the-art review by the American College of Cardiology Electrophysiology Council. J Interv Card Electrophysiol 2020;57:5−26
32. Zeppenfeld K, Tfelt-Hansen J, de Riva M, et al. 2022 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. Eur Heart J. 2022;43(40):3997–4126. doi: 10.1093/eurheartj/ehac262.
33. Stec S, Sikorska A, Zaborska B, Kryński T, Szymot J, Kułakowski P. Benign symptomatic premature ventricular complexes: short- and long-term efficacy of antiarrhythmic drugs and radiofrequency ablation. Kardiol Pol. 2012;70:351–8.
34. Baycan OF, Fidan S, Celik FB, Tatlisu MA, Ozyildirim S, Caliskan M. Comparison of Medical Treatments According to the Characteristics of Idiopathic Premature Ventricular Contractions: Beta-blockers or Calcium Channel Blockers? Medeni Med J. 2023 Mar 28;38(1):32-38. doi: 10.4274/MMJ.galenos.2023.00532. PMID: 36974457; PMCID: PMC10064106
35. Hu X, Wang J, Xu C, He B, Lu Z, Jiang H. Effect of oestrogen replacement therapy on idiopathic outflow tract ventricular arrhythmias in postmenopausal women. Arch Cardiovasc Dis. 2011;104:84–8
36. Demir S, Gulsen K, Kepez A, et al. Predictors of positive response to beta-blockers for treatment of premature ventricular complexes. J Electrocardiol. 2022;70:50–55
37. Chu IH, Wu WL, Lin IM, Chang YK, Lin YJ, Yang PC. Effects of Yoga on Heart Rate Variability and Depressive Symptoms in Women: A Randomized Controlled Trial. J Altern Complement Med. 2017 Apr;23(4):310-316. doi: 10.1089/acm.2016.0135. Epub 2017 Jan 4. PMID: 28051319
38. Könemann H, Eckardt L. Von der Extrasystole zur anhaltenden Kammertachykardie: Neuerungen der ESC-Leitlinie 2022 zur Therapie ventrikulärer Arrhythmien im Überblick [From premature ventricular complexes to sustained ventricular tachycardia: An overview of innovations in the 2022 ESC Guideline on the therapy of ventricular arrhythmias]. Herzschrittmacherther Elektrophysiol. 2022 Dec;33(4):450-457. German. doi: 10.1007/s00399-022-00908-1. Epub 2022 Nov 16. PMID: 36385401; PMCID: PMC9691474.
39. Kantharia BK, Shah AN. Are antiarrhythmic agents indicated in premature ventricular complex-induced cardiomyopathy and when? J Cardiovasc Electrophysiol. 2024 Mar;35(3):574-582. doi: 10.1111/jce.16055. Epub 2023 Sep 7. PMID: 37676022
40. Krzeminski, T., Chatterjee, S.S.: Ischemia and early reperfusion induced arrhythmias: beneficial effects of an extract of Crataegus oxyacantha. Pharm. Pharmacol. Lett. 3 (1993): 45–48
41. Müller, A., Linke, W., Zhao, Y., Klaus, W.: Crataegus extract prolongs action potential duration in guinea pig papillary muscle. Phytomedicine. 3 (1996): 257–261.
42. Müller, A., Linke, W., Klaus, W.: Crataegus extract blocks potassium currents in guinea pig ventricular cardiac myocytes. Planta. Med. 65 (1999): 335–339.
43. Cai Y, Zhang CS, Liu S, Zhou L, Tang B, Chen W. (2022) Acupuncture for premature ventricular complexes without ischemic or structural heart diseases: A systematic review and meta-analysis of clinical and pre-clinical evidence. Front Med (Lausanne). 2022 Dec 8;9:1019051. doi: 10.3389/fmed.2022.1019051. PMID: 36569126; PMCID: PMC9773094.
44. Fleg JL, Kennedy HL. Long-term prognostic significance of ambulatory electrocardiographic findings in apparently healthy subjects greater than or equal to 60 years of age, Am J Cardiol, 1992, vol. 70 (pg. 748-751)
45. Farinha JM, Gupta D, Lip GYH. Frequent premature atrial contractions as a signalling marker of atrial cardiomyopathy, incident atrial fibrillation, and stroke. Cardiovasc Res. 2023 Mar 31;119(2):429-439. doi: 10.1093/cvr/cvac054. PMID: 35388889; PMCID: PMC10064848
46. Lin CY, Lin YJ, Chen YY, Chang SL, Lo LW, Chao TF, Chung FP, Hu YF, Chong E, Cheng HM, Tuan TC, Liao JN, Chiou CW, Huang JL, Chen SA. Prognostic Significance of Premature Atrial Complexes Burden in Prediction of Long-Term Outcome. J Am Heart Assoc. 2015 Aug 27;4(9):e002192. doi: 10.1161/JAHA.115.002192. PMID: 26316525; PMCID: PMC4599506.
47. Hygrell T, Stridh M, Friberg L, Svennberg E. (2021) Prognostic Implications of Supraventricular Arrhythmias. Am J Cardiol. 2021 Jul 15;151:57-63. doi: 10.1016/j.amjcard.2021.04.020.PMID: 34167689
48. Shinya et al (2013), Usefulness of Frequent Supraventricular Extrasystoles and a High CHADS2 Score to Predict First-Time Appearance of Atrial Fibrillation. The American Journal of Cardiology, Volume 111, Issue 11, 1 June 2013, Pages 1602-1607
49. Kennedy HL, Whitlock JA, Sprague MK, Kennedy LJ, Thomas A, et al (1985) Long-term follow-up of asymptomatic healthy subjects with frequent and complex ventricular ectopy. N Engl J Med 1985; 312: 193–7
50. Joshi S, Wilber D J. (2005) Ablation of idiopathic right ventricular outflow tract tachycardia: current perspectives. J Cardiovasc Electrophysiol 200516(suppl 1) S52–S58.This review summarises the current data on ablation for idiopathic ventricular tachycardia arising from the right ventricular outflow tract. [PubMed]
51. Abdalla I S, Prineas R J, Neaton J D.et al (1987) Relation between ventricular premature complexes and sudden cardiac death in apparently healthy men. Am J Cardiol 1987601036–1042. [PubMed] [Google Scholar]
52. Rath W, Friese K (2005) Erkrankungen in der Schwangerschaft. Georg Thieme Verlag Stuttgart 63
53. Akella K, Kanuri SH, Murtaza G, G Della Rocca D, Kodwani N, K Turagam M, Shenthar J, Padmanabhan D, Basu Ray I, Natale A, Gopinathannair R, Lakkireddy D. Impact of Yoga on Cardiac Autonomic Function and Arrhythmias. J Atr Fibrillation. 2020 Jun 30;13(1):2408. doi: 10.4022/jafib.2408. PMID: 33024508; PMCID: PMC7533135
54. Blomström-Lundqvist C, Scheinman MM et al, European Society of Cardiology Committee, NASPE-Heart Rhythm Society. ACC/AHA/ESC guidelines for the management of patients with supraventricular arrhythmias–executive summary. a report of the American college of cardiology/American heart association task force on practice guidelines and the European society of cardiology committee for practice guidelines (writing committee to develop guidelines for the management of patients with supraventricular arrhythmias) developed in collaboration with NASPE-Heart Rhythm Society. J Am Coll Cardiol. 2003 Oct 15;42(8):1493-531. doi: 10.1016/j.jacc.2003.08.013. PMID: 14563598.
PRAXIS
- Vol. 114
- Ausgabe 5
- Mai 2025