- Die Rolle der Integrativen Onkologie in der (post-kurativen) Survivorship Care
Einleitung
In der Schweiz erkranken jedes Jahr circa 45 500 Menschen an einer Krebserkrankung (1). Die Zahl der Cancer Survivors – Menschen, die eine Krebserkrankung überstanden haben oder mit der Erkrankung leben – steigt aufgrund besserer Diagnostik und Therapie kontinuierlich an. Viele Betroffene sind jedoch mit Langzeitfolgen konfrontiert und können auch Jahre nach Abschluss der aktiven Behandlung unter anhaltenden, mit der Erkrankung oder der Therapie assoziierten Beschwerden leiden. Die überwiegende Mehrheit aller Cancer Survivors berichtet über anhaltende körperliche Beschwerden (z. B. Fatigue, therapieinduzierte Polyneuropathie, Schlafstörungen, kognitive Dysfunktionen) und psychische Symptome (z. B. emotionale Belastung/Disstress, Ängste, depressive Symptome) sowie relevante soziale Herausforderungen im Bereich von Beziehungen, Familie sowie Erwerbstätigkeit im weiteren zeitlichen Verlauf. Der Begriff der sogenannten Survivor-ship Care, d. h. die Langzeitbetreuung nach einer Krebserkrankung, gewinnt aufgrund der oben geschilderten Zusammenhänge zunehmend an Bedeutung (2).
Definition Cancer Survivorship
Der von Fitzhugh Mullan 1985 geprägte Begriff «Cancer Survivorship» (3) wurde in den letzten Jahren unterschiedlich definiert. International durchgesetzt hat sich die Definition der US-amerikanischen Patientenorganisation National Coalition for Cancer Survivorship (NCCS), die jedes betroffene Individuum vom Zeitpunkt der Diagnose an bis zu seinem Tod als Cancer Survivor – als Krebsüberlebenden – bezeichnet (4). Diese Definition, der sich zahlreiche internationale Fachgesellschaften angeschlossen haben, ermöglicht es, die onkologische Versorgung entlang eines Kontinuums zu verstehen und damit die möglichen Auswirkungen der Krebstherapie auf die Lebensqualität des Cancer Survivor bereits während der Primärtherapie zu berücksichtigen (5). Andere Definitionsvorschläge orientieren sich an Phasenmodellen (6), welche sich am Behandlungs- und Krankheitsverlauf orientieren. Hier wird zum Beispiel die akute Behandlungsphase vom mittleren (bis ca. 5 Jahre nach Diagnosestellung) sowie Langzeitüberleben ab dem 5. Jahr nach Diagnosestellung abgegrenzt. Unterschieden werden darüber hinaus das krebsfreie Überleben und das Überleben mit einer chronischen oder fortschreitenden Krebserkrankung (4). In der Schweiz entwickelt Oncosuisse als Teil des Masterplans (7) mit zwei Expertenworkshops nationale Konsensusempfehlungen für «Cancer Survivorship Care» (Publikation in Vorbereitung) unter Verwendung der NCCS-Definition.
Survivorship Care
Studien weisen darauf hin, dass viele Krebsüberlebende im Langzeitverlauf gute Funktions- und Lebensqualitätswerte aufweisen (8). Vergleiche mit Referenzdaten zeigen jedoch, dass Cancer Survivors auch Jahre nach der Behandlung gegenüber der Allgemeinbevölkerung (nach Alter und Geschlecht angepasst) klinisch relevante Beeinträchtigungen in körperlichen, psychischen und sozialen Aspekten aufweisen (2). Diese Beeinträchtigungen dienen als Ansatzpunkte für Survivorship Care Plans (SCPs), welche optimalerweise kurz nach Beendigung der Primärtherapie erstellt werden und welche neben Informationen zur Notwendigkeit zukünftiger Nachsorgeuntersuchungen in Hinblick auf mögliche Langzeit- und Spätfolgen Empfehlungen zu gesundheitsfördernden Massnahmen und zur Symptombehandlung enthalten (6). Konkret bedeutet dies, dass SCPs neben primär krankheitsspezifischen Themen auch Empfehlungen zum Lebensstil, sozialrechtliche Themen sowie psychosoziale Unterstützungsangebote enthalten sollten. Da die Probleme der Cancer Survivors oft vielschichtig sind und sich gegenseitig bedingen und/oder verstärken, erfordern SCPs einen multidisziplinären Ansatz, um dieser Problematik gerecht zu werden (9). Obwohl die Anzahl der Cancer Survivors stetig steigt, gibt es innerhalb des Schweizer Gesundheitssystems erst wenige koordinierte Nachsorgeangebote für die Zeit nach der medizinischen Erstbehandlung (10). Das Projekt All.Can hat die «Ist-Situation der Versorgungslandschaft und Empfehlungen zur Verbesserung der Krebsnachsorge» untersucht, inkl. qualitativer Interviews mit 18 Experten, einem Online-Survey und einem Validierungsworkshop, der finale Bericht ist veröffentlicht (1.5.2025 [11]).
In der Schweiz wird Survivorship Care erforscht. Die Gesundheitsförderung Schweiz unterstützt aktuell das «Cancer Survivors Support Program», welches sowohl digitale als auch persönliche Elemente eines Coachings nutzt, und koordiniert den medizinischen Nachsorgeplan, psychosoziale Unterstützungsangebote sowie die Förderung des Selbstmanagements von krebsbetroffenen Menschen. Das Projekt ist im Sommer 2024 gestartet und dauert 4 Jahre (12). Das PACE-Partnership-Projekt der Berner Fachhochschule erforscht ab Oktober 2025 für 4 Jahre mit SNF-Förderung im transdisziplinären Team, wie Fachpersonen und Menschen mit chronischer Fatigue einander besser verstehen und begegnen können (13).
Perspektive der Integrativen Onkologie
In den letzten zwei Jahrzehnten hat die Integrative Onkologie (IO) als zunehmend sichtbarer Bestandteil der Krebsbehandlung ein deutliches Wachstum erlebt. Ihr Ziel ist es, evidenzbasierte komplementäre Therapien mit konventionellen Behandlungen zu kombinieren, um das Wohlbefinden und die Lebensqualität von Menschen mit Krebserkrankungen zu verbessern. Zudem sollen die betroffenen Personen befähigt werden, Krebserkrankungen vorzubeugen und sich vor, während und nach einer Krebsbehandlung aktiv zu beteiligen (14). Die Verbreitung von Programmen für IO in grossen Krebszentren weltweit spiegelt diese Realität ebenfalls wider. Verschiedene Studien zeigen, dass bis zu 50 % der Cancer Survivors traditionell-komplementär-integrative Medizin (TCIM) (15) beanspruchen (16); eine Studie aus dem Jahr 2010 kam auf einen Prozentsatz von 65 % (17). Es gibt zunehmend Forschungsarbeiten dazu, ob und wie integrative medizinische Ansätze dazu beitragen können, die Symptome und die Lebensqualität (QoL) von Krebsüberlebenden zu verbessern. Durch die Entwicklung nationaler (AWMF: Deutsche S3-Guidelines) (18) und internationaler Leitlinien (Society for Integrative Oncology, SIO) (19), die anschliessend von den entsprechenden Expertengremien gebilligt wurden, unterstützen evidenzbasierte Empfehlungen eine Reihe von therapeutischen Ansätzen für die Behandlung in diesem Bereich (siehe auch Artikel Edukation). Die drei klinischen Praxisleitlinien von ASCO-SIO, die als Leitfaden für die integrative unterstützende Behandlung dienen, umfassen Integrative Medizin zur Schmerzbehandlung (20), von Angst- und Depressionssymptomen (21) und die Behandlung von Cancer-related Fatigue (CRF) (22) und adressieren somit relevante Langzeitsymptome der betroffenen Personen. Aktuell erfolgen Umsetzungsprojekte für die Implementierung (23, 24). Im Weiteren sollen nun am Beispiel der CRF, von Schlafstörungen im Zusammenhang mit einer Krebserkrankung sowie der Chemotherapie-induzierten Polyneuropathie konkrete Anwendungsbereiche von Therapiekonzepten aus der IO und die Zusammenarbeit und Überlappungen mit anderen medizinischen Fachgebieten beispielhaft bezüglich Ernährung und körperlicher Aktivität erläutert werden.
Cancer-related Fatigue (CRF)
Krebsbedingte Müdigkeit (CRF) ist eine der häufigsten Nebenwirkungen, die mit der Diagnose und Behandlung von Krebserkrankungen einhergehen (25). Sie ist durch ein «anhaltendes und oft überwältigendes Gefühl körperlicher, geistiger und/oder emotionaler Erschöpfung» gekennzeichnet und unterscheidet sich von durch Anstrengung verursachter Müdigkeit, da sie nicht ohne Weiteres durch ausreichend Schlaf oder Ruhepausen nachlässt. Ihre Auswirkungen sind in allen Stadien der Krebserkrankung zu spüren, von der Erstdiagnose bis hin zu den Cancer Survivors. Schätzungen zur Prävalenz sind abhängig von der Definition des Schweregrads, der Behandlungsphase (während multimodaler onkologischer Erstbehandlung, Langzeit-Cancer-Survivor, End-of-Life), der onkologischen Behandlungsmodalität (Chemo-, Immun-, Hormon-, Radio- und Protonentherapie, Operation in Vollnarkose oder Kombinationen davon [26]), der Tumorart, dem Tumorstadium (aktive/inaktive Krebserkrankung), dem Geschlecht und auch dem Jahrzehnt der Publikation (früher Prävalenzraten höher) (27, 28, 29, 30, 31). Während der onkologischen Behandlung leiden 30 % bis 60 % der Betroffenen an mässiger bis schwerer Fatigue, bei Mammakarzinom deutlich mehr (58 % bis 94 %) (29). Auch Jahre nach Abschluss der Erstbehandlung in kurativer Absicht ohne Hinweis auf ein Rezidiv persistiert bei ca. 20 % bis 35 % ein klinisch relevantes Fatigue-Syndrom. Viele betroffene Cancer Survivors fühlen sich hiermit nicht gut wahrgenommen und behandelt (32).
Cancer-related Fatigue (CRF) wird heute nicht mehr nur als isoliertes Symptom angesehen, sondern als eine komplexe Störung unter Berücksichtigung von Schlafstörungen. Dies verdeutlicht sich bei der Betrachtung der gängigen Definition von CRF im ICD-10, bei der z. B. zwei von zehn A-Kriterien diesen Bezug zu Schlafstörungen belegen, u.a. Insomnie und Hypersomnie sowie die Erfahrung, den Schlaf als nicht erholsam zu erleben (33). In einer deutschen Studie wurden als am stärksten ausgeprägte Symptome von Mammakarzinom-Patientinnen drei Jahre nach Erstdiagnose neben Fatigue (38 %) auch Insomnie mit 46 % in der EORTC QLQ-C30-Symptom-Skala angegeben (34). Interessanterweise persistieren gemäss einer Langzeitstudie bei über 6900 Patienten (45 % Mammakarzinom) diese Symptome über 14 Jahre mit einer Symptomlast von über 35% (35). Schlafstörungen werden im nächsten Abschnitt diskutiert.
Bei der Ätiologie der CRF werden verschiedene Faktoren postuliert: eine mitochondriale Schädigung (36) inklusive der astralen Gliazellen (37, 38, 39), neuro-immunologische Veränderungen sowie autonome Dysfunktion (41). Zur Diagnostik werden neben der ausführlichen Anamnese der ergänzende Einsatz von verschiedenen Assessments wie z.B. SIF (42), CFS-D (43), DICRFS (44) und BFI (45) empfohlen.
Zusätzlich sollten mögliche Funktionseinschränkungen wichtiger Organe wie Leber, Niere oder Herz ausgeschlossen werden sowie laborchemische Untersuchungen mit dem Fokus auf eine mögliche entzündliche Aktivität, Elektrolytstörungen oder Glukosestoffwechselstörungen sowie Substratmangel (Vitamine, Mineralstoffe inkl. Selen und Zink) oder hormonelle Imbalancen sowie Status nach Virusinfektionen wie z.B. Covid-19 durchgeführt werden. Bei kognitiven Einschränkungen wird die Durchführung einer neuropsychologischen Untersuchung (optimalerweise in den Nachmittagsstunden) empfohlen, bei ausgeprägten Schlafstörungen eine ergänzende schlafmedizinische Untersuchung, des Weiteren einfache körperliche Funktionstests (52) (z.B. FTSTS) (53). Therapeutisch ist bei einem CRF ein evidenzbasiertes, multimodales Interventionsprogramm empfohlen. Dieses besteht aus Ausdauer- und Krafttraining (54), Energiemanagement (55), psychologischer Begleitung mit Fokus auf emotionalen Energieverlust, Achtsamkeits- bzw. Mind-Body-Interventionen (56), Beratung zu einer antientzündlichen (57), pflanzenbasierten sowie proteinreichen Ernährung (58), Schulung zur Schlafhygiene (Berücksichtigung von Nacht/Tag-Rhythmen) (59). Die einzelnen Bestandteile des Programms sollten aufeinander abgestimmt sein, um sowohl eine Unter- als auch eine Überforderung (insbesondere auch in Hinblick auf das körperliche Training) zu vermeiden.
Die Behandlungsleitlinien der onkologischen Fachgesellschaften (60, 61, 62) beinhalten sowohl nichtmedikamentöse Interventionen der IO (siehe Artikel Kerndisziplinen), hier insbesondere bezüglich Mind-Body-Verfahren wie MBSR/MBCT, Tai Chi, Qi Gong oder restorativem (63) Yoga, Kognitiver Verhaltenstherapie (KVT) mit oder ohne Hypnose zum Energiemanagement und Akupunktur/Akupressur sowie phytotherapeutischer Präparate (Ginseng) und die Verwendung von Mistelgesamtextrakt. Ein kürzlicher Übersichtsartikel (open access) fasst die Evidenz und Empfehlungen zusammen (64).
Bei der Beurteilung der verschiedenen Behandlungsmodalitäten sollten der Kontext und Kombinationsbehandlungen berücksichtigt werden. Beispielhaft zeigte eine klinische Hypnoseintervention während der Radiotherapie in kurativer Absicht bei Brustkrebs (15 Minuten Beginn und Ende, dazwischen wöchentlich 5 Min. entspannende innere Bilder und Anregungen zur Reduktion von Stress und Fatigue) in Kombination mit KVT im Vergleich zur randomisierten Kontrollgruppe (Aufmerksamkeit) eine klinisch und statistisch signifikante Verbesserung der Fatigue nach Abschluss der Radiotherapie und 1 bis 6 Monate danach (alle P < 0.001) (65). Auch können Patientenpräferenzen eine Rolle spielen (siehe Artikel Forschung). Cancer Survivors nach Brustkrebs (bis 18 Monate nach Erstdiagnose) wurden 3 Interventionen angeboten: Yoga, KVT und Selbsthypnose-Self-Care in Kleingruppen, 69 % wählten Self Care/Hypnose (6 Sitzungen alle 2 Wochen, jeweils 120 Minuten, davon 15 Minuten Hypnose). Die Verbesserung der Fatigue (EORTC QLQ-C30) war klinisch signifikant (Baseline 2.59 [0.78], nach 9 Monaten 2.18 [0.67], p = 0.002) (66). Ein anderes Beispiel ist eine intensive Yoga-Intervention im ländlichen Indien mit wenig verfügbaren anderen Behandlungen (67).
Schlafstörungen bei Cancer Survivors
Das National Comprehensive Cancer Network der USA verweist darauf, dass Schlafstörungen mit Prävalenzen von 30 %–75 % nicht nur ein häufiges, sondern auch ein vernachlässigtes Problem bei Krebspatient/-innen darstellen (68, 69). Die European Society for Medical Oncology (ESMO) stellt in ihrer Leitlinie zu Schlafstörungen dar, dass in der erwachsenen Allgemeinbevölkerung die Häufigkeit von Insomnie 6-10 % beträgt, während Insomnie bei Krebspatient/-innen dreimal häufiger auftritt (70). Dabei beziehen sich die Autoren auf Insomnie im Sinne der ICD-11, DSM-5-TR und der International Classification of Sleep Disorders (ICSD 3). Unter Insomnie werden die drei Hauptsymptome verstanden (Einschlafstörung, Durchschlafstörung, frühes Erwachen), welche mindestens dreimal pro Woche über mindestens drei Monate bestehen und auch mit Tagesfunktionseinschränkungen einhergehen (71). Die ICSD-3 definiert dies als chronische Insomnie (72).
Bis zu 95% Krebsbetroffene berichten über Schlafstörungen (70). Laut einer kanadischen Studie traten Schlafstörungen im Sinne eines insomnischen Syndroms am häufigsten bei Brustkrebspatientinnen auf, im Vergleich eher selten bei Prostatakrebspatienten. Die Ergebnisse zeigten eine Inzidenzrate von 18,6 %, eine Persistenzrate von 68,0 % und eine Remissionsrate von 32,0 % (73). Weitere Daten zeigen, dass es bei Brustkrebspatientinnen unter Chemotherapie zu einer Störung des Ruhe-und Aktivitätsrhythmus kommt, dies spiegelt sich in einer verminderten Tagesaktivität und einer vermehrten nächtlichen Unruhe wieder (74).
Aus pathophysiologischer Sicht bestehen Hinweise darauf, dass es bei Krebserkrankungen zu komplexen Dysregulationen u.a. im Bereich der Melatoninproduktion kommen kann, ausgelöst u.a. auch durch die Grösse der Primärtumoren (75, 76). Des Weiteren konnten Daten eine Assoziation zwischen einer bereits zwei Jahre vor Erstdiagnose eines Mammakarzinoms bestehenden kurzen Schlafdauer unter 6 Stunden mit einem höheren (schlechteren) Rezidiv-Score im Oncotype-DX (umfasst 21 Gen-Marker, welche auf eine stärkere Entdifferenzierung, Aggressivität oder Invasivität des Karzinoms hinweisen) aufzeigen (77).
In polysomnographischen Untersuchungen von Patient/-innen mit Mammakarzinom und Lungenkarzinom ergaben sich im Vergleich zu den Kontrollgruppen signifikant häufiger Durchschlafstörungen im Sinne von Awake-after-Sleep-Onset sowie Body-Movements (78). Epidemiologische Studien der letzten Jahre liefern Hinweise, welche auf einen Zusammenhang zwischen einem erhöhten Risiko für die Entstehung einer Krebserkrankung und dem Vorliegen eines Schlafapnoe-Syndroms hindeuten. Aus pathophysiologischer Sicht scheinen hier neben dem Auftreten von Arousal insbesondere auch die mit den Apnoen assoziierten Desaturationen als relevante Faktoren eine Rolle zu spielen (79). Insbesondere Patienten mit einem schwergradigen Schlafapnoe-Syndrom mit langen Desaturationszeiten weisen eine Risikozunahme von Krebserkrankungen auf (80).
In einer retrospektiven Studie an Patienten mit einem CRF, welche mittels Polysomnographie untersucht wurden, wurde bei 33 von 39 Patienten ein Schlafapnoe-Syndrom nachgewiesen und zusätzlich auch vermehrte periodische Beinbewegungen dokumentiert (81). Neben chronischen Insomnien und einer höheren Prävalenz von schlafbezogenen Atmungsstörungen bei Krebs-Patienten wird auch von Restless-Legs Syndromen unter Chemotherapien berichtet (82). Therapeutisch kommen sowohl nicht-medikamentöse als auch medikamentöse Konzepte zum Einsatz: Bei der kognitiven Verhaltenstherapie Insomnie (CBTI), welche neben Elementen der Schlafhygiene und Schlafedukation auch Schlafrestriktion, Stimuluskontrolle und Entspannungsverfahren beinhaltet, liegt für den Einsatz bei Cancer Survivors als auch bei Brustkrebsbetroffenen mit chronischen Insomnien eine A-Empfehlung bezüglich der Evidenz dieses Verfahrens vor (70). Dabei sind Effekte auf die Schlafeffizienz, die Schlafqualität sowie die Schlaflatenz gut belegt (83).
Auch für auf Mind-Body-Medizin basierende Verfahren wie Meditationen (z.B. Mindfulness Meditation, MAPS) sowie Tai Chi/Chi Gong oder andere achtsamkeitsbasierte Techniken (84, 85) besteht eine B-Empfehlung (70). CBTI kann über eine Verbesserung der Schlafqualität auch eine bestehende CRF-Symptomatik verbessern (86). Bei symptomassoziierten Ursachen der Schlafstörungen, wie z. B. Schmerzen, Depression, Hypoxämie oder Anämie stehen die symptombezogenen Therapien im Vordergrund (87).
Bei der medikamentösen Therapie der Insomnie liegen für den Einsatz von Benzodiazepin- Agonisten und Benzodiazepinen nur wenige Studien bei Tumorpatienten vor, für die Wirksamkeit bei Cancer-Survivors existieren keine Studiendaten (70).
Da neben fehlenden Hinweisen auf einen förderlichen Effekt auf eine physiologische Schlafstruktur und Schlafregulation auch Hinweise auf ein erhöhtes Risiko für eine Verschlechterung der kognitiven Funktion durch den Einsatz von langwirksamen Benzodiazepinen bestehen (88), sollten Benzodiazepine zur schlaffördernden medikamentösen Therapie nicht eingesetzt und Benzodiazepin-Agonisten äusserst restriktiv und zeitlich nur kurz begrenzt eingesetzt werden (87). Eine weitere Therapieoption stellt Bryophyllum pinnatum 50 % zur Behandlung bei insomnischen Störungen bei Krebspatienten dar (90). Es kann die Bryophyllum-50 %-Kautablette eingesetzt werden. Zudem wurde für die Misteltherapie in einer Metaanalyse eine Reduktion von Fatigue gezeigt (91), und in einem Review zu randomisierten Studien wurden bei 7 von 10 Studien eine signifikante Abnahme von Fatigue/Müdigkeit sowie bei 6 von 9 randomisierten Studien eine signifikante Verbesserung der Schlafqualität/Schlaf-Items gefunden (92). Ferner kann auch mittels Akupunktur eine Verbesserung der Schlafqualität erzielt werden (93).
Bei Mammakarzinom-Patientinnen mit CRF wurde im Rahmen einer multimodalen Therapie über zehn Wochen, bestehend aus Psychoedukation, Schlafedukation mit einer chronoadaptierten Schlafrestriktion und Stimuluskontrolltherapie, Mal- und Eurythmietherapie und einer Kombinationstherapie, bestehend aus multimodaler Therapie und einem aeroben Training, sechs Monate nach Ende der Therapie (94) und nach vier Jahren (95) eine nachhaltige Verbesserung und Überlegenheit gegenüber einem alleinigen Ausdauertraining auf die Schlafqualität und das kombinierte Outcome Fatigue/Schlafqualität gezeigt.
Chemotherapie-induzierte periphere Neuropathie
Die Chemotherapie-induzierte periphere Neuropathie (CIPN) ist eine häufige und belastende Nebenwirkung der Behandlung mit bestimmten Chemotherapeutika, die die Lebensqualität der Patienten erheblich beeinträchtigen kann.
Die Symptome reichen von Schmerzen und Kribbeln bis hin zu Taubheit und motorischen Beeinträchtigungen. Eine Einteilung kann in Funktionsverlust (Minus-Symptome) und Übererregbarkeit durch Nerven(membran)schädigung (Plus-Symptome) erfolgen. Zu den Minus-Symptomen zählen sensorisch Hypästhesien und motorisch Funktionsverlust, zu den Plus-Symptomen zählen Missempfindungen wie Kribbeln/Ameisenlaufen, Stromgefühl oder Brennen und Schmerzen (S3-Leitlinie Supportive Therapie bei onkologischen Patient/-innen [96]). Während der Chemotherapie erleiden bis zu 71 % der Patienten eine CIPN (z. B. nach Taxan, Platin) (97). Bis zu 42 % verspüren die CIPN noch 2 Jahre nach ihrer taxan- und platinhaltigen Therapie (98).
Betroffene berichten als Hauptsymptome über Taubheit, Kribbeln, eingeschränkte Empfindlichkeit, stechende und brennende Schmerzen, Kältegefühl, Muskelkrämpfe u. a. (99). Das Risiko, eine periphere Neurotoxizität zu entwickeln, ist massgeblich von der Art und Dosis des eingesetzten Wirkstoffs abhängig (für Häufigkeiten und klinische Charakterisierung der substanzabhängigen Neuropathie: siehe S3-Guideline [96]). Das Risiko einer CIPN ist bei Vorliegen weiterer Risikofaktoren, wie z. B. Diabetes mellitus, Alkoholkonsum, Vitamin-B-Mangel oder einer anderen Neuropathie in der Familie oder Anamnese, erhöht (96, 100).
Die Pathophysiologie von CIPN ist komplex und nicht vollständig verstanden, aber sie wird mit der direkten neurotoxischen Wirkung der Chemotherapeutika (Platinverbindungen, Taxane, Vinca-Alkaloide, Bortezomib etc.) in Verbindung gebracht (101).
Zu den medikamentösen Optionen gehören Antikonvulsiva wie Gabapentin und Pregabalin sowie Antidepressiva wie Duloxetin oder Venlafaxin. Diese Medikamente können helfen, neuropathische Schmerzen zu lindern. Ihre Wirksamkeit variiert, und Nebenwirkungen müssen berücksichtigt werden. Laut ASCO-Guideline ist Duloxetin das Medikament mit der besten, wenn auch begrenzten Evidenz bei schmerzhafter CIPN (100). Nicht-medikamentöse Ansätze spielen eine wichtige Rolle bei der Behandlung der CIPN: Physikalische Therapie und Ergotherapie zielen darauf ab, die funktionelle Kapazität der Patienten zu erhalten und die Auswirkungen der Neuropathie auf das tägliche Leben zu minimieren (102, 103). Körperliche Aktivität (Ausdauer-, Krafttraining [104], sensomotorisches Training, Balanceübungen) kann ebenfalls helfen, die Lebensqualität zu verbessern und die funktionelle Mobilität zu erhalten (105, 106).
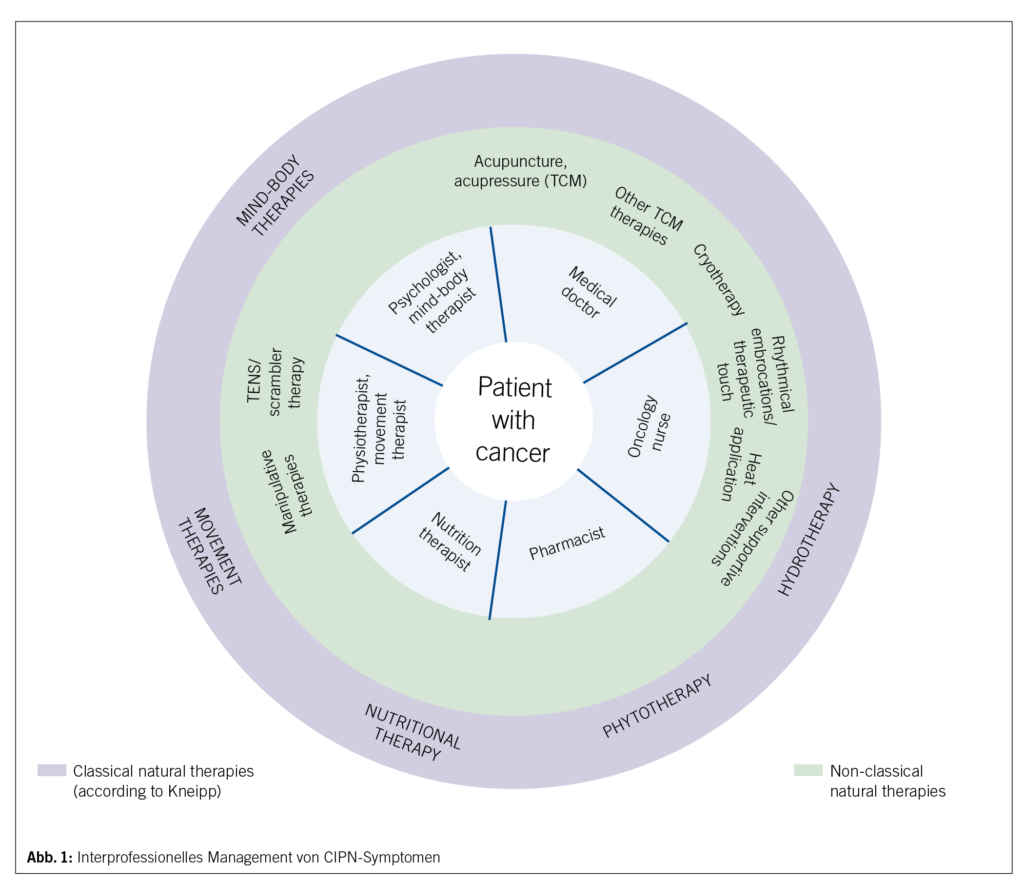
Für die Behandlung der CIPN werden evidenzbasierte Behandlungsmassnahmen aus verschiedenen IO-Kerndisziplinen (siehe Artikel Gemeinsamkeiten und Kerndisziplinen) eingesetzt. Ein kürzlich publizierter umfangreicher Expertenkonsensus (107) mit Durchsicht von 75 Studien unter Berücksichtigung einer früheren Metaanalyse (108) unterstützt, mit einer Beurteilung von mehr als der Hälfte der Interventionen von moderater bis hoher (v. a. subjektiver) klinischer Effektivität, eine Vielfalt von körperbasierten Therapien (Massage, rhythmische Einreibungen u. a.), Mind-Body-Verfahren, Akupunktur/Akupressur und einige phytotherapeutische Arzneimittel und Anwendungen. Exemplarisch zeigten Akupunktur/Akupressur (109, 110, 111) eine Verbesserung der Schmerzen und anderer sensorischer Symptome oder Yoga (112) eine Verbesserung der Lebensqualität und des Sturzrisikos. Es wird die lokale Applikation von Mentholcreme (1 %), Aconit- oder Solum-Öl sowie Arnica-comp-Öl, Formica-Öl oder -Salbe, Rosmarinsalbe, Pfefferminz-, Eukalyptusöl oder auch ein Leinsamenbad empfohlen.
Der Expertenkonsensus betont die Bedeutung eines interprofessionellen Vorgehens (107)(Abb. 1).
Weitere Indikationen für IO-Behandlungen in der Survivorship Care
Neben den exemplarisch erwähnten Indikationen Fatigue, Schlafstörungen und CIPN liegen zunehmend Daten vor, welche die Vielzahl an Beschwerden und Einschränkungen der Cancer Survivors adressieren. Es liegen IO-Guidelines für Schmerzen (20) bei Krebs und Angst/Depression (21) vor, die S3-Guidelines Komplementärmedizin (18) und Supportive Care (96) (siehe Artikel Edukation) erwähnen weitere Massnahmen. Beispielhaft Akupunktur bei Xerostomie (113), Hitzewallungen (114) oder TCM bei therapieassoziierter Nausea (CINV) (115).
Ernährung und körperliche Aktivität in der Survivorship Care
Krebsbetroffene Menschen interessieren sich zunehmend für eine Ernährung, die die Wahrscheinlichkeit eines Rückfalls oder einer Progression der Erkrankung positiv beeinflusst. Aufgrund der Bedeutung der Mangelernährung und der Tumorkachexie in der Onkologie, die weiterhin zu wenig beachtet werden (116, 117), mit negativen Folgen auf die Lebensqualität, körperliche Funktion und die Verträglichkeit und Wirksamkeit der krebsspezifischen Behandlungen (118), liegt der Schwerpunkt der meisten Onkologen (119) und Ernährungsfachleute bisher auf einer Erkennung und Verbesserung der Mangelernährung und Tumorkachexie (120). Bisherige Guidelines fokussieren auf diese Thematik. In den Aktualisierungsprozess der ESPEN Guideline «Clinical Nutrition in Cancer» (121) wurden nun auch Kapitel zu Fasten, ketogener Ernährung, Mikrobiom und pflanzlichen Eiweissquellen aufgenommen. Hier zeigt sich, dass auch eine zunehmend vorliegende wissenschaftliche Evidenz mit Studien zu den positiven Auswirkungen einer antiinflammatorisch-mediterranen (122) Ernährung Aufmerksamkeit in der modernen Ernährungsmedizin erlangt hat, mit primär pflanzenbasierten (123), auf biologischen Böden angebauten Lebensmitteln, sowie einer zuckerarmen und mikrobiomunterstützenden Ernährung (124) einschliesslich Fastenimpulsen. Auch liegt eine zunehmende wissenschaftliche Evidenz vor, dass die positive Wirkung der Ernährung auf Therapie und Krankheitsverlauf mit körperlicher Aktivität kombiniert werden sollte (125), wobei körperliche Aktivität mit bester Evidenz (126) ein obligatorischer Bestandteil jeder onkologischen Behandlung darstellen sollte.
Die erfolgreiche Implementierung von Lebensstiländerungen im klinischen Alltag erfordert entsprechende Kenntnisse der Psychologie und Praxis von Gewohnheitsänderungen des Lebensstils (126). Die Wahrnehmung von körperlichen Signalen wie Sättigung oder Hunger, von verbesserter Energie nach einer körperlichen Aktivität oder nach einem hochwertigen mediterranen, pflanzlich-eiweissreichem Essen oder Umgang mit Emotionen beim Verlangen nach Zucker kann unterstützt werden durch Mind-Body-Verfahren, Anwendung von Phytotherapie (z.B. Bitterstoffen) oder bewusstes Pflegen von Tagesrhythmen, unterstützt durch äussere Anwendungen. In diesem Sinne können und sollen IO-Kerndisziplinen die für Veränderung von Ernährung und körperlicher Aktivität notwendigen Lebensstilveränderungen (14) begleiten, dies in Ergänzung zu einer transparenten Zusammenarbeit mit Fachpersonen der modernen, konventionellen Ernährungsmedizin.
Fazit
Massnahmen aller Kerndisziplinen der IO können in vielen Bereichen der Survivorship Care evidenzbasiert (siehe Artikel Forschung) Anwendung finden, teils ergänzend, kollaborativ und transparent zu sogenannten konventionell-medizinischen Behandlungen eingesetzt werden. Dabei verwischen sich zunehmend die «Grenzen». Das Gesundheitswesen kann transformiert werden, indem das «Neue» und «Innovative» (einschliesslich traditioneller Weisheiten und Erfahrungen) unter Beachtung von intuitiv-mentalen und sozialen Interaktionen von Fachpersonen zur neuen Normalität in der Medizin werden kann.
Julia Reusch 1, Matthias Kröz 2, 3, 4, Tilly Nothhelfer 5, Florian Strasser 6, 7
1 Klinik für Onkologie und Hämatologie, Stadtspital Zürich Triemli, Schweiz
2 Schlafmedizin und Forschungsabteilung, Klinik Arlesheim, Arlesheim, Schweiz
3 Forschungsinstitut Havelhöhe, Berlin, Deutschland
4 Institut für Integrative Medizin, Universität Witten/Herdecke, Deutschland
5 Klinik für Onkologie und Hämatologie, Kantonsspital Baden, Schweiz
6 Zentrum Integrative Medizin, Hoch Health Ostschweiz, Kantonsspital St. Gallen, Schweiz
7 Cancer Fatigue Clinic (Münsterlingen, Sargans, Schaffhausen), Schweiz
Klinik für Onkologie und Hämatologie
Stadtspital Zürich Triemli
Birmensdorferstrasse 497
8063 Zürich
julia.reusch@stadtspital.ch
Matthias Kröz ist Mitarbeiter der Klinik Arlesheim AG.
Tilly Nothhelfer hat Honorare für Vorträge, Beratung oder Teilnahme an Advisory Boards erhalten von Abbvie, Daiichi Sankyo, Eli Lilly Suisse, Novartis, Pfizer, Pierre Fabre, Astra Zeneca, Takeda.
Florian Strasser ist Extended Board Member des Swiss Network for Integrative Oncology, er hat Honorare für Vorträge, Beratung oder Teilnahme an Advisory Boards erhalten (letzte 5 Jahre) von Abbott Nutrition, Danone-Nutricia, Fresenius, Helsinn, Ology, Pfizer, Sanofi; er führt in selbstständiger Tätigkeit die ambulanten Sprechstunden der Cancer Fatigue Clinic durch.
1. https://www.nkrs.ch/de/fakten-zu-krebs/statistiken-zu-krebs
2. Shapiro CL. Cancer Survivorship. N Engl J Med. 2018 Dec 20;379(25):2438-2450
3. Mullan F. Seasons of Survival: Reflections of a Physician with Cancer. N. Engl. J. Med. 1985;313:270–273
4. Denlinger CS, Carlson RW, Are M et al (2014) Survivorship: introduction and definition. Clinical practice guidelines in oncology. J NatlComprCanc Netw12(1):34–45
5. Vaz-Luis I et al. ESMO Expert Consensus Statements on Cancer Survivorship: promoting high-quality survivorship care and research in Europe. Ann Oncol. 2022 Nov;33(11):1119-1133.
6. Esser P, Mehnert-Theuerkauf A. Cancer-Survivorship-Care-Programme und Selbstmanagement [Cancer survivorship care programs and self-management]. Onkologe (Berl). 2021;27(8):766-770
7. https://oncosuisse.ch/wp-content/uploads/Oncosuisse-Masterplan-2025.pdf
8. Ganz PA, Desmond KA, Leedham B, Rowland JH, Meyerowitz BE, Belin TR. Quality of life in long-term, disease-free survivors of breast cancer: a follow-up study. J. Natl. Cancer Inst. 2002;94(1):39–49
9. Mayer DK, Nasso SF, Earp JA. Defining cancer survivors, their needs, and perspectives on survivorship health care in the USA. Lancet Oncol. 2017;18(1):e11–e18
10. https://www.krebsliga.ch/forschung/gefoerderte-forschungsprojekte/aktualitaeten/geheilt-aber-nicht-gesund-vom-ueber-leben-nach-krebs
11. https://all-can.ch/wp-content/uploads/2024/05/Studie-zu-Cancer-Survivorship-All.Can-Schweiz.pdf
12. https://gesundheitsfoerderung.ch/praevention-in-der-gesundheitsversorgung/projektfoerderung/gefoerderte-projekte/projekt-cssp
13. https://www.bfh.ch/de/forschung/forschungsprojekte/2025-139-800-296/
14. Witt C. et al. Comprehensive Definition of Integrative Oncology, JNCI Monographs, Volume 2017, Issue 52
15. https://www.who.int/health-topics/traditional-complementary-and-integrative-medicine#tab=tab_1
16. Molassiotis P, Fernandex-Ortega P, Pud D, Ozden G, Scott JA, Panteli V, et al. Use of complementary and alternative medicine in cancer patients: a European study. Ann Oncol. 2005;(16):655–63.
17. Oh B, Butow P, Mullan B, Beale P, Pavlakis N, Rosenthal D, et al. The use and perceived benefits resulting from the use of complementary and alternative medicine by cancer patients in Australia. Asia-Pacific Journal of Clinical Oncology. 2010;6(4):342–9
18. https://register.awmf.org/assets/guidelines/032-055OLl__S3_Komplementaermedizin-in-der-Behandlung-von-onkologischen-PatientInnen-2025-06.pdf
19. Gowin, K et al. Synthesis and Educational Overview of the ASCO–Society of Integrative Oncology Guidelines: On the Path to Implementation, Am Soc Clin Oncol Educ Book, June 2025
20. Mao JJ, Ismaila N, Bao T, Barton D, Ben-Arye E, Garland EL, Greenlee H, Leblanc T, Lee RT, Lopez AM, Loprinzi C, Lyman GH, MacLeod J, Master VA, Ramchandran K, Wagner LI, Walker EM, Bruner DW, Witt CM, Bruera E. Integrative Medicine for Pain Management in Oncology: Society for Integrative Oncology-ASCO Guideline. J Clin Oncol. 2022 Dec 1;40(34):3998-4024.
21. Carlson LE, Ismaila N, Addington EL, Asher GN, Atreya C, Balneaves LG, Bradt J, Fuller-Shavel N, Goodman J, Hoffman CJ, Huston A, Mehta A, Paller CJ, Richardson K, Seely D, Siwik CJ, Temel JS, Rowland JH. Integrative Oncology Care of Symptoms of Anxiety and Depression in Adults With Cancer: Society for Integrative Oncology-ASCO Guideline. J Clin Oncol. 2023 Oct 1;41(28):4562-4591.
22. Bower JE, Lacchetti C, Alici Y, Barton DL, Bruner D, Canin BE, Escalante CP, Ganz PA, Garland SN, Gupta S, Jim H, Ligibel JA, Loh KP, Peppone L, Tripathy D, Yennu S, Zick S, Mustian K. Management of Fatigue in Adult Survivors of Cancer: ASCO-Society for Integrative Oncology Guideline Update. J Clin Oncol. 2024 Jul 10;42(20):2456-2487.
23. Mustian K, Lacchetti C, Zick S, Bower JE. Management of Fatigue in Adult Survivors of Cancer: American Society of Clinical Oncology – Society for Integrative Oncology (ASCO-SIO) Guideline Update Clinical Insights. JCO Oncol Pract. 2024 Dec;20(12):1575-1579
24. Gowin K, Ahn ER, Lopez AM. Synthesis and Educational Overview of the ASCO-Society of Integrative Oncology Guidelines: On the Path to Implementation. Am Soc Clin Oncol Educ Book. 2025 Jun;45(3):e471830.
25. Vaz-Luis I, Masiero M, Cavaletti G, Cervantes A, Chlebowski RT, Curigliano G, Felip E, Ferreira AR, Ganz PA, Hegarty J, Jeon J, Johansen C, Joly F, Jordan K, Koczwara B, Lagergren P, Lambertini M, Lenihan D, Linardou H, Loprinzi C, Partridge AH, Rauh S, Steindorf K, van der Graaf W, van de Poll-Franse L, Pentheroudakis G, Peters S, Pravettoni G. ESMO Expert Consensus Statements on Cancer Survivorship: promoting high-quality survivorship care and research in Europe. Ann Oncol. 2022 Nov;33(11):1119-1133
26. Abrahams HJG, et al. Risk factors, prevalence, and course of severe fatigue after breast cancer treatment: a meta-analysis involving 12 327 breast cancer survivors. Ann Oncol 2016;27(6):965-974
27. Kang YE, Yoon JH, Park NH, Ahn YC, Lee EJ, Son CG. Prevalence of cancer-related fatigue based on severity: a systematic review and meta-analysis. Sci Rep. 2023 Aug 7;13(1):12815
28. Al Maqbali M, Al Sinani M, Al Naamani Z, Al Badi K, Tanash MI. Prevalence of Fatigue in Patients With Cancer: A Systematic Review and Meta-Analysis. J Pain Symptom Manage. 2021 Jan;61(1):167-189.e14.
29. de Jong N, Candel MJ, Schouten HC, Abu-Saad HH, Courtens AM. Prevalence and course of fatigue in breast cancer patients receiving adjuvant chemotherapy. Ann Oncol. 2004 Jun;15(6):896-905
30. Goldstein D, Bennett B, Friedlander M, Davenport T, Hickie I, Lloyd A. Fatigue states after cancer treatment occur both in association with, and independent of, mood disorder: a longitudinal study. BMC Cancer. 2006 Oct 9;6:240.
31. Bower JE, Ganz PA, Desmond KA, Rowland JH, Meyerowitz BE, Belin TR. Fatigue in breast cancer survivors: occurrence, correlates, and impact on quality of life. J Clin Oncol. 2000 Feb;18(4):743-53.
32. Stone P, Richardson A, Ream E, Smith AG, Kerr DJ, Kearney N. Cancer-related fatigue: inevitable, unimportant and untreatable? Results of a multi-centre patient survey. Cancer Fatigue Forum. Ann Oncol. 2000 Aug;11(8):971-5.
33. NCI NCI. Fatigue (PDQ) U.S. National Institutes of Health; 2023 [https://www.cancer.gov/about-cancer/treatment/side-effects/fatigue/fatigue-hp-pdq]
34. Arndt V, Merx H, Stegmaier C, Ziegler H, Brenner H. Persistence of restrictions in quality of life from the first to the third year after diagnosis in women with breast cancer. J Clin Oncol. 2005 Aug 1;23(22):4945-53.
35. Arndt V, Koch-Gallenkamp L, Jansen L, Bertram H, Eberle A, Holleczek B, Schmid-Höpfner S, Waldmann A, Zeissig SR, Brenner H. Quality of life in long-term and very long-term cancer survivors versus population controls in Germany. Acta Oncol. 2017 Feb;56(2):190-197.
36. Barreto R, et al. Chemotherapy-related cahcexia is associated with mitochondrial depletion and the activation of ERK1/2 and p38 MAPKs. Oncotarget 2016;7(28):43442-60
37. Henderson FM, et al. ‚A new normal with chemobrain‘: Experiences of the impact of chemotherapy-related cognitive deficits in long-term breast cancer survivors. Health Psychol Open 2019;6(1):2055102919832234
38. Nguyen LD, Ehrlich BE. EMBO Mol Med 2020;12(6):e12075
39. Gutmann DH. Clearing the Fog surrounding Chemobrain. Cell 2019;176(1-2):2-4
40. Bower JE. The role of neuro-immune interactions in cancer-related fatigue: Biobehavioral risk factors and mechanisms. Cancer. 2019 Feb 1;125(3):353-364
41. Aoki et al. Autonomic function measurements for evaluating fatigue and quality of life in patients with breast cancer undergoing radiation therapy: a prospective longitudinal Study. Radiation Oncology 2023;18:171
42. Strasser F, Müller-Käser I, Dietrich D. Evaluating cognitive, emotional, and physical fatigue domains in daily practice by single-item questions in patients with advanced cancer: a cross-sectional pragmatic study. J Pain Symptom Manage. 2009 Oct;38(4):505-14.
43. Kröz M, Zerm R, Reif M, VON Laue HB, Schad F, Büssing A, Bartsch C, Feder G, Girke M. Validation of the German version of the Cancer Fatigue Scale (CFS-D). Eur J Cancer Care (Engl). 2008 Jan;17(1):33-41.
44. Cella D, Davis K, Breitbart W, Curt G; Fatigue Coalition. Cancer-related fatigue: prevalence of proposed diagnostic criteria in a United States sample of cancer survivors. J Clin Oncol. 2001 Jul 15;19(14):3385-91
45. Radbruch L, Sabatowski R, Elsner F, Everts J, Mendoza T, Cleeland C. Validation of the German version of the brief fatigue inventory. J Pain Symptom Manage. 2003 May;25(5):449-58.
46. Thong MSY, Doege D, Koch-Gallenkamp L, Bertram H, Eberle A, Holleczek B, Nennecke A, Waldmann A, Zeissig SR, Pritzkuleit R, Brähler E, Brenner H, Arndt V. Fatigue in long-term cancer survivors: prevalence, associated factors, and mortality. A prospective population-based study. Br J Cancer. 2025 Jul 15.
47. Afzali A, et al. The effect of zinc supplementation on fatigue among elderly community dwellers: A parallel clinical trial. Health Sci Rep 2021;4(2):e301.
48. Ribeiro SMF, et al. Effects of zinc supplementation on fatigue and quality of life in patients with colorectal cancer. Einstein (Sao Paulo) 2017;15(1):24-28.
49. Vieira ML, et al. Supplementation with selenium can influence nausea, fatigue, physical, renal, and liver function of children and adolescents with cancer. J Med Food. 2015 Jan;18(1):109-17
50. Frei A., et al. (2016). Kriterien zur Bestimmung des Schweregrades einer neuropsychologischen Störung sowie Zuordnungen zur Funktions- und Arbeitsfähigkeit. Zeitschrift für Neuropsychologie, 27 (2), 107–119
51. Vasquez P, et al. Association between fatigue and sleep disturbances during treatment for pediatric acute lymphoblastic leukemia and posttreatment neurocognitive performance. Pediatr Blood Cancer 2022;69(5):e29507
52. Beeler DM, O‘Higgins CM, Brady B, Walsh D, Reilly RB. Objective measurement of cancer-related fatigue. Support Care Cancer. 2025 Jul 24;33(8):716
53. Cruz-Montecinos C, Torres-Castro R, Otto-Yáñez M, Barros-Poblete M, Valencia C, Campos A, et al. Which sit-to-stand test best differentiates functional capacity in older people? Am J Phys Med Rehabil. 2024; 103(10): 925-928
54. Campbell KL, et al. Exercise Guidelines for Cancer Survivors: Consensus Statement from International Multidisciplinary Roundtable. Med Sci Sports Exerc. 2019;51(11):2375-90
55. Hosseini Koukamari P, Karimy M, Ghaffari M, Milajerdi A. Effect of cognitive-behavioral therapy on fatigue in cancer patients: a systematic review and meta-analysis. Front Psychol. 2025 Jan 10;15:1435110.
56. Haussmann A, et al. Meta-Analysis of Randomized Controlled Trials on Yoga, Psychosocial, and Mindfulness-Based Interventions for Cancer-Related Fatigue: What Intervention Characteristics Are Related to Higher Efficacy? Cancers (Basel) 2022;14(8):2016
57. Zhang Y, et al. The Effect of Nutritional Support Based on the Dietary Anti-Inflammatory Index on Cancer-Related Fatigue in Lung Cancer Patients Undergoing Chemotherapy. Cancer Nurs 2023;46(5):394-404
58. Sathiaraj E, et al. Effects of a Plant-Based High-Protein Diet on Fatigue in Breast Cancer Patients Undergoing Adjuvant Chemotherapy – a Randomized Controlled Trial. Nutr Cancer 2023;75(3):846-56
59. Dun L, Xian-Yi W, Si-Ting H, Xin-Yuan Y. Effects of sleep interventions on cancer-related fatigue and quality of life in cancer patients: a systematic review and meta-analysis. Support Care Cancer. 2022 Apr;30(4):3043-3055.
60. Fabi A, et al. Cancer-related fatigue: ESMO Clinical Practice Guidelines for diagnosis and treatment. Ann Oncol 2020;31(6):713-723
61. Berger AM, et al; National comprehensive cancer network. Cancer-Related Fatigue, Version 2.2015. J Natl Compr Canc Netw 2015;13(8):1012-39
62. Bower JE, et al. Management of Fatigue in Adult Survivors of Cancer: ASCO-Society for Integrative Oncology Guideline Update. J Clin Oncol 2024:JCO2400541
63. Deng G et al. Effects of Vigorous Versus Restorative Yoga Practice on Objective Cognition Functions in Sedentary Breast and Ovarian Cancer Survivors: A Randomized Controlled Pilot Trial Integr Cancer Ther 2022;21:1–6
64. Busch A, Krause A, Rostock M. Komplementärmedizinische Therapieansätze bei krebsbedingter Fatigue [Complementary and integrative medicine in cancer-related fatigue]. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. 2024 Nov;67(11):1295-1305
65. Montgomery GH, David D, Kangas M, Green S, Sucala M, Bovbjerg DH, Hallquist MN, Schnur JB. Randomized controlled trial of a cognitive-behavioral therapy plus hypnosis intervention to control fatigue in patients undergoing radiotherapy for breast cancer. J Clin Oncol. 2014 Feb 20;32(6):557-63
66. Grégoire C, Bragard I, Jerusalem G, Etienne AM, Coucke P, Dupuis G, Lanctôt D, Faymonville ME. Group interventions to reduce emotional distress and fatigue in breast cancer patients: a 9-month follow-up pragmatic trial. Br J Cancer. 2017 Nov 7;117(10):1442-1449.
67. Jain M, Mishra A, Yadav V, Shyam H, Kumar S, Mishra SK, Ramakant P. Long-term yogic intervention decreases serum interleukins IL-10 and IL-1? and improves cancer-related fatigue and functional scale during radiotherapy/chemotherapy in breast cancer patients: a randomized control study. Support Care Cancer. 2022 Dec 13;31(1):6
68. Tan SY, Turner J, Kerin-Ayres K, Butler S, Deguchi C, Khatri S, Mo C, Warby A, Cunningham I, Malalasekera A, Dhillon HM, Vardy JL. Health concerns of cancer survivors after primary anti-cancer treatment. Support Care Cancer. 2019 Oct;27(10):3739-3747
69. Berger AM, Mooney K, Alvarez-Perez A, Breitbart WS, Carpenter KM, Cella D, Cleeland C, Dotan E, Eisenberger MA, Escalante CP, Jacobsen PB, Jankowski C, LeBlanc T, Ligibel JA, Loggers ET, Mandrell B, Murphy BA, Palesh O, Pirl WF, Plaxe SC, Riba MB, Rugo HS, Salvador C, Wagner LI, Wagner-Johnston ND, Zachariah FJ, Bergman MA, Smith C; National comprehensive cancer network. Cancer-Related Fatigue, Version 2.2015. J Natl Compr Canc Netw. 2015 Aug;13(8):1012-39
70. Grassi L, Zachariae R, Caruso R, Palagini L, Campos-Ródenas R, Riba MB, Lloyd-Williams M, Kissane D, Rodin G, McFarland D, Ripamonti CI, Santini D; ESMO Guidelines Committee. Electronic address: clinicalguidelines@esmo.org. Insomnia in adult patients with cancer: ESMO Clinical Practice Guideline. ESMO Open. 2023 Dec;8(6):102047.
71. American-Psychiatric-Association. Diagnostic and Statistical Manual of Mental Disorders (DSM-5-TR). Washington2022.
72. American-Academy-of-Sleep-Medicine. International Classification of Sleep Medicine2014
73. Savard J, Villa J, Ivers H, Simard S, Morin CM. Prevalence, natural course, and risk factors of insomnia comorbid with cancer over a 2-month period. J Clin Oncol. 2009 Nov 1;27(31):5233-9.
74. Savard J, Liu L, Natarajan L, Rissling MB, Neikrug AB, He F, et al. Breast cancer patients have progressively impaired sleep-wake activity rhythms during chemotherapy. Sleep. 2009;32(9):1155-60
75. Bartsch C, Bartsch H, Fuchs U, Lippert TH, Bellmann O, Gupta D. Stage-dependent depression of melatonin in patients with primary breast cancer. Correlation with prolactin, thyroid stimulating hormone, and steroid receptors. Cancer. 1989 Jul 15;64(2):426-33
76. Bartsch C, Bartsch H, Mecke D. Analysis of Melatonin in Patients with Cancer of the Reproductive System. In: Bartsch C, Bartsch H, Blask D, Cardinali D, Hrushesky W, Mecke D, editors. The Pineal Gland and Cancer. Berlin, Heidelberg, New York… Springer; 2001. p. 153-76
77. Thompson CL, Li L. Association of sleep duration and breast cancer OncotypeDX recurrence score. Breast Cancer Res Treat. 2012 Aug;134(3):1291-5.
78. Silberfarb PM, Hauri PJ, Oxman TE, Schnurr P. Assessment of sleep in patients with lung cancer and breast cancer. J Clin Oncol. 1993 May;11(5):997-1004
79. Gozal D, Farré R, Nieto FJ. Obstructive sleep apnea and cancer: Epidemiologic links and theoretical biological constructs. Sleep Med Rev. 2016 Jun;27:43-55.
80. Tan BKJ, Teo YH, Tan NKW, Yap DWT, Sundar R, Lee CH, See A, Toh ST. Association of obstructive sleep apnea and nocturnal hypoxemia with all-cancer incidence and mortality: a systematic review and meta-analysis. J Clin Sleep Med. 2022 May 1;18(5):1427-1440
81. Wu IHC, Balachandran DD, Faiz SA, Bashoura L, Escalante CP, Manzullo EF. Characteristics of Cancer-Related Fatigue and Concomitant Sleep Disturbance in Cancer Patients. J Pain Symptom Manage. 2022 Jan;63(1):e1-e8.
82. Büttner-Teleaga A, Kim YT, Osel T, Richter K. Sleep Disorders in Cancer-A Systematic Review. Int J Environ Res Public Health. 2021 Nov 7;18(21):11696.
83. Nissen ER, Neumann H, Knutzen SM, Henriksen EN, Amidi A, Johansen C, von Heymann A, Christiansen P, Zachariae R. Interventions for insomnia in cancer patients and survivors-a comprehensive systematic review and meta-analysis. JNCI Cancer Spectr. 2024 Apr 30;8(3):pkae041
84. Bower JE, Crosswell AD, Stanton AL, Crespi CM, Winston D, Arevalo J, Ma J, Cole SW, Ganz PA. Mindfulness meditation for younger breast cancer survivors: a randomized controlled trial. Cancer. 2015 Apr 15;121(8):1231-40
85. Wayne PM, Lee MS, Novakowski J, Osypiuk K, Ligibel J, Carlson LE, Song R. Tai Chi and Qigong for cancer-related symptoms and quality of life: a systematic review and meta-analysis. J Cancer Surviv. 2018 Apr;12(2):256-267.
86. Dean R. Can improving quality of sleep reduce the symptoms of cancer-related fatigue in adults?: A systematic review. Eur J Cancer Care (Engl). 2022 Jul;31(4):e13597.
87. Kröz M, Blau A, Blau I. Hämatologische Erkrankungen. In: Peter H, Penzel T, Peter JH, Peter JG, editors. Enzyklopädie der Schlafmedizin. 2. Berlin: Springer; 2025. p. 438-43.
88. Freund W, Weber F. The Function of Sleep and the Treatment of Primary Insomnia. Dtsch Arztebl Int. 2023;120(50):863-70
89. Hemmeter UM, Holsboer-Trachsler E. Pflanzliche Sedativa. In: Peter H, Penzel T, Peter JH, Peter JG, editors. Enzyklopädie der Schlafmedizin. 2, M-Z. Berlin: Springer; 2025. p. 858-65.
90. Simoes-Wust AP, Hassani TA, Muller-Hubenthal B, Pittl S, Kuck A, Meden H, et al. Sleep Quality Improves During Treatment With Bryophyllum pinnatum: An Observational Study on Cancer Patients. Integrative cancer therapies. 2015;14(5):452-9
91. Pelzer F, Loef M, Martin DD, Baumgartner S. Cancer-related fatigue in patients treated with mistletoe extracts: a systematic review and meta-analysis. Support Care Cancer. 2022 Aug;30(8):6405-6418.
92. Kröz M, Büssing A, Reif M, Pranga D, Schad F, Zerm R, et al. Besteht eine Indikation für die Misteltherapie in der Behandlung von Cancer-related Fatigue und Insomnie – ein Review. In: Scheer R, Becker H, Beer AM, Blaschek W, Kreis W, H. M, et al., editors. Die Mistel in der Tumortherapie 4. Essen: KVC Verlag; 2016. p. 287-98.
93. Yang Y, Wang H, Chen ZZ, Teng QR. Effects of acupuncture on improving sleep quality and the risk of emotional maladjustment of breast cancer patients: a systematic review and meta-analysis. Frontiers in oncology. 2025;15:1617818
94. Kröz M, Reif M, Glinz A, Berger B, Nikolaou A, Zerm R, Brinkhaus B, Girke M, Büssing A, Gutenbrunner C; CRF-2 study group. Impact of a combined multimodal-aerobic and multimodal intervention compared to standard aerobic treatment in breast cancer survivors with chronic cancer-related fatigue – results of a three-armed pragmatic trial in a comprehensive cohort design. BMC Cancer. 2017 Mar 2;17(1):166. doi: 10.1186/s12885-017-3142-7. Erratum in: BMC Cancer. 2020 Dec 1;20(1):1174
95. Kröz M, Quittel F, Reif M, Zerm R, Pranga D, Bartsch C, Brinkhaus B, Büssing A, Gutenbrunner C; CRF study group. Four-year follow-up on fatigue and sleep quality of a three-armed partly randomized controlled study in breast cancer survivors with cancer-related fatigue. Sci Rep. 2023 Feb 15;13(1):2705.
96. https://www.leitlinienprogramm-onkologie.de/fileadmin/user_upload/Downloads/Leitlinien/Supportivtherapie/Version_2/LL_Supportive_Therapie_Langversion_2.0.pdf
97. Molassiotis A, Cheng HL, Lopez V, Au JSK, Chan A, Bandla A, Leung KT, Li YC, Wong KH, Suen LKP, Chan CW, Yorke J, Farrell C, Sundar R. Are we mis-estimating chemotherapy-induced peripheral neuropathy? Analysis of assessment methodologies from a prospective, multinational, longitudinal cohort study of patients receiving neurotoxic chemotherapy. BMC Cancer. 2019 Feb 8;19(1):132.
98. Bandos H, Melnikow J, Rivera DR, Swain SM, Sturtz K, Fehrenbacher L, Wade JL 3rd, Brufsky AM, Julian TB, Margolese RG, McCarron EC, Ganz PA. Long-term Peripheral Neuropathy in Breast Cancer Patients Treated With Adjuvant Chemotherapy: NRG Oncology/NSABP B-30. J Natl Cancer Inst. 2018 Feb 1;110(2):djx162
99. Prager K, Passig K, Micke O, Zomorodbakhsch B, Keinki C, Hübner J. Chemotherapy-induced polyneuropathy in cancer care-the patient perspective. Support Care Cancer. 2023 Mar 27;31(4):235
100. Loprinzi CL, Lacchetti C, Bleeker J, Cavaletti G, Chauhan C, Hertz DL, Kelley MR, Lavino A, Lustberg MB, Paice JA, Schneider BP, Lavoie Smith EM, Smith ML, Smith TJ, Wagner-Johnston N, Hershman DL. Prevention and Management of Chemotherapy-Induced Peripheral Neuropathy in Survivors of Adult Cancers: ASCO Guideline Update. J Clin Oncol. 2020 Oct 1;38(28):3325-3348
101. Avallone A, Bimonte S, Cardone C, Cascella M, Cuomo A. Pathophysiology and Therapeutic Perspectives for Chemotherapy-induced Peripheral Neuropathy. Anticancer Res. 2022 Oct;42(10):4667-4678
102. Dhawan S, Andrews R, Kumar L, Wadhwa S, Shukla G. A Randomized Controlled Trial to Assess the Effectiveness of Muscle Strengthening and Balancing Exercises on Chemotherapy-Induced Peripheral Neuropathic Pain and Quality of Life Among Cancer Patients. Cancer Nurs. 2020 Jul/Aug;43(4):269-280
103. Zimmer P, Trebing S, Timmers-Trebing U, Schenk A, Paust R, Bloch W, Rudolph R, Streckmann F, Baumann FT. Eight-week, multimodal exercise counteracts a progress of chemotherapy-induced peripheral neuropathy and improves balance and strength in metastasized colorectal cancer patients: a randomized controlled trial. Support Care Cancer. 2018 Feb;26(2):615-624.
104. Kleckner IR, Kamen C, Gewandter JS, Mohile NA, Heckler CE, Culakova E, Fung C, Janelsins MC, Asare M, Lin PJ, Reddy PS, Giguere J, Berenberg J, Kesler SR, Mustian KM. Effects of exercise during chemotherapy on chemotherapy-induced peripheral neuropathy: a multicenter, randomized controlled trial. Support Care Cancer. 2018 Apr;26(4):1019-1028.
105. Streckmann F, Zopf EM, Lehmann HC, May K, Rizza J, Zimmer P, Gollhofer A, Bloch W, Baumann FT. Exercise intervention studies in patients with peripheral neuropathy: a systematic review. Sports Med. 2014 Sep;44(9):1289-304.
106. Kanzawa-Lee GA, Larson JL, Resnicow K, Smith EML. Exercise Effects on Chemotherapy-Induced Peripheral Neuropathy: A Comprehensive Integrative Review. Cancer Nurs. 2020 May/Jun;43(3):E172-E185.
107. Klafke N, Bossert J, Kröger B, Neuberger P, Heyder U, Layer M, Winkler M, Idler C, Kaschdailewitsch E, Heine R, John H, Zielke T, Schmeling B, Joy S, Mertens I, Babadag-Savas B, Kohler S, Mahler C, Witt CM, Steinmann D, Voiss P, Stolz R. Prevention and Treatment of Chemotherapy-Induced Peripheral Neuropathy (CIPN) with Non-Pharmacological Interventions: Clinical Recommendations from a Systematic Scoping Review and an Expert Consensus Process. Med Sci (Basel). 2023 Jan 30;11(1):15.
108. Brami C, Bao T, Deng G. Natural products and complementary therapies for chemotherapy-induced peripheral neuropathy: A systematic review. Crit Rev Oncol Hematol. 2016 Feb;98:325-34
109. Molassiotis A, Suen LKP, Cheng HL, Mok TSK, Lee SCY, Wang CH, Lee P, Leung H, Chan V, Lau TKH, Yeo W. A Randomized Assessor-Blinded Wait-List-Controlled Trial to Assess the Effectiveness of Acupuncture in the Management of Chemotherapy-Induced Peripheral Neuropathy. Integr Cancer Ther. 2019 Jan-Dec;18:1534735419836501
110. Lu W, Giobbie-Hurder A, Freedman RA, Shin IH, Lin NU, Partridge AH, Rosenthal DS, Ligibel JA. Acupuncture for Chemotherapy-Induced Peripheral Neuropathy in Breast Cancer Survivors: A Randomized Controlled Pilot Trial. Oncologist. 2020 Apr;25(4):310-318.
111. D‘Alessandro EG, Nebuloni Nagy DR, de Brito CMM, Almeida EPM, Battistella LR, Cecatto RB. Acupuncture for chemotherapy-induced peripheral neuropathy: a randomised controlled pilot study. BMJ Support Palliat Care. 2022 Mar;12(1):64-72.
112. Galantino ML, Tiger R, Brooks J, Jang S, Wilson K. Impact of Somatic Yoga and Meditation on Fall Risk, Function, and Quality of Life for Chemotherapy-Induced Peripheral Neuropathy Syndrome in Cancer Survivors. Integr Cancer Ther. 2019 Jan-Dec;18:1534735419850627.
113. Simcock R, Fallowfield L, Monson K, Solis-Trapala I, Parlour L, Langridge C, Jenkins V; ARIX Steering Committee. ARIX: a randomised trial of acupuncture v oral care sessions in patients with chronic xerostomia following treatment of head and neck cancer. Ann Oncol. 2013 Mar;24(3):776-83.
114. Lesi G, Razzini G, Musti MA, Stivanello E, Petrucci C, Benedetti B, Rondini E, Ligabue MB, Scaltriti L, Botti A, Artioli F, Mancuso P, Cardini F, Pandolfi P. Acupuncture As an Integrative Approach for the Treatment of Hot Flashes in Women With Breast Cancer: A Prospective Multicenter Randomized Controlled Trial (AcCliMaT). J Clin Oncol. 2016 May 20;34(15):1795-802
115. Wei H, Sun Y, Xie L, Jia Y, He J, Deng X, Huang W, Hu Y, Zhu J. Huo Xiang Zheng Qi Oral Liquid Combined with 5-HT3 Receptor Antagonists and Dexamethasone Can Prevent Chemotherapy-Induced Nausea and Vomiting for Patients Receiving Multiday Cisplatin-Based Regimen: A Multicenter Trial. J Integr Complement Med. 2023 Aug;29(8):501-509
116. Amano K, Koshimoto S, Hopkinson JB, Baracos VE, Mori N, Morita T, Oyamada S, Ishiki H, Satomi E, Takeuchi T. Perspectives of Health Care Professionals on Multimodal Interventions for Cancer Cachexia. Palliat Med Rep. 2022 Dec 2;3(1):244-254
117. Arends J, Muscaritoli M, Anker S, Audisio R, Barazzoni R, Bosnjak S, Bossi P, Bowman J, Gijssels S, Krznari? Ž, Strasser F, Aapro M. Overcoming barriers to timely recognition and treatment of cancer cachexia: Sharing Progress in Cancer Care Task Force Position Paper and Call to Action. Crit Rev Oncol Hematol. 2023 May;185:103965
Therapeutische Umschau
- Vol. 82
- Ausgabe 5
- November 2025