Auch dieses Jahr berichten wir über einige Highlights des alljährlichen, zweitägigen, ausgezeichneten Kongresses der Deutschen Gesellschaft für Kardiologie in Berlin respektive Mainz. In diversen Vorträgen wurden am 24. und 25. Februar beziehungsweise am 17. und 18. März die neuesten relevanten Fachpublikationen aus dem Jahre 2022 von Experten besprochen und gewertet.
Hot Topic Kardioonkologie
Eine der drei Hot Topic Sessions war die Kardioonkologie. In einem sehr schönen Referat hat Prof. Dr. T. Rassaf aus Essen die erste ESC Leitlinie Kardioonkologie 2022 dargestellt (1, 2, 3). Die Bedeutung dieser Disziplin hat deutlich zugenommen, sind doch Herzkreislauferkrankungen und Krebsleiden die häufigsten Todesursachen in Europa, und hat die Überlebensrate nach Krebserkrankung in den letzten Jahren stark zugenommen. Ziel der neuen Guideline ist es, Therapieansätze zu personalisieren, um die Tumortherapie-bedingte kardiovaskuläre (cv) Toxizität zu minimieren und sowohl die Krebs- als auch die cv-Ergebnisse zu verbessern. Die Leitlinie bietet Hilfe für die Definition, Diagnose, Behandlung und Prävention von onkologisch bedingter cv-Toxizität und das Management von cv-Erkrankungen, die direkt oder indirekt durch Krebs verursacht werden. Durch die deutlich bessere Langzeitprognose moderner onkologischer Therapien ist es entscheidend, potentielle kardiotoxische Nebenwirkungen früh zu identifizieren und korrekt zu behandeln.
Neben den toxischen Kardiomyopathien mit Entwicklung einer Herzinsuffizienz müssen Arrhythmien und QT-Verlängerungen, arterielle und venöse Thromboembolien, Klappenvitien, Perikard-erkrankungen, koronare und arterielle Gefässerkrankungen und die Hypertonie als Folge onkologischer Therapien früh erkannt und behandelt werden.
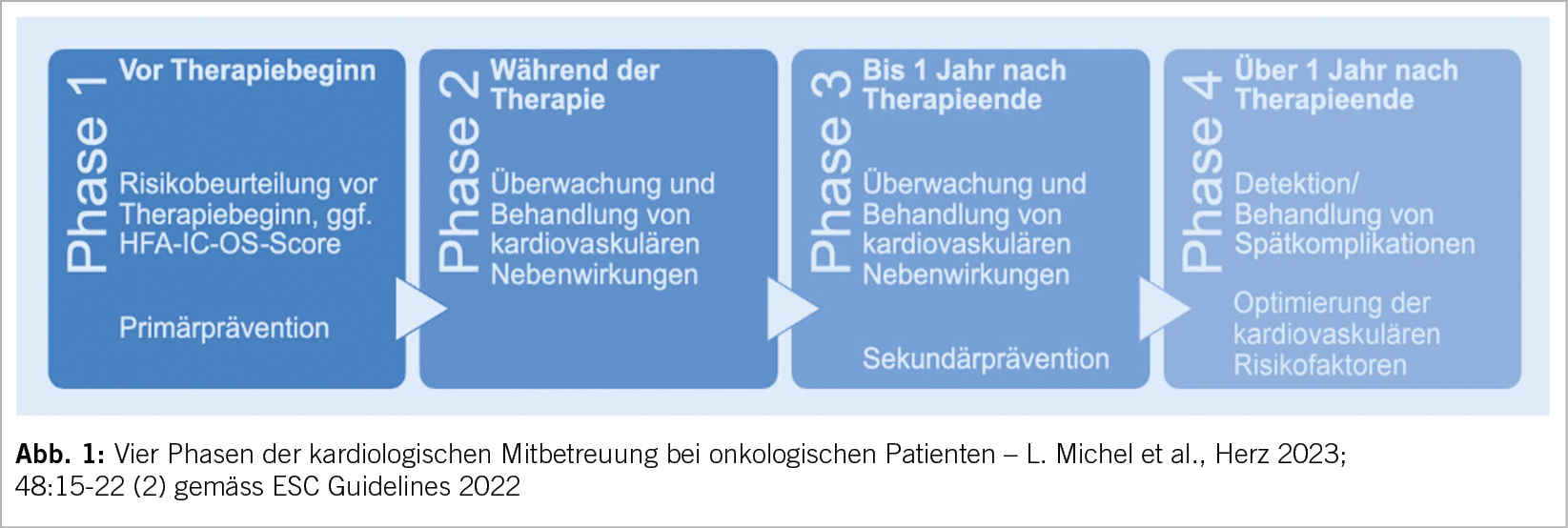
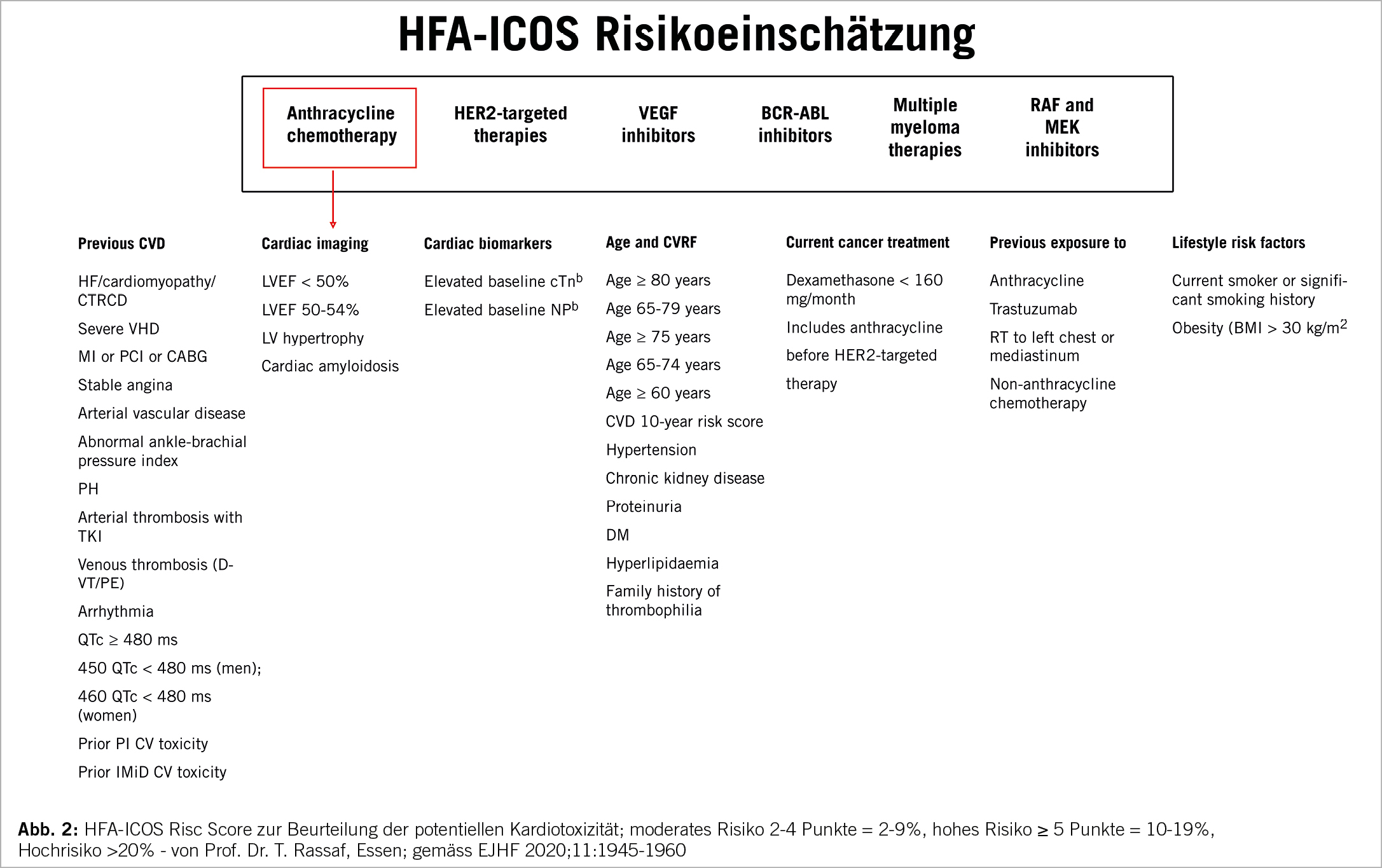
Es gibt drei resp. vier Phasen der Mitbetreuung in der Kardioonkologie (Abb. 1). In der ersten Phase vor der onkologischen Therapie bedarf es einer Standortbestimmung des individuellen Risikos. Dieses ist Patienten und Therapie assoziiert. Zur Risikoevaluation hat man den HFA-IC-OS Risc Score eingeführt (Abb. 2). Patienten können mittels guter Anamnese (inkl. kardiovaskulär und onkologisch), einer gründlichen klinischen Untersuchung, einem 12-Abl. EKG, einer Echokardiographie (2D-EF, 3D-EF, LV Vol., GLS) und Biomarkern (hs-Tn, NT-pro BNP) identifiziert und in Risikokategorien klassifiziert werden. Bei hohem resp. sehr hohem Risiko muss der Patient vor einer kardiotoxischen Krebstherapie kardiologisch beurteilt werden (Klasse I).
Während einer onkologischen Therapie bedarf es erneuter kardiologischer Kontrollen, um kardiotoxische Komplikationen rasch zu erkennen und zu behandeln. Je nach onkologischer Therapie (Anthrazykline, HER-2, ICI u.a.) gibt es sehr hilfreiche Kontroll-Tabellen. Eine Chemotherapie kann zur Freisetzung kardialer Biomarker führen. Eine Erhöhung des hs-Troponins ist mit einer LV-Dysfunktion assoziiert.
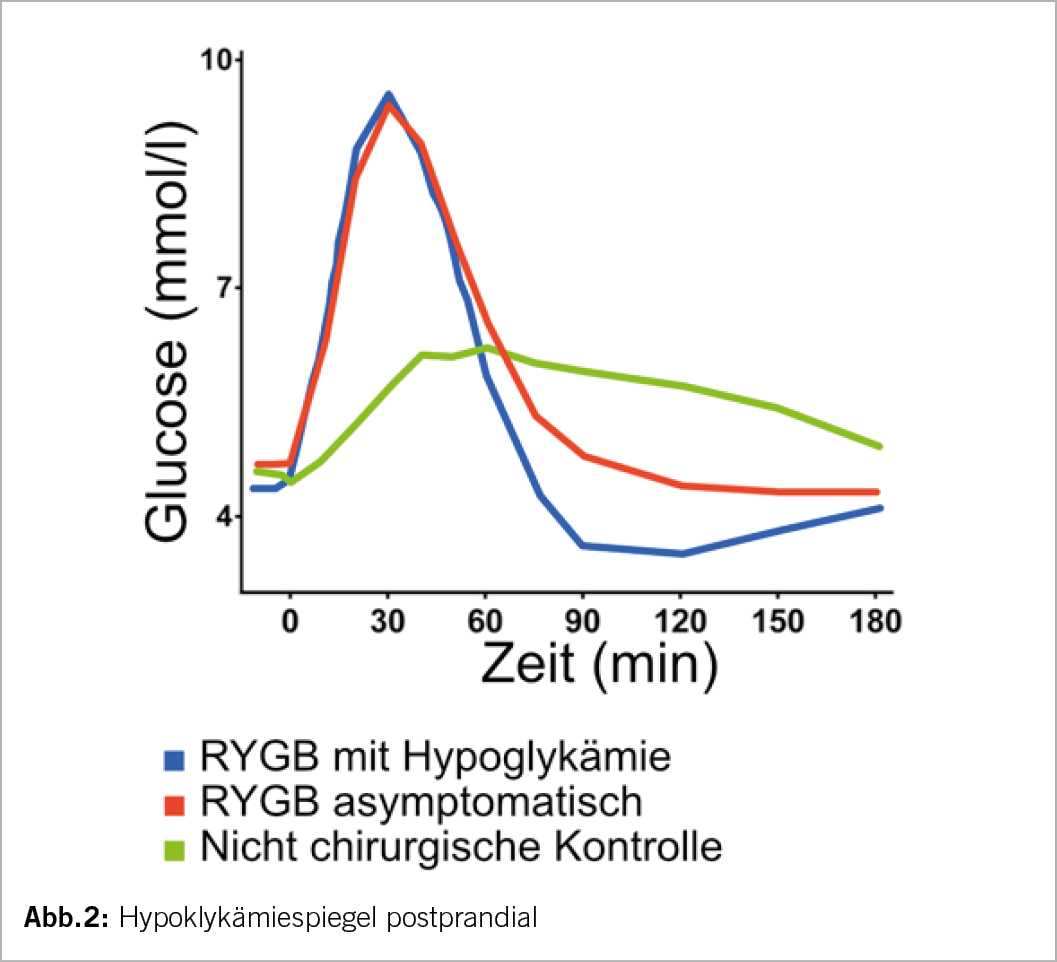
Erste Daten zum GLS (global longitudinal strain) in der Echokardiographie zeigen, dass ein isoliert reduzierter GLS vor Therapiebeginn und ein Abfall unter onkologischer Therapie von 15% mit einem erhöhten Risiko für eine spätere Kardiotoxiziät assoziiert ist. So ist eine frühzeitige Erfassung einer subklinischen LV-Dysfunktion möglich und mittels einer Therapie mit ACE-H./BB/SGLT2-H. kann ein späterer EF-Abfall verhindert werden. Diese Medikamente wirken kardioprotektiv (IIa). Es kommt auch zu einer verringerten Troponinfreisetzung.
Die modernen Immuncheckpoint-Inhibitoren (ICI), welche die Immunabwehr aktivieren und u.a. bei Lungenkrebs und Melanom eingesetzt werden, verursachen bei 9,7% der Patienten kardiale Events im 1. Jahr. 1-2% der Patienten erleiden eine autoimmun bedingte Myokarditis mit sehr unterschiedlicher Symptomatik und deutlich erhöhter Mortalität innerhalb der ersten 6 Wochen. Weitere kardiale Schädigungen sind: Perikarditis, Arrhythmien, ACS, Takotsubo, LV-Dysfunktion und eine beschleunigte Atherosklerose. Daher sind kontinuierliche, langfristige kardiologische Kontrollen notwendig. Auch andere Organsysteme sind betroffen – Haut, Colitis, Pneumonitis, Hepatitis, Nephritis, Myositis u.a.
Deshalb wird ein spezielles Monitoring (Biomarker, EKG, TTE) unter ICI-Therapie empfohlen.
Auch nach einer onkologischen Therapie muss nach einem Jahr und im Langzeitverlauf der Patient resp. die Patientin auch kardiologisch regelmässig kontrolliert werden, um potentielle kardiovaskuläre Schädigungen zu erkennen und zu behandeln. Die Häufigkeit der kardialen Kontrollen richtet sich auch hier nach dem basalen kardiovaskulären Risiko und der spezifischen onkologischen Therapie und deren Nebenwirkungen – HFA-IC-OS Risc Score. Auch bei jungen Erwachsenen, welche als Kind erfolgreich onkologisch therapiert wurden, sind regelmässige kardiologische Verlaufskontrollen sehr wichtig. Bei einer Anthrazyklin-Behandlung und einer thorakalen Bestrahlung als Kind besteht ein besonders hohes Risiko von fast 50%. Auch Jahre nach einer Bestrahlung der linken Brust bei einem Mamma-Ca oder einem thorakalen Morbus Hodgkin besteht ein erhöhtes koronares Risiko.
Eine gute, enge und andauernde Zusammenarbeit zwischen Onkologen, Kardiologen und weiteren involvierten Ärzten ist bei diesen Risiko-Patienten essentiell.
Fazit für Klinik und Praxis:
- Die onkologische Kardiologie ist ein integraler Bestandteil der Behandlung von Krebspatienten.
- Die neue ESC-Leitlinie bietet dezidierte Empfehlungen für die Diagnose und Behandlung von betroffenen Patienten.
- Komplikationen durch Krebsimmuntherapien werden die Kardioonkologie in Zukunft massgeblich beeinflussen.
- Die Stratifizierung des Toxizitätsrisikos vor Therapiebeginn ist wichtig; engmaschige Überwachung bei hohem Risiko und multidisziplinäre Diskussionen bezüglich des weiteren Managements sind entscheidend.
Literatur:
1. Lyon AR et al., 2022 ESC Guidelines on cardio-oncology entwickelt in Zusammenarbeit mit der European Hematology Association (EHA), der European Society for Therapeutic Radiology and Oncology (ESTRO) und der International Cardio-Oncology Society (IC-OS). Eur H J. 2022 doi/10.1093/eurheartj/ehac244
2. L. Michel et al., ESC -Leitlinien 2022; Onkologische Kardiologie; Herz 2023; 48:15-22
3. L. Michel, T. Rassaf, Kardiologische Langzeitfolgen nach Malignombehandlung; Cardiovasc 2022; 22(4): 50-54
Hot Topic Das perioperative Konsil
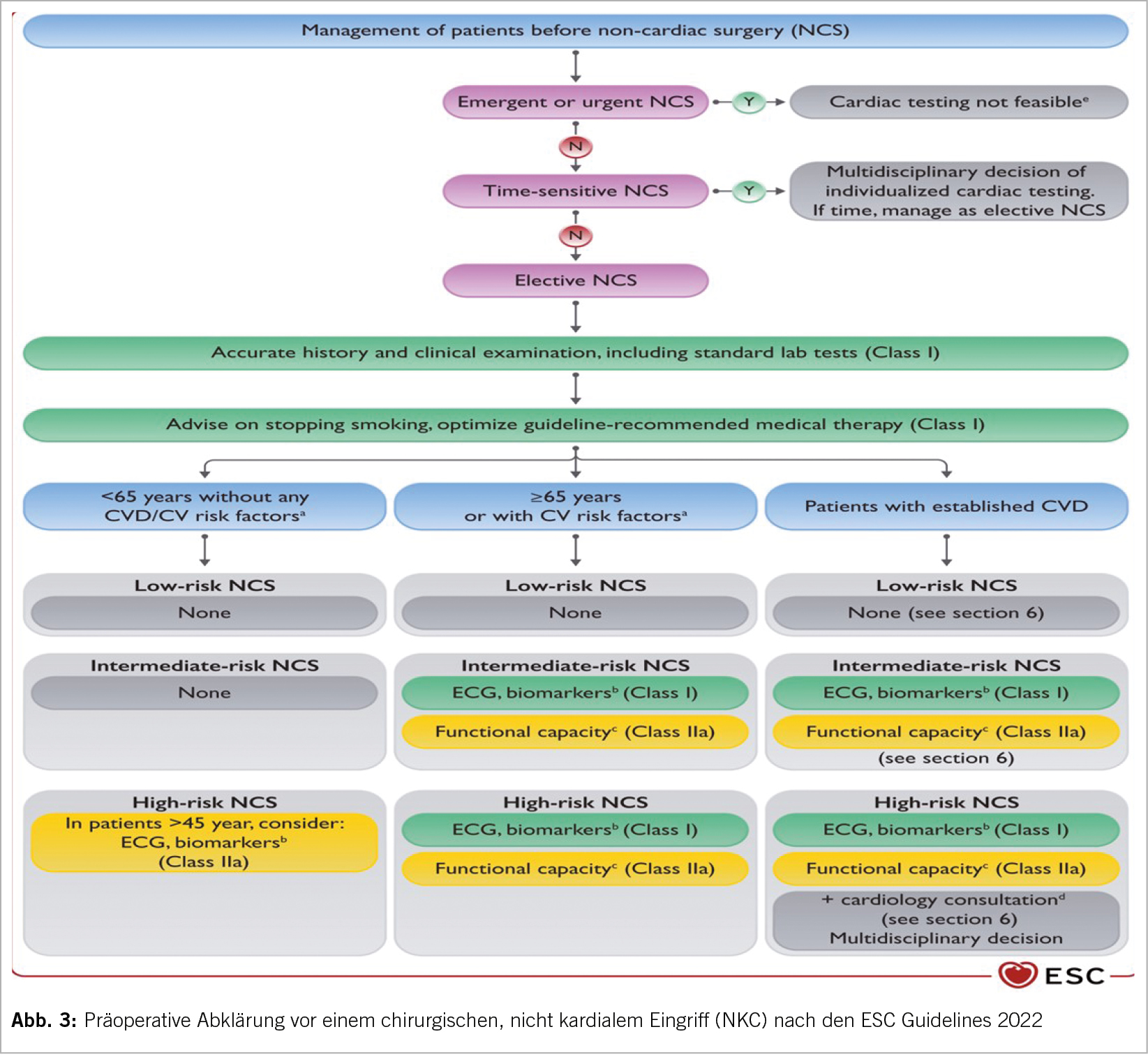
In einem weiteren Hot Topic Vortrag wurde die neue ESC-Guideline (1) über die nicht kardiale Chirurgie (NKC) von Prof. Dr. Dr. S. Schirmer aus Kaiserslauten sehr schön und umfassend dargestellt. Die neue Leitlinie hat das Ziel peri- und postoperative Komplikationen zu reduzieren und eine Verbesserung der Versorgungsqualität zu bewirken. Es wird eine schrittweise Bewertung des Patienten, die klinischen Risikofaktoren und Untersuchungsergebnisse mit der geschätzten Belastung des geplanten chirurgischen Eingriffs und den mit dem Absetzen von Medikamenten verbundenen Risiken empfohlen. Die kardiologischen Abklärungsmöglichkeiten werden klar bewertet. Ebenso die verschiedenen Risikoreduktionsstrategien und das Management der perioperativen kardiovaskulären Komplikationen. 50% der Patienten älter als 45 Jahre haben mindestens zwei kardiovaskuläre Risikofaktoren.
Ein neues und sehr wichtiges Kapitel ist der richtige Einsatz von Biomarkern (hs-CTnT/I und NT-pro-BNP) vor, während und nach einer Operation bei einer cv Erkrankung oder cv Risikopatienten. Ein perioperativer Infarkt muss rasch erkannt und richtig behandelt werden. Bei CHK- resp. PAVK-Patienten kommt es in bis zu 15% zu einem Infarkt. In solchen Situationen hs-Troponin präoperativ, nach 24 und 48 Stunden. Die Biomarker werden neben den peri- und post-operativen Komplikationen auch bei einem mittleren bis hohem Risiko und bei jüngeren Patienten mit cv Risiko bestimmt. Bei einer bekannten cv Erkrankung werden serielle Troponin Bestimmungen bei einem Intermediär- oder Hochrisikoeingriff empfohlen. Ein erhöhtes postoperatives Troponin ist mit der 30 Tage Sterblichkeit assoziiert. Dabei muss eine Anämie und ein Infarkt ausgeschlossen und eine spezifische Therapie eingeleitet werden.
Bei Risikopatienten welche nicht belastbar sind (<2 Stockwerke), wird bei einem Intermedärem- resp. Hochrisiko-Eingriff präoperativ ein Echo (TTE) gefordert, ebenso bei pos. Biomarkern oder bei einem Herz-Geräusch bei Symptomen oder einer cv Erkrankung (1,2,3).
Das präoperative Risiko bezüglich cv Morbidität und Mortalität besteht aus dem individuellen Patientenrisiko (Alter, cv Risikofaktoren, cv Erkrankungen, Komorbiditäten), dem Eingriffsrisiko (drei Gruppen) und der Dringlichkeit. Es bedarf keiner kardialen Massnahmen bei einem Niedrigrisikoeingriff (Zähne, Augen, Brust, Meniskus, TUR-Prostata u.a.) (Abb. 3). Auch nicht bei einem jüngeren gesunden Patienten (<65J.) ohne cv Risiko und einem mittleren Risikoeingriff wie z.B. einer Hüft-TP. Es bedarf nicht routinemässig einem EKG oder Biomarker bei Niedrigrisiko- Patienten oder Niedrigrisikoeingriffen. Auch keine routinemässigen TTE oder Belastungsuntersuchungen.
Ein weiterer wichtiger Abschnitt ist das richtige Vorgehen bei einer antithrombotischen Therapie. Hier gibt es sehr schöne und sehr praktische graphische Abbildungen. Da ein chirurgischer Eingriff häufig nach einer PCI, nach einem Infarkt oder einem hohen ischämischen Risiko durchgeführt werden muss, ist der Umgang mit einer dualen Thrombozytenaggregationshemmung wichtig. Auch das Blutungsrisiko des Eingriffs ist dabei zu berücksichtigen. Es gibt auch ein sehr schönes Schema zur NOAK-Pausierung gemäss EHRA. Kein bridging in niedrigem/moderatem Thromboembolierisiko.
Der neue Einsatz eines Betablockers zur Prävention eines VHFLi wird nicht empfohlen. Bei einem SGLT2-H. sollte dieser 3 Tage vor einer Operation pausiert werden. Der ACE-H./ARB sollte am Tag der Operation bei einer Hypertonie weggelassen werden, ebenso das Diuretikum. Betablocker und Statine werden belassen.
Spezifische kardiovaskuläre Erkrankungen bei einem NKC werden in der Leitlinie beleuchtet. So die Hypertonie, die koronare Herzkrankheit, die Herzinsuffizienz, die verschiedenen Vitien, Arrhythmien wie VHFLi, Devices, Gefässerkrankungen, onkologische- und VAD-Patienten. Empfehlungen zu peri- und post-operativen Komplikationen finden sich in der umfassenden Leitlinie. CHK: Bei schlecht belastbarem Patienten und Verdacht auf eine CHK resp. ausgeprägtem Risikoprofil wird vor einem Hochrisikoeingriff ein Stressimaging empfohlen (I). In Abhängigkeit von der ischämischen Myokardmasse, refraktärer Symptomatik und Koronarbefund, Myokardrevaskularisation vor NKC erwägen (IIbB).
Diese Guideline ist entscheidend; sind doch ca. 50 % aller perioperativen Todesfälle (4,2 Mio/Jahr weltweit) kardiovaskulär. Ziel ist es, diese signifikant zu vermindern und Komplikationen rasch und richtig zu behandeln. Es bedarf einer sehr guten Zusammenarbeit verschiedener involvierter Fachrichtungen.
Fazit für Klinik und Praxis:
- Präoperative Risikobeurteilung (Alter, Symptome, Anamnese, Belastbarkeit). Es bedarf dann je nach Risikopatient ein EKG, Biomarker und evt. eine TTE vor einem Eingriff mit inter-mediärem oder hohem Risiko.
- Das Risiko muss reduziert werden: Modifizierung der Risikofaktoren, Ausschluss einer Anämie, Therapie von speziellen cv Erkrankungen nach Guidelines. Einsatz oder Pause kardialer Medikamente je nach Risiko; Durchführung einer notwendigen Thromboseprophylaxe.
- Perioperative Komplikationen müssen erkannt und rasch behandelt werden – hs Troponin Anstieg, ACS, Anämie, Herzinsuffizienz und Apoplexie (3).
Literatur:
1. Halvorsen S et al, 2022 ESC Guidelines on cardiovascular assessment and management of patients undergoing non-cardiac surgery. Eur Heart J 2022;43:3826-3924.
2. Mehilli J. Winhard M., ESC Leitlinie 2022 zum kardiovaskulären Assessment und Managment von Patienten, die sich einer nicht kardiologischen Operation unterziehen; Herz 2023; 48:31-38
3. Mehilli et al., The ten commandments, EHJ 2023;44:336-337
Prävention und stabile CHK; Hypertonie und Niereninsuffizienz
Hier einige wichtige Aussagen zu den beiden Vorträgen von Prof. Dres U. Lauf aus Leipzig und F. Mahfoud aus Homburg/Saar: Kardiovaskuläre Risikofaktoren im Kindesalter erhöhen die Sterblichkeit im mittleren Lebensalter. Nach einem schwedischen Zwillingsregister korrelieren kardiometabolische Erkrankungen mit einer Demenz.
Die DANCAVAS-Studie aus Dänemark prüfte das Konzept eines kardio-vaskulären Screenings mit klinischer Untersuchung, EKG, ABI, Echo, Koronar-/Gefäss-CT ohne Kontrast bei bei 46’611 älteren Männern zwischen 65-74 Jahren. Der verstärkte Einsatz einer Statin- und Aspirin-Therapie bei Patienten mit subklinischen Herzkreislauferkrankungen
erklärt wahrscheinlich die Vorteile in der Untergruppe im Alter von 65-69 Jahren (HR 0,89). Leider fehlen Screening-Daten in der weiblichen Population und bei etwas jüngeren Personen. Insgesamt konnte aber die Sterblichkeit in der Gesamtpopulation nicht signifikant gesenkt werden. In der POST-PCI Studie aus Südkorea ergab ein routinemässiger Stresstest bei 1708 Patienten ohne Symptome (30% Ergo, Scinti, Stressecho) 1 Jahr nach der Intervention keine Verbesserung der klinischen Endpunkte nach zwei Jahren. Es kam aber zu mehr Reangiographien und mehr Revaskularisationen. Es gibt somit bisher keine überzeugenden Beweise für Screening-
Programme.
Rauchen bleibt leider immer noch der Gesundheitsrisikofaktor Nummer 1 in DL (35,5%). Das Rauchen hat leider nicht abgenommen; bei den 14-17 Jährigen hat sich der Anteil im letzten Jahr sogar auf 16% verdoppelt. Verbote funktionieren in Neuseeland. Dieser Risikofaktor sollte immer wieder angesprochen werden. E-Zigaretten sollten nicht zur Entwöhnung gebraucht werden.
Ein regelmässiges Nachsalzen ist mit einer erhöhten Sterblichkeit assoziiert.
Nahrungsergänzungsmittel wie Fischöl, Zimt, Knoblauch, gelber Ingwer (Kukuma), pflanzliche Sterole und roter Reis sind ungeeignet für eine LDL-Senkung dies im Gegensatz zur Gabe von 5 mg Rosuvastatin. Dies konnte in der SPORT-Studie gezeigt werden.
Der Goldstandard bei der schweren Adipositas bleibt die bariatrische Chirurgie mit anhaltend positiven Effekten. Es gibt keinen Wirksamkeitsbeleg für ein Intervallfasten und für eine Ernährungs-beratung. Semaglutid ist in hoher Dosis ähnlich wirksam wie eine Magenplastik. Eine Schlafrestriktion erhöht die Enegiezufuhr und die abdominelle Fettablagerung ohne Auswirkung auf den Energieverbrauch.
Beim Diabetes mellitus gibt es immer bessere Daten für die SGLT2-Hemmer und für die GLP1-RA betreffend Nephro- und Kardio-Protektion. Auch die Kombinationstherapie ergibt ein vermindertes kardiovaskuläres Risiko. Für Metformin gibt es keine Endpunktdaten.
20% der Bevölkerung haben ein erhöhtes Lpa (>125nmol/l). Dieses wirkt proinflammatorisch und möglicherweise prothrombotisch und ist ein wichtiger Risikomarker für atherosklerotische Ereignisse und für die Aortenklappenstenose. Die Wirkung ist linear ab 75nmol/l. 90% dieses Wertes ist genetisch festgelegt. Es gibt aber Faktoren, welche den Wert etwas variieren: eine Erhöhung gibt es bei einer SS, Entzündung, Hypothyreose, chron. Niereninsuffizienz und beim nephrot. Syndrom. Eine Senkung findet man bei einer Hyperthyreose, bei Östrogengabe und bei einer Lebererkrankung u.a.. Bei einer Aortenklappenstenose im frühen Alter sollte man immer das Lpa bestimmen, wie auch bei einer vorzeitigen und rasch progredienten Atherosklerose. In Zukunft wird es spezifische RNA basierte Therapien geben. Die ESC empfiehlt Lpa einmal im Leben zu bestimmen – dabei sollten die erwähnten Variationsfaktoren beachtet werden. «Lipoprotein(a) erklärt häufig ein residuales lipidbezogenes Risiko bei Personen mit niedrigem oder nur moderat erhöhtem LDL-Cholesterin. Die aktuelle Therapie besteht in der Behandlung aller kardiovaskulären Risikofaktoren und einer Senkung des lipid-bezogenen Risikos durch eine optimale LDL-Senkung».
Lipidtherapie: Drei Studien mit IVUS und OCT haben mit einem Statin und PCSK9 -H. gezeigt, dass ein LDL <1,0mmol/l zu einer Plaque-Stabilisierung führt. Für Fibrate gibt es erneut keinen Wirksamkeitsbeleg. Bei der Bempedoinsäure ist die Endpunktstudie CLEAR-Outcomes positiv. Die Bempedoinsäure verursacht als Prodrug, welches in der Leber in die aktive Form überführt wird, keine Muskelbeschwerden. Bei fast 14’000 Statin intoleranten Patientinnen und Patienten mit einem LDL >2,6mmol/l und einer cv Vorerkrankung oder einem hohen cv Risiko war die Behandlung mit einem geringeren Risiko von -13% im Vergleich zu Placebo für schwerwiegende unerwünschte kardiovaskuläre Ereignisse (Tod durch cv Ursachen, nicht tödlicher Myokardinfarkt, nicht tödlicher Schlaganfall oder koronare Revaskularisation) verbunden. Das LDL wurde nach 6 Monaten um 21%, das hs-CRP um 22% gesenkt. Als NW ist ein Anstieg der Harnsäure mit Gichtanfällen, ein Anstieg von Kreatinin, Leberenzymen und mehr Gallensteine zu beobachten. Wir haben somit bei einer wirklichen Statinintoleranz, cave Nocebo-Effekt, einen alternativen Behandlungsansatz. Eine Kombination mit Ezetrol wird von Experten empfohlen mit einer LDL-Senkung von 45%.
Die Bedeutung der Grippeimpfung wurde in der IAMI- Studie nochmals klar dargelegt. Bei Patienten mit einem Myokardinfarkt in der Grippesaison wurde innert 72 Stunden geimpften Patienten die Sterblichkeit, der Reinfarkt und die Stentthrombose um 41% deutlich gesenkt.
Zum Thema Hypertonie: Die Fixkombinationen sollten heute Standard sein – bessere Adhärenz, stärkere BD-Senkung durch frühe Kombination und weniger Nebenwirkungen. Leider wurden diese 2020 in DL nur in 11 % der Fälle eingesetzt. Zu beachten ist, dass Paracetamol den BD um ca. 5mmHg systolisch erhöht und mit einer schlechten Prognose assoziiert ist. Vor allem in verschiedenen Brausetabletten und OC-Medikamenten, welche frei erhältlich sind, hat es viel Natrium, welches diese negativen Effekte hat. In einer aktuellen Studie konnte kein Unterschied von HCT und Chlorthalidon auf kardiovaskuläre Endpunkte nachgewiesen werden. Somit sind die beiden Diuretika vergleichbar und gut für Fixkombinationen. Die Fototoxizität sollte bei HCT nur bei massiver Sonnenexposition und Gabe von Amiodaron beachtet werden. Die nächtliche Gabe von Antihypertensiva war der morgendlichen Gabe nicht überlegen aber auch nicht schädlich (TIME Studie). Cave Adhärenz bei abendlicher Einnahme.
In der Schwangerschaft sollte auch eine milde Hypertonie (140-159/90-109mmHg) behandelt werden. Als Medikamente kommen in Frage: Metoprolol, Labetalol, Nifedipin und Alpha-Methyl-Dopa. Cave ACEH/ARB – diese sollten schon vor der SS abgesetzt werden.
Zum Thema Niereninsuffizienz: Empagliflozin reduziert bei CKD das Risiko für einen Erkrankungsprogress und kardiovaskuläre Todesfälle in der EMPA-Kidney Studie um 28% über 2,5 Jahre. In einer grossen Metaanalyse von 13 Studien bei 90’409 Patienten konnte die Progression der Niereninsuffizienz um 37%, der cv Tod und die HI Hospitalisation um 23% gesenkt werden. Der cv Tod um 14%., das akute Nierenversagen um 23%. Dies mit oder ohne Diabetes mellitus. Die Genese der NI hat keinen Einfluss auf den protektiven Effekt. Eine Etablierung einer Therapie mit einem ACE-H./ARB und einem SGLT2-H. bei CKD führt zu einer Lebenszeitverlängerung von 7,4 Jahren. ACE-H./ARB können auch bei einer chron. Niereninsuffizienz im Stadium IV/V weitergegeben werden. Die nephroprotektiven Effekte von Dapagliflozin und Eplerenon sind additiv.
Literatur: auf Anfrage
Dr. med. Urs N. Dürst
Zelglistrasse 17
8127 Forch
u.n.duerst@ggaweb.ch