Übergewicht und Adipositas stellen eine der grössten globalen Herausforderungen für das Gesundheitssystem unserer Zeit dar (1-4). Gemäss den neuesten Zahlen des WHO European Regional Obesity Reports 2022 sind bereits jetzt fast 60% aller Erwachsenen und 1/3 aller Kinder in Europa von Übergewicht oder Adipositas betroffen (5) – und die Zahlen in Europa und weltweit sind weiter steigend. Adipositas ist ein Hauptrisikofaktor für zahlreiche Erkrankungen wie Herz-Kreislauf-Erkrankungen, Diabetes mellitus Typ2 und verschiedenste Krebserkrankungen und ist mit einer erhöhten Sterblichkeit assoziiert (6, 7). Für eine erfolgreiche Behandlung ist es wichtig, zu verstehen, dass es sich bei Adipositas um eine Erkrankung handelt und dass Menschen mit Adipositas eine spezifische, massgeschneiderte Therapie benötigen.
Obesity, represents a global socioeconomic health burden with epidemic dimensions worldwide (1-4). According to the WHO European Regional Obesity Reports 2022, already now 60% or adults and 1/3 of all children are affected in Europe (5) – and the numbers keep increasing in Europe and worldwide. Obesity is a major risk factor for multiple comorbidities such as type 2 diabetes, cardiovascular disease and cancer and is associated with an increased overall mortality (6, 7). To successfully fight this epidemic now and in the future, it is important to understand that obesity is a disease and that people with obesity need a specific, tailored treatment.
Key Words: obesity, GLP-1 analogues, stigmatization, tailored treatment
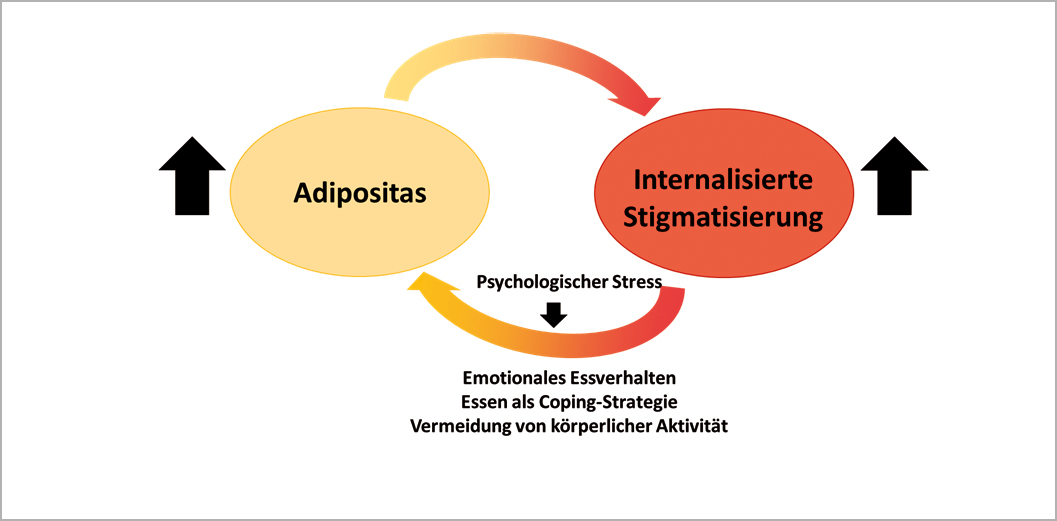
Dramatischerweise ist noch immer der Irrglaube weit verbreitet, dass Übergewicht und Adipositas eine Folge unzureichender Willensanstrengung seien und dass sich betroffene Menschen «einfach mehr anstrengen, weniger Essen und mehr bewegen sollten». Dies hat zur Folge, dass Menschen mit Adipositas nicht nur im gesellschaftlichen Rahmen sondern auch und gerade im Gesundheitssektor eine massive Stigmatisierung erfahren, die, zunächst externer Natur, über die Zeit internalisiert wird. So machen sich Menschen mit Adipositas sehr häufig grosse Selbstvorwürfe in Hinblick auf die eigene Gewichtsentwicklung und werten sich selbst ab. Dies kann in eine gefährliche Spirale münden, die sowohl Folge als auch Ursache der Adipositas ist und wodurch emotionales Essverhalten, Essen als Coping-Strategie und eine Vermeidung der Exposition durch körperliche Aktivität gefördert werden aufgrund einer Zunahme von psychologischen Stressfaktoren (Abb. 1).
Gerade die Stigmatisierung im Gesundheitssektor und durch behandelnde Ärzte, welche in einer grossen multinationalen, multizentrischen Studie von fast 70% der Befragten mindestens einmalig erlebt wurde (12), kann schwerwiegende Folgen haben wie eine vollständige Abwendung vom Gesundheitssystem, Substanzmissbrauch und eine erhöhte Suizidalität (12-14).
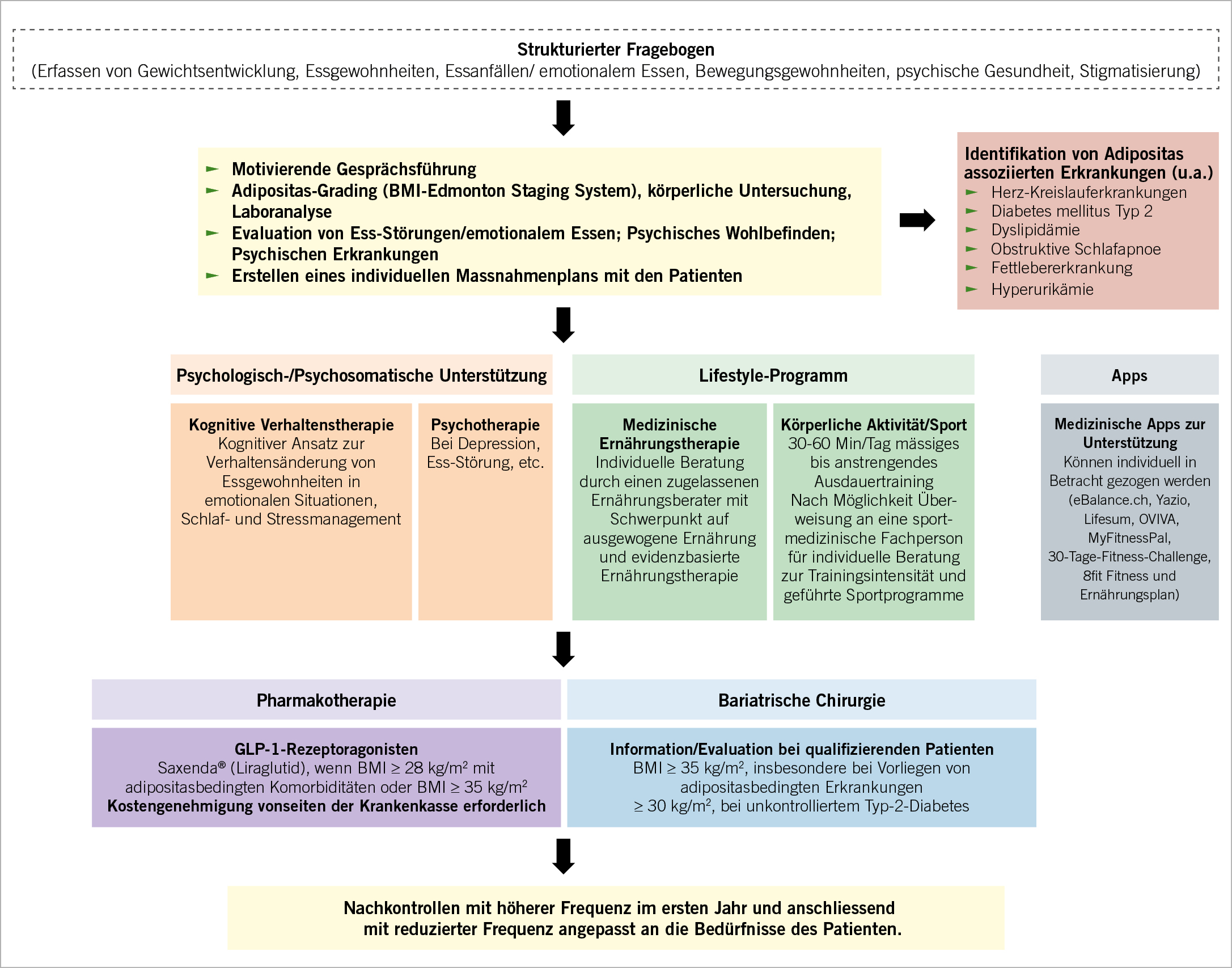
Diagnose und Pathogenese
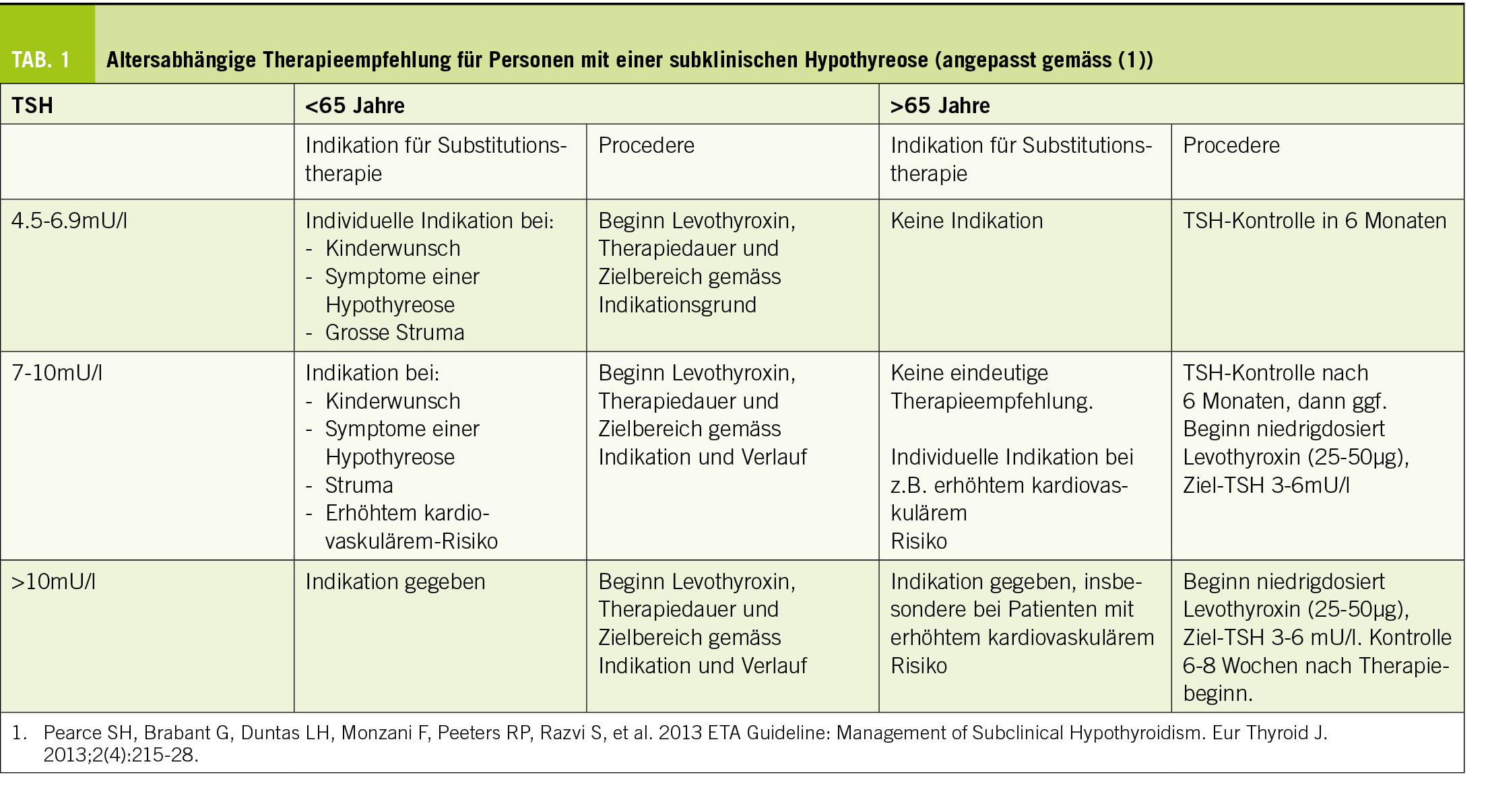
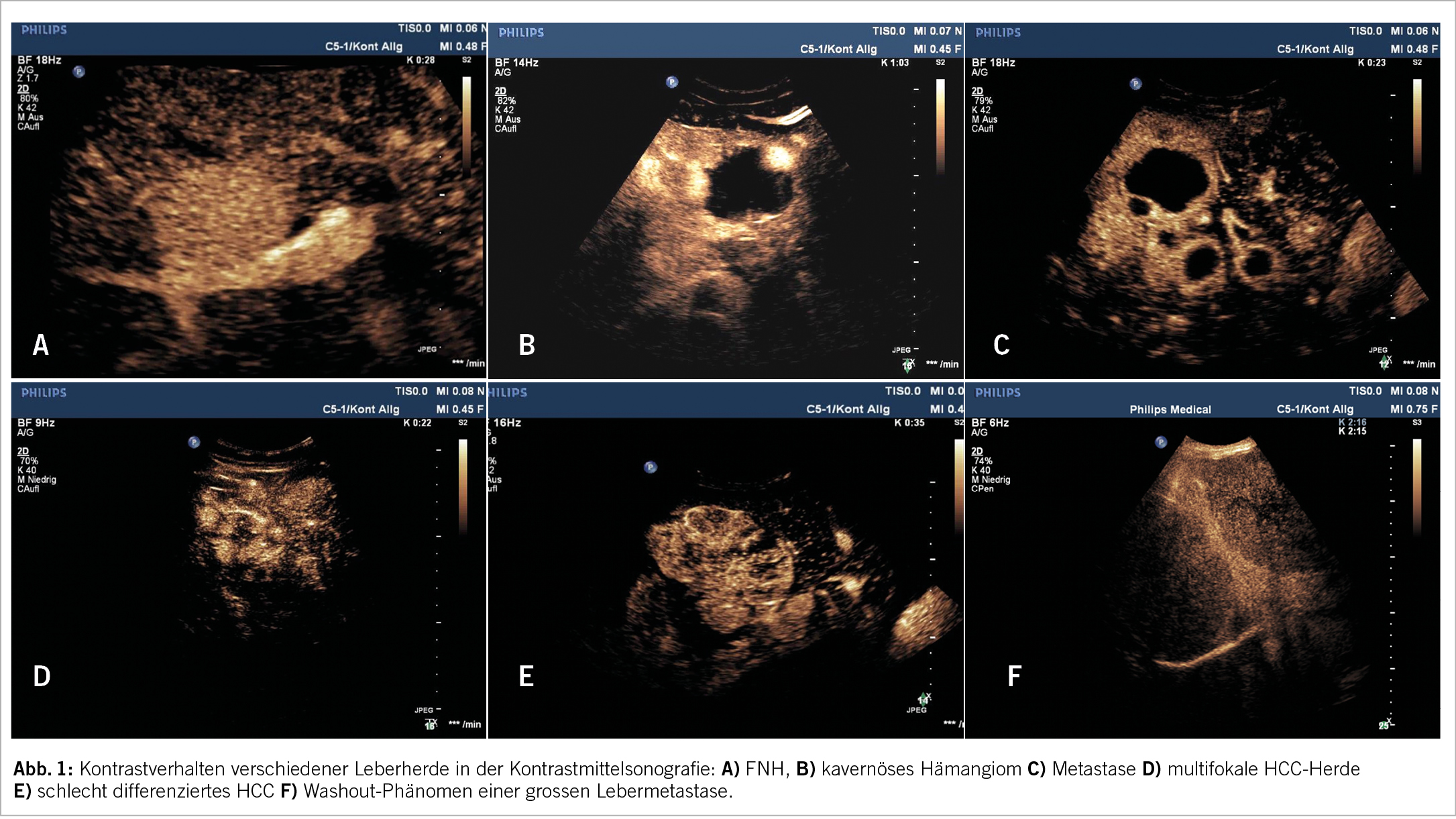
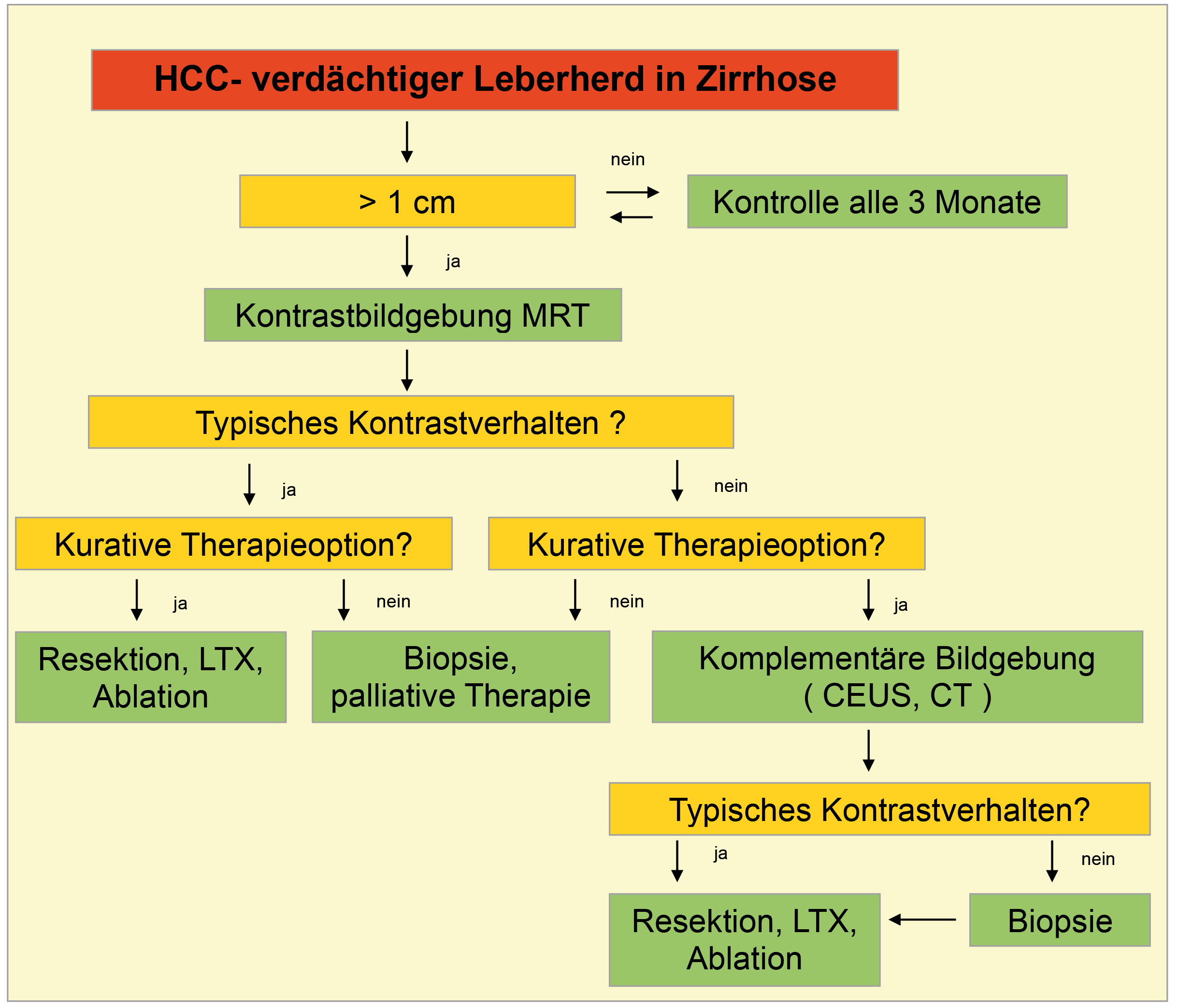
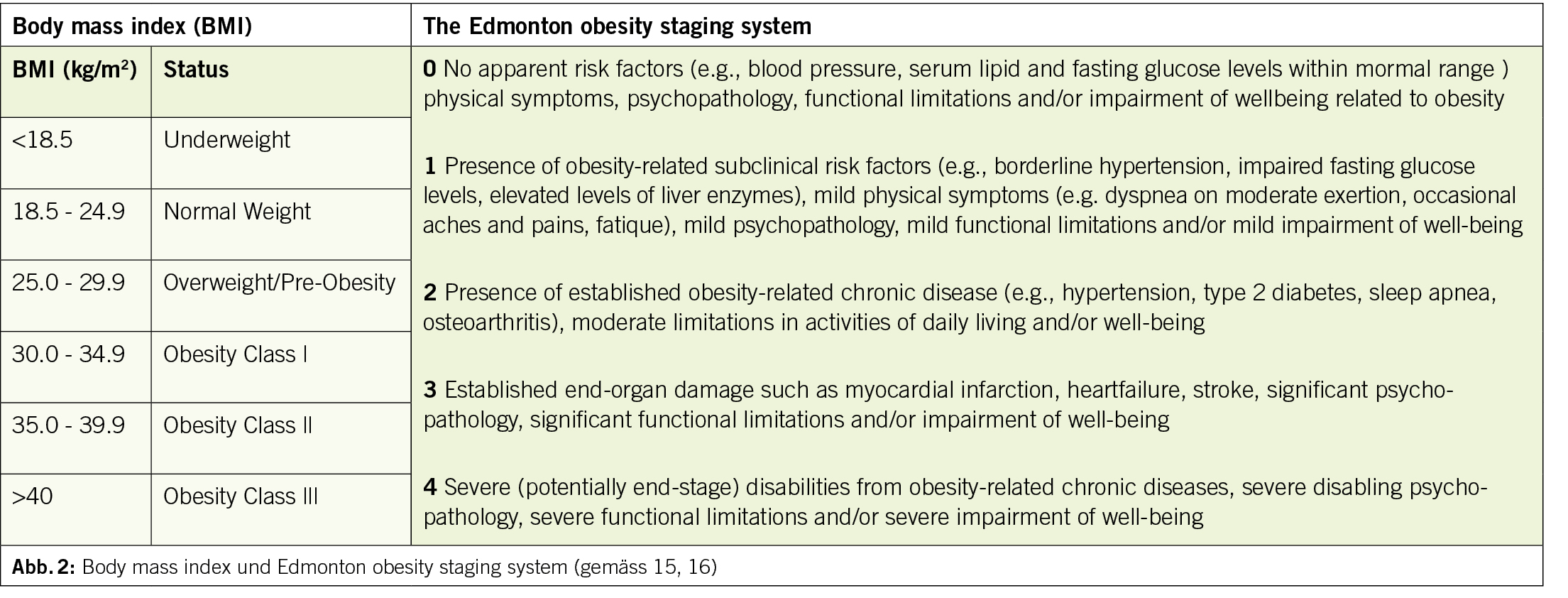
Übergewicht und Adipositas werden weithin gemäss dem sogenannten Body Mass Index (BMI, kg/m2) klassifiziert, wobei es sich hierbei nur um eine sehr grobe Einteilung handelt, welche durch die zusätzliche Anwendung des «Edmonton obesity staging systems», das den Folgeerkrankungen der Adipositas Rechnung trägt, sinnvoll ergänzt wird (Abb. 2).
Bei Adipositas handelt es sich um eine multifaktorielle Erkrankung, bei der (epi)genetische, (neuro)biologische und äussere Faktoren, sogenannte «Lifestyle»-Faktoren, eine Rolle spielen. Eine entscheidende Rolle kommt hierbei den veränderten neurobiologischen Prozessen zu, da das Gehirn in weitestgehend autonomer Weise vorgibt, was, wann und wie wir essen und wie unsere Stoffwechselprozesse ablaufen. Diese Prozesse sind analog zu vielen anderen Prozessen im menschlichen Körper nur sehr marginal willentlich beeinflussbar. D.h., der Patient mit Adipositas ist nicht übergewichtig, weil er zu viel isst, er isst zu viel, weil er an Adipositas erkrankt ist!
Adipositas-Therapie mit GLP-1 Analoga
Noch immer sind eine angepasste, ausgewogene Ernährung und ein Ausbau der körperlichen Aktivität Grundpfeiler der Adipositas-Therapie. Aber: Adipositas muss vor allem dort behandelt werden, wo sie entsteht, und zwar auf neurobiologischer Ebene. Mit den GLP-1 Analoga haben wir erstmals in der Geschichte der
Adipositas-Therapie Medikamente zur Verfügung, mit denen wir Adipositas gezielt therapieren können bei guter Verträglichkeit und akzeptablem Nebenwirkungsprofil. GLP-1 Analoga bewirken auf Ebene des Gehirns eine Verstärkung des Sättigungsgefühls und eine Verringerung des Hungergefühls, so dass es zu einer Reduktion der Nahrungsaufnahme kommt. In Studien konnte eine mittlere Abnahme des Körpergewichts um 10% vom Ausgangsgewicht gezeigt werden (17, 18). Die individuellen Effekte können aber stärker und schwächer ausfallen.
Patienten unter Therapie mit GLP-1 Analoga berichten vor allem, dass sie schneller satt sind, nur noch kleinere Portionen essen möchten bzw. können. Viele Patienten berichten, insgesamt eine grosse Entspannung zu erleben, weil sie nicht mehr so viel Energie darauf verwenden müssen «um das Essen herumzukommen». Neben der Gewichtsreduktion hat die Therapie mit GLP-1 Analoga andere positive Wirkungen auf Stoffwechselprozesse z.B. auf Ebene der Leber und positive Effekte auf das Herzkreislaufsystem.
In der Schweiz ist das GLP-1 Analogon Liraglutid (Saxenda®) für die Therapie von Adipositas zugelassen. Die Kosten für eine Therapie mit dem GLP-1 Analogon Liraglutid (Saxenda®) werden in der Schweiz seit dem 01.04.2020 unter bestimmten Voraussetzungen von der Krankenkasse übernommen. Wichtig zu wissen ist, dass dieses Medikament ausschliesslich durch Fachärzte FMH Endokrinologie/Diabetologie oder Adipositas-Spezialisten
(gemäss Liste BAG) verordnet werden darf. D.h., Patienten müssen den jeweiligen Spezialisten für eine Therapie zugewiesen werden.
Voraussetzungen für eine Kostenübernahme für die Behandlung mit dem GLP-1 Analogon Saxenda® (Liraglutid) sind:
- BMI ≥ 28kg/m2 mit Gewichts-bedingten Begleiterkrankungen (Prädiabetes, Diabetes mellitus Typ 2, Dyslipidämie, Arterielle Hypertonie ODER BMI ≥ 35kg/m2 (unabhängig von Begleiterkrankungen)
- Dokumentierte Einhaltung einer 500kcal/d Defizit-Diät.
- Belegte Steigerung der körperlichen Aktivität, z.B. durch Schrittzähler.
- Erfolgskontrolle und Entscheid bezüglich weiterer Übernahme der Kosten nach 4 Monaten und nachfolgend jeweils alle
6 Monate - Kostenübernahme für maximal 3 Jahre
Liraglutid (Saxenda®) muss täglich durch den Patienten subkutan appliziert werden. Die Injektion ist einfach und erfolgt mittels eines Pens. Dennoch ist es wichtig, den Patienten hinsichtlich der richtigen Injektionstechnik gut zu instruieren. Ebenso wichtig ist es, mit einer niedrigen Dosis (0.6mg/Tag) zu beginnen und die Dosis nur langsam, in wöchentlichen Abständen bis zu einer Maximaldosis von 3mg/Tag zu steigern, um dem Körper die Möglichkeit zu geben, sich langsam an das Präparat zu gewöhnen. So können mögliche Nebenwirkungen wie Übelkeit und sehr selten Erbrechen minimiert oder ganz vermieden werden. Weitere mögliche Nebenwirkungen sind Diarrhö oder Obstipation. Ebenso wie das Therapieansprechen ist auch das Auftreten von Nebenwirkungen von Patient zu Patient sehr verschieden.
Neben der Therapie mit GLP-1 Analoga stellt die bariatrische Chirurgie für ausgewählte Patienten eine sehr effektive und sichere Methode dar, das Gewicht zu senken und Adipositas-assoziierte Begleiterkrankungen zu behandeln oder vollständig zu heilen.
Egal bei welcher Therapieform gilt: der Patient muss im Zentrum der Behandlung stehen und für jeden Patienten muss ein individuelles, massgeschneidertes Vorgehen gefunden werden. Für eine erfolgreiche Adipositas-Therapie gilt viel mehr «state oft the heart» als «state oft the art»: der Patient muss spüren, dass er an einem Ort ist, an dem er mit seinen individuellen Bedürfnissen und Wünschen gesehen und mit seiner Lebenswirklichkeit wahrgenommen wird.
Klinik für Endokrinologie, Diabetologie und Metabolismus
Universitätsspital Basel
Petersgraben/Spitalstrasse 21
4031 Basel
Die Autorin hat keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
Literatur:
1. WHO Fact sheet 311 uA. Obesity an overweight. 2014 (accessed 30. October 2014).
2. Collaboration NCDRF. Trends in adult body-mass index in 200 countries from 1975 to 2014: a pooled analysis of 1698 population-based measurement studies with 19.2 million participants. Lancet 2016; 387(10026): 1377-96.
3. Collaboration NCDRF. Worldwide trends in body-mass index, underweight,
overweight, and obesity from 1975 to 2016: a pooled analysis of 2416 population-based measurement studies in 128.9 million children, adolescents, and adults. Lancet 2017; 390(10113): 2627-42.
4. Bluher M. Obesity: global epidemiology and pathogenesis. Nat Rev Endocrinol 2019; 15(5): 288-98.
5. https://apps.who.int/iris/bitstream/handle/10665/353747/9789289057738-eng.pdf.
6. Malik VS, Willett WC, Hu FB. Global obesity: trends, risk factors and policy
implications. Nat Rev Endocrinol 2013; 9(1): 13-27.
7. Kivimaki M, Luukkonen R, Batty GD, et al. Body mass index and risk of dementia:
Analysis of individual-level data from 1.3 million individuals. Alzheimers Dement 2018; 14(5): 601-9.
8. Puhl RM, Brownell KD. Confronting and coping with weight stigma: an investigation of overweight and obese adults. Obesity (Silver Spring) 2006; 14(10): 1802-15.
9. Himmelstein MS, Puhl RM, Quinn DM. Intersectionality: An Understudied Framework for Addressing Weight Stigma. Am J Prev Med 2017; 53(4): 421-31.
10. Pearl RL, Puhl RM. Weight bias internalization and health: a systematic review. Obes Rev 2018; 19(8): 1141-63.
11. Himmelstein MS, Puhl RM, Pearl RL, Pinto AM, Foster GD. Coping with Weight Stigma Among Adults in a Commercial Weight Management Sample. Int J Behav Med 2020; 27(5): 576-90.
12. Puhl RM, Lessard LM, Himmelstein MS, Foster GD. The roles of experienced and internalized weight stigma in healthcare experiences: Perspectives of adults engaged in weight management across six countries. PLoS One 2021; 16(6): e0251566.
13. Albury C, Strain WD, Brocq SL, et al. The importance of language in engagement between health-care professionals and people living with obesity: a joint consensus statement. Lancet Diabetes Endocrinol 2020; 8(5): 447-55.
14. Puhl RM, Phelan SM, Nadglowski J, Kyle TK. Overcoming Weight Bias in the Management of Patients With Diabetes and Obesity. Clin Diabetes 2016; 34(1): 44-50.
15. https://www.euro.who.int/en/health-topics/disease-prevention/nutrition/
a-healthy-lifestyle/body-mass-index-bmi.
16. Padwal RS, Pajewski NM, Allison DB, Sharma AM. Using the Edmonton obesity staging system to predict mortality in a population-representative cohort of
people with overweight and obesity. CMAJ 2011; 183(14): E1059-66.
17. Fujioka K, O’Neil PM, Davies M, et al. Early Weight Loss with Liraglutide 3.0 mg Predicts 1-Year Weight Loss and is Associated with Improvements in Clinical Markers. Obesity (Silver Spring) 2016; 24(11): 2278-88.
18. le Roux CW, Astrup A, Fujioka K, et al. 3 years of liraglutide versus placebo for type 2 diabetes risk reduction and weight management in individuals with prediabetes: a randomised, double-blind trial. Lancet 2017; 389(10077): 1399-409.