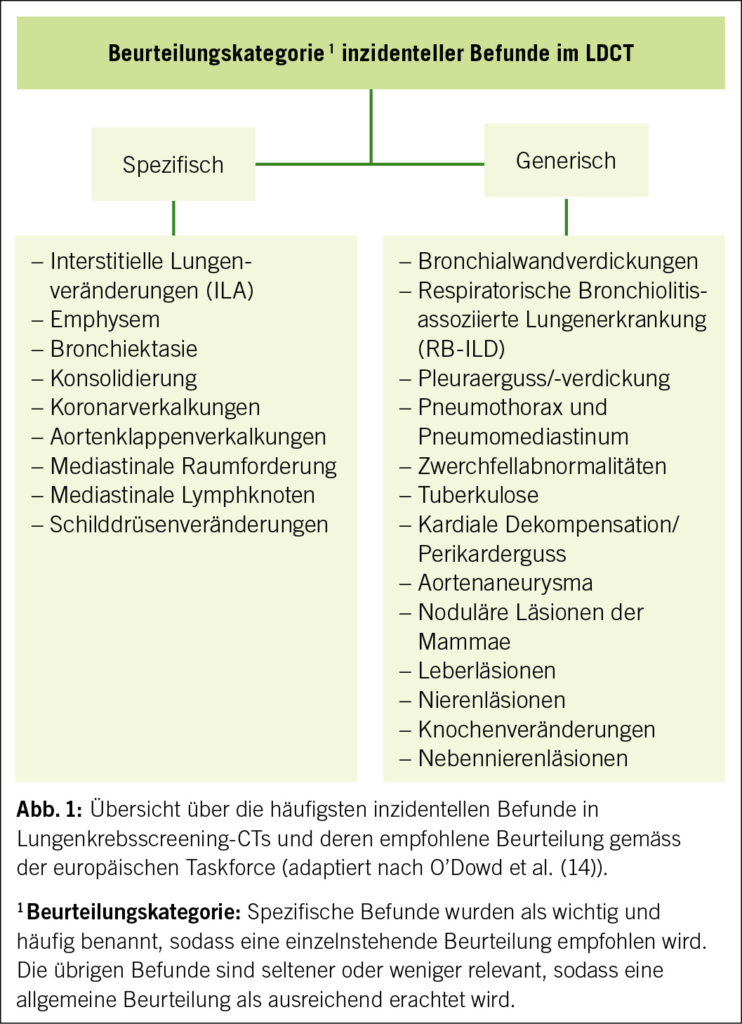
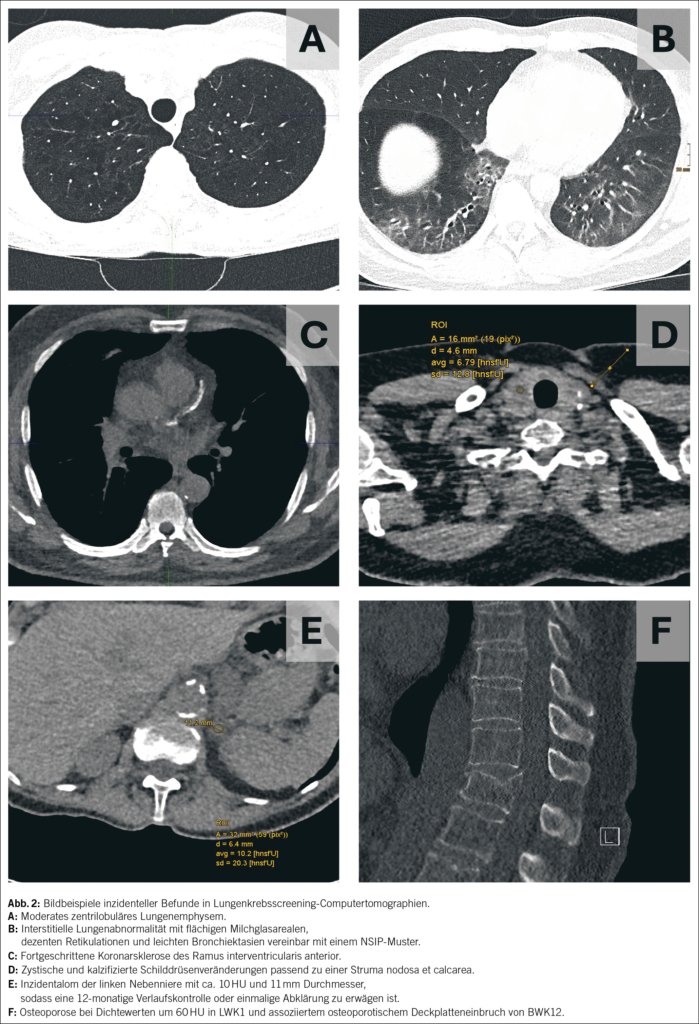
Die Harnentleerungsstörung bei der Frau steht selten im Fokus der Gynäkologie. Die chronische Harnretention bei der Frau umfasst asymptomatische Formen, stark symptomatische Formen bis zu Störungen, die mittelfristig zu einer lebensbedrohlichen Nieren-Insuffizienz führen können. Es macht also durchaus Sinn, die zugrundeliegenden Krankheiten zu kennen und sich für die chronische Harnretention bei der Frau (CUR-chronic urinary retention) eine Systematik anzueignen.
Urinary retention in women is rarely in the gynaecologist’s focus. Chronic urinary retention (CUR) in women includes asymptomatic forms, highly symptomatic forms, and disorders that can lead to life-threatening renal failure. It is therefore useful to be aware of the underlying diseases and to adopt a systematic approach to chronic urinary retention in women.
Key Words: chronic urinary retention (CUR), underactive bladder (UB), underactive detrusor (UD), bladder outlet obstruction (BOO), detrusor-sphincter-dyssynergia (DSD)
Bei Frauen sind die Entleerungsstörungen wesentlich seltener als beim Mann. Definiert ist die chronische Urinretention durch die unvollständige Blasenentleerung und durch das Vorliegen von Resturin bei wiederholter Messung (post voiding residual – PVR).
Bei der Frau fokussieren wir uns auf die Abklärung einer Inkontinenz und versuchen zwischen Urge und Stress zu unterscheiden. Dabei vergessen wir gerne, dass auch bei der Frau eine Retention möglich ist.
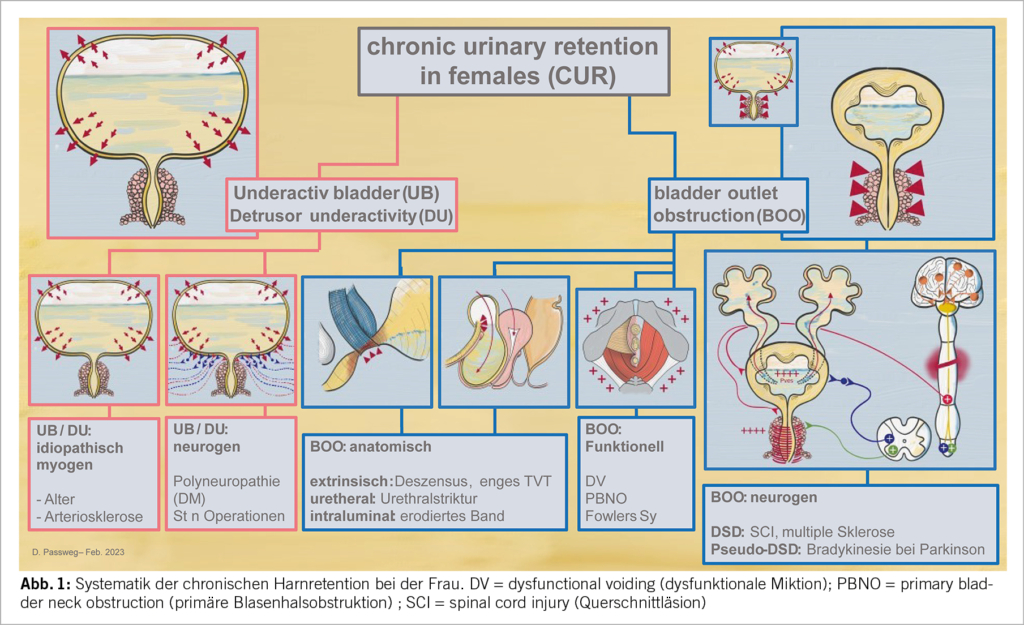
Prinzipiell kann man zwischen einer Retention auf Grund einer Detrusormuskelschwäche (detrusor underactivity DU) oder auf Grund einer Obstruktion (infravesikales Hindernis) (bladder outlet obstruction BOO) unterscheiden. Weiter kann man jeweils in neurologisch bedingte und nicht neurologisch bedingte Harnentleerungsstörungen (dysfunctional voiding) unterteilen.
Die möglichen therapeutischen Antworten auf eine chronische Harnretention sind, wenn überhaupt möglich, relativ einfach und uniform – dennoch macht es Sinn, sich durch die Ursachen und durch die Physiopathologie zu denken (Abb. 1). Beim hypo- oder akontraktilen Detrusor gelingt es kaum, die Kontraktilität der Blase wiederherzustellen und man muss sich bei symptomatischen Formen meist damit begnügen, eine Strategie für die Entleerung zu finden, während man bei der BOO die Ursache zwischen funktionell und mechanisch erkennen und bei Vorliegen eines infravesikalen Hindernis beseitigen muss.
Symptome
Irritative Miktionsbeschwerden wie Urgency und Urgeinkontinenz definieren die (idiopathische) überaktive Blase (overactive bladder (OAB)). Eine Urininkontinenz, welche durch eine Urethralinsuffizienz bei erhöhtem intravesikalem oder intraabdominalem Druck auftritt, definiert die Belastungsinkontinenz (stress urinary incontinence (SUI)). Symptome wie der abgeschwächte Harnstrahl, das Gefühl der unvollständigen Blasenentleerung, der verzögerte Start der Miktion, die lang dauernde Miktion, die mehrzeitige (Stakkato-) Miktion oder das Nachtröpfeln treten bei chronischer Harnretention auf. Diese Symptome können sowohl durch eine infravesikale Obstruktion wie auch durch eine Detrusorschwäche resp. eine dysfunktionale Miktion verursacht sein und sind diesbezüglich nicht spezifisch. Symptome wie Pollakisurie, Nykturie, Stressinkontinenz oder
Dauerinkontinenz bzw. Überlaufinkontinenz (typisch) teilen sich die Blasenentleerungsstörung mit den funktionell «gegenteiligen» Krankheitsbildern wie der OAB oder der SUI. Die Anamnese kann einen hier fehlleiten. Auch beklagen sich Frauen mit Harnretention seltener darüber und man tut gut daran, bei Patientinnen mit urogynäkologischen Problemen die Symptome der Entleerungsstörung mindesten einmal spezifisch abzufragen. Die chronische Harnretention kann auch asymptomatisch sein.
Abklärung
Formal ist die Diagnose an eine vollständige Urodynamik mit Zystoskopie gebunden, die auch die Miktionsphase mit Elekromyogramm (EMG) und eine Videourodynamik beinhalten kann, um in Druckflusskurven bei der BOO den reduzierten Flow bei erhöhtem Detrusordruck während der Miktion zu demonstrieren, das Verhalten der Beckenbodenmuskulatur während der Miktion zu zeigen und um Stenosen oder Reflux und Öffnen des Blasenhalses darzustellen. Umgekehrt erkennt man bei der UB die fehlenden Detrusorkontraktionen und den dadurch reduzierten Flow oder die reine Pressmiktion.
Allerdings untersucht man ein meist älteres Kollektiv, das ohnehin schon Probleme mit Wasserlösen hat. Die Messung der Miktion mit einem liegenden Katheter in der Urethra in unphysiologischer Position «en public» ist dadurch fehleranfällig oder gar unmöglich.
Einfache klinische Untersuchungen wie der gynäkologische Status zur Beurteilung eines Genitaldeszensus (POP-Q, Quetschhahn, kinking?), die Urethrakalibrierung mit Bougies oder Hegarstiften (Urethralstenose?), die freie Uroflowmetrie (Beurteilung des Flows ohne zwischen einer Detrusorschwäche und einem erhöhten Auslasswiderstand unterscheiden zu können) und die vaginale/perineale und abdominale Sonographie (Sanduhrzystocele, Blasenkapazität, Resturinbestimmung, Urethraldivertikel, Veränderung des urethrovesikalen Winkels beim Pressen, Fremdmaterial, Beurteilung der oberen ableitenden Harnwege) werden einem Kollektiv mit neurologischen Störungen natürlich nie gerecht, der durchschnittlichen gynäkologischen oder geriatrischen Patientin in der Praxis aber schon.
Behandlung
Sehr wichtig und als erstes zu indizieren, ist eine Physiotherapie mit Beckenbodenrelaxation und Biofeedback.
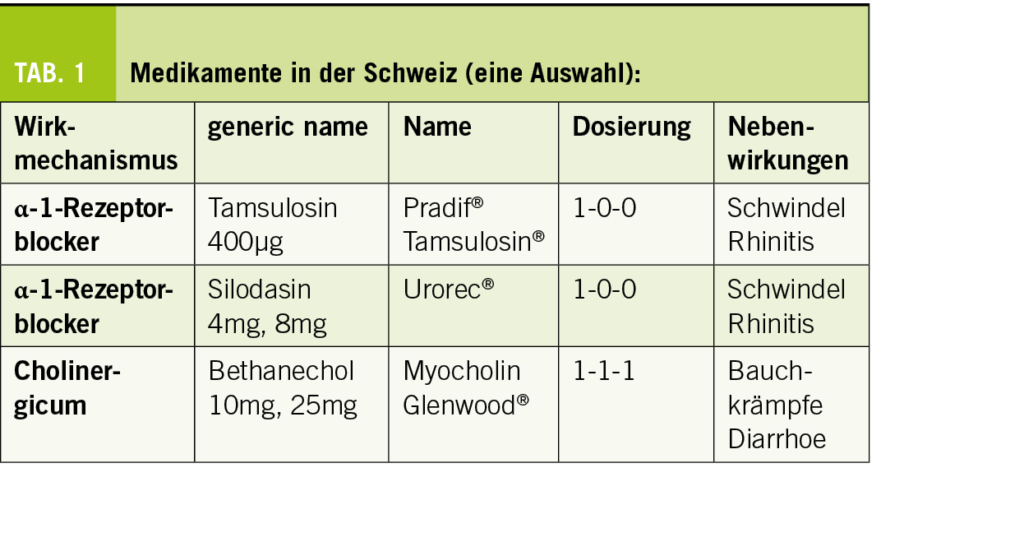
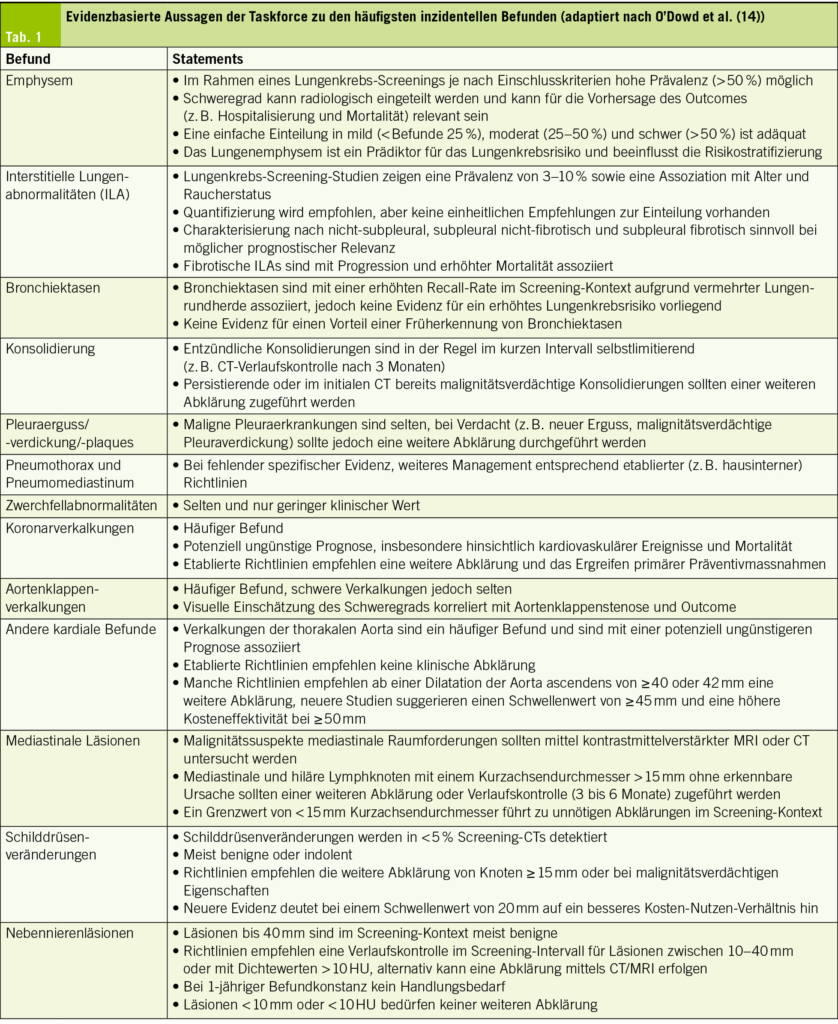
Medikamentös (Tab. 1): Medikamentöse Therapien gibt es, diese sind aber häufig nicht effektiv und robuste Daten bei der Frau fehlen sowohl für Medikamente, die den Auslasswiderstand senken, wie auch für α-1-Rezeptorenblocker. Cholinergika werden aufgrund der Nebenwirkungen nicht mehr empfohlen. Baclofen ist eine Option bei vermehrter EMG-Aktivität. Für Sildenafil ist die Evidenz schwach.
Falls konservative Massnahmen nicht helfen, kann eine sakrale Nervenstimulation oder intrasphinkterische Botox-Injektion indiziert werden.
Selbstkatheterisieren (clean intermittend self-catherisation (CIC)), Dauerableitung (indwelling catheter): Bei chronischer Harnretention auf Grund einer unteraktiven Blase (UB) ist der CIC häufig die Therapiemethode der Wahl, aber gerade bei betroffenen betagten Menschen häufig nicht realisierbar, ist doch die Fingerfertigkeit zum Beispiel durch rheumatologische Krankheiten oder durch eine Parkinsonkrankheit verloren gegangen, so dass man auf eine Dauerableitung – einen Foley Katheter oder einen suprapubischen Katheter – zurückgreifen muss.
Ein hypokontraktiler Detrusor ist per definitionem ein Zustand mit niedrigem intravesikalen Druck, so dass auch höhere Restharnmengen akzeptiert werden dürfen. Die oberen Harnwege sind in den allermeisten Fällen nicht durch einen Reflux resp. Hochdruck gefährdet.
Eine asymptomatische Bakteriurie soll man nicht antibiotisch behandeln, auch wenn die Restharnmengen erhöht sind oder der CIC durchgeführt wird. Bei liegendem Katheter ist der Urin fast immer besiedelt.
Hohe Restharnmengen können symptomatische Harnwegsinfekte triggern, dann ist man im therapeutischen Zugzwang. Zur Prophylaxe von Harnwegsinfekten stehen lokale Östrogene, D-Mannose, Urovaxom zur Verfügung. Antibiotische Therapien soll man vermeiden.
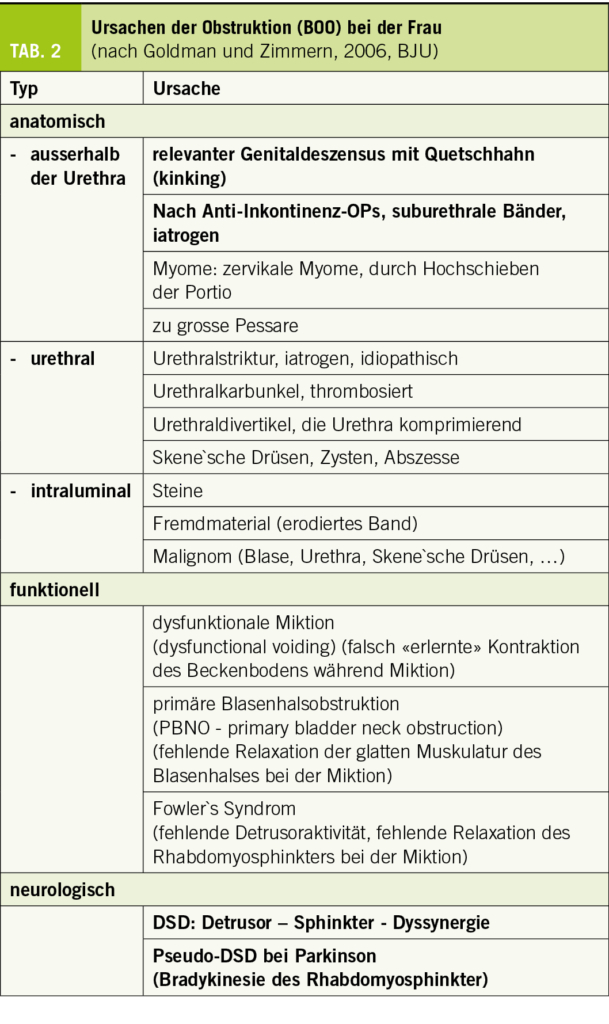
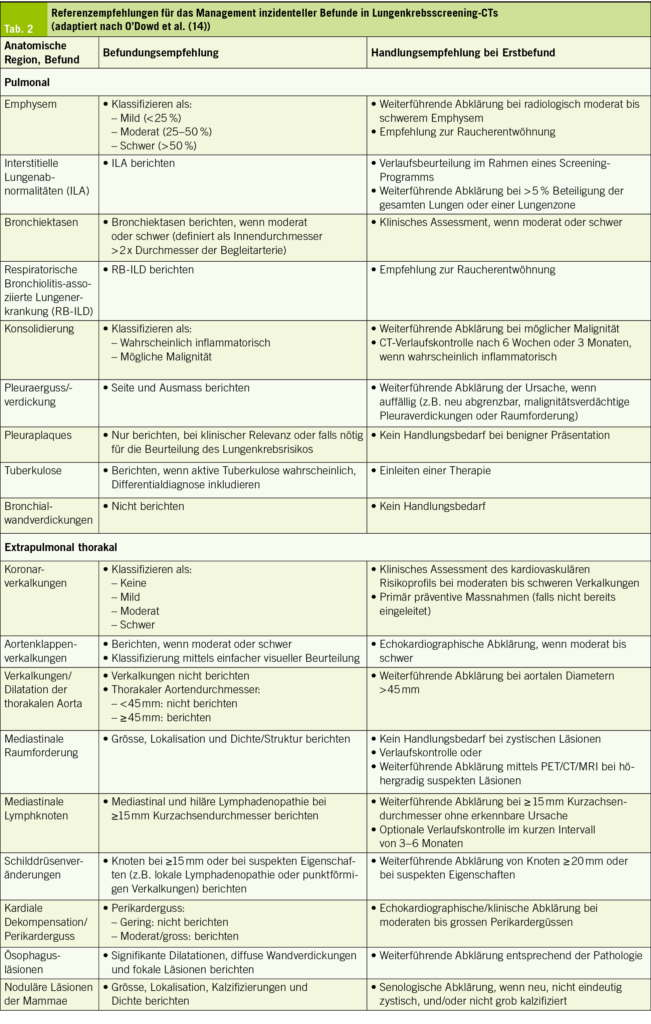
Ursachen der BOO bei der Frau (Tab. 2) – die Krankheitsbilder im Einzelnen
Nicht neurogene Detrusorschwäche (myogen)
(hypo – oder akontraktiler Detrusor) (bladder underactivity)
Die UB ist ebenso häufig wie die OAB. Die UB ist häufig im Alter, bei gebrechlichen Patientinnen oder Patientinnen mit Komorbiditäten (1, 2). Chronische Ischämie der Blasenwand durch Gefässveränderung, durch Arteriosklerose und Fibrose führen nicht nur zu der häufigen Instabilität, sondern auch zur Hypokontraktilität oder auch zur Kombination von beidem (3, 4). Die Kontraktionskraft nimmt ab und der Resturin nimmt zu (5).
Insofern ist die Detrusorschwäche nicht wirklich als gegenteilige Störung zur idiopathischen OAB zu verstehen, sondern allenfalls als Krankheitsbild mit gleicher Ursache.
Die Ursache der Detrusorschwäche lässt sich weder durch die gynäkologische und sonographische Untersuchung des kleinen Beckens noch durch die urodynamische Untersuchung erkennen. Hier hilft nur die Anamnese, die sorgfältig geführte hausärztliche Diagnoseliste und auch der Allgemein- und neurologische Status.
Neurogen bedingte Detrusorschwäche
Infrasakrale Läsionen: Läsionen unter dem sakralen Miktionszentrum S2 – S4 führen zur Denervation der Blase und zum akontraktilen Detrusor.
Autonome Polyneuropathie: typischerweise verursacht durch einen länger bestehenden oder schlecht eingestellten Diabetes mellitus (6). Afferente und efferente Bahnen werden gestört, die Sensibilität für die Blasenfüllung geht verloren, die Blasenkontraktion kann nicht mehr ausgelöst werden. Die gestörte Blasenentleerung kann auch mit Symptomen der Blaseninstabilität kombiniert sein.
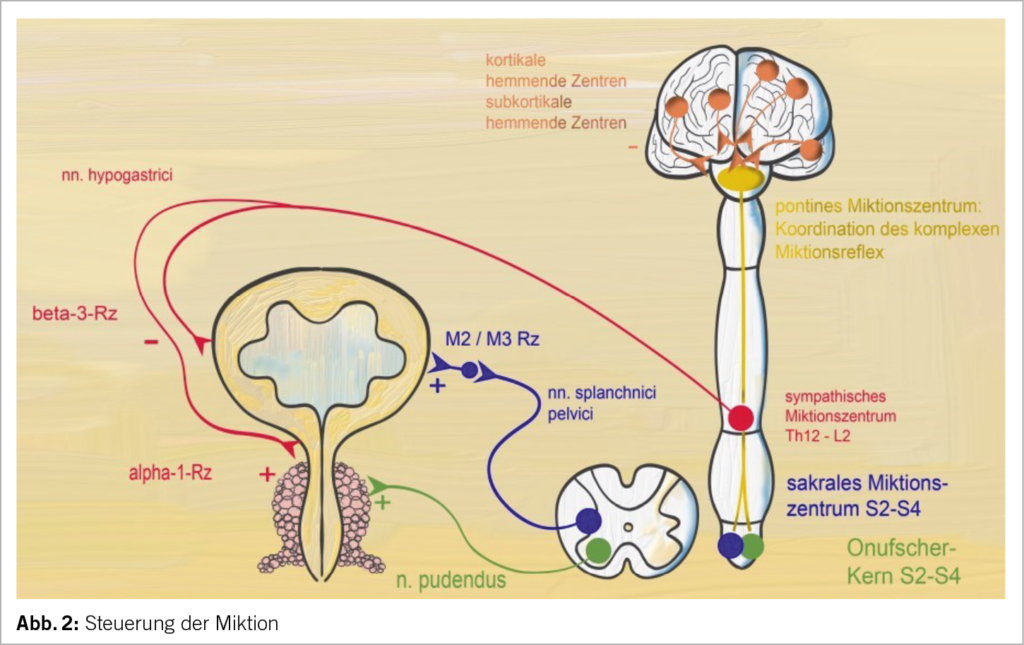
Chirurgie im kleinen Becken mit Denervation der Blase: Die Störung der autonomen peripheren Innervation der Blase und die daraus resultierende, definitive und persistierende Blasenatonie (7) ist eine mögliche typische Komplikation nach «destruktiven» Operationen im kleinen Becken. Die parasympathische Versorgung der Blase geschieht über die nervi splanchnici pelvici (S2-S4), welche in der Tiefe der Sakrouterinligamente zum plexus hypogastricus inferior verlaufen. Die parasympathische und sympathische autonome Innervation besteht aus feinen Nervengeflechten, diese werden bei infiltrativen Prozessen automatisch mitreseziert. Heute werden, wenn möglich, Nerven schonende OP-Techniken angewendet (8). (Abb. 2)
Cauda equina Läsion: Bei einer tiefen Querschnittläsion (spinal cord injury (SCI)) oder einer medialen lumbalen Diskushernie kann es ebenfalls zu einer infrasakralen Läsion kommen. Die Blasenatonie mit Harnretention ist die «red flag» der medialen lumbalen Diskushernie. Da die cauda aequina auch die somatische Innervation beinhaltet, gehört die Reithosen Anästhesie mit beidseitigem Sensibilitätsverlust der sakralen Dermatome zum klinischen Bild.
Läsion des Conus / Läsion der sakralen Segmente des Rückenmarkes: Analog führt auch eine Läsion auf Höhe der sakralen Rückenmarksegmente zu einer Blasenatonie, wie dies beispielsweise eine tiefe Querschnittläsion oder ein tief gelegener MS Herd oder auch eine Wirbelsäulen-Operation verursachen kann.
Die postpartale Harnretention: Ob die postpartale Harnretention als neurogene Störung verstanden werden muss, ist schwierig zu sagen. Für somatische Nerven (n. rectalis inferior des n. pudendus) hat man im Modell eine gegen dreissigprozentige Überdehnung durch die «second stage» der Geburt berechnet. Dies ist deutlich mehr, als nervöse Strukturen ohne Schaden tolerieren (9). Vielleicht darf man das auf das autonome Nervensystem im kleinen Becken übertragen? Risikofaktoren für die postpartale Harnretention sind lange «second stage», PDA, Primiparität oder instrumentelle vaginale Geburtshilfe. Resturin nach der Geburt ist sehr häufig und die Lattenhöhe für therapeutische Massnahmen ist grosszügig hoch anzusetzen: Einige Autoren tolerieren postpartal Resturin bis 500ml (10). Bei sehr hohen Resturinmengen ist der CIC oder der suprapubische Katheter dem Dauerkatheter vorzuziehen, die Patientin wird damit schneller zur Normalität zurückfinden.
Beruhigend: Die postpartale Harnretention ist quasi immer transient. Die Blasenentleerung erholt sich über die Zeit und es sind keine uro-gynäkologischen Langzeitfolgen beschrieben (11).
Nicht neurogen bedingtes infravesikales Hindernis: anatomische Obstruktion
Genitaldeszensus (pelvic organ prolaps (POP)): Der Genitaldeszensus kann durch Abknicken (kinking) der gesenkten prolabierenden Blase zu einer Entleerungsstörung und zu Restharn führen (12). Man weiss ohne zusätzliche Urodynamik nicht, ob nicht zusätzlich eine Detrusorschwäche oder eine instabile Blase vorliegt. Es ist auch schwierig vorherzusagen, ob die Entleerungsstörung durch die Korrektur des Deszensus mit Pessar oder Operation verschwinden wird – meistens jedoch schon (13, 14)! Auch kann man präoperativ mit keinem Test eindeutig klären, ob durch die chirurgische Korrektur der Zystozele eine de novo Belastungsinkontinenz auftreten wird. Es ist aus diesen Gründen ratsam, Deszensusoperationen nicht mit Inkontinenzoperationen zu kombinieren, sondern diese erst bei Bedarf zweizeitig durchzuführen.
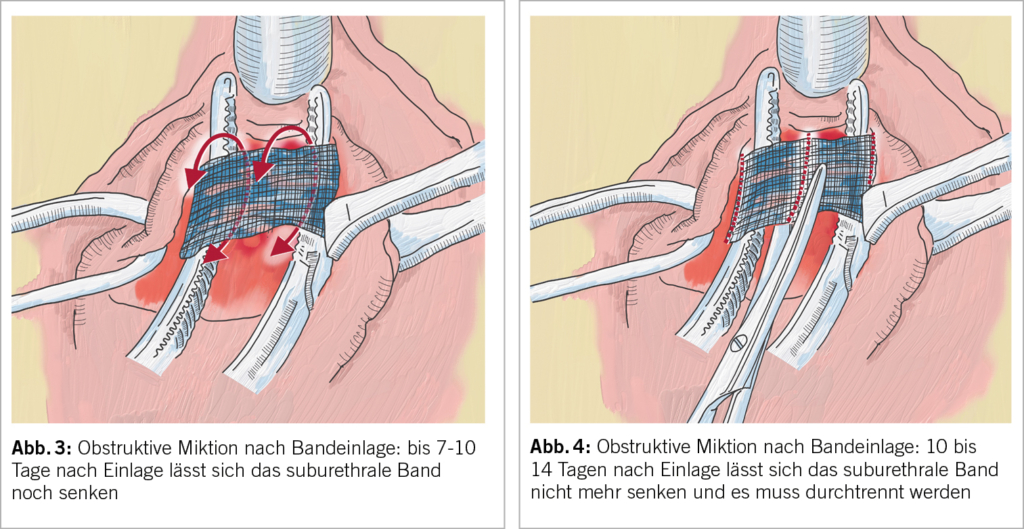
Iatrogene Obstruktion durch suburethrale Bänder: Die iatrogene Obstruktion zählt zu den häufigsten Ursachen einer anatomischen BOO. Die akute postoperative Retention mit massiv behinderter Miktion ist offensichtlich. Schwieriger ist es, die sich langsam entwickelnde Retention als durch eine suburethral gelegte Schlinge verursacht zu verstehen. Die Anamnese ist wegweisend: War die Miktion vor der Bandeinlage problemlos und die Entleerung nach der Bandeinlage gestört und ist dieser zeitliche Zusammenhang klar gegeben, ist das Band obstruktiv. Resturin muss nicht immer von Beginn an vorhanden sein, ein gesunder Detrusormuskel vermag den erhöhten Widerstand zuerst einmal zu überwinden. Die Antwort der Blase auf Obstruktion ist die stärkere Kontraktion und das kann wiederum eine Detrusorinstabilität verursachen: DeNovo OAB. Auch rezidivierende Harnwegsinfekte können die Folge sein.
Das Band lässt sich während 7 bis maximal 10 Tagen noch einfach senken, ohne den Kontinenz-Effekt zu gefährden. (Abb. 3)
Realisiert man die Obstruktion erst verspätet, muss das Band komplett durchtrennt werden. Die obstruktiven Symptome kann man so chirurgisch in den allermeisten Fällen beheben (15, 16). Je nach dem aber wie lange die Obstruktion angedauert hatte, werden die OAB-Symptome trotz aufgehobener Obstruktion persistieren (17). Mit einer Rezidiv-Inkontinenz ist durch Bandspaltung in 30 bis 50% zu rechnen. Nur ein Teil dieser Patientinnen (14%) werden sich in der Folge auf eine erneute Inkontinenzoperation einlassen (18, 19). (Abb. 4)
Urethralstrikturen: Urethralstrikturen sind bei Frauen häufig iatrogen durch prolongiertes Katheterisieren, Radiatio oder nach chirurgischen Eingriffen verursacht.
Nicht neurogen bedingtes infravesikales Hindernis: funktionelle Obstruktion
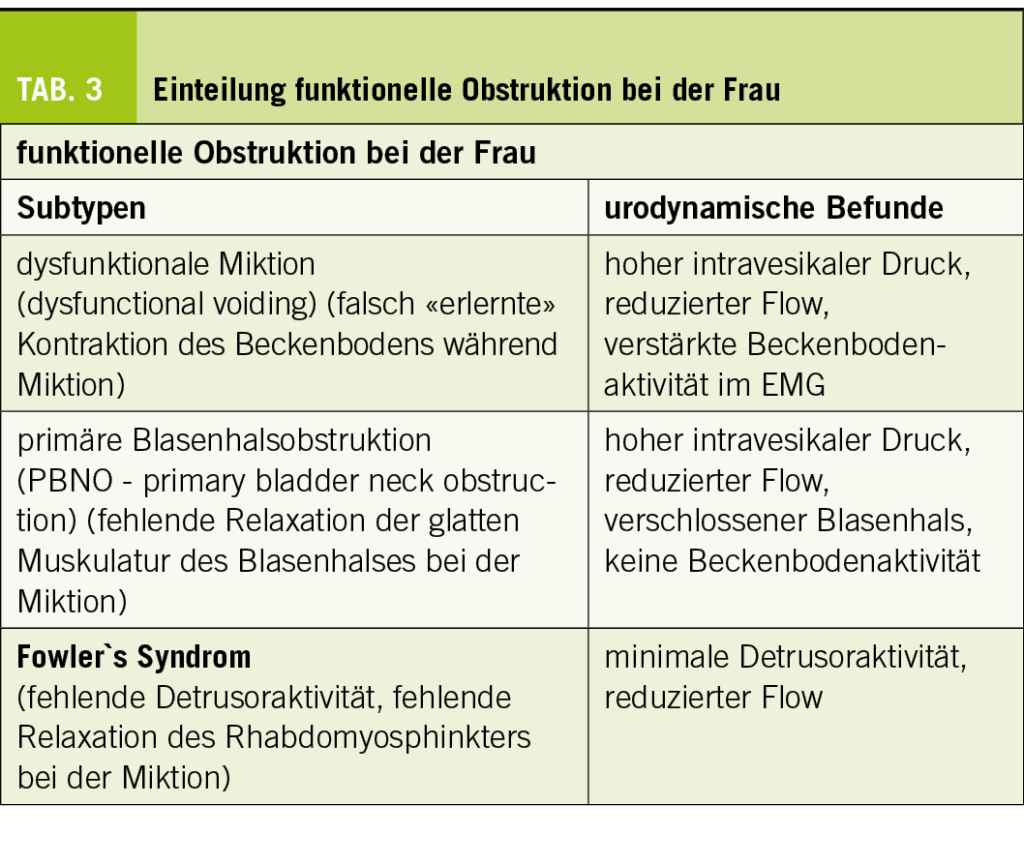
Die funktionellen Obstruktionen sind vielleicht am schwierigsten zu verstehen: weil eine klare und nachvollziehbare Krankheitsursache fehlt und weil sie negativ definiert sind, nämlich durch das Fehlen einer zugrundeliegenden neurologischen Krankheit. Auch braucht es für die Diagnose eine komplexe Videourodynamik der Miktionsphase mit EMG und sollte neuro-urologisch abgeklärt werden.
Die dazugehörenden Subtypen sind in der Tabelle 3 unter «funktionell» gelistet.
Neurogen bedingtes infravesikales Hindernis:
DSD – Detrusor-Sphinkter-Dyssynergie: Kommt es zu einer Störung vom koordinierenden pontinen Miktionszentrum im Stammhirn zu den basalen Reflexzentren des Rückenmarkes in den lumbalen und sakralen Segmenten resultiert eine Detrusor-Sphinkter-Dyssynergie (DSD): ein Fehlen der zeitgleichen Relaxation des urethralen Rabdomyosphinkters bei der Kontraktion des Detrusormuskels. Folgen dieser Massenreflexe sind exorbitant hohe intravesikale Drücke, damit Reflux in die oberen ableitenden Harnwege und sukzessive Zerstörung des Nierenparenchyms.
Bei jungen Patientinnen mit unerklärten OAB-Symptomen und evt. zusätzlich Resturin, sollte eine sorgfältige Anamnese zu neurologischen Symptomen erhoben werden: z.Bsp schubweise aufgetretene fokale Sensibilitäts- oder motorische Störungen, Schwindel, Störungen im Gleichgewicht oder Sehstörungen, die nicht beachtet, verdrängt oder nicht zugeordnet wurden (20). Die Diagnose der DSD gelingt mit der Video-Urodynamik mit EMG. Hier sollte unbedingt eine Zuweisung zu einem Neurourologen erfolgen.
Therapie der DSD: Kombination von hohen Botulinumtoxin Dosen in den Sphincter urethrae und getimtes Selbstkatheterisieren (CIC).
Parkinson – Pseudo-Detrusor-Sphinkter-Dyssynergie: Die Parkinsonkrankheit ist eine suprapontine Läsion und macht eine neurogene Detrusorhyperreflexie, eine neurogen bedingte OAB. Nicht selten findet man dennoch auch relevante Resturinmengen, die nicht zu einem unkontrollierten und überaktiven Detrusor passen. Die durch Parkinson bedingte Bradykinesie erklärt die verzögerte Relaxation der Urethra, welche der Blasenkontraktion hinterherhinkt und so eine vollständige Blasenentleerung verunmöglicht.
Und selbstverständlich können vor allem bei älteren Patientinnen verschiedene Störungen gleichzeitig vorliegen, was es schwierig machen kann, therapeutische Konzepte zu etablieren.
Zweitabdruck aus «info@gynäkologie» 03-2023
Copyright bei Aerzteverlag medinfo AG
Stadtspital Triemli, Frauenklinik
Birmensdorferstrasse 501
8063 Zürich
Stadtspital Triemli, Klinik für Urologie
Birmensdorferstrasse 497
8063 Zürich
Frauenklinik Stadtspital Weid und Triemli
Birmensdorferstrasse 501
8063 Zürich
daniel.passweg@triemli.zuerich.ch
Die Autoren haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Nadir I Osman , Christopher R Chapple , Paul Abrams , Roger Dmochowski , François Haab , Victor Nitti , Heinz Koelbl , Philip van Kerrebroeck , Alan J Wein.. Detrusor underactivity and the underactive bladder: a new clinical entity? A review of current terminology, definitions, epidemiology, aetiology, and diagnosis. Eur Urol. 2014 Feb;65(2):389-98.
2. Smith PP. Aging and the underactive detrusor: a failure of activity or activation?.Neurourol Urodyn. 2010 Mar;29(3):408-12.
3. Chapple CR, Osman NI, Birder L, van Koeveringe GA, Oelke M, Nitti VW, Drake MJ, Yamaguchi O, Abrams P, Smith PP. The underactive bladder: a new clinical concept?. Eur Urol. 2015 Sep;68(3):351-3.
4. Masanori Nomiya, Karl-Erik Andersson, Osamu Yamaguchi. Chronic bladder ischemia and oxidative stress: new pharmacotherapeutic targets for lower urinary tract symptoms. Int J Urol. 2015 Jan;22(1):40-6.
5. Sheng-Fu Chen , Cheng-Ling Lee , Hann-Chorng Kuo.. Change of Detrusor Contractility in Patients with and without Bladder Outlet Obstruction at Ten or More Years of follow-up. Sci Rep. 2019 Dec 11;9(1):18887.
6. S A Kaplan, A E Te, J G Blaivas. Urodynamic findings in patients with diabetic cystopathy. J Urol. 1995 Feb;153(2):342-4.
7. S M Axelsen, L K Petersen. Urogynaecological dysfunction after radical hysterectomy. Eur J Surg Oncol. 2006 May;32(4):445-9.
8. Francesco Maneschi , Palmiero Ianiri, Michele Sarno, Francesco Gagliardi, Pierluigi Benedetti Panici. Nerve-sparing class III-IV radical hysterectomy: urodynamic study and surgical technique. Int J Gynecol Cancer. 2012 May;22(4):675-80.
9. Kuo-Cheng Lien, Daniel M Morgan, John O L Delancey, James A Ashton-Miller. Pudendal nerve stretch during vaginal birth: a 3D computer simulation. Am J Obstet Gynecol. 2005 May;192(5):1669-76.
10. Femke E. M. Mulder, Robert A. Hakvoort, Jan-Peter de Bruin, Erica W. Janszen, Joris A. M. van der Post & Jan-Paul W. R. Roovers. Long-term micturition problems of asymptomatic postpartum urinary retention: a prospective case–control study. International Urogynecology Journal volume 29, pages481–488 (2018)
11. Noa Mevorach Zussman, Noa Gonen, Michal Kovo, Hadas Miremberg, Jacob Bar, Alexander Condrea, Shimon Ginath..Protracted postpartum urinary retention-a long-term problem or a transient condition?. Int Urogynecol J. 2020 Mar;31(3):513-519.
12. Lior Lowenstein, Charles Anderson, Kimberly Kenton, Yashika Dooley, Linda Brubaker. Obstructive voiding symptoms are not predictive of elevated postvoid residual urine volumes. Int Urogynecol J Pelvic Floor Dysfunct. 2008 Jun;19(6):801-4.
13. L J Romanzi, D C Chaikin, J G Blaivas. The effect of genital prolapse on voiding. J Urol. 1999 Feb;161(2):581-6.
14. M P Fitzgerald, N Kulkarni, D Fenner. Postoperative resolution of urinary retention in patients with advanced pelvic organ prolapse. Am J Obstet Gynecol. 2000 Dec;183(6):1361-3; discussion 1363-4.
15. Rebecca McCrery, Rodney Appell. Transvaginal urethrolysis for obstruction after antiincontinence surgery. Int Urogynecol J Pelvic Floor Dysfunct. 2007 Jun;18(6):627-33.
16. H B Goldman, R R Rackley, R A Appell. The efficacy of urethrolysis without re-suspension for iatrogenic urethral obstruction. J Urol. 1999 Jan;161(1):196-8; discussion 198-9.
17. Iryna M Crescenze, Nitya Abraham, Jianbo Li, Howard B Goldman, Sandip Vasavada. Urgency Incontinence before and after Revision of a Synthetic Mid Urethral Sling. J. Urol. 2016 Aug;196(2):478-83.
18. Nitya Abraham, Iryna Makovey , Ashley King, Howard B Goldman, Sandip Vasavada.. The effect of time to release of an obstructing synthetic mid-urethral sling on repeat surgery for stress urinary incontinence. Neurourol Urodyn. 2017 Feb;36(2):349-353.
19. Howard B Goldman. Urethrolysis. Urol Clin North Am. 2011 Feb;38(1):31-7, vi.
20. Panicker JN, Fowler CJ, Kessler TM. Lower urinary tract dysfunction in the neurological patient: clinical assessment and management. Lancet Neurol. 2015 Jul;14(7):720-32.
21. Salvador Arlandis et al. European Association of Urology Guidelines on the Management of Female Non-neurogenic Lower Urinary Tract Symptoms. Part 2: Underactive Bladder, Bladder Outlet Obstruction, and Nocturia. European Urology 82 (2022 Jan): 60-70