Die Herzinsuffizienz (HI) bleibt ein sehr wichtiges Thema der Medizin. Trotz einer gut etablierten medikamentösen vierer Therapie bleiben die HI-Hospitalisationsrate und die kardiovaskuläre (cv) Mortalität weiterhin hoch – 1 von 7 Patient*innen (14,3%) über 24 Monate erleidet ein kardiales Event (1). Weltweit gibt es ca. 64 Millionen Patient*innen mit einer HI; davon hat ca. die Hälfte eine EF >40%. Dieser Anteil wächst markant. Die Prävalenz in der Schweiz beträgt 1,45% und nimmt mit dem Alter deutlich zu, das mediane Alter beträgt 75 Jahre. Bei Patient*innen älter als 65 Jahre ist die HI die häufigste Hospitalisationsursache mit einer deutlich erhöhten Mortalität von 30% im ersten Jahr. Jeder dritte Betroffene wird innerhalb von 90 Tagen nach Entlassung abermals hospitalisiert.
Heart failure (HI) remains a very important medical issue. Despite well-established four-drug therapy, HI hospitalisation rates and cardiovascular (cv) mortality remain high – 1 in 7 patients (14.3%) over 24 months experience a cardiac event (1). There are approximately 64 million patients with HI worldwide, half of whom have an EF >40%. This proportion is growing rapidly. The prevalence in Switzerland is 1,45% and increases significantly with age; the median age is 75 years. In patients older than 65 years, HI is the most frequent cause of hospitalisation with a significantly increased mortality of 30% in the first year. Every third patient is hospitalised again within 90 days after discharge.
Key Words: Heart failure, ejection fraction, quadruple therapy
Definition und Entwicklung der Herzinsuffizienz
Die Herzinsuffizienz ist ein Syndrom und die gemeinsame Endstrecke verschiedener kardialer Erkrankungen. Sie hat zunehmend klinische und gesundheitsökonomische Bedeutung, da die Mortalität vieler kardialer Erkrankungen abnimmt, dadurch jedoch der chronische Verlauf und damit die Prävalenz der HI ansteigt. Die Definition lautet: «Eine strukturelle oder funktionelle Abnormalität des Herzens, welche zu einem erhöhten intrakardialen Füllungsdruck und/oder einer verminderten Pumpleistung in Ruhe oder bei Belastung führt.» Wichtig ist hierbei, dass sich die HI nicht allein durch die verminderte Pumpleistung definiert (klassische HI mit reduzierter Ejektionsfraktion – HFrEF) sondern auch über einen Zustand mit erhöhtem Füllungsdruck des Herzens (wie beispielsweise auch bei der HI mit erhaltener Ejektionsfraktion – HFpEF).
Die Entwicklung der HI wird in Stadien eingeteilt, vom Vorliegen spezifischer Risikofaktoren bis zum Vollbild des Syndroms. Die Risikofaktoren einer HI sind: Inaktiver Lebensstil, Adipositas, Hypertonie, Hyperlipidämie, Diabetes mellitus, Nikotinabusus, KHK, exzessiver Alkoholkonsum, kardiotoxische Medikamente, thorakale Bestrahlung. Diese führen dann über die Jahre zu einer strukturellen Störung mit systolischer und/oder diastolischer Dysfunktion, LV-Hypertrophie, LV-Dilatation, Vitien und erhöhtem Füllungsdruck mit erhöhten Biomarkern. In der Folge leidet der Patient an Symptomen wie Anstrengungsdyspnoe, verminderter Belastbarkeit mit verlängerter Erholung, Orthopnoe, paroxysmale nächtliche Dyspnoe, Bendopnoe, Schwäche, Müdigkeit und Gewichtsanstieg. Man findet dann die typischen Zeichen mit Halsvenenstauung, Ödemen, verlagertem Herzspitzenstoss/3.Herzton bei HFrEF oder ein intensiver Spitzenstoss/4.Herzton bei der HFpEF.
Klassifizierung der Herzinsuffizienz anhand der Ejektionsfraktion Die Bestimmung der Biomarker, ein abnormes Ruhe-EKG und evt. ein Thorax-Röntgen sind häufig die ersten Abklärungen beim Hausarzt. Es folgt eine kardiologische Beurteilung mit Echokardiographie. So kann dann die HI anhand der Ejektionsfraktion (EF) in eine der drei Formen eingeteilt werden (2):
- HI mit reduzierter EF (HFrEF) mit LV-EF ≤40%
- HI mit leicht reduzierter EF (HFmrEF) mit LV-EF von 41-49%
- HI mit erhaltener EF (HFpEF) mit LV-EF ≥ 50%
Der Pathomechanismus einer HI mit reduzierter EF unterscheidet sich grundsätzlich von demjenigen einer HI mit erhaltener EF. Dies erklärt die unterschiedliche prognostische Beeinflussbarkeit durch Medikamente bei diesen Formen der Herzschwäche. Während bei der HFrEF (und auch bei der HFmrEF) eine myokardiale Schädigung zu einer verminderten Pumpleistung führt, kommt es bei der HFpEF durch Risikofaktoren und Komorbiditäten zu einer systemischen Entzündung und einer endothelialen Dysfunktion. Folge sind eine Hypertrophie und Fibrose, was wiederum zu einer eingeschränkten Relaxation des linken Ventrikels und zu einem erhöhten linksventrikulären Füllungsdruck führt.
Eine zusätzliche Form ist die HI mit verbesserter EF unter Therapie (>40%): «HFimpEF». Hier sollte die Herzinsuffizienz-Medikation nicht reduziert werden, da es sonst gemäss TRED-HF Studie in 44% der Patienten zu einer erneuten Verschlechterung der HI kommt (3).
Zur Klärung der Ätiologie der HI müssen gegebenenfalls weiterführende Untersuchungen (z.B. Koronar-CT, Koronarangiographie, Herz-MRI etc.) durchgeführt werden. Differentialdiagnostisch wird grundsätzlich zwischen ischämischer und nicht ischämischer Kardiomyopathie unterschieden. Die ischämische Form ist die häufigste Ätiologie der HI mit reduzierter EF. Bei den nicht ischämischen Ursachen muss differentialdiagnostisch u.a. an eine genetische Form (Kardiomyopathien), eine Myokarditis, Speichererkrankungen (z.B. Amyloidose, Hämochromatose, M. Fabry etc.), Klappenvitien, eine hypertensive Herzkrankheit, eine Arrhythmie (z.B. Tachykardiomyopathie), eine toxische Ursache, ein High Output Failure (Thyreotoxikose, Anämie etc.) oder eine autoimmun-entzündliche Form (z.B. die Sarkoidose) gedacht werden. Bei einer HI mit erhaltener EF (HFpEF) sind häufig mehrere Komorbiditäten wie Adipositas, Hypertonie, Diabetes, KHK, Vorhofflimmern, OSAS, chron. Niereninsuffizienz u.a. vorhanden. Je mehr Komorbiditäten desto höher die Morbidität und Mortalität. Ein Screening sowie deren gezielte Behandlung wird empfohlen (2).
Diabetes mellitus (DM) Typ 2 stellt eine wichtige Komorbidität der HI dar, die massgeblich die Prognose der Patient*innen determiniert. So haben 20-40% der HI-Patient*innen einen DM. Umgekehrt sollte man bei jedem Diabetiker auch an die HI denken und gezielt nach den Symptomen fragen. Somit beinhaltet das frühe Labor-Screening ein HbA1c und bei Symptomen einer HI beim Diabetiker ein NT-pro-BNP (4).
Die vier Säulen der medikamentösen Herzinsuffizienz-Therapie
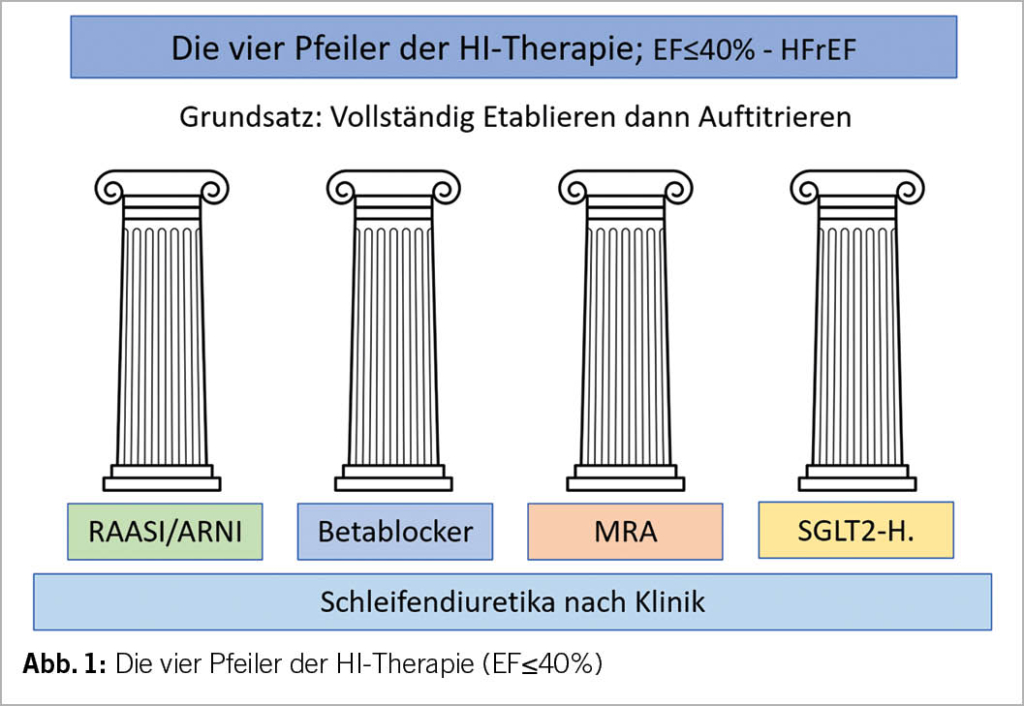
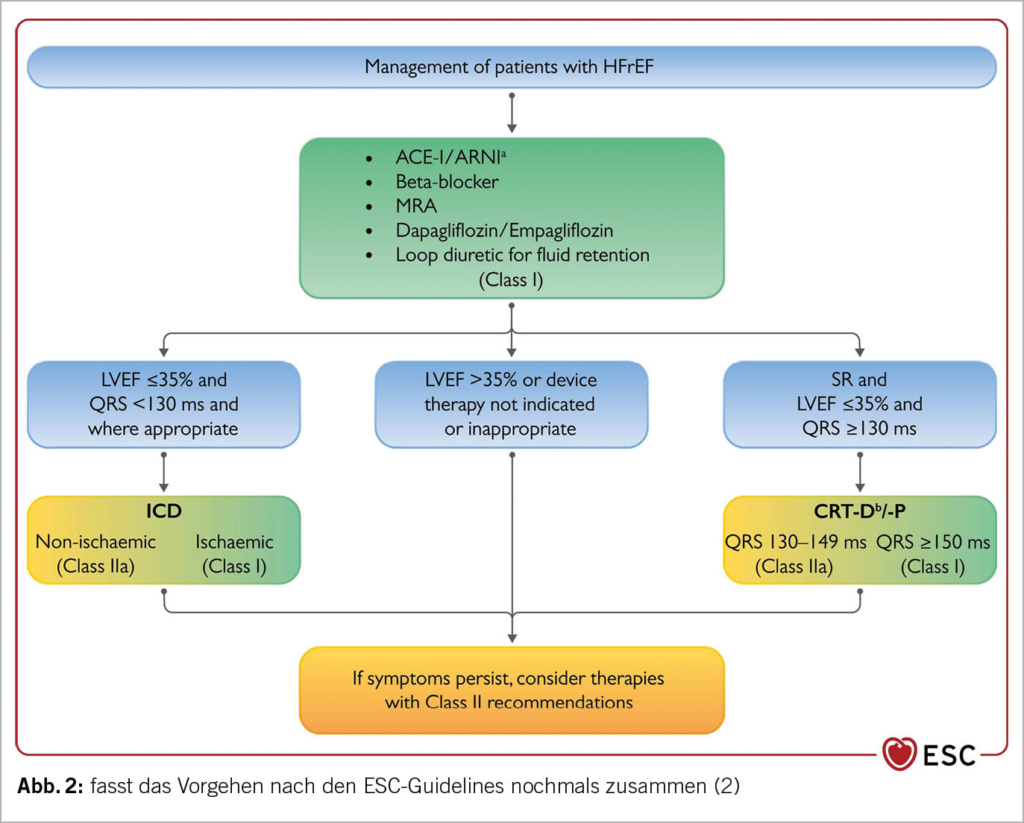
Die Ziele einer HI-Therapie sind: Verbesserung des Überlebens, Verhinderung der HI-Hospitalisationen, Behandlung und Prävention der Symptome, Verbesserung der Lebensqualität und der körperlichen Leistungsfähigkeit. Die vier medikamentösen Pfeiler der HI-Therapie bei einer HFrEF sind in Abbildung 1 ersichtlich.
Aufgrund der heutigen ESC-Leitlinie sollten bei einer akuten HI nach der Dekongestion mit Schleifendiuretika und evt. zusätzlicher Gabe von Azetazolamid i.v. (5) folgende vier Medikamente zur Reduktion der Mortalität rasch und möglichst gleichzeitig eingesetzt werden:
- Angiotensin-Rezeptor-Neprilysin-Hemmer (ARNI) oder ACE-Hemmer (ACE-H.) = RAAS-Hemmer
- Beta-Blocker (BB)
- SGLT2-Hemmer (SGLT2-H.)
- Mineralocorticoid-Rezeptor-Antagonisten (MRA)
Die Datenlage dieser vier Medikamente ist so überzeugend, dass für alle eine IA Indikation (=Indiziert, Daten aus mehreren randomisierte Studien) besteht (2). Selbstverständlich muss die Dosierung der Klinik, dem Blutdruck, der Herzfrequenz, der Nierenfunktion und dem Kaliumspiegel angepasst werden. Die Dosissteigerung richtet sich ebenfalls nach diesen Parametern. Diese vier Medikamente sollten innerhalb von vier Wochen eingesetzt werden. Die Titration zur Zieldosis erfolgt erst nach Initiierung aller vier Medikamente. Entscheidend für den prognostischen Benefit bezüglich Rehospitalisationsrate und Überleben ist die Implementierung in kurzer Zeit (2). Wichtig ist auch, nach Erreichen der Euvolämie die Schleifendiuretika (Furosemid oder Torasemid) zu reduzieren, damit die anderen Wirkstoffe in der Dosierung gesteigert werden können. Die Diuretika verbessern die Prognose nicht.
In den Guidelines werden die ACE-H. (IA) immer noch vor den ARNI (IB = indiziert, Daten aus einer randomisierten Studie) erwähnt (2). ARNI haben als Ersatz für den ACE-H. bei persistierenden Symptomen eine klare Empfehlung (IB). Ein Mortalitätsbenefit wurde nach initialem Beginn mit einem RAAS-H. gezeigt (6). Allerdings kann auch ein direkter Beginn mit ARNI gemäss Leitlinien erwogen werden (IIb/B). Dieser führt zu einer signifikanten Mortalitätsreduktion und zeigt eine signifikante Senkung des kombinierten Endpunktes kardiovaskulärer Tod oder Herzinsuffizienz-Hospitalisation durch Sacubitril/Valsartan gegenüber Enalapril (6, 7). Bei einem Wechsel von einem ACE-H. zu Entresto® muss eine 36-stündige Pause eingehalten werden. Dabei muss die Dosis vorsichtig auftitriert werden. Bei Verordnung eines ARNI ist die Limitatio des BAG zu beachten: NYHA II-IV, EF ≤40% und Vorbehandlung mit einem RAAS-Hemmer. Angiotensin-Rezeptor-Blocker (ARB) haben ihre Berechtigung bei einer ACE-H. Intoleranz. Die Datenlage ist eingeschränkt (IB, CHARM Trial).
Die Analyse dreier Studien (EMPHASIS-HF, PARADIGM-HF, DAPA-HF) zeigte, dass eine Therapie mit den «fantastic four»: ARNI, BB, MRA, SGLT2-H. einen signifikant besseren ereignisfreien Verlauf (bez. cv Tod und Herzinsuffizienz-Hospitalisationen) ergibt als eine konventionelle Doppel-Therapie mit einem ACE-H./ARB und einem BB. Es ergab sich ein Gewinn von 8,3 ereignisfreien Jahren bei einer Therapie bei 55-Jährigen, resp. von 6,3 Jahren bei 65-Jährigen (8).
Ambulante Behandlung der chronischen Herzinsuffizienz
Nach der Hospitalisation obliegt die Langzeit-Therapie dem Hausarzt und dem niedergelassenen Kardiologen*in oder einer ambulanten kardiologischen Sprechstunde. In schwierigen Fällen wird der Patient*in in einer spezialisierten Herzinsuffizienz-Ambulanz betreut. Eine erste Kontrolle nach Rekompensation sollte innert 7-14 Tagen nach Spitalentlassung beim Hausarzt/Hausärztin stattfinden (IA Empfehlung) um die Verträglichkeit der Therapie zu beurteilen, den Volumenstatus/Gewichtsverlauf zu überprüfen und die Diuretika anzupassen (2). Neben einer klinischen Kontrolle bedarf es einer Laborkontrolle (u.a. Elektrolyte, Kreatinin/eGFR, Transaminasen, Hämoglobin, Eisenstatus) und eines weiteren Ruhe-EKGs.
Je nach Klinik und Komplexität des Falles ist auch der betreuende Kardiolog*in bereits bei der ersten Kontrolle involviert. Sicher aber sollte nach ca. vier Wochen eine kardiologische Untersuchung stattfinden. Wenn möglich sollten bei der HFrEF die Medikamente ARNI, BB und MRA in der Dosis noch weiter gesteigert werden. Die Gabe eines SGLT2-H. (Empagliflozin oder Dapagliflozin) erfolgt in einer Dosis von 10mg. Dieses Medikament hat praktisch keinen Einfluss auf den Ausgangs-BD. Hingegen können ARNI und die MRA (Spironolacton, Eplerenon) den BD senken. Eplerenon hat einen deutlichen Prognosevorteil bei einer HFrEF bei koronarer Herzkrankheit. Bei einem Serumkalium >5.5mmol/l ist der Einsatz nicht – respektive nur zusammen mit einem Kaliumbinder (z.B. Patiromer) empfohlen (9). Regelmässige Kalium- und Kreatininkontrollen sind wichtig.
Der BB reduziert den plötzlichen Herztod (SCD). Es gibt folgende Möglichkeiten: Metoprolol Succinat 12,5 – max. 200mg 1x tgl., Bisoprolol 1,25 – 10mg 1x tgl., Carvedilol 3,125 – 25mg 2x tgl. oder Nebivolol 1,25 – 10mg 1x tgl. Die Ziel-HF im SR liegt bei einer HI bei <70/min. Ivabradin, ein If-Kanal-Blocker, ist zu erwägen, falls diese Ziel-HF mit dem BB (evt. auch wegen NW) nicht erreicht wird (IIa) (2).
Wenn möglich sollten die Zieldosen der vier Medikamente je nach Patient*in innerhalb von vier bis acht Wochen erreicht werden.
SGLT2-H. sind lediglich in einer Dosis empfohlen und müssen nicht auftitriert werden. Der genaue Wirkmechanismus ist nicht bekannt, durch die diuretische Wirkung allein wird der prognostische Benefit nicht erklärt. Diese Medikamentenklasse senkt aber u.a. das Renin-Angiotensin-Aldosteron, den Sympathikotonus, den oxidativen Stress und die Entzündungsreaktion (10).
Bei einer EF <40% (HFrEF) haben Empa- und Dapagliflozin eine Klasse IA Indikation (2). Dies mit oder ohne DM Typ 2. Empagliflozin reduzierte in der EMPEROR-Reduced-Studie den cv-Tod oder die Hospitalisation wegen HI um 25% mit einer NNT von 19 (11). In der DAPA-HF-Studie zeigten sich vergleichbare Resultate – RRR 26%, NNT 21 (1). Ein SGLT2-H. kann zur Behandlung der HI bis zu einer minimalen GFR von ≥20-25ml/min/1.73m2 eingesetzt werden. Die SGLT2-H. sind nach mehreren chron. Niereninsuffizienzstudien nephroprotektiv.
Pausiert werden sollten die SGLT2-H. vor einer Operation oder bei fehlender Nahrungsaufnahme. Dies aufgrund einer möglichen Ketoazidose, was zwar selten aber potenziell letal wäre. Aus dem gleichen Grund ist bei einer HI und einem DM Typ 1 ein SGLT2-Hemmer kontraindiziert. Das Problem der Genitalinfekte durch SGLT2-H. ist bei der Behandlung der HI viel geringer als beim DM Typ 2. Ein weiterer Vorteil: es gibt weniger Hyperkaliämien bei der gleichzeitigen Gabe von MRAs und SGLT2-H. (Vgl.: www.heart-failure.ch: Pocketcard der Swiss Heart Failure Working Group der SGK.)
Bei der HFmrEF mit einer EF von 41-49% haben die Medikamente ARNI, BB, MRA «nur» eine IIbC-Indikation (= können erwogen werden, Expertenmeinung), da sich die Empfehlung in diesem EF-Bereich aus Subgruppenanalysen ableitet. Die HFmrEF ist aber vom Pathomechanismus und dem Therapieansprechen der HFrEF ähnlicher als der HFpEF. Der SGLT2-H. Empagliflozin hat gemäss Studienlage (EMPEROR-Preserved) (12) auch bei Patienten mit HI mit LV-EF ≥40% (umfasst HFmrEF und HFpEF) einen prognostischen Benefit bezüglich cv Tod und Zeit bis zur ersten Herzinsuffizienz-Hospitalisation gezeigt. Der prognostische Benefit ist bereits in den ersten 3 Wochen zu sehen. Es profitieren alle Subgruppen. Die Lebensqualität wird verbessert. Die DELIVER Studie (13) mit Dapagliflozin konnte die Indikation auch für diesen SGLT2-H. bei einer EF ≥40% bestätigen, so dass von einem Klasseneffekt auszugehen ist. Ausschlaggebend für den Unterschied war in beiden Studien eine signifikante Reduktion von HI-bedingten Klinikeinweisungen.
Bei einer HFpEF zeigten die SGLT2-H. in den genannten Studien ebenfalls einen statistisch signifikanten Benefit. In beiden Studien senken sie das relative Risiko für einen kardiovaskulären Tod oder eine Hospitalisation wegen HI um 20%. In einer Metaanalyse, welche am ESC-Kongress 2022 in Barcelona vorgestellt wurde, konnte in fünf Studien über das gesamte Spektrum der EF eine Risikoreduktion von 23% (NNT von 25) bezüglich cv Tod oder eine Hospitalisation wegen HI erzielt werden (14). So bekommt der SGLT2-H. hier bald auch in den ESC-Leitlinien eine entsprechende Indikation bei Patient* innen mit HFmrEF und HFpEF.
SGLT2-H. werden von den Experten schon heute über das gesamte Spektrum der Ejektionsfraktion der HI (HFrEF, HFmrEF, HFpEF) empfohlen. Auch in der Schweiz ist eine Erweiterung der Indikation für Herzinsuffizienzen mit EF >40% in absehbarer Zeit zu erwarten. Aktuell bedarf die Verschreibung gemäss SL-Liste des BAG noch «einer EF≤40%» (15).
Erneute Dekompensation/Verschlechterung der Herzinsuffizienz
Bei einer Dekompensation sollte der Patient*in sofort an einen Kardiologen*in oder an die Klinik überwiesen werden. Jede Dekompensation verschlechtert die Gesamtprognose. Neben einer Optimierung der bisherigen Therapie erfolgt eine Suche und gegebenenfalls Behandlung neuer Ursachen der Dekompensation. Neu stellt der lösliche Guanylatcyclase Stimulator Vericiguat bei einer HI Hospitalisation eine erfolgreiche medikamentöse Therapieoption bei HFrEF-Patient*innen mit schlechter werdender HI trotz optimaler Therapie mit ARNI, BB, MRA und SGLT2-H. dar (IIbB) (2). Patienten mit sehr hohem NT-pro-BNP sollten aber vor Gabe von Vericiguat stabilisiert werden, da sonst die kardiovaskuläre Mortalität und das Risiko für eine erneute Hospitalisation erhöht sind.
Weitere Empfehlungen und Therapieoptionen
Weiterführende interventionelle (z.B. PCI oder CABG bei ischämischer Kardiomyopathie, PVI eines VHFLi bei HI (IIa), Mitra-Clip (16) bei einer signifikanten funktionellen Mitralklappeninsuffizienz etc.) oder Device-basierte Therapien (z.B. ICD oder CRT-D bei entsprechender Indikation) richten sich nach der zugrundeliegenden kardialen Erkrankung und/oder individuellen Konstellationen.
Essentiell sind bei chronischer HI die regelmässigen Verlaufskontrollen (IA) beim Hausarzt/Hausärztin und beim behandelnden Kardiologen*in. Da die HI häufig eine Multisystemerkrankung ist, müssen bei Bedarf evt. weitere Spezialisten in die Behandlung miteinbezogen werden: z.B. Psychiater bei Depression, Nephrologe bei begleitender schwerer Niereninsuffizienz, Diabetologe bei unbefriedigender metabolischer Stoffwechsellage. Auch wiederholte Patient*innen Schulungen sind für den Therapieerfolg sehr hilfreich (2). Bei der HI ist die Prävalenz eines Eisenmangels mit >50% sehr hoch; dies unabhängig vom Hämoglobin. Ein Eisenmangel (definiert als Ferritin <100ug/ml oder Ferritin 100-299ug/ml und Transferrin-sättigung <20%) sollte gesucht (IC Empfehlung) und intravenös mit Eisencarboxymaltose substituiert werden, um die Hospitalisationsrate zu senken und die Leistungsfähigkeit und Lebensqualität zu verbessern (IIa A) (2, 17). Eine perorale Eisensubstitution ist wegen einer Eisenresorptionsstörung bei HI nicht sinnvoll.
Wichtig ist auch eine gezielte Sport- und Bewegungstherapie zur Verbesserung der Leistungsfähigkeit und Lebensqualität und Verminderung der HI-Hospitalisationen (IA Empfehlung). Bei schweren Fällen einer HI, Gebrechlichkeit oder Komorbiditäten (z.B. eine HI mit Depression) soll gemäss Expertenmeinung eine kardiale Rehabilitation erwogen werden (IIa C) (2).
Eine Grippe- (gem. CH-Impfplan bei allen HI Patienten) und Pneumokokken-Impfung (gemäss CH- Impfplan ab NYHA Stadium III-IV) sollte durch den Hausarzt/Hausärztin bei diesen Patient*innen durchgeführt werden. Damit können schwere Verläufe und HI-Hospitalisationen signifikant vermindert werden (IIa B) (2).
Auch das Telemonitoring (entweder «nicht-invasiver Daten» wie Gewicht, BD, HF, Symptome oder «invasiver Daten» von implantierten Devices zur Messung des pulmonal arteriellen Drucks) erlangt bei der Früherkennung einer Dekompensation einer HFrEF zunehmend an Bedeutung. So profitieren gewisse Patient*innen mit einer Reduktion der Sterblichkeit, der HI-Hospitalisation und einer Verbesserung der Lebensqualität (IIbB) (2).
Eine Kontrolle findet bei stabilen Verhältnissen alle 6-12 Monate beim Kardiolog*in statt. Entscheidend bleibt für den Patient*in die gute und enge Zusammenarbeit zwischen seinem Hausarzt/Hausärztin und seinem Kardiolog*in, der Klinik und weiteren Spezialist* innen.
Copyright bei Aerzteverlag medinfo AG
Herzpraxis Zollikon
Zollikerstrasse 79
8702 Zollikon
Herzpraxis Zollikon
Zollikerstrasse 79
8702 Zollikon
Zelglistrasse 17
8127 Forch
u.n.duerst@ggaweb.ch
Die Autoren haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. McMurray JJV. et al., DAPA-HF, NEJM 2019;381 (21):1995-2008
2. McDonagh TA. et al., Heart Failure Guidelines ESC 2021; EHJ 2021;42 (36): 3599-3726
3. Halliday BP. et al., TRED-HF, Lancet 2019;393, 10166: 61-73
4. Schütt K. et al., Positionspapier Herzinsuffizienz und Diabetes; Diabetologie 2022;17:277-288
5. Mullens W. et al., ADVOR, NEJM 2022;387:1185-1195
6. Schweizer Expertenpapier zur Verwendung von Sacubitril/Valsartan (Entresto®) in der Praxis, aktualisierte Version 2022, EMH Media
7. Packer M. et al., PARADIGM-HF, Circulation 2015;131:54-61
8. Vaduganathan M. et al., Lancet 2020;396 (10244):121-128
9. Eur J Int Med 2022; https://doi.org/10.1016/j.ejim.2021.12.027
10. European J of Heart Fail, Volume: 23, Issue: 8, Pages: 1250-1255, 26 June 2021
11. Packer M. et al., EMPEROR Reduced, NEJM 2020;383 (15): 1413-1424
12. Anker St D. et al., Emperor Preserved, NEJM 2021; 385:1451-1461
13. Solomon S. et al, DELIVER, 27. August 2022; doi.org/ 10.1056/NEJMoa2206286
14. Vaduganathan M., Metaanalyse, anlässlich ESC Barcelona, August 2022
15. Spezialitätenliste Bundesamt für Gesundheit (BAG)
16. Stone G.W. et al., COAPT, N Engl J Med 2018; 379:2307-2318
17. Ponikowski P. et al., CONFIRM-HF, ESC Heart Failure 2014;1:52–58