Die medikamentöse Therapie der Herzinsuffizienz mit eingeschränkter systolischer Funktion (heart failure with reduced ejection fraction, HFrEF) hat sich in den letzten Jahren stark weiterentwickelt. Neu wird bei allen HFrEF-Patientinnen und Patienten eine möglichst rasche Etablierung einer sogenannten Vier-Säulen-Basistherapie, bestehend aus einem angiotensin converting enzyme inhibitor (ACE-I), einem Betablocker, einem Mineralokortikoid-Rezeptor-Antagonist (MRA) und einem sodium glucose co-transporter-2 inhibitor (SGLT2-I) angestrebt. Erst in einem zweiten Schritt erfolgen die Auftitrierung dieser Therapie-Säulen und ein Wechsel vom ACE-I zum Angiotensin Rezeptor Neprilysin Inhibitor (ARNI). Je nach Wirkung dieser Medikationsschritte sind im weiteren Verlauf zusätzliche medikamentöse und nicht-medikamentöse Optionen zu evaluieren. Im folgenden Artikel wird insbesondere auf wichtige praktische Aspekte der Umsetzung der neuen Therapie-Leitlinien eingegangen.
Drug therapy options for patients with heart failure with reduced ejection fraction (HFrEF) have increased substantially over the past years. The latest proposed therapy concept consists of a basic quadruple therapy including low doses of an angiotensin converting enzyme inhibitor (ACE-I), a betablocker, a mineralocorticoid receptor antagonist (MRA) and a sodium glucose co-transporter-2 inhibitor (SGLT2-I). Only after establishing all four therapy pillars, the drugs are up-titrated, and the ACE-I is changed to an angiotensin receptor neprilysin inhibitor (ARNI). Depending on the response to the quadruple therapy additional therapeutic options need to be considered. This article discusses practical aspects of implementing the new therapeutic guidelines.
Key Words: heart failure with reduced ejection fraction (HFrEF), quadruple therapy
Fallvignette
Ein 48-jähriger Mann ohne Vorerkrankungen und ohne Vormedikation stellt sich auf Grund seit einigen Wochen progredienter Anstrengungsdyspnoe in der hausärztlichen Praxis vor. Ausserdem hat er beidseitige Knöchelödeme und ein Gewichtsanstieg von 3 Kilogramm innerhalb 2 Wochen bemerkt. Der Blutdruck wird aktuell in der Praxis mit 152/86 mmHg gemessen, die Herzfrequenz liegt bei 97/min. In der klinischen Untersuchung werden Knöchelödeme beidseits bestätigt, und es zeigt sich ein positiver hepatojugulärer Reflux. Pulmonal bestehen Rasselgeräusche basal beidseits. Die Herzauskultation ist unauffällig. Das EKG zeigt einen Sinusrhythmus mit diskreten Repolarisationsstörungen V4-V6. Laborchemisch besteht eine normale Nierenfunktion mit einem Kreatinin von 96 µmol/l und ein normales Kalium von 4.1mmol/l. Das NT-proBNP ist mit 1075ng/l erhöht.
Bei hochgradigem Verdacht auf eine Herzinsuffizienz mit Zeichen der Hypervolämie wird mit einer oralen diuretischen Therapie begonnen und der Patient wird zur kardiologischen Abklärung mittels Echokardiographie zugewiesen. Dabei zeigt sich eine schwer eingeschränkte linksventrikuläre Auswurffraktion (left ventricular ejection fraction, LVEF 28%) bei diffuser Hypokinesie und dilatiertem linkem Ventrikel. Relevante Klappenvitien bestehen nicht. Im weiteren Verlauf werden spezifische Ursachen der Herzinsuffizienz laborchemisch und mittels Herz-MRI sowie Koro-CT ausgeschlossen. Noxen werden vom Patienten verneint, die Familienanamnese ist bezüglich Kardiomyopathien bland. Die Diagnose einer dilatativen Kardiomyopathie unklarer Ätiologie wird gestellt und eine Therapie soll nun eingeleitet werden.
Einleitung
Die medikamentöse Therapie der Herzinsuffizienz hängt entscheidend von der LVEF ab, auch wenn diese kein perfektes Mass für die systolische linksventrikuläre Funktion ist.
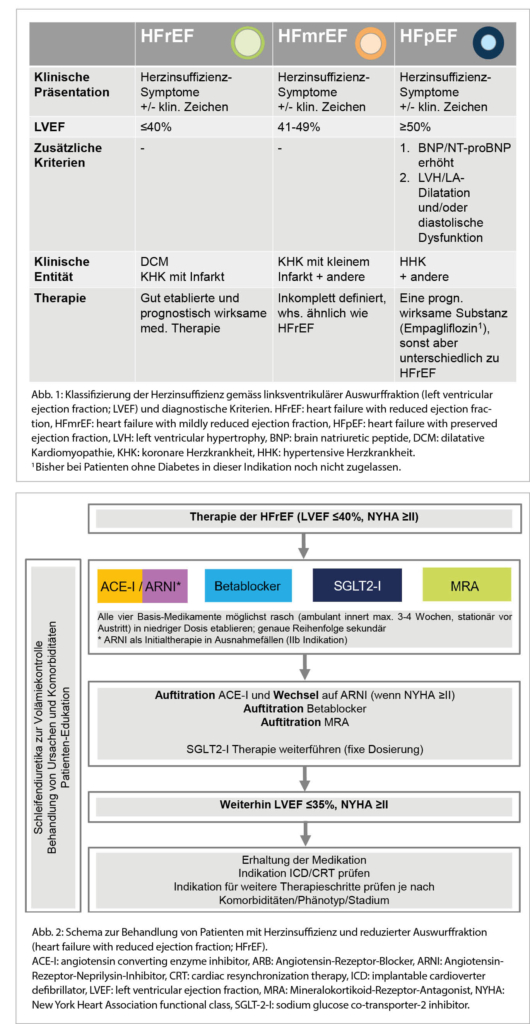
In den neuen ESC-Herzinsuffizienz-Leitlinien 2021 (1) sind kleinere Definitionsänderungen der drei bisherigen Herzinsuffizienz-Phänotypen vorgenommen worden (Abb. 1). Dabei ist zu beachten, dass zur Diagnosestellung einer Herzinsuffizienz immer auch Symptome +/- klinische Zeichen nötig sind. Neu sind die drei Phänotypen wie folgt definiert:
1. Herzinsuffizienz mit reduzierter LVEF ≤40% (heart failure with reduced ejection fraction, HFrEF).
2. Herzinsuffizienz mit leicht eingeschränkter LVEF von 41% bis 49% (feart failure with mildly reduced ejection fraction, HFmrEF).
3. Herzinsuffizienz mit erhaltener Auswurffraktion von ≥50% und zusätzlichen Zeichen einer strukturellen Kardiopathie und/oder Zeichen eines erhöhten Füllungsdruckes respektive einer höhergradigen diastolischen Dysfunktion (heart failure with preserved ejection fraction, HFpEF).
Eine Echokardiografie ist somit für die Diagnose einer Herzinsuffizienz grundsätzlich immer erforderlich.
Für den HFrEF-Phänotyp gibt es zahlreiche Prognose-verbessernde Medikamente, wobei eine sogenannte Vier-Säulen-Therapie neu die Basis bildet. Auf diese wird in diesem Artikel eingegangen. Post hoc-Analysen von «HFpEF-Studien» (die typischerweise nicht nur Patienten mit einer LVEF ≥50%, sondern Patienten mit einer LVEF bis zu 40% eingeschlossen haben) weisen darauf hin, dass die bei HFrEF wirksamen Medikamente auch bei HFmrEF-Patienten effektiv sind.
Für die HFpEF wurde kürzlich die erste positive Studie überhaupt publiziert (2), welche einen prognostischen Nutzen einer Therapie mit Empagliflozin (SGLT2-Inhibitor) versus Placebo zeigen konnte, wobei der Benefit bei «tieferer» LVEF grösser war. Da diese Studie jedoch zeitgleich mit den neuen Guidelines publiziert wurde, ist sie darin noch nicht berücksichtigt worden.
Prinzip der Therapie bei HFrEF
Neben der Initialisierung einer medikamentösen Herzinsuffizienz-Therapie müssen, wie in der einleitenden Fallvignette dargestellt, spezifische Ursachen der Herzinsuffizienz gesucht und wenn möglich behandelt werden (z. B. Koronare Herzkrankheit, Tachykardie, Klappenerkrankung, Hämochromatose, Hypothyreose, Alkoholüberkonsum). Des Weiteren ist eine optimale Edukation der Patientinnen und Patienten bezüglich Krankheits- und Medikationsverständnis sowie bezüglich Verhaltensänderungen essentiell, um die Compliance und die Prognose zu optimieren.
Bis anhin wurde die medikamentöse Therapie bei HFrEF anhand eines Stufenschemas etabliert (3). Dabei wurde mit der Therapie mittels eines angiotensin converting enzyme inihibtors (ACE-I) (oder einem Angiotensin-Rezeptor-Blocker (ARB) bei ACE-I-Unverträglichkeit) und einem Betablocker begonnen und diese möglichst bis zur Zieldosis auftitriert. Nur bei weiterhin bestehender LVEF ≤35% und persistierender Dyspnoe NYHA ≥II erfolgte als nächster Schritt die zusätzliche Therapie mittels Mineralokortikoid-Rezeptor-Antagonist (MRA), welcher dann ebenfalls wieder auftitriert werden musste.
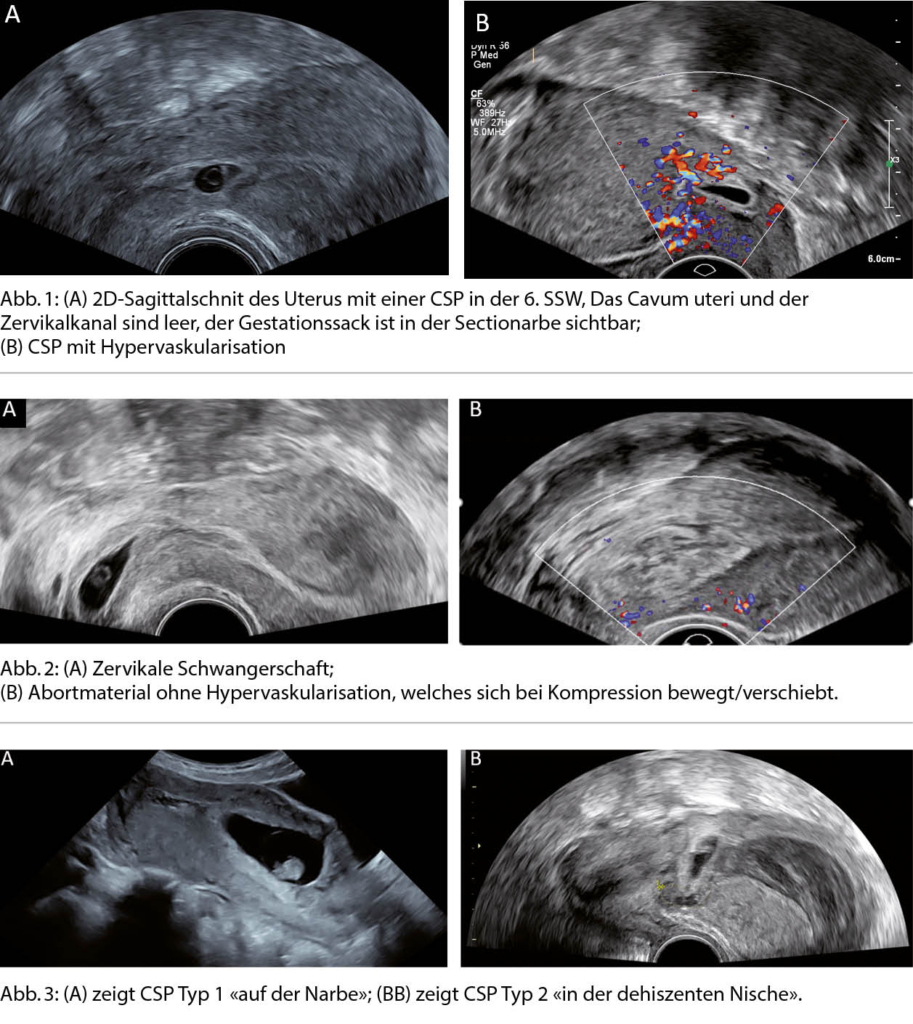
Neu wird anstelle dieses klaren Stufenschemas schon initial und unabhängig von der Antwort auf den ACE-I und/oder Betablocker eine sogenannte Vier-Säulen-Basistherapie empfohlen, welche neben den genannten Substanzen (ACE-I, Betablocker, MRA) neu auch einen sodium glucose co-transporter-2 inhibitor (SGLT2-I) als vierte Säule beinhaltet (1). In grossangelegten Placebo-kontrollierten Studien zeigten die beiden SGLT2-I Dapagliflozin (4) und Empagliflozin (5) gegenüber Placebo einen deutlichen signifikanten Benefit bezüglich des kombinierten Endpunktes Tod und Hospitalisationen wegen Herzinsuffizienz, wobei dies v.a. durch eine Reduktion der Hospitalisationen getrieben war. Ein signifikanter Mortalitäts-Benefit konnte streng genommen nur für Dapagliflozin gezeigt werden (4).
Diese vier Therapiesäulen – alle mit einer Empfehlungs-Klasse I – sollen nun bei allen HFrEF-Patienten möglichst früh parallel in niedriger Dosierung etabliert werden. Erst danach werden die einzelnen Säulen auftitriert, und der ACE-I wird möglichst durch den Angiotensin Rezeptor Neprilysin Inhibitor (ARNI) ersetzt (Abb. 2). Es wird oft kontrovers diskutiert, ob nicht auch direkt mit dem ARNI begonnen werden kann. Der Einsatz des ARNI nach vorgängiger Etablierung eines ACE-I entspricht dem Vorgehen der PARADIGM-HF-Studie (6), welche den Benefit des ARNI gegenüber dem ACE-I gezeigt hat. Ein direkter Beginn mit einer ARNI-Therapie kann bei hospitalisierten Patienten erwogen werden: Es konnte gezeigt werden, dass dies zu einer stärkeren Reduktion des NT-proBNPs als durch den ACE-I führt und sicher ist (7). Die Studie (PIONEER-HF) war aber zu klein für aussagekräftige Outcome-Daten. Die Einstufung dieses Vorgehens als Klasse IIb-Empfehlung («may be considered») ist angesichts der Daten folgerichtig. Trotzdem wird im Gegensatz zu den europäischen Leitlinien in den amerikanischen Herzinsuffizienz-Leitlinien der ARNI als primäre Therapie empfohlen (8). In der Schweiz ist zusätzlich zu beachten, dass bezüglich Rückerstattung durch die Grundversicherung mindestens bis im Herbst 2022 eine Limitatio für die Kombination des ARNI und einem SGLT2-I bei nicht Diabetes-Patienten besteht, weshalb sich die Versicherungen weigern können, diese Kombination zurückzuerstatten. Medizinisch gesehen ist diese Haltung nicht nachvollziehbar, da es keinerlei Hinweise gibt, dass SGLT-2-Hemmer bei ARNI-Background-Therapie weniger wirksam sind.
Grundlage für die neue vier Säulen Strategie ist die Annahme, dass eine möglichst frühe Hemmung aller vier pathophysiologischen Pathways wichtig ist, auch wenn allenfalls nicht für alle Substanzen Maximaldosierungen erreicht werden können (9, 10). Wichtig zu realisieren ist, dass die vier Säulen nicht nur eine symptomatische, sondern auch eine stark Prognose-verbessernde Therapie darstellen. Da die Herzinsuffizienz auch heute noch eine schlechte Prognose (teilweise sogar schlechter als viele Tumorerkrankungen) aufweist, ist die vollständige Etablierung der Herzinsuffizienz-
Therapie essentiell (11).
Sollte nach Etablierung und optimaler Dosierung der Basis-Therapie die LVEF bei ≤35% mit einer Symptomatik NYHA ≥II persistieren, kommen weitere Therapieschritte zum Zug. Dazu gehören die Device-Therapien (insbesondere die Resynchronisationstherapie (CRT) sowie die Defibrillatoren (ICD)) und weitere medikamentöse Optionen zur Behandlung der Herzinsuffizienz bis hin zu linksventrikulären Assist Devices und einer Herztransplantation bei fortgeschrittener Herzinsuffizienz (Abb. 2). Falls sich jedoch unter der Vier-Säulen Basistherapie die LVEF >35% verbessert und der Patient keine Symptome mehr hat, gibt es keine Indikation für einen weiteren Therapieausbau. Allerdings darf die etablierte Medikation (ausser bei entsprechenden Nebenwirkungen) auch nicht reduziert oder sogar gestoppt werden. Dies würde in einem relevanten Anteil der Patienten zu einer erneuten Verschlechterung der Herzinsuffizienz führen (12).
Etablierung der Vier-Säulen-Basistherapie im praktischen Alltag
Wie die Vier-Säulen-Therapie im praktischen Alltag genau etabliert werden soll, wird in den Leitlinien nicht konkret ausgeführt. Expertinnen und Experten empfehlen, einen Therapiebeginn mit allen vier Säulen inklusiv deren Auftitrierung innerhalb von
6 Wochen vorzunehmen (13). Dies ist allerdings in der Praxis häufig so schnell nicht zu erreichen. Wir empfehlen, die vier Substanzen in einem ambulanten Setting innerhalb von maximal 3-4 Wochen in niedriger Dosierung zu beginnen und danach aufzudosieren. Im stationären Setting sollten alle vier Säulen zumindest in niedriger Dosierung bei Austritt etabliert sein (Abb. 2).
Die genaue Sequenz der Initiierung wird in den Guidelines ebenso offengelassen. Diese muss nach patienten-spezifischen Faktoren erfolgen. Nachfolgend sind einige Beispiel-Szenarien und die entsprechenden Überlegungen betreffend Therapieetablierung aufgeführt:
1. Initial normaler/hoher Blutdruck, normale Nierenfunktion und Kalium: Dies begünstigt einen Therapiebeginn mit bereits relativ hoher Dosis eines ACE-I in Kombination mit einem MRA. Danach folgt ein niedrigdosierter Betablocker. Der SGLT2-I kann jederzeit dazu kombiniert werden.
2. Initial tiefer Blutdruck und stark eingeschränkte LVEF: Hier kann ein Therapiebeginn mit einem sehr tiefdosierten ACE-I und einem SGLT2-I evaluiert werden, bevor dann im Verlauf der sehr tiefdosierte Betablocker und der MRA eingeführt werden.
3. Initial deutlich eingeschränkte Nierenfunktion und mässig eingeschränkte LVEF: Dies begünstigt den Therapiebeginn mit einem SGLT2-I (sofern eGFR >20ml/min/1.73m2) und einem tiefdosierten Betablocker, gefolgt je nach Verlauf der Nierenfunktion und des Kaliums, von einem tiefdosierten ACE-I und schliesslich, wenn möglich, von einem MRA.
Der Patient aus der Fallvignette passt mit den beschriebenen Charakteristika und Befunden am besten zum dargestellten Beispielszenario eins. Entsprechend wurde bei ihm relativ zeitgleich mit einem ACE-I und einem MRA begonnen und die Therapie innerhalb 10-14 Tage mit einem tiefdosierten Betablocker sowie einem SGLT2-I problemlos kombiniert.
Auftitration der Vier-Säulen-Basistherapie und Wechsel ACE-I auf ARNI im praktischen Alltag
Nach Etablierung der vier Therapiesäulen müssen drei davon (ACE-I, Betablocker, MRA) bis zu den jeweiligen Zieldosen oder zur maximal tolerierten Dosis auftitriert werden (ABB. 3). Lediglich der SGLT2-I wird bei beiden hierfür zugelassenen Medikamenten (Empagliflozin und Dapagliflozin; in der Schweiz bisher jedoch nur Dapagliflozin auf der Spezialitätenliste in dieser Indikation ohne zusätzlichen Diabetes mellitus) direkt mit der fixen Dosis von 10mg/d begonnen und muss entsprechend nicht titriert werden (4, 5). Das Ziel ist es, die ACE-I und die MRA-Dosierung unter entsprechenden klinischen und laborchemischen Kontrollen (Kreatinin und Kalium) jeweils alle 14 Tage zu verdoppeln (14). In einem stationären Setting mit entsprechend besseren Überwachungsmöglichkeiten soll dies schneller erfolgen. Die Auftitrierung dieser beiden Therapiesäulen ist nicht selten nur in limitiertem Ausmass möglich. Dabei spielen folgende Faktoren eine wichtige Rolle (14):
1. Hypotonie: Diese tritt vor allem bei Patienten ohne vorbestehende Hypertonie auf und darf nicht a priori zu einer Reduktion der Herzinsuffizienz-Therapie führen. Asymptomatische hypotensive Blutdruckwerte können ohne Medikationsänderungen (ausser allfälliger Reduktion der Diuretika-Dosierung) toleriert werden. Bei symptomatischer Hypotonie müssen primär Antihypertensiva, welche keinen Benefit auf die Herzinsuffizienz zeigen (z.B. Amlodipin, Nitrate, Alphablocker), gestoppt werden, und eine allfällige diuretische Therapie soll auf die zur Erhaltung einer Euvolämie minimal nötige Dosierung reduziert werden. Erst bei persistierender symptomatischer Hypotonie folgte eine zumindest vorübergehende Reduktion des ACE-I/MRA. Bei Patienten mit CRT-Indikation soll ein solcher frühzeitig implantiert werden, da dieser via Verbesserung des Schlagvolumens zu einem Anstieg des Blutdrucks führen und somit einen weiteren Therapieausbau im Verlauf erlauben kann.
2. Niereninsuffizienz: Grundsätzlich gilt, dass ein Anstieg des Kreatinins bei einer klinischen Verbesserung nicht zu einer Reduktion der Therapie führen soll. Die Richtlinien empfehlen, dass ein Anstieg des Kreatinins um 50% über die Baseline oder bis 266 µmol/l (oder eGFR 25ml/min/1.73 m2) toleriert wird, bevor die Dosis des ACE-I, ARB oder ARNI verändert wird (1). Falls das Kreatinin über 100% der Baseline oder über 310 µmol/l (oder eGFR <20 ml/min/1.73 m2) ansteigt, soll die Therapie mit ACE-I, ARB bzw. ARNI gestoppt werden (1). Dies sind allerdings nur Richtwerte und das genaue Vorgehen ist abhängig vom jeweiligen Setting. Auf jeden Fall muss der Volumenstatus geklärt (sowohl eine Hypovolämie wie auch eine Hypervolämie können zur Verschlechterung der Nierenfunktion führen) und allfällige nephrotoxische Medikamente (z.B. NSAR) müssen durch andere Schmerzmittel ersetzt werden.
3. Hyperkaliämie: Insbesondere der MRA kann (v.a. bei zusätzlicher Niereninsuffizienz) zu einer relevanten Hyperkaliämie führen. Ein Anstieg des Kaliums bis 5.5 mmol/l kann hierbei unter entsprechendem Monitoring toleriert werden. Bei Kaliumwerten von 5.5-6 mmol/l muss eine Dosisreduktion des MRA erfolgen, bei einem Kalium >6 mmol/l muss dieser gestoppt werden. Daneben sollen aber auch anderweitige Strategien zur Kaliumreduktion evaluiert werden. Diese beinhalten einen frühzeitigen Wechsel des ACE-I auf ARNI (dieser führt zu einem etwas geringeren Kaliumanstieg (15)), eine fixe Dosierung eines Schleifendiuretikums (wobei Hypovolämien vermieden werden müssen) oder (unter Berücksichtigung der Limitatio) den Einsatz neuer Kaliumbinder wie Patiromer (16) um das Serumkalium zu senken und so eine maximale ACE-I/MRA-Therapie zu ermöglichen.
Die Aufdosierung des Betablockers ist insbesondere bei Patienten mit schwer eingeschränkter linksventrikulärer systolischer Funktion langsam vorzunehmen, um insbesondere den potentiell negativ inotropen Effekt zu minimieren. Eine Dosisverdopplung sollte hierbei nicht schneller als minimal alle 2 Wochen erfolgen. Generell ist es jedoch auch beim Betablocker essentiell eine möglichst hohe Dosierung anzustreben. Der prognostische Effekt bei HFrEF ist dabei proportional zur Reduktion der Herzfrequenz bzw. umgekehrt proportional zur erreichten Herzfrequenz unter Therapie, wobei die Ziel-Herzfrequenz in Ruhe bei <70/min liegt. Es gibt jedoch auch einen Herzfrequenz-unabhängigen Effekt. Nur wenn unter Betablocker-Therapie eine symptomatische Bradykardie mit Herzfrequenz <50/min (oder ein höhergradiger AV-Block) auftritt muss die Dosis reduziert werden.
Nach der Auftitrierung der obengenannten Säulen erfolgt, sofern noch mindestens eine NYHA II Symptomatik besteht, der frühzeitige und möglichst standardmässige Wechsel vom ACE-I auf ARNI. Bei der Umstellung von einem ACE-I auf ARNI muss auf Grund des Risikos eines Angioödems eine Therapiepause von 36 Stunden eingehalten werden. Bei der Umstellung von einem ARB auf ARNI entfällt diese Therapiepause. Bei vorgängig toleriertem ACE-I in zumindest der halben Zieldosis kann mit Sacubitril/Valsartan 2x100mg/d begonnen und nach 2 Wochen auf 2x200mg gesteigert werden. Ansonsten liegt die Startdosis bei 2x50mg/d. Die Blutdruckreduktion unter Sacubitril/Valsartan kann stärker ausfallen als unter ACE-I (6). Allerdings sollten auch Patienten mit relativ tiefem Blutdruck wenn möglich umgestellt werden, da die absolute Risikoreduktion bezgl. kardiovaskulärem Tod oder Hospitalisationen wegen Herzinsuffizienz gerade in dieser Patientengruppe besonders hoch ist, wenn der ARNI erfolgreich eingesetzt werden kann (17). Jedoch muss hier die Initiierung sehr tiefdosiert und langsam erfolgen.
Beim Patienten aus der initialen Fallvignette konnte die gesamte Vier-Säulen-Therapie bis zur Zieldosis etabliert und der ACE-I erfolgreich durch den ARNI ersetzt werden. Die LVEF verbesserte sich darunter substantiell und wurde 6 Monate nach Erreichen der Zieldosen echokardiographisch mit 40% gemessen. Der Patient ist darunter kardial beschwerdefrei. Die Weiterführung der Therapie ohne Reduktion der Dosen ist nun essentiell.
Copyright bei Aerzteverlag medinfo AG
Klinik für Kardiologie
Kantonsspital St. Gallen
Rorschacherstrasse 95
9007 St. Gallen
marc.buser@kssg.ch
Klinik für Kardiologie
Kantonsspital St. Gallen
Rorschacherstrasse 95
9007 St. Gallen
Die Autoren haben keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
1. McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Bohm M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42(36):3599-726.
2. Anker SD, Butler J, Filippatos G, Ferreira JP, Bocchi E, Böhm M, Brunner-La Rocca H-P, et al. Empagliflozin in Heart Failure with a Preserved Ejection Fraction. N Engl J Med. 2021;385(16):1451-1461.
3. Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JGF, Coats AJS, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC)Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J. 2016;37(27):2129-200.
4. McMurray JJV, Solomon SD, Inzucchi SE, Kober L, Kosiborod MN, Martinez FA, et al. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med. 2019;381(21):1995-2008.
5. Packer M, Anker SD, Butler J, Filippatos G, Pocock SJ, Carson P, et al. Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure. N Engl J Med. 2020;383(15):1413-24.
6. McMurray JJ, Packer M, Desai AS, Gong J, Lefkowitz MP, Rizkala AR, et al. Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Engl J Med. 2014;371(11):993-1004.
7. Velazquez EJ, Morrow DA, DeVore AD, Duffy CI, Ambrosy AP, McCague K, et al. Angiotensin-Neprilysin Inhibition in Acute Decompensated Heart Failure. N Engl J Med. 2019;380(6):539-48.
8. Maddox TM, Januzzi JL et al. 2021 Update to the 2017 ACC Expert Consensus Decision Pathway for Optimization of Heart Failure Treatment: Answers to 10
Pivotal Issues About Heart Failure With Reduced Ejection Fraction. JACC 2021:77; 772-810.
9. Lam CSP, Butler J. Victims of Success in Failure. Circulation. 2020;
142(12):1129-31.
10. Vaduganathan M, Claggett BL, Jhund PS, Cunningham JW, Pedro Ferreira J, Zannad F, et al. Estimating lifetime benefits of comprehensive disease-modifying pharmacological therapies in patients with heart failure with reduced ejection fraction: a comparative analysis of three randomised controlled trials. Lancet. 2020;396(10244):121-8.
11. Mamas MA, Sperrin M, Watson MC, Coutts A, Wilde K, Burton C, et al. Do patients have worse outcomes in heart failure than in cancer? A primary care-based cohort study with 10-year follow-up in Scotland. Eur J Heart Fail. 2017;19(9):1095-104.
12. Halliday BP, Wassall R, Lota AS, Khalique Z, Gregson J, Newsome S, et al. Withdrawal of pharmacological treatment for heart failure in patients with recovered dilated cardiomyopathy (TRED-HF): an open-label, pilot, randomised trial. Lancet. 2019;393(10166):61-73.
13. Greene SJ, Butler J, Fonarow GC. Simultaneous or Rapid Sequence Initiation of Quadruple Medical Therapy for Heart Failure-Optimizing Therapy With the Need for Speed. JAMA Cardiol. 2021;6(7):743-4.
14. McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Bohm M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: supplementary data. Eur Heart J. 2021;00:1-42
15. Desai AS, Vardeny O, Claggett B, McMurray JJ, Packer M, Swedberg K, et al. Reduced Risk of Hyperkalemia During Treatment of Heart Failure With Mineralocorticoid Receptor Antagonists by Use of Sacubitril/Valsartan Compared With Enalapril: A Secondary Analysis of the PARADIGM-HF Trial. JAMA Cardiol. 2017;2(1):79-85.
16. Meyer P, Lu H, Hullin R. Patiromer and medication optimisation in heart failure with reduced ejection fraction: a Swiss perspective. Swiss Med Wkly. 2020;150:w20362
17. Bohm M, Young R, Jhund PS, Solomon SD, Gong J, Lefkowitz MP, et al. Systolic blood pressure, cardiovascular outcomes and efficacy and safety of sacubitril/valsartan (LCZ696) in patients with chronic heart failure and reduced ejection fraction: results from PARADIGM-HF. Eur Heart J. 2017;38(15):1132-43.