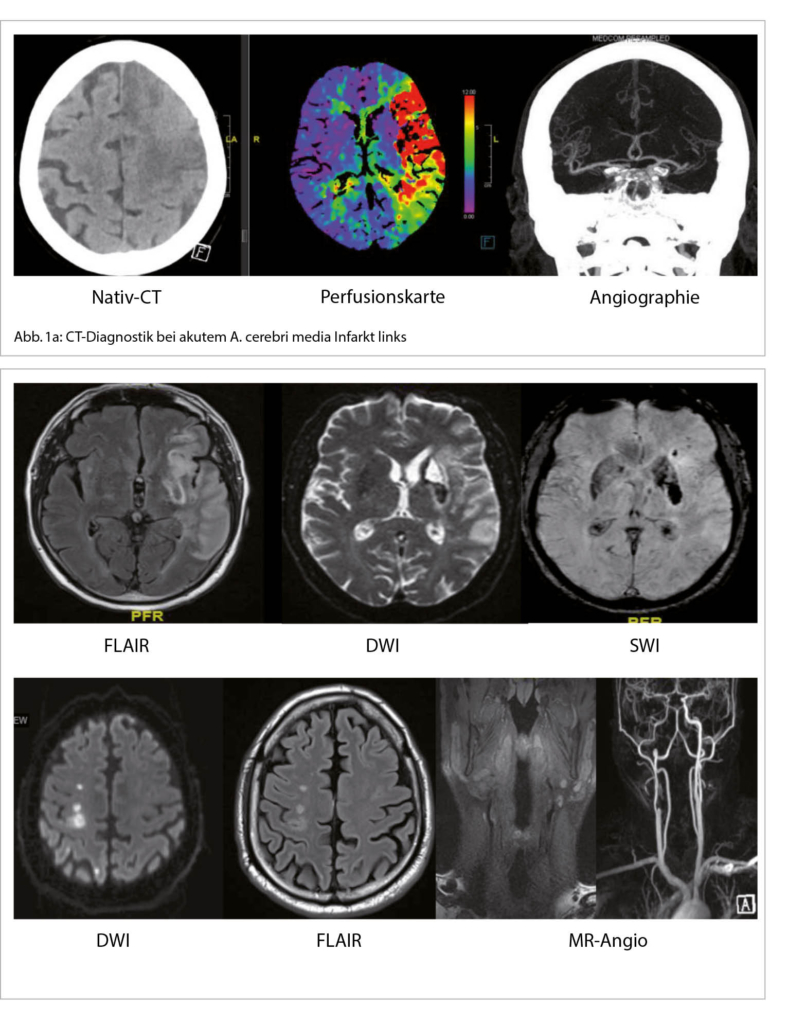
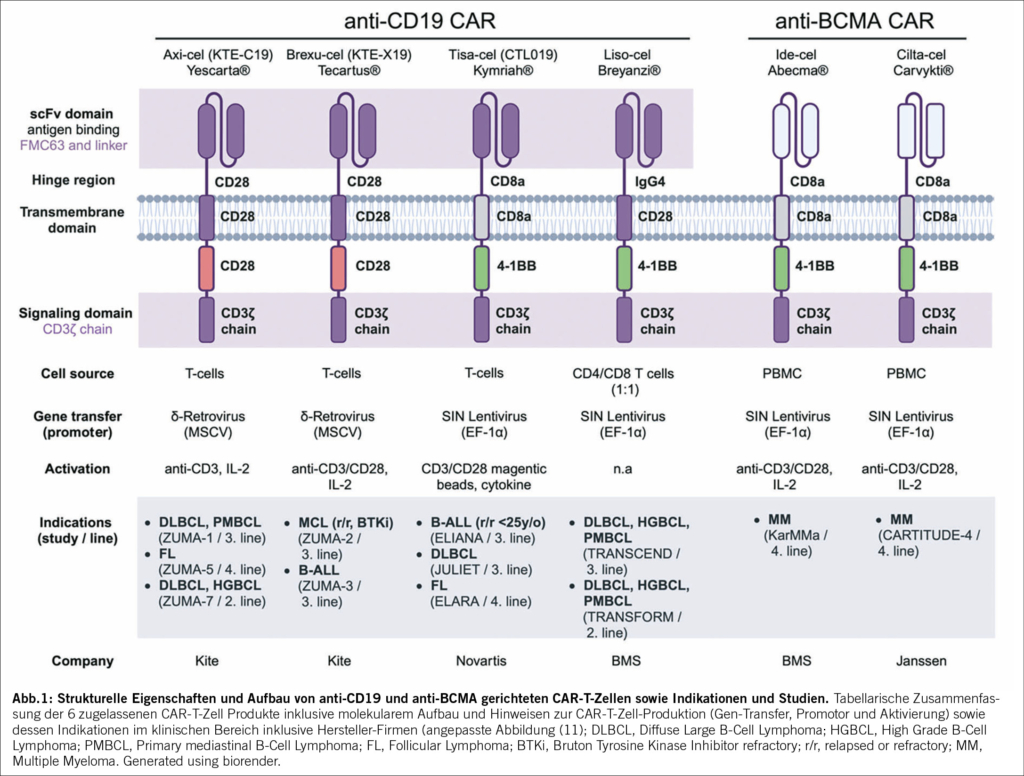
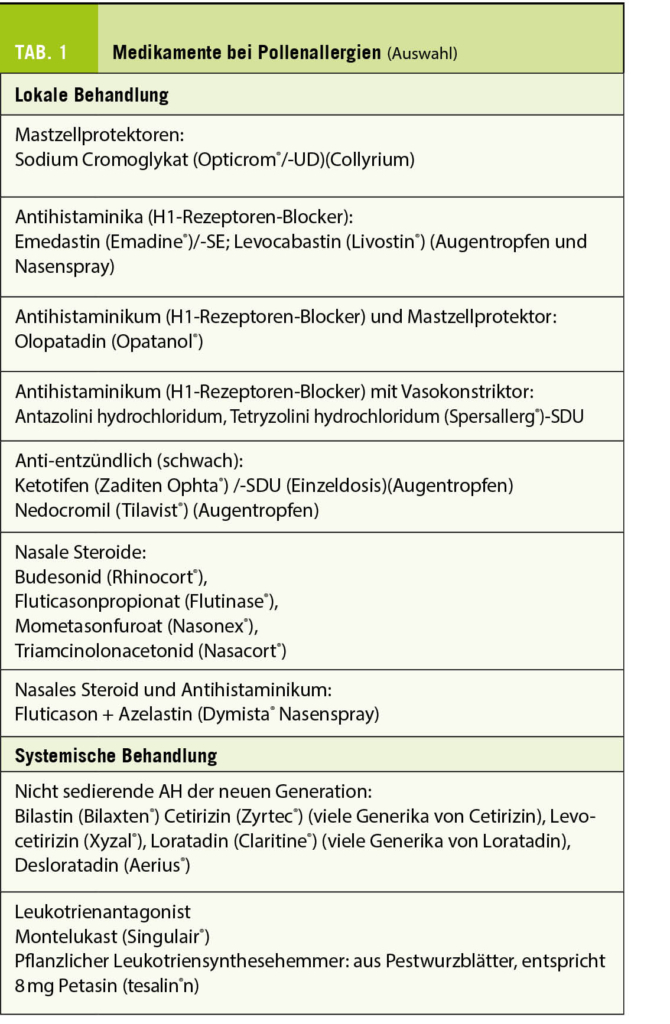
2022 jährt sich die erste Publikation zur Women’s Health Initiative-Studie (WHI-Studie) zum 20. Mal. Diese Studie wurde bei asymptomatischen Frauen mit einem mittleren Alter von 63 Jahren durchgeführt, von denen rund ein Drittel mit vorbestehenden Risikofaktoren belastet war. Diese Population ist für jüngere symptomatische peri- und früh postmenopausale Frauen nicht repräsentativ. Bei der Datenanalyse waren deshalb Subanalysen bei der jüngsten Altersgruppe zwischen 50-59 Jahren notwendig. Dies beeinträchtigte die statistische Power, führte aber zu neuen Erkenntnissen wie dem «Window of Opportunity». Die WHI-Studie muss immer im Zusammenhang mit anderen Studien interpretiert werden. Eine individualisierte transdermale E2-Gabe, wenn nötig kombiniert mit mikronisiertem Progesteron oder Dydrogesteron, kann auch nach der WHI-Studie als sicher gelten. Die Menopausale Hormon-Therapie deckt als einziges Therapieprinzip gleichzeitig die Behandlung des klimakterischen Syndroms und die Frakturprävention ab.
2022 marks the 20th anniversary of the first publication on the Women’s Health Initiative study (WHI study). This study was conducted in asymptomatic women with a median age of 63 years, about one-third of whom had pre-existing risk factors. Such a population is not representative for younger symptomatic peri- and early postmenopausal women. Therefore, subanalyses were essential in the youngest age group between 50-59 years. This affected the statistical power, but allowed the discovery of new therapeutic laws such as the «window of opportunity». The WHI study must always be interpreted in the context of other studies. Transdermal estradiol, if needed combined with micronised progesterone or dydrogesterone is considered to be safe. Menopause Hormone Therapy is the only therapeutic principal that covers at the same time the treatment of the climacteric syndrome as well as fracture prevention.
Key Words: WHI Study – menopause – estrogens – climacteric syndrome – osteoporosis – cardiovascular diseases
Das späte Eingeständnis von WHI-Investigatoren, dass nach der Erstpublikation aus der WHI-Studie wissenschaftliche und ethische Regeln verletzt worden waren, erlaubt es, die Datenlage zur Menopausalen Hormon-Therapie (MHT) objektiv in ihren methodischen Grenzen zu sehen. Die WHI-Studie hat neue Erkenntnisse gebracht wie die Existenz eines «günstigen Fensters» innerhalb dessen der Nutzen die Risiken überwiegt. Jede MHT erfordert eine klare individualisierte Indikation. In die Nutzen-Risiko-Abwägung müssen die günstigen Nebenwirkungen einer MHT ebenso wie die evidenzbasierten nicht-hormonalen Alternativen mit einbezogen werden. Eine individualisierte transdermale E2-Gabe, wenn nötig kombiniert mit mikronisiertem Progesteron oder Dydrogesteron, kann auch nach der WHI-Studie als sicher gelten. Diesen Sommer jährt sich die erste Publikation zur Women’s Health Initiative-Studie zum 20. Mal. Seither wurden die durch diese Studie aufgeworfenen Fragen weitgehend geklärt. Es ist daher zulässig, eine Bilanz zu ziehen.
Indikationen der Hormon-Ersatz-Therapie bis 2002
Vor 2002 galt, dass eine Hormonersatztherapie (HET) die Symptome des klimakterischen Syndroms lindert, die Lebensqualität nach der Menopause verbessert und die Abnahme der Knochendichte reduziert. Ein «International Position Paper on Women’s Health and Menopause» (1) hielt diese Punkte gestützt auf die bereits damals solide Evidenz (2-9) als Indikationen fest. Die Reduktion der gesamten und der kardiovaskulären Mortalität wurde im Lorenzini-Report als günstige Nebenwirkungen, aber nicht als Indikation aufgeführt.
Ziele der Women’s Health Initiative-Studie
Die WHI-Studie wollte zeigen, dass die Prävention weiterer estrogenmangel-bedingter Krankheiten, insbesondere der kardiovaskulären Erkrankungen, zu den Indikation einer HET gehören soll. Wegen der Vorgabe einer niedrigen Drop-Out-Rate in der Placebogruppe und einer raschen Rekrutierung schlichen sich folgende Biases in die Studie ein:
1. Die Behandlung des klimakterischen Syndroms war kein Studienziel. Symptomatische Frauen wurden ausgeschlossen. Das mittlere Alter betrug daher bei Studieneinschluss 63 Jahre, der mittlere Abstand zur Menopause 12 Jahre. Aus heutiger Sicht hätte in dieser älteren asymptomatischen Population eine HET nicht mehr begonnen werden dürfen.
2. Es wurden überproportional viele Frauen mit vorbestehenden Erkrankungen rekrutiert. Die Volontärinnen wiesen in 34% einen BMI ≥ 30kg/m2, waren in 50 % Raucherinnen und litten in 36 % an einer arteriellen Hypertonie; knapp 13 % nahmen bereits Statine und 20 % eine Aspirintherapie ein.
Somit wurde für den WHI-Trial eine Studienpopulation selektioniert, die nicht der Normalpopulation entsprach, bei der in der Praxis eine HET verschrieben wird. Ungünstig wirkten sich auch die Wahl einer ausschliesslich peroralen HET mit konjugierten equinen Estrogenen (CEE) und Medroxyprogesteron-Azetats (MPA) aus, ein Gestagen mit glucocorticoider Partialwirkung. CEE und MPA waren 2002 Marktführer in den USA und wurden von einem Sponsor der Studie produziert.
Erste Analyse zur WHI-Studie und deren Folgen
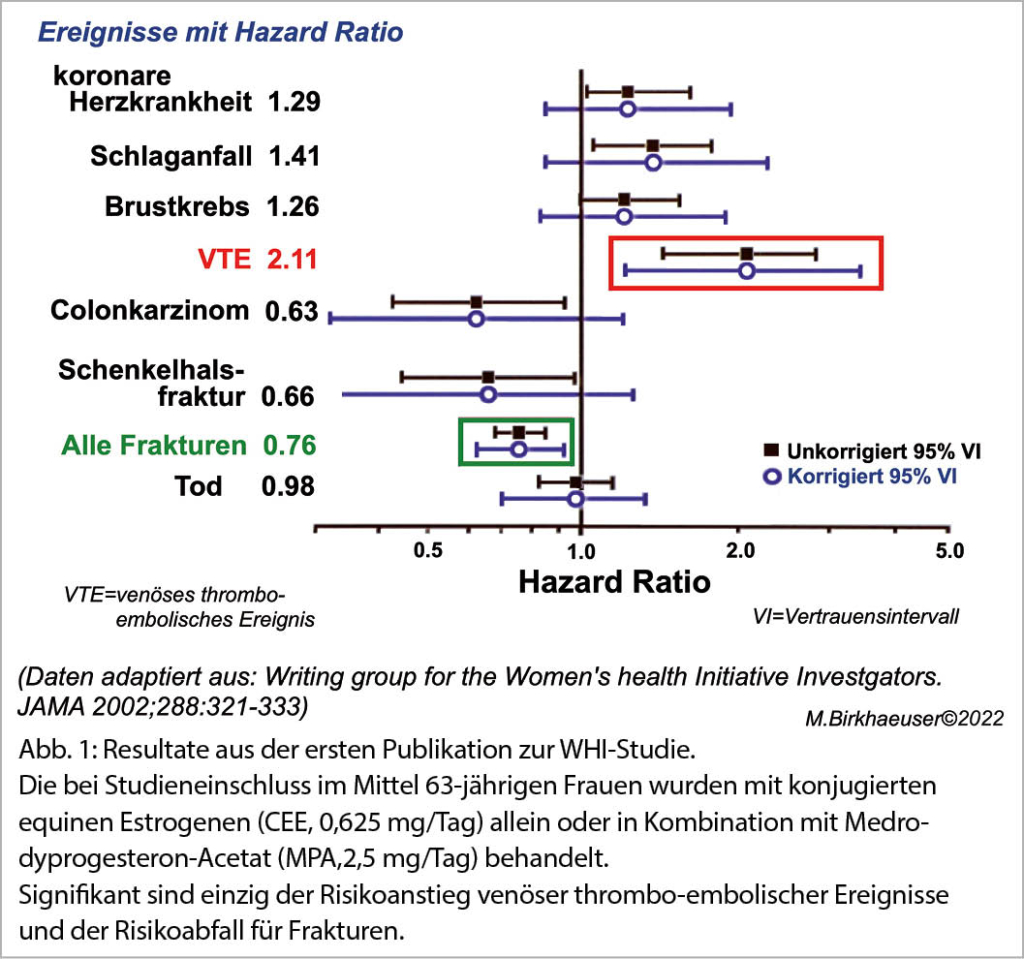
Die erste Publikation zum WHI-Trial von 2002 (10) umfasste die Gesamtpopulation im Alter von 50-79 Jahren (mittleres Alter:
63 Jahre). Nur die Senkung des Frakturrisikos und der Anstieg venöser thrombo-embolischer Ereignisse waren signifikant (Abb. 1), alle andern Parameter veränderten sich nicht signifikant. Durch gezielte Leaks vor dem Erscheinen des Artikels bekamen Laienmedien einen Vorsprung vor den nicht informierten Experten (Abb. 2), was sich auf die Wahrnehmung der Studienresultate verheerend auswirkte (11).
Leider wurde nicht nur in den Laienmedien übersehen,
- dass sich diese Daten auf ältere und mit Krankheiten vorbelastete Frauen bezogen,
- dass nicht zwischen korrigierten und unkorrigierten Resultaten unterschieden und dass nicht-signifikante Risikoveränderungen wie diejenige von Brustkrebs hochgespielt wurden.
- dass die Risiken überschätzt und falsche Schlüsse zur Indikation der HET bei gesunden symptomatischen Frauen im Alter von 50-59 Jahren gezogen wurden.
Als direkte Folge dieses Artikels lehnten viele Frauen eine HET ab. Nach 2002 litten in den USA 20 % der Frauen unter 55 Jahren an starken klimakterischen Beschwerden, da die noch eingesetzten alternativen Methoden nicht wirksam genug waren. Dies liess nach 2002 auch Morbidität und Mortalität ansteigen:
◆ Zwischen 2002-2011 verstarben in den USA 58’000 Frauen im Alter von 50-59 Jahren mit Estrogenmangel vorzeitig. Diese vermeidbare Exzess-Mortalität betraf 13/10,000 Frauen/Jahr. 12 der 13 vorzeitigen Todesfälle waren kardiovaskulär bedingt (12, 13).
◆ Eine Abnahme der HET um 50 % führte in den USA zu einem um 50 % erhöhten Frakturrisiko, entsprechend 43’000 vermeidbaren zusätzlichen Frakturen/Jahr (14).
Erkenntnisse aus den Subanalysen zur WHI-Studie
Erst die ab 2007 publizierten Subanalysen in der Altergruppe von 50-59 Jahren erlaubten ein differenziertes Bild zu Nutzen und Risiken einer Menopausalen Hormon-Therapie (MHT = HET). Dies wurde mit einem Verlust an statistischer Power erkauft.
Totale Mortalität
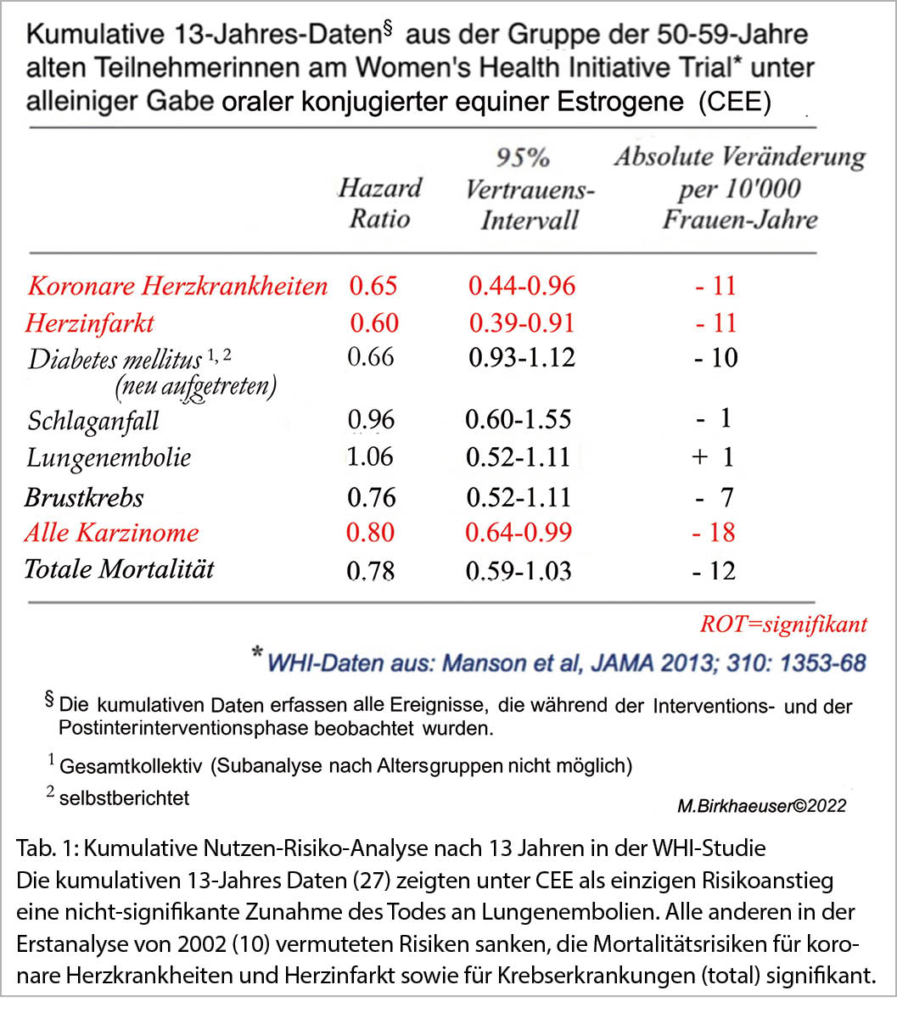
Die Subanalyse von 2007 ergab für Frauen von 50-59 Jahren unter MHT eine um 30% verminderte totale Mortalität (p<0.05). Bei Frauen von 70-79 Jahren stieg sie an (15). Dies stimmte mit einer älteren Metaanalyse überein, welche für die totale Mortalität bei Frauen ≤ 60 Jahren unter MHT einen signifikanten Abfall der Odds Ratio (0,61; VI 0,39-0,95; 9) gefunden hatte. Die kumulativen 13-Jahres-Daten (27) zeigten unter CEE als einzigen Risikoanstieg eine nicht-signifikante Zunahme des Todes an Lungenembolien (Tab. 1). Alle andern in der Erstanalyse von 2002 (10) vermuteten Risiken sanken in absoluten Fallzahlen ab. Die kumulativen 18-Jahres-Daten zeigten für die gesamte Studienpopulation, alle Altersgruppen und beide Studien (CEE allein und CEE+MPA) zusammengenommen, für die Interventionsphase und den kumulativen Follow-Up keine Veränderungen der totalen, der kardiovaskulären und der krebsbedingten Mortalität (28). In der Interventionsphase kam es für Frauen zwischen 50-59 Jahren im Gegenteil zu einer signifikanten Reduktion der Mortalität (Hazard Ratio 0,69 (p = 0,01) (28).
Diese Ergebnisse bestätigen ältere Langzeitresultate (29, 42). Auch die NHS (30) fand bis zu einer Beobachtungszeit von 36 Jahren keinen Anstieg der Gesamtmortalität.
Kardiovaskuläre Mortalität
Der Tod an koronaren Herzkrankheiten nahm in der WHI-Studie unter MHT signifikant ab (Tab. 1). Dies überrascht nicht, da perorale und transdermale Estrogene unter anderem die Inzidenz von Diabetes mellitus senken (28, 31-33) und einen günstigen Effekt auf die Arterienwand ausüben (34). Nach Absetzen der MHT steigt das Risiko wieder an (13).
Das Brustkrebs-Risiko
Unter CEE fiel das Risiko für Morbidität und Mortalität an Brustkrebs nach einem medianen Follow-Up von 11,8 Jahren signifikant (37). Die kumulativen 13-Jahres Daten fanden eine nicht-signifikant gesenkte Mortalität an Brustkrebs, die auch nach 18 Jahren erniedrigt blieb (38). Dies könnte auch dadurch erklärt werden, dass Frauen mit metabolischem Syndrom und Adipositas in der WHI-Studie überrepräsentiert waren.
In einem RCT bei einer dänischen Normalpopulation fand sich nach 16 Jahren für Brustkrebs keine Risikoveränderung (29). Die NHS (30) beobachtete erst bei einer HET-Einnahme von >20 Jahren einen Anstieg des relativen Risikos auf 1,42. (95% VI 1,13–1,77). Bei Beginn innerhalb des «günstigen Fensters» ist nach der Internationalen Menopausegesellschaft (IMS; 20) das Risiko eines mit einer MHT assoziierten Mammakarzinoms klein und wird auf weniger als 0.1 % pro Jahr oder auf eine Inzidenz von <1.0 per 1000 Frauen pro Anwendungsjahr geschätzt. Dies ist vergleichbar oder niedriger als alltägliche Risiken wie geringe körperliche Aktivität, Adipositas oder Alkoholeinnahme (20, 21).
Dennoch hält sich das Misstrauen gegenüber einer MHT weiter, obwohl in der Schweiz sechsmal mehr Frauen an Herz-Kreislauf-Krankheit als an einem Brustkrebs sterben (Abb. 3).
Das Eingeständnis von 2016
Das offizielle Eingeständnis der Schwächen der WHI-Studie kam erst 2016 über eine Review mit dem Titel ««Getting Clinical Care back on Track» (25). Sie wurde von WHI-Investigatoren verfasst und enthält folgende Kernaussagen:
- Die Resultate aus der WHI-Studie bei älteren Frauen wurden auf unangemessene Weise dazu benützt, um therapeutische Entscheide für jüngere Frauen in ihren 40-ern und 50-ern zu treffen. Damit wurden wissenschaftliche und ethische Regeln verletzt.
- Die systemische MHT ist die wirksamste heute verfügbare Behandlung der klimakterischen Symptome und sollte bei
Fehlen von Kontraindikationen bei mittelstarken bis schweren vasomotorischen Symptomen empfohlen werden. - Unbehandelte menopausale Symptome sind mit höheren Gesundheitskosten und einem Verlust an Leistungsfähigkeit verbunden.
- Das Widerstreben gegen die hormonelle Behandlung klimakterischer Beschwerden ist nach der WHI-Studie entgleist und führte zu einer grossen und unnötigen Last an Leiden und zur Propagierung von ungeprüften und unregulierten Ersatzbehandlungen, welche die Gesundheit von peri- und postmenopausalen Frauen nachhaltig schädigen können.
- Es hat sich der Konsensus herauskristallisiert, dass der Nutzen einer MHT die Risiken überwiegt
Mit dieser Review schlossen sich die WHI-Autoren den internationalen und nationalen Empfehlungen an (Global Consensus, Empfehlungen der IMS, Schweizer Expertenbrief) (20, 21, 26).
Erkenntnisse zur modernen MHT aus anderen Studien
Gleichzeitig zum WHI-Trial wurden vor allem in Europa Studien zu nicht-oralen Präparaten und zu metabolisch günstigen Gestagenen vorangetrieben.
Transdermal oder peroral?
Eine transdermale Gabe von E2 vermeidet den Anstieg von thrombo-embolischem Risiko und CVI einer oralen MHT, solange die Standarddosis von 50µg E2/Tag nicht überschritten wird (16-19). Orale und transdermale MHT unterscheiden sich nicht in ihrer Wirkung auf das klimakterische Syndrom, das Skelett und auf die Brust.
Welches Gestagen?
Gestagene beeinflussen das Risiko einer Estrogentherapie. Nicht alle Gestagene haben das gleiche metabolische Risikopotential. Ein Klasseneffekt für Gestagene existiert nicht.
Die Zugabe von mikronisiertem Progesteron oder Dydrogesteron zu E2/EV besitzt ein signifikant niedrigeres Risiko für das kardiovaskuläre System, Bustkrebs und thrombo-embolische Ereignisse als diejenige anderer Gestagene (16-19, 22-24); weiterführende Literatur in (20, 21).
Wie lange behandeln?
In Europa geben im Mittel 74% (Range 60%-88%) aller Frauen klimakterische Symptome an. Oft wird unterschätzt, wie lange VMS andauern können (39-41):
- rund 25 % aller Frauen leiden noch mit > 65 Jahren unter VMS
- Bei 85-jährigen Frauen litten noch 16 % tagsüber und/oder nachts an VMS, 10 % litten stark bis mittelstark darunter
- in dieser Gruppe benötigten 6,5 % noch regelmässig eine MHT
Die Fortführung einer MHT nach dem Alter von 65 Jahren darf somit nicht willkürlich limitiert werden. Die Indikation muss jährlich auf das Auftreten von Kontraindikationen überprüft werden. Bei Frauen ≥ 60 Jahren wird bei Verdacht auf fortgeschrittene Atherosklerose eine Messung der Carotis-Intima-Media-Dicke empfohlen.
Indikationen für eine MHT 2022
Behandlung des klimakterischen Syndroms
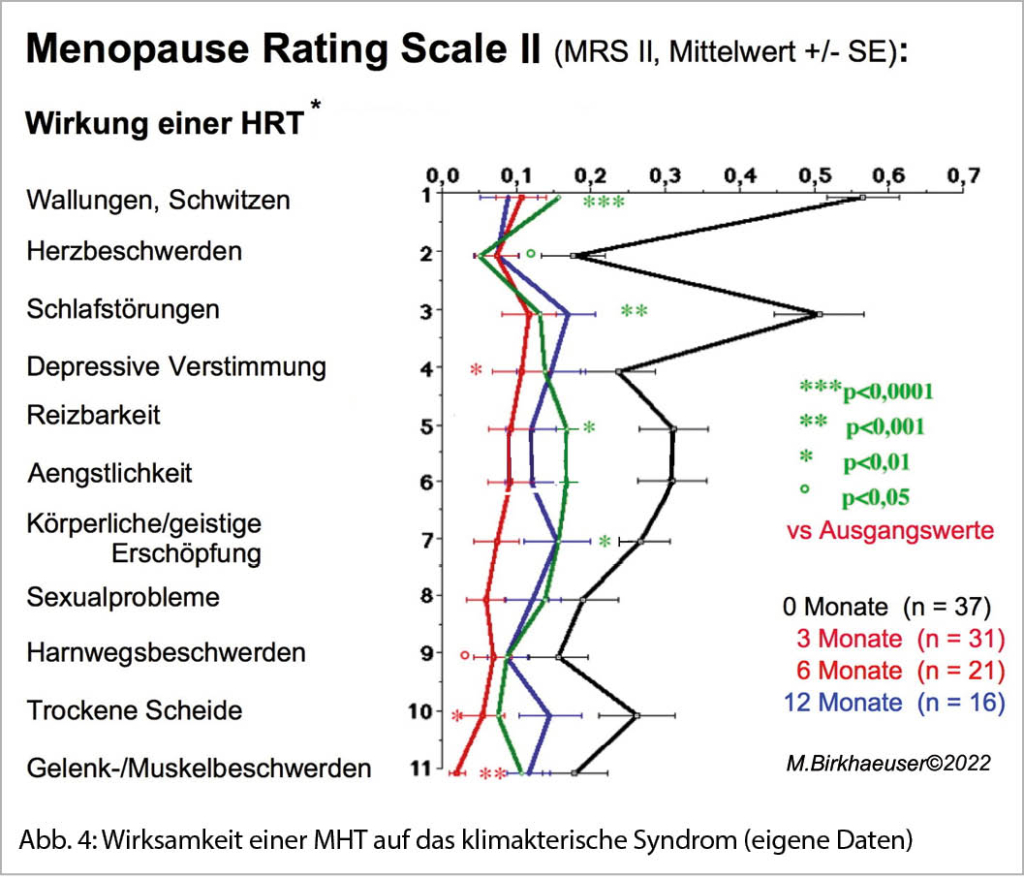
Die MHT bleibt die wirksamste Behandlungsmöglichkeit schwerer klimakterischer Beschwerden, die auf nicht-hormonale Möglichkeiten nicht ansprechen (Abb. 4).
Oft reicht für klimakterische Symptome eine niedrigere als die Standard-Dosierung aus (2mg E2 peroral, 50µg E2 transdermal, 1,0–1,5mg E2 als Gel pro Tag).
Bei symptomatischer vaginaler Atrophie ist die lokale niedrig dosierte Gabe von Estrogenen oder DHEA der systemischen MHT überlegen.
Frakturprävention
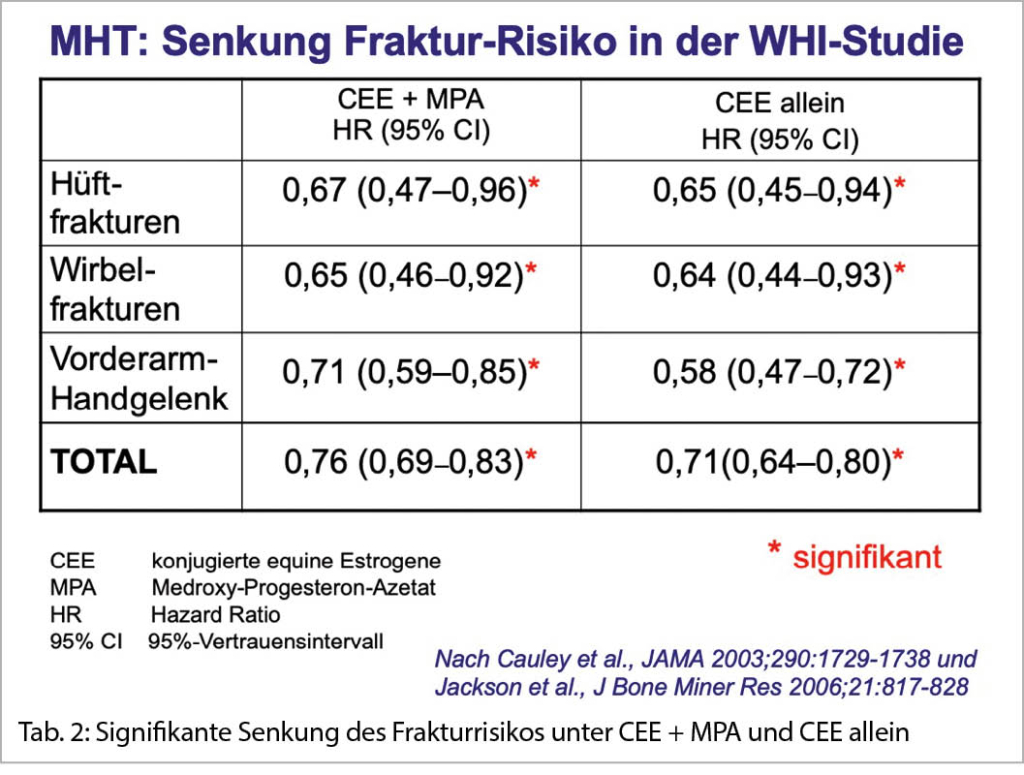
Die Wahrscheinlichkeit einer Fraktur an einer der vier Hauptlokalisationen (Wirbelsäule, Schenkelhals, Vorderarm, proximaler Humerus; «Major Fractures») liegt bei 40 % oder mehr, das lebenslängliche Risiko bei einer gesunden 50-jährigen Frau bei 52.3 %. Die verbleibende Ueberlebenszeit nach einer «Major Fracture» ist weniger günstig als nach einem Mammakarzinom. (43, 44). Die fatale erste Fraktur muss daher vermieden werden. Nur für eine Estrogengabe wurde auch bei gesunden Frauen (≤60 Jahre) ohne erhöhtes Frakturrisiko eine signifikante Senkung um 25–40 % für einen Knochenbruch an allen Lokalisationen nachgewiesen (Tab. 2) (44). Eine MHT verbessert zudem die «Stossdämpferfunktion» der Zwischenwirbelscheiben (46, 47). Sie ist wirksam, sicher und kosteneffektiv (NNT = 7) (45). Ihr Schutzeffekt hält bis zu 15 Jahre nach Absetzen an (45). Frakturdaten gibt es nur für die obige Standard-Dosierung. Beim Einsatz einer niedrigen oder ultraniedrigen E2-Dosierung zur Frakturprävention sollte deren Wirksamkeit durch die Messung der Knochendichte mittels DXA oder allenfalls durch die Bestimmung von Knochenmarkern überprüft werden.
Raloxifen, das einzige in der Schweiz zugelassene SERM, ist bei Frauen mit erhöhtem Brustkrebsrisiko eine Alternative zur MHT. Sein osteoprotektiver Schutz ist nur an der Wirbelsäule, aber nicht am nicht-vertebralen Skelett gesichert (48).
Prämature Ovarialinsuffizienz (POI)
Bei jeder POI besteht zumindest bis zum Alter des normalen Menopauseneintritts eine absolute Indikation für eine MHT (49, 50)
Relevante günstige Nebenwirkungen
Die Verminderung des kardiovaskulären Risikos durch eine MHT wird heute als Zusatznutzen, aber nicht als selbstständige Indikation für eine MHT anerkannt (11, 20, 21, 27-28, 42). Eine weitere günstige Nebenwirkung der MHT scheint auch eine Neuroprotektion zu sein (11, 20, 21, 27, 28, 35, 36). Günstige Nebenwirkungen können bei der Individualisierung einer MHT einbezogen werden.
Schlussfolgerungen
Das Eingeständnis von WHI-Investigatoren, dass nach der Erstpublikation aus der WHI-Studie (10) wissenschaftliche und ethische Regeln verletzt worden sind, erlaubt es uns heute, die Datenlage zur MHT objektiv in ihren methodischen Grenzen zu sehen. Nicht immer ist ein RCT die beste verfügbare Evidenz. Dies kann auch eine solide und gut geplante Beobachtungsstudie sein, wenn diese als einzige bei derjenigen Population durchgeführt wurde, die später mit dem untersuchten Präparat behandelt werden soll. Nach Jahren von Hybris und Fehlschlüssen sind wir zu den schon im Lorenzini-Report von 2002 (1) empfohlenen und seit vier Jahrzehnten gesicherten Indikationen zurückgekehrt: back to the roots!
Die WHI-Studie ist dennoch eine wichtige Studie. Sie hat uns zu neuen Erkenntnissen geführt wie der Existenz eines «günstigen Fensters». Innerhalb dieses «günstigen Fensters» (Beginn der MHT bei Frauen < 60 Jahre oder weniger als 10 Jahre von der Menopause entfernt) überwiegt der Nutzen die Risiken. Eine individualisierte transdermale E2-Gabe, wenn nötig kombiniert mit mikronisiertem Progesteron oder Dydrogesteron, kann auch bei älteren gesunden Frauen als sicher eingestuft werden.
Jede MHT erfordert eine klare individualisierte Indikation. Bis heute ist die MHT das einzige therapeutische Prinzip, das gleichzeitig beide Indikationen abdeckt, klimakterisches Syndrom und Frakturprävention. In die Nutzen-Risiko-Abwägung müssen die günstigen Nebenwirkungen einer MHT ebenso wie die evidenzbasierten nicht-hormonalen Alternativen mit einbezogen werden.
Copyright bei Aerzteverlag medinfo AG
Gartenstrasse 67
4052 Basel
martin.birkhaeuser@bluewin.ch
Der Autor hat keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
1. INTERNATIONAL POSITION PAPER ON WOMEN’S HEALTH AND MENOPAUSE: a comprehensive approach. National Heart, Lung and Blood Institute, Office of Research on Women’s Health and Giovanni Lorenzini Medical Science Foundation. Wenger NK, Paoletti R, Lenfant CJM and Pinn VW, editors. NIH PUBLICATION NO. 02-3284, July 2002.
2. Grodstein F, Stampfer MJ, Colditz GA et al. POSTMENOPAUSAL HORMONE
THERAPY AND MORTALITY. N Engl J Med 1997;336:1769-75.
3. Grodstein F, Manson JAE, Colditz GA et al. A Prospective, Observational Study of Postmenopausal Hormone Therapy and Primary Prevention of Cardiovascular Disease. Ann Intern Med. 2000;133:933-941.
4. Grodstein F, Manson JAE. Stampfer MJ. Postmenopausal Hormone Use and
Secondary Prevention of Coronary Events in the Nurses’ Health Study. Ann Intern Med. 2001;135:1-8.
5. Grodstein F, Manson JAE. Stampfer MJ. Hormone Therapy and Coronary Heart Disease: The Role of Time since Menopause and Age at Hormone Initiation. JOURNAL OF WOMEN’S HEALTH 15;2006:35-44.
6. Grodstein F, Manson JAE. Stampfer MJ and Rexrode K. Postmenopausal Hormone Therapy and Stroke. Arch Intern Med. 2008;168(8):861-866.
7. Writing group for the PEPI Trial. Effects of estrogen or estrogen/progestin regimens on heart disease risk factors in postmenopausal women. JAMA 1995;273:199–208.
8. Hulley S, Grady D, Bush T, et al. Randomized trial of estrogen plus progestin for secondary prevention of coronary heart disease in postmenopausal women. Heart and Estrogen/progestin Replacement Study (HERS) Research Group. JAMA 1998;280:605–13.
9. Salpeter SR, Walsh JME, Greyber E et al. Mortality Associated with Hormone
Replacement Therapy in Younger and Older Women. J GEN INTERN MED 2004;19:791-804.
10. Rossouw JE, Anderson GL, Prentice RL, et al.; Writing Group for the Women’s Health Initiative Investigators. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results from the Women’s Health Initiative randomized controlled trial. JAMA 2002;288:321–333.
11. Langer RD, Hodis HN, Lobo RA and M. A. Allison MA. Hormone replacement therapy – where are we now? CLIMACTERIC 2021;24(1):3–10.
12. Sarrel PM, Njike VY, Vivante V, Katz DL (2013) The Mortality Toll of Estrogen Avoidance: An Analysis of Excess Deaths Among Hysterectomized Women Aged 50 to 59 Years. Am J Public Health 103: 1583-8.
13. Mikkola TS, Tuomikoski P, Lyytinen H et al. Increased cardiovascular mortality risk in women discontinuing postmenopausal hormone therapy. J Clin Endocrinol Metabol 2015; 100: 4588–4594.
14. Karim R, Dell RM, Greene DF et al. Hip fracture in postmenopausal women after,cessation of hormone therapy: results from a prospective study in a large
health,mmanagement organization. Menopause . 2011 November ; 18(11): 1172–1177.
15. Rossouw JE, Prentice RL, Manson JAE et al. Postmenopausal hormone therapy and risk of cardiovascular disease by age and years since menopause. JAMA 2007;297:1465-1477.
16. Canonico M, Plu-Bureau G, Lowe GD, Scarabin PY. Hormone replacement therapy and risk of venous thromboembolism in postmenopausal women: systematic review and meta-analysis. BMJ 2008;336:1227–31.
17. Canonico M, Fournier A, Carcaillon L, et al. Postmenopausal hormone therapy and risk of idiopathic venous thromboembolism: results from the E3N cohort study. Arterioscler Thromb Vasc Biol 2010;30:340–345.
18. Canonico M, Oger E, Conard J, et al. EStrogen and THromboEmbolism Risk
(ESTHER) Study Group. Obesity and risk of venous thromboembolism among postmenopausal women: differential impact of hormone therapy by route of estrogen administration. The ESTHER Study. J Thromb Haemost 2006;4:1259–65.
19. Olié V, Plu-Bureau G, Conard J, et al. Hormone therapy and recurrence of venous thromboembolism among postmenopausal women. Menopause 2011;18:488–93.
20. Baber RJ, Panay N & Fenton A. The IMS Writing Group. IMS Recommendations on Women’s Midlife Health and Menopause Hormone Therapy. CLIMACTERIC 2016;19:2, 109-150, DOI: 10.3109/13697137.2015.1129166.
21. de Villiers TJ, Hall JE, Pinkerton JV et al. Revised Global Consensus Statement on Menopausal Hormone Therapy. Climacteric 2016 http://dx.doi.org/10.1080/13697137.2016.1196047.
22. Fournier A, Berrino F, Clavell-Chapelon F. Unequal risks for breast cancer
associated with different hormone replacement therapies: results from the E3N cohort study. Breast Cancer Res Treat 2008;107:103–111.
23. Cordina-Duverger E, Truong T, Anger A, et al. Risk of breast cancer by type of £menopausal hormone therapy: a casecontrol study among post-menopausal women in France. PLoS One 2013;8:e78016.
24. Lyytinen H, Pukkala E, Ylikorkala O. Breast cancer risk in postmenopausal women using estradiol–progestogen therapy. Obstet Gynecol 2009;113:65–73.
25. Manson JAE and Kaunitz AM. Menopause Management – Getting Clinical Care back on Track. NEJM 2016; 374:903-806.
26. Expertenbrief Nr. 42 Menopausale Hormon-Therapie. 28.8.2015.
https://www.sggg.ch/fachthemen/expertenbriefe/
27. Manson JAE, Chlebowski RT, Stefanick ML et al. Menopausal Hormone Therapy and Health Outcomes During the Intervention and Extended Poststopping Phase of the Women’s Health Initiative Randomized Trials. JAMA. 2013;310(13):1353-1368. doi:10.1001/jama.2013.278040
28. Manson JAE, Aragaki AK, Rossouw JE et al. Menopausal Hormone Therapy
and Long-term All-Cause and Cause-Specific Mortality. The Women’s Health Initiative Randomized Trials. JAMA. 2017;318(10):927-938. doi:10.1001/jama.2017.11217
29. Schierbeck LL, Rejnmark L, Tofteng CL, et al. Effect of hormone replacement therapy on cardiovascular events in recently postmenopausal women: randomised trial. BMJ2012;345:e6409.
30. Bhupathiraju SN, Grodstein F, Stampfer MJ et al. Exogenous Hormone Use: Oral Contraceptives, Postmenopausal Hormone Therapy, and Health Outcomes in the Nurses’ Health Study. Am J Public Health. 2016;106:1631–1637. doi:10.2105/AJPH.2016.303349.
31. de Lauzon-Guillain B, Fournier A, Fabre A, et al. Menopausal hormone therapy and new-onset diabetes in the French Etude Epidemiologique de Femmes de la Mutuelle Generale de l’Education Nationale (E3N) cohort. Diabetologia 2009;52:2092–100.
32. Margolis KL, Bonds DE, Rodabough RJ et al. Effect of Estrogen plus progestin on the incidence of diabetes in postmenopausal women: results from the Women’s Health Initiative Hormone Trial. Diabetologia 2004;47:1175–1187.
33. Bonds DE, Lasser N, Qi L et al. The effect of conjugated equine Estrogen on diabetes incidence: The Women’s Health Initiative randomised trial. Diabetologica 2006;49:456-468.
34. Clarkson TB. Estrogen effects on arteries vary with stage of reproductive life and extent of subclinical atherosclerosis progression. Menopause 2007;14:373-384.
35. Shao H, Breitner JCS, Whitmer RA, et al. Hormone therapy and AD dementia: new findings from the Cache County study. Neurology 2012;79:1846–52.
36. Henderson VW, Benke KS, Green RC et al.;for the MIRAGE Study Group. Postmenopausal hormone therapy and Alzheimer’s disease risk: interaction with age. J Neurol Neurosurg Psychiatry 2005;76:103–105.
37. Anderson GL, Chlebowski RT, Aragaki AK et al. Conjugated equine oestrogen and breast cancer incidence and mortality in postmenopausal women with hysterectomy: extended follow-up of the Women’s Health Initiative randomised placebocontrolled trial. Lancet Oncol 2012; 13: 476–86.
38. Chen WY, Manson JE, Hankinson SE, Rosner B, Holmes MD, Willett WC, Colditz GA: Unopposed estrogen therapy and the risk of invasive breast cancer. Arch Intern Med 2006;166:1027–1032.
39. Hunter MS, Gentry-Maharaj A, Ryan A et al (2012) Prevalence, frequency and problem rating of hot flushes persist in older postmenopausal women: impact of age, body mass index, hysterectomy, hormone therapy use, lifestyle and mood in a cross-sectional cohort study of 10,418 British women aged 54–65. BJOG 119:40–50.
40. Huang AJ, MD, Grady D, Jacoby VL et al (2008) Persistent Hot Flushes in Older Postmenopausal Women. Arch Intern Med. 168(8):840-846.
41. Vikström J, Spetz Holm AC, Sydsjö G (2013) Hot flushes still occur in a population of 85-year old Swedish women. Climacteric 16; 453-459.
42. Mikkola TS, Tuomikoski P, Lyytinen H, et al. Estradiol-based postmenopausal hormone therapy and risk of cardiovascular and all-cause mortality. Menopause 2015;22:976–83.
43. Birkhaeuser M. Menopausale Hormontherapie zur Frakturprävention. Eine Standortbestimmung. Gynäkologische Endokrinologie 2015;13:188–194.
44. Birkhaeuser M. Healthy Bones After Menopause: What Has to Be Done? In Pre-Menopause, Menopause and Beyond: Volume 5: Frontiers in Gynecological Endo-crinology (M. Birkhaeuser and SR Genazzani, eds), pp 165.185. International Society of Gynecological Endocrinology 2018; Springer Nature, ISBN 978-3-319-63539-2.
45. Bagger YZ, Tanko LB, Alexandersen P et al. Two to three years of hormone replacement treatment in healthy women have long-term preventive effects on bone mass and osteoporotic fractures: the PERF study. Bone 2004;34:728–735.
46. Muscat-Baron Y, Brincat M, Galea R, Calleja N. Intervertebral disc thickness in treated and untreated postmenopausal women. Hum Reprod 2005;20:3566-3570.
47. Sornay-Rendu E, Munoz F, Duboeuf F, Delmas PD Disc space narrowing is associated with an increased vertebral fracture risk in postmenopausal women: The OFELY Study. J Bone Miner Res 2004;19:1994–1999.
48. Stute P und Birkhäuser M. Selektive Östrogenrezeptormodulatoren (SERM). Gynäkologische Endokrinologie 2015;13:126–134.
49. Shuster LT , Rhodes DJ, Gostout BS et al. Premature menopause or early menopause: Long-term health consequences. Maturitas 2010;65:161-166.
50. Rivera CM, Grossardt BR, Rhodes DJ et al. Increased cardiovascular mortality after early bilateral oophorectomy. Menopause 2009;16:15–23.