Hochrisikoläsionen der Brust bilden eine heterogene Gruppe an Befunden, welche eine Herausforderung im klinischen Alltag darstellen können. In diesem Beitrag werden die wichtigsten Hochrisikoläsionen der Brust erklärt und sowohl die Diagnostik, das therapeutische Management nach initialer Diagnose als auch die weiteren Empfehlungen im Rahmen des Follow-up besprochen.
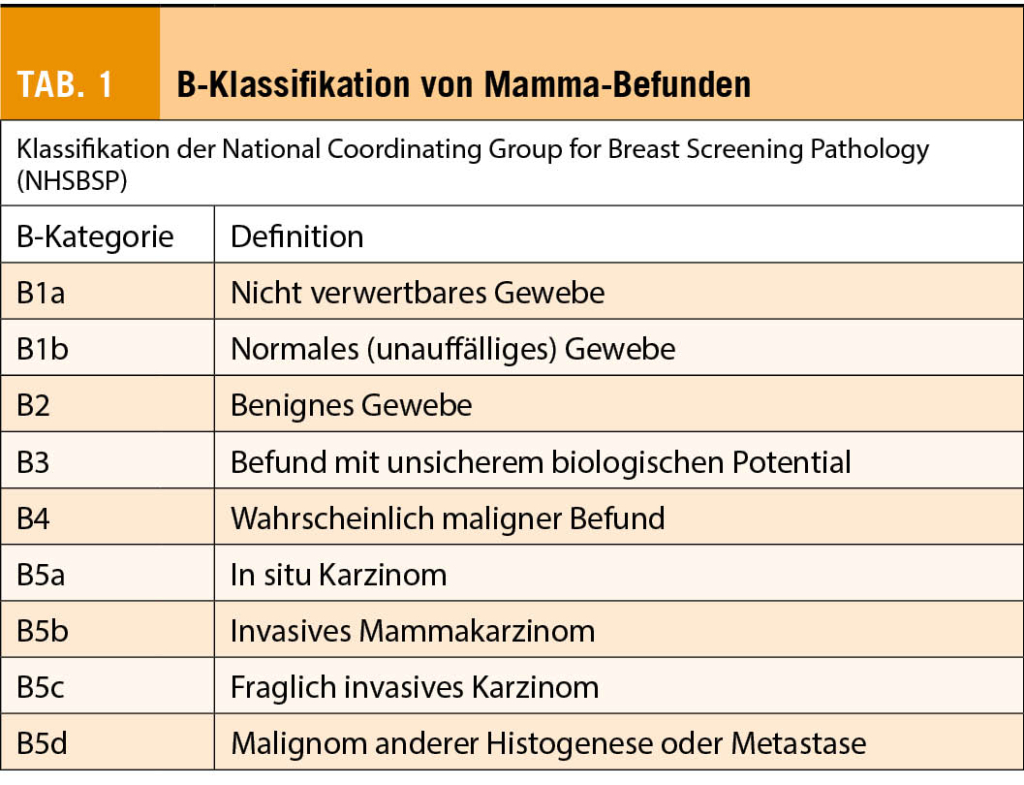
Auffällige Befunde der Mamma, welche sich in der Bildgebung präsentieren (Sonographie, Mammographie oder auch MRI), werden heutzutage in der Regel diagnostisch minimal-invasiv abgeklärt. Hierzu bietet sich die Stanzbiopsie (core needle biopsy, CNB) oder auch die Vakuumbiopsie (VAB) an. Für die Einteilung der histopathologischen Befunde hat sich im deutschsprachigen Raum und in vielen weiteren Ländern die so genannte B-Klassifikation durchgesetzt (siehe Tab. 1). Im Rahmen dieser Klassifikation werden die histopathologischen Befunde in 5 Gruppen eingeteilt (B1-B5). Bei den B1b- und B2-Läsionen handelt es sich um benigne Befunde, die seltene B4-Klassifikation umfasst Läsionen, bei denen in der Biopsie Malignität nicht ausgeschlossen werden kann und B5 beinhaltet die malignen Befunde. Eine Herausforderung im klinischen Alltag können die Befunde der B3-Klassifikation darstellen, bei welchen eine differenzierte und insbesondere interdisziplinäre Betrachtung notwendig ist. Bei den B3-Läsionen handelt es sich um eine heterogene Gruppe von Befunden, welche per Definition zwar primär nicht maligne sind, jedoch mit einem sogenannten «unsicheren biologischen Potential» einhergehen. Ein erhöhtes Risiko für die Patientin ergibt sich dabei zum einen durch einen, im Rahmen der weiteren Abklärung, doch noch nachweisbaren malignen Befund (sekundäres Upgrading). Zum anderen ist bei bestimmten B3-Läsionen eine zum Teil deutliche Risikoerhöhung für die zukünftige Entstehung eines malignen Befundes in der ipsi- oder auch kontralateralen Mamma bekannt, sodass diese Läsionen als Indikatorläsionen zu sehen sind.
Während in der Vergangenheit in der Regel eine offene Exzision als Therapiestandard galt, wird heutzutage die weitere Therapie wesentlich differenzierter festgelegt. Faktoren wie der histopathologische Subtyp, Befundgrösse, zusätzliche radiologische Kriterien oder auch das individuelle Risikoprofil der Patientin müssen bei der Therapieempfehlung mit betrachtet werden. Jede B3-Läsion sollte in einer postinterventionellen Konferenz unter Mitwirkung von Pathologen, Radiologen und Senologen diskutiert werden. Dabei ist die Korrelation von präinterventioneller Bildgebgung und histopathologischem Befund essentiell. Es gilt, ein unnötiges Overtreatment im Sinne einer standardmässigen offenen Exzision zu vermeiden. Hierbei muss die onkologische Sicherheit der Patientin jedoch gewährleistet sein. So sind bestimmte Subtypen mit einem malignen Potential von >30% assoziiert. Durchschnittlich lassen sich in ca. 17% der Fälle einer minimal-invasiv diagnostizierten B3-Läsion im Rahmen einer weiteren Abklärung doch noch höhergradige Neoplasien detektieren (1).
Der Nachweis einer B3-Läsion in Brustbiopsien ist in absoluten Zahlen in der Vergangenheit angestiegen. Dies wird durch Ausdehnung der Screeningprogramme, eine höhere Bereitschaft seitens der Patientin für eine bioptische Abklärung, aber auch durch eine höhere Awareness im Rahmen der Diagnostik erklärt. Bioptische Abklärungen mittels Vakuumbiopsie werden in der Schweiz seit mittlerweile über einer Dekade innerhalb einer zentralen Datenbank gesammelt (MIBB Datenbank). Die letzte Auswertung der Schweizer Daten mit konsekutiver Konsensuskonferenz erfolgte in 2018 (2). Die Auswertungen solcher Daten, aber auch verschiedene Handlungsalgorithmen bzw. Guidelines (z.B. AGO (3)) helfen, eine evidenzbasierte Therapieempfehlung in individuellen Situationen zu finden.
Die folgende Übersicht der häufigsten Hochrisikoläsionen soll neben einer histopathologischen Beschreibung insbesondere auch auf die mit den verschiedenen Subtypen assoziierte Risikoerhöhung sowie das empfohlene Management nach initialer Diagnose im Rahmen einer minimal-invasiven Biopsie eingehen.
Atypische duktale Hyperplasie
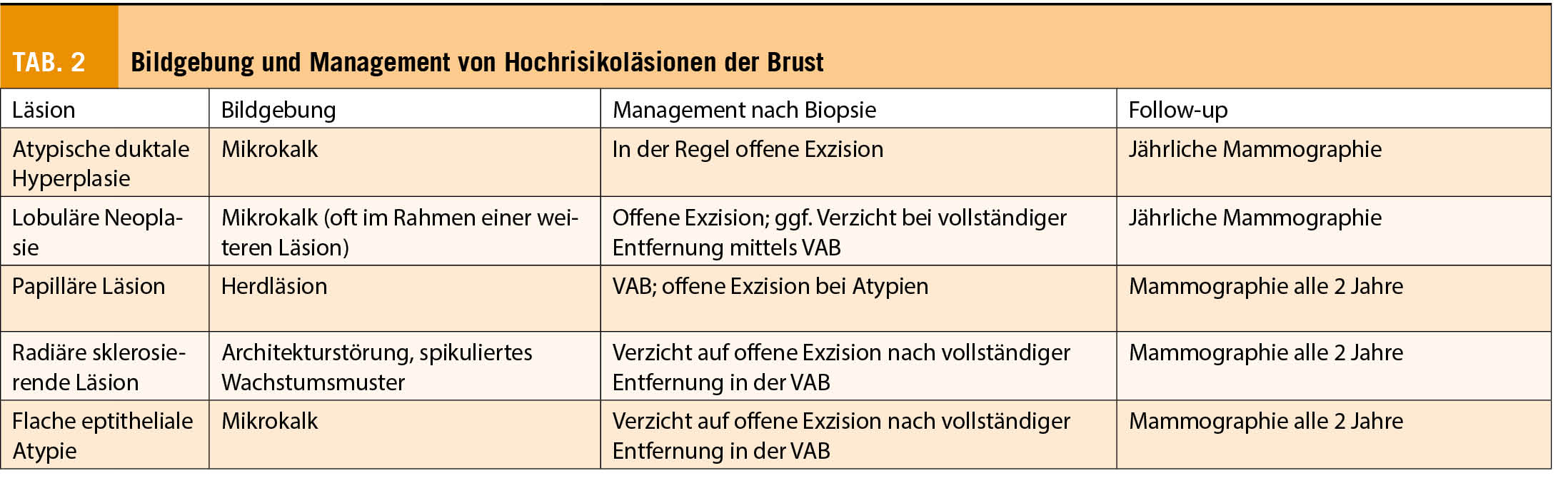
Bei der atypischen duktalen Hyperplasie (ADH) handelt es sich um eine der häufigsten diagnostizierten Risikoläsionen im Rahmen einer Screeningmammographie. Sie imponiert typischerweise durch gruppierten Mikrokalk. Histopathologisch ist sie durch eine intraduktale Epithelproliferation mit Atypien gekennzeichnet. Des Weiteren ist definiert, dass höchstens zwei ganz von atypischen Epithelproliferaten ausgefüllte Gänge vorhanden sind und der Durchmesser aller betroffenen Lumina in einer duktulolobulären Einheit (TDLU) nicht mehr als 2mm beträgt. Sofern diese Kriterien nicht erfüllt sind, liegt definitionsgemäss bereits ein low-grade DCIS vor. Somit stellt die Grösse der Läsion ein entscheidendes Merkmal zur wichtigen Unterscheidung zwischen einer ADH und einem DCIS dar. Entsprechend ist eine endgültige Unterscheidung an Stanzzylindern oftmals nicht möglich. Hieraus erklärt sich die hohe Rate an Upgrades zu höhergradigen Läsionen nach sekundär durchgeführter offener Biopsie, welche in der Literatur bei bis zu 40% beschrieben wird (4). Die Auswertung der MIBB Datenbank zeigte eine Upgrading in 25.2% der Fälle, wobei in 20.1% ein DCIS und in 5.2% ein invasives Karzinom in der definitiven Histopathologie detektiert wurde. Faktoren, die mit einem Upgrade korrelieren sind u.a. das Patientinnenalter, die Anzahl und Grösse der Biopsiezylinder sowie die Grösse der Läsion. Therapeutisch wird aufgrund der hohen Upgrade-Rate nach erfolgter Diagnose einer ADH im Rahmen einer Stanzbiopsie die offene Exzision empfohlen. Nach Diagnose einer ADH im Rahmen einer Vakuumbiopsie sollte ebenfalls eine offene Exzision diskutiert werden. In diesem Fall könnte allenfalls auf die offene Exzision verzichtet werden, sofern es sich lediglich um eine fokale Läsion handelte, welche in der Bildgebung komplett entfernt wurde. Bei Diagnose einer ADH zeigt sich ein erhöhtes ipsi- und kontralaterales Brustkrebsrisiko, welches nach 10 Jahren 4-5fach ist. Somit ist der Patientin die Durchführung einer jährlichen Mammographie zu empfehlen.
Lobuläre Neoplasie
Die Gruppe der lobulären Neoplasien (LN) beinhaltet die atypische lobuläre Hyperplasie (ALH) und das lobuläre Carcinoma in situ (LCIS). Die Subtypen der pleomorphen lobulären Neoplasie und die floride lobuläre Neoplasie gelten hingegen als maligne und entsprechen einer B5a-Läsion und werden analog zum DCIS behandelt. Histologisch zeigt sich bei der LN eine mässig bis hoch differenzierte intralobuläre Epithelproliferation (5). In der Mehrzahl der Fälle erfolgt die Diagnose dieser B3-Läsion als Zufallsbefund im Rahmen der Diagnostik einer weiteren Läsion, welche ursächlich für einen auffälligen mammographischen oder sonographischen Befund ist. Ausgenommen vom pleomorphen Subtyp ist die Darstellung von Mikrokalk selten, und wenn vorhanden, findet sich dieser in der Regel innerhalb einer weiteren Läsion anderer Histopathologie. Oftmals tritt sie multifokal bzw. multizentrisch und bilateral auf. Eine Unterschätzungsrate bei alleiniger minimal-invasiver Biopsie von bis zu 25% ist beschrieben (6,7). In der MIBB Datenbank zeigt sich nach erfolgter offener Exzision ein Upgrade auf ein DCIS bzw. pleomorphe Neoplasie in 13.1% der Fälle, zusätzlich erfolgte in 12.3% der Fälle der Nachweis eines invasiven Karzinoms. Darüber hinaus gilt die lobuläre Neoplasie als Indikator-/Vorläuferläsion mit einem 7-fach erhöhten ipsi- und kontralateralen Brustkrebsrisiko nach 10 Jahren. Bei Nachweis einer LN in der Vakuumbiopsie kann bei einem isolierten oder inzidentellen Befund mit Befall von ≤ 3 terminalen duktulolobulären Einheiten bei vollständiger Entfernung der radiologischen Läsion sowie Konkordanz mit der Bildgebung auf eine offene Exzision verzichtet werden. Bei in der Bildgebung nicht vollständig entfernter Läsion, ist die ergänzende offene Exzision empfohlen.
Auf Grund des erhöhten Risikos für die Entwicklung eines Mammakarzinoms ist analog zur ADH die jährliche Mammographie im Rahmen des Follow-up indiziert.
Papilläre Läsion
Bei Papillomen handelt es sich um von duktalem Epithel bekleidete Tumoren innerhalb vom Milchgangslumen. Histologisch können Atypien nachweisbar sein, welche prognostisch relevant sind. Papillomen können zentral oder in der Peripherie vorhanden sein. Je nach Lokalisation kann, im Gegensatz zu anderen B3-Läsionen, das typische klinische Bild einer uniduktalen serösen oder auch blutigen Mamillensekretion auftreten. In diesen Fällen lässt sich häufig primär der Nachweis einer auffälligen radiologischen Läsion mittels Sonographie oder MRI erbringen, während asymptomatische Papillome oft als Zufallsbefund in der Bildgebung erfasst werden. Das Unterschätzungsrisiko bei Nachweis einer papillären Läsion ist wie oben beschrieben v.a. abhängig vom Nachweis von Atypien. Während Upgrade-Raten bei Papillomen ohne Atypien bei ca. 10% beschrieben sind (MIBB Datenbank 7.7%), zeigt sich bei Nachweis von Atypien eine deutlich erhöhte Upgrade-Quote von >30% (8). Bei Nachweis eines Papilloms ohne Atypien im Rahmen einer Vakuumbiopsie kann auf eine offene Exzision verzichtet werden, sofern von einer repräsentativen Biopsie (100mm2) ausgegangen werden kann und keine Diskordanz zur Bildgebung besteht (3). Im Falle eines Nachweises eines Papilloms im Rahmen einer Stanzbiopsie kann ergänzend eine Vakuumbiopsie erfolgen, ohne dass eine offene Exzision erfolgen muss. Sofern multiple Papillome vorliegen bzw. Atypien nachgewiesen sind, ist die offene Exzision empfohlen.
Ein erhöhtes Risiko für die Entwicklung eines ipsilateralen Mammakarzinoms besteht v.a. bei Nachweis von Atypien. Somit kann bei fehlenden Atypien die reguläre zweijährige Screeningmammographie im Follow-up empfohlen werden.
Radiäre sklerosierende Läsion
Unter den radiären sklerosierenden Läsionen werden die radiäre Narbe (RN) und die komplexe sklerosierende Läsion (CSL) zusammengefasst. Als unterscheidendes Merkmal gilt die Grösse der Läsion. Während der Begriff der radiären Narbe für Befunde <1cm gewählt wird, werden Befunde >1cm als komplexe sklerosierende Läsion bezeichnet. Histologisch handelt es sich um eine pseudoinfiltrierende Läsion mit zentralem fibroelastischen Kern und radiärem Aufbau. Atypien können vorhanden sein. Die in der Bildgebung typischen Architekturstörungen bzw. das spikulierte Wachstumsmuster können die Unterscheidung zu einem invasiven Karzinom erschweren. Ein Upgrade zu einem DCIS/invasiven Karzinom in der Histologie nach offener Biopsie ist in unter 10% der Fälle beschrieben (MIBB Datenbank 8%) und ist u.a. mit dem Vorhandensein von Atypien assoziiert (9,10). Sofern es sich um eine kleine Läsion (<5mm) handelt oder der Befund in der Vakuumbiopsie bereits vollständig oder weitgehend vollständig entfernt wurde, kann auf eine offene Exzision verzichtet werden.
Im Rahmen des Follow-Up ist die zweijährige Screeningmammographie ausreichend.
Flache epitheliale Atypie
Bei der eher selteneren Diagnose (ca. 1-3% aller Mammabiopsien) einer flachen epithelialen Atypie (FEA), zeigen sich geringgradig atypische Zellen im Bereich der terminalen Drüsenendgänge, welche das native Epithel ersetzen und oft mit grobscholligem Kalk einhergehen. Entsprechend zeigt sich in der Bildgebung mittels Mammographie typischerweise gruppierter Mikrokalk, jedoch sind auch Zufallsbefunde im Rahmen einer Stanzbiopsie möglich. In der Umgebung einer FEA können sich weitere Veränderungen (u.a. ADH, lobuläre Neoplasie, low-grade DCIS oder gut differenzierte Karzinome) finden lassen. Die Upgrade-Rate nach offener Exzision wird mit 15% angegeben (6). Sofern der auffällige radiologische Befund im Rahmen einer Vakuumbiopsie vollständig bzw. weitgehend entfernt wurde, kann auf eine offene Exzision verzichtet werden. Bei verbliebenem Mikrokalk, ausgedehnten begleitenden Verkalkungen oder Diskordanz zum radiologischen Befund wird eine repräsentative offene Biopsie empfohlen.
Bei Nachweis einer FEA zeigt sich ein nur leicht erhöhtes Risiko (Faktor 1.5) für die Entwicklung von einem ipsi- oder kontralateralen Mammakarzinom (11), so dass die routinemässige zweijährliche Screeningmammographie ausreichend ist.
Copyright bei Aerzteverlag medinfo AG
Interdisziplinäres Brustzentrum Kantonsspital Baden
Frauenklinik, Kantonsspital Baden
Im Ergel 1
5404 Baden
marc.koernig@ksb.ch
Interdisziplinäres Brustzentrum Kantonsspital Baden
Frauenklinik, Kantonsspital Baden
Im Ergel 1
5404 Baden
Die Autoren haben keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Forester ND et al. High risk (B3) breast lesions: What is the incidence of malignancy for individual lesion subtypes? A systematic review and meta-analysis. Eur J Surg Oncol. 2019;45(4):519-527.
2. Rageth C et al. Second international Consensus Conference on lesions of uncertain malignant potential in the breast (B3 lesions). Breast Cancer Research and Treatment. 2019;174:279-296.
3. www.ago-online.de/leitlinien-empfehlungen/leitlinien-empfehlungen/kommission-mamma
4. Co M et al. Factors affecting the under-diagnosis of atypical ductal hyperplasia diagnosed by core needle biopsies: a 10-year retrospective study and review of the literature. Int J Surg; 2018;49:27–31.
5. Calle et al. Non-invasive lobular neoplasia of the breast: Morphologic features, clinical presentation, and management dilemmas. Breast J. 2020;(6):1448-1455.
6. Degnim AC et al. Surgical management of high-risk breast lesions. Surg Clin North Am. 2013;93(2):329-340.
7) Racz JM et al. Lobular Neoplasia and Atypical Ductal Hyperplasia on Core Biopsy: Current Surgical Management Recommendations. Ann Surg Oncol. 2017;24(10):2848-2854.
8. Khan S et al. Papillary lesions of the breast: To excise or observe? Breast J. 2018;24(3):350-355.
9. Chou WYY et al. Radial scar on image-guided breast biopsy: is surgical excision necessary? Breast Cancer Res Treat. 2018;170(2):313-320.
10. Rakha EA et al. Characterization and outcome of breast needle core biopsy diagnoses of lesions of uncertain malignant potential (B3) in abnormalities detected by mammographic screening. Int J Cancer. 2011;129(6):1417-24.
11. Aroner SA et al. Columnar cell lesions and subsequent breast cancer risk: a nested case-control study. Breast Cancer Res. 2010;12(4):R61.