Die ICD (interner Cardiverter Defibrillator) Therapie stellt eine sehr wirksame Prävention des plötzlichen Herztodes dar. Entscheidend ist eine sorgfältige Indikationsstellung hierfür, denn trotz der eindrücklichen Wirksamkeit der ICD-Therapie gibt es damit verbundene Risiken. Neuerdings können bei geeigneten Patienten subkutan liegende ICD Systeme implantiert werden, welche theoretische Vorteile diesbezüglich aufweisen könnten. Zur Überbrückung bis zur Implantation eines ICD Systems ist ferner die LifeVest verfügbar.
Obschon die kardiovaskuläre Mortalität durch bessere Behandlungsmöglichkeiten der koronaren Herzkrankheit (KHK) und der Herzinsuffizienz abgenommen hat, stellt der plötzliche Herztod (sudden cardiac death, SCD) weiterhin eine der häufigsten Todesursachen dar. Man schätzt, dass ein Viertel der kardiovaskulären Mortalität auf einen SCD zurückzuführen ist (1). Die effektivste Methode zur Verhinderung des plötzlichen Herztodes ist der Implantierbare Cardioverter Defibrillator (ICD), welcher der medikamentösen antiarrhythmischen Therapie in der Sekundärprophylaxe als auch der Primärprophylaxe des SCD bei Patienten mit entsprechendem Risikoprofil überlegen ist (1).
Funktionsweise eines ICD
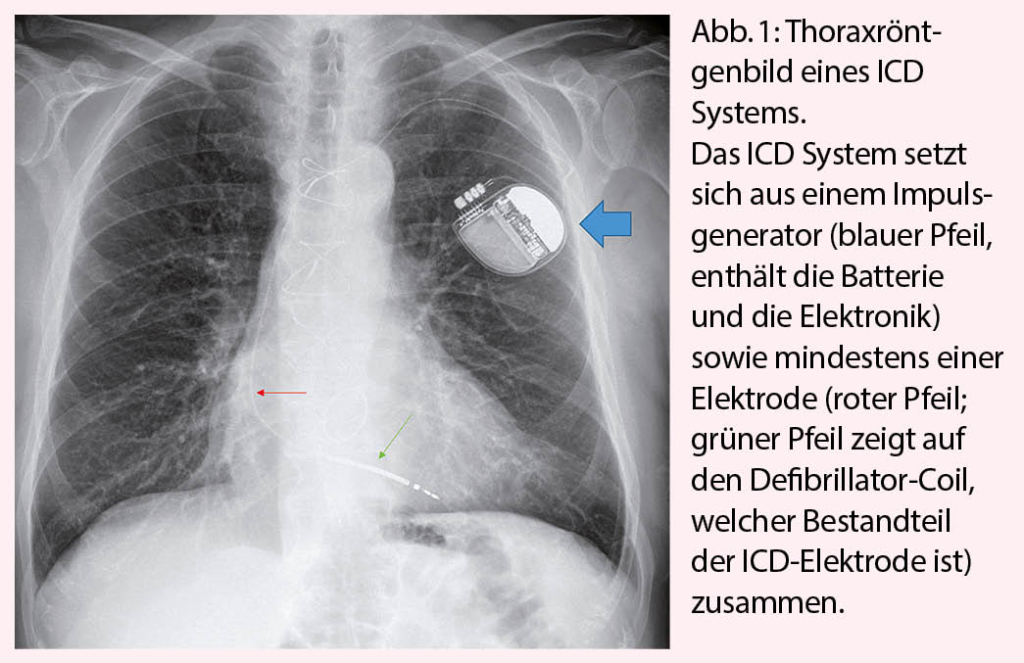
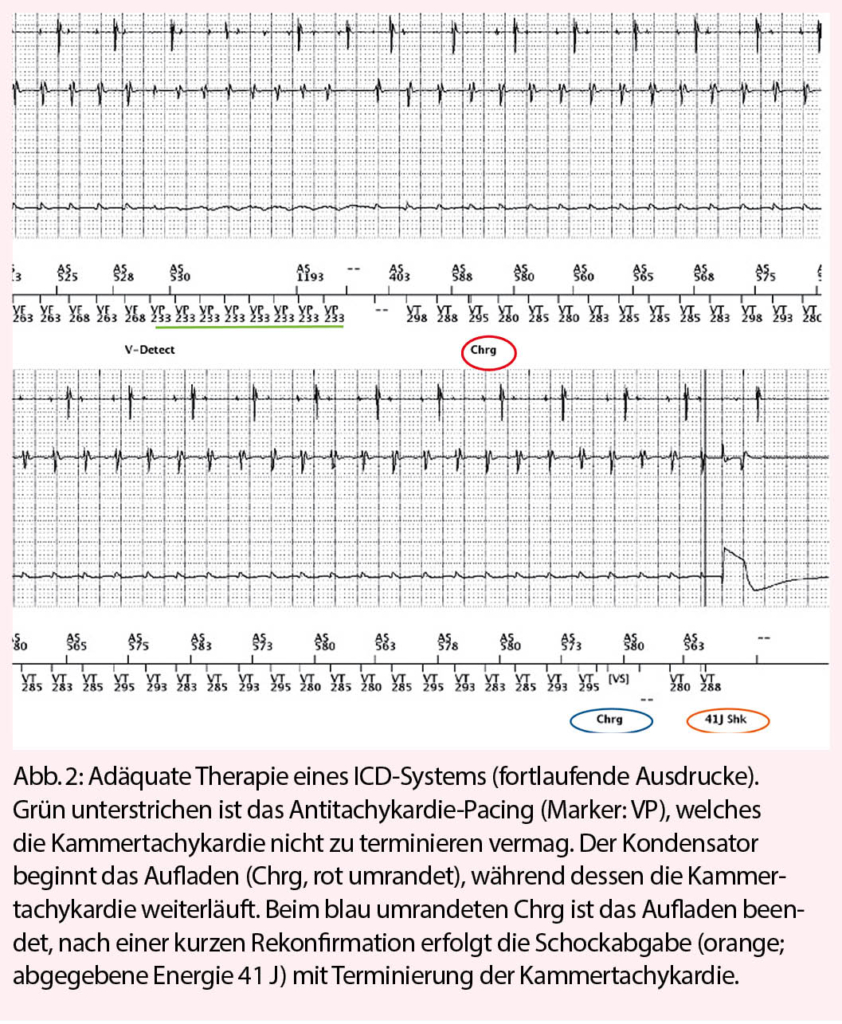
Der ICD setzt sich aus mindestens einer Elektrode in der rechten Herzkammer und einem Impulsgenerator zusammen (Abbildung 1). Beim CRT-D (Cardiale Resynchronisations-Therapie mit ICD-Funktion) wird nebst der rechtsventrikulären Elektrode eine linksventrikuläre Elektrode und meist auch eine Vorhofelektrode implantiert, um zusätzlich zum ICD eine Herzinsuffizienztherapie mittels Resynchronisation der linken und der rechten Herzkammer sowie den Vorhöfen mit den Kammern durchzuführen. Obwohl jeder ICD die Möglichkeit der kardialen Stimulation analog einem Herzschrittmacher besitzt, liegt die Hauptfunktion eines ICD in der Therapieabgabe im Falle einer lebensbedrohlichen ventrikulären Rhythmusstörung (Abbildung 2). Die Schockabgabe ist für den Patienten schmerzhaft, falls er noch bei Bewusstsein ist, für umstehende Personen besteht dagegen keine Gefahr, selbst wenn ein direkter Hautkontakt mit dem Patienten besteht. Zusätzlich zur Schockfunktion bieten die ICDs die Möglichkeit, langsamere Kammertachykardien mittels Antitachykardie-Pacing (ATP) zu überstimulieren, was vom Patienten meist nicht verspürt wird. Um inadäquate Therapien, zum Beispiel bei einer Sinustachykardie oder einem tachykarden Vorhofflimmern, zu vermeiden, sind bei den ICDs Diskriminatoren programmierbar, welche eine ICD-Therapie im Falle einer Tachykardie supraventrikulären Ursprungs zurückhalten können.
Indikationen in der Primärprophylaxe
Die Daten für einen primärprophylaktischen ICD sind bei Patienten mit KHK besser als für Patienten mit nicht-ischämischer Kardiopathie (NICM). Die MADIT-Studie war die erste grosse prospektive, randomisierte Studie, die sich mit der primärprophylaktischen ICD Implantation bei Patienten mit KHK befasste (2). Die Patientenselektion war strikt: Lediglich Patienten ≥ 3 Wochen nach einem Myokardinfarkt mit einer linksventrikulären Auswurffraktion (LVEF) ≤ 35% und asymptomatischen nicht anhaltenden sowie induzierbaren anhaltenden (> 30 sek) Kammertachykardien, die nicht mittels Procainamid supprimierbar waren, wurden zu einer medikamentösen antiarrhythmischen Therapie oder zur ICD-Implantation randomisiert. Nachdem die Gesamtmortalität in der ICD-Gruppe nach 27 Monaten um 54% tiefer lag, wurde die Studie vorzeitig abgebrochen. Die MADIT II Studie war bezüglich Patientenauswahl weniger selektiv und erlaubte die Teilnahme bei Patienten mit einem Myokardinfarkt vor über einem Monat und einer LVEF ≤30% (3). In dieser Studie konnte die kardiale Mortalität um 31% (relatives Risiko) gesenkt werden. Die DINAMIT- und IRIS- Studien haben aber gezeigt, dass die primärprophylaktische ICD Implantation nicht innerhalb des ersten Monats nach einem akuten Myokardinfarkt erfolgen sollte. In dieser Zeit unmittelbar nach einem Myokardinfarkt bietet sich für Risiko-Patienten (z.B. mit LVEF im ICD-Bereich) als temporäre Lösung ein trabgarer Defibrillator (LifeVest) an.
Der absolute Nutzen einer ICD Therapie ist in einem Kollektiv von Patienten mit KHK grösser als in einem Kollektiv von NICM, da das absolute Arrhythmierisiko höher ist. Zudem ist die Evidenz für den primärprophylaktischen ICD bei NICM weniger überzeugend. Auf diesem Hintergrund randomisierte die DANISH Studie 1116 Patienten mit einer NICM zu einer konventionellen Herzinsuffizienz-Therapie resp. einer konventionellen Herzinsuffizienz-Therapie plus ICD (4). Interessanterweise war die Gesamtmortalität bei einem medianen Follow-up von 5.6 Jahren nicht unterschiedlich in den beiden Gruppen, obschon die SCD- Mortalität in der ICD-Gruppe signifikant tiefer war. Eine mögliche Erklärung dafür ist, dass die Patientenpopulation ein absolut gesehen so tiefes SCD-Risiko hatte, dass der SCD eine sehr seltene Todesursache war, d.h. dass die Patienten, welche den primären Endpunkt erreichten (Tod), an anderen Ursachen verstorben waren. Ein Charakteristikum dieser Studie war die umfassende «Background»-Therapie der Herzinsuffizienz inkl. kardialer Resynchronisationstherapie (in ca. 60% der Studienpopulation), welche bekanntermassen ebenfalls das SCD-Risiko substanziell senkt; eine solch optimale Therapie ist im Gegensatz zu Studien-Bedingungen im Real-Life-Setting kaum gegeben. Eine Subgruppenanalyse zeigte zudem einen signifikanten Nutzen einer ICD-Therapie bezüglich Mortalität bei jüngeren Patienten, sodass aus der DANISH-Studie nicht gefolgert werden darf, dass Patienten mit NICM nicht von einer primärprophylaktischen ICD-Implantation profitieren.
Die meisten Studien zur primärprophylaktischen ICD-Therapie sind älteren Datums und zwischenzeitlich erfolgten eindrückliche Verbesserungen der Herzinsuffizienztherapie und Revaskularisationsstrategien für Patienten mit KHK. Man kann sich daher fragen, wie gut die Anwendbarkeit der älteren Studiendaten auf die zeitgemässe Population zu übertragen ist. Diesbezüglich haben kürzlich publizierte, grosse Registerstudien den Nutzen einer primärprophylaktischen ICD Implantation bezüglich Gesamtmortalität in gemischten Kollektiven von KHK und NICM mit zeitgemässer Background-Therapie bestätigt (5, 6), sodass die älteren Studienresultate getrost auf die moderne Population übertragen werden dürfen.
Indikationen in der Sekundärprophylaxe
Bei Patienten, die bereits einen Herzstillstand, eine hämodynamische Beeinträchtigung oder eine Synkope aufgrund von ventrikulären Tachyarrhythmien überlebt haben, wird die Implantation eines ICD als Sekundärprophylaxe bezeichnet. Mehrere frühe randomisierte ICD-Studien haben den Nutzen eines ICD in dieser Situation belegt (Tabelle 1). In einer Metaanalyse der drei Sekundärpräventionsstudien zeigte sich eine 28-prozentige Reduktion der Gesamtmortalität und eine 50-prozentige Reduktion der Arrhythmie-Mortalität durch die ICD-Therapie im Vergleich zu einer Amiodarone-Therapie, unabhängig von der zugrunde liegenden Herzerkrankung oder Arrhythmie (7).
Subkutaner ICD
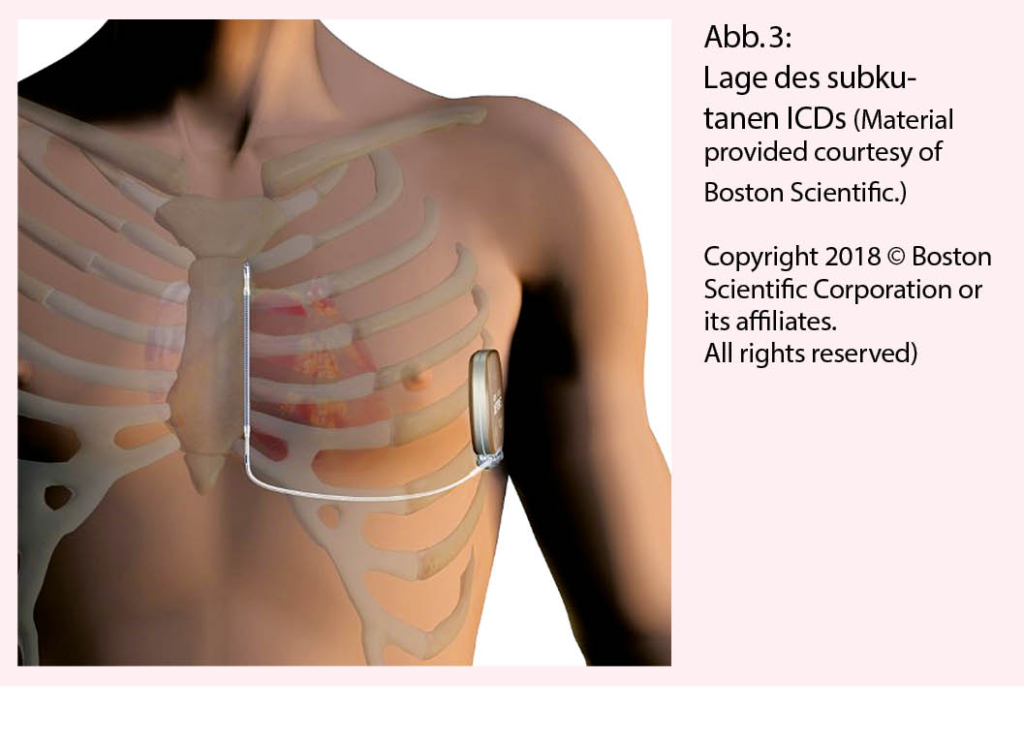
Wenn kein kardiales Pacing nötig ist, kann gemäss Europäischen Guidelines mit einer Empfehlungsstärke IIa ein subkutaner ICD (SICD, Abbildung 3) implantiert werden (1). Das Gerät wird durch einen submammären Hautschnitt zwischen den M. latissimus dorsi und den M. serratus anterior eingebracht, die Elektrode wird subkutan am Rand des Brustbeins zum manubriosternalen Übergang tunneliert.
Der Vorteil liegt beim SICD im Fehlen von intravaskulärem Fremdmaterial, was aus infektions-prophylaktischen Gesichtspunkten insbesondere bei jungen Patienten mit mehreren erwarteten Generatorwechseln in Zukunft günstig ist. Ein weiterer Vorteil liegt in der tieferen Elektrodenbeanspruchung bei extrathorakaler Elektrode, liegt doch bei transvenösem System die Rate von Elektrodenproblemen im Bereich bis 20% innerhalb von ca. 10 Jahren (8). Ein Nachteil ist die fehlende Möglichkeit der Stimulation, sei es zur Überstimulation von Kammertachykardien oder zur antibradykarden Stimulation. Ferner ist die Rate an inappropriaten Therapien erwähnenswert, welche aber gemäss den neuesten Daten nicht relevant erhöht sein dürfte gegenüber einem transvenösen System (9). Damit ist der SICD bei Patienten, welche auf ein Pacing und/oder eine kardiale Resynchronisation verzichten können eine attraktive Alternative zu den transvenösen ICDs.
LifeVest
Die LifeVest («wearable cardioverter defibrillator») ist streng genommen kein ICD, da sie extern getragen wird, soll hier aber wegen der zunehmenden Verbreitung trotzdem eine kurze Erwähnung finden. Die LifeVest ist eine tragbare Weste, welche den Herzrhythmus kontinuierlich überwacht und bei Detektion einer lebensbedrohlichen Arrhythmie einen Schock abgibt, sofern diese Therapie nicht vom Patienten manuell inhibiert wird. Durch einen Alarm wird der Patient aufgefordert, die Therapie durch Knopfdruck zurückzuhalten, was natürlich nur gelingt, wenn der Patient bei Bewusstsein ist. Die LifeVest bietet keine Möglichkeit der Überstimulation von langsamen Arrhythmien und ist nur dann wirksam, wenn die Weste auch wirklich rund um die Uhr getragen wird. Sie stellt lediglich eine Überbrückung bis zur definitiven ICD Implantation (zum Beispiel nach einem kürzlich erlittenen Herzinfarkt oder nach Extraktion eines ICDs infolge eines Infekts) oder bis zum Zeitpunkt, wo ein reversibles Arrhythmierisiko (zum Beispiel bei Myokarditis oder peripartaler Kardiopathie) signifikant abgenommen hat.
Zusammenfassung
Der Nutzen einer ICD-Therapie nach einem überlebten SCD oder nach einer hämodynamisch instabilen Kammertachykardie ist gut belegt und intuitiv nachvollziehbar. Die primärprophylaktische ICD Therapie ist ein etablierter Bestandteil einer umfassenden Herzinsuffizienztherapie, sowohl bei KHK als auch bei NICM mit eingeschränkter linksventrikulärer Auswurffraktion (LVEF <35%). Trotz eindrücklicher Fortschritte in der Herzinsuffizienztherapie in den letzten Jahren mit entsprechenden Auswirkungen auf das SCD Risiko hat die ICD-Therapie ihren Nutzen nicht verloren. In Situationen, in denen kein Pacing und keine Notwendigkeit der Überstimulation einer Kammertachykardie erwartet wird, kann ein SICD erwogen werden. Zur Überbrückung bis zu einer definitiven ICD-Therapie oder bis zur Erholung der LVEF (im Falle einer reversiblen Ursache) steht die LifeVest zur Verfügung.
Copyright bei Aerzteverlag medinfo AG
Klinik für Kardiologie
Kantonsspital St. Gallen
9007 St.Gallen
Roman.brenner@kssg.ch
Der Autor hat im Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
1. Priori, S.G. and C. Blomstrom-Lundqvist, 2015 European Society of Cardiology Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death summarized by co-chairs. Eur Heart J, 2015. 36(41): p. 2757-9.
2. Moss, A.J., et al., Improved survival with an implanted defibrillator in patients with coronary disease at high risk for ventricular arrhythmia. Multicenter Automatic Defibrillator Implantation Trial Investigators. N Engl J Med, 1996. 335(26): p. 1933-40.
3. Moss, A.J., et al., The multicenter research group. Ann Noninvasive Electrocardiol, 2002. 7(3): p. 271-7.
4. Kober, L., et al., Defibrillator Implantation in Patients with Nonischemic Systolic Heart Failure. N Engl J Med, 2016. 375(13): p. 1221-30.
5. Zabel, M., et al., Clinical effectiveness of primary prevention implantable cardioverter-defibrillators: results of the EU-CERT-ICD controlled multicentre cohort study. Eur Heart J, 2020. 41(36): p. 3437-3447.
6. Schrage, B., et al., Association Between Use of Primary-Prevention Implantable Cardioverter-Defibrillators and Mortality in Patients With Heart Failure: A Prospective Propensity Score-Matched Analysis From the Swedish Heart Failure Registry. Circulation, 2019. 140(19): p. 1530-1539.
7. Connolly, S.J., et al., Meta-analysis of the implantable cardioverter defibrillator secondary prevention trials. AVID, CASH and CIDS studies. Antiarrhythmics vs Implantable Defibrillator study. Cardiac Arrest Study Hamburg . Canadian Implantable Defibrillator Study. Eur Heart J, 2000. 21(24): p. 2071-8.
8. Lambiase, P.D., et al., Worldwide experience with a totally subcutaneous implantable defibrillator: early results from the EFFORTLESS S-ICD Registry. Eur Heart J, 2014. 35(25): p. 1657-65.
9. Gold, M.R., et al., Primary Results From the Understanding Outcomes With the S-ICD in Primary Prevention Patients With Low Ejection Fraction (UNTOUCHED) Trial. Circulation, 2021. 143(1): p. 7-17.
10. Antiarrhythmics versus Implantable Defibrillators, A comparison of antiarrhythmic-drug therapy with implantable defibrillators in patients resuscitated from near-fatal venticular arrhythmias. N Engl J Med, 1997. 337(22): p. 1576-83.
11. Kuck, K.H., et al., Randomized comparison of antiarrhythmic drug therapy with implantable defibrillators in patients resuscitated from cardiac arrest: the Cardiac Arrest Study Hamburg (CASH). Circulation, 2000. 102(7): p. 748-54.
12. Connolly, S.J., et al., Canadian implantable defibrillator study (CIDS): a randomized trial of the implantable cardioverter defibrillator against amiodarone. Circulation, 2000. 101(11): p. 1297-302