Dank Erfolgen in der translationalen und klinischen Forschung mit Fokus auf die Pathophysiologie der chronischen myeloischen Leukämie (CML) (spezifische Tyrosinkinase-Hemmer (TKI) gerichtet auf das Onkoprotein BCR-ABL1) können heute Patienten zielgerichtet und personalisiert therapiert werden. Im Vordergrund stehen dabei Kenntnisse zu therapieinduzierten molekularen Verläufen, deren Interpretation und Konsequenzen, der Umgang mit potenziellen Nebenwirkungen und Resistenzen auf die modernen Therapieoptionen sowie das mögliche längerfristige Ziel der therapiefreien Remission (TFR).
CML ist eine seltene hämatologische Erkrankung mit einer jährlichen Inzidenz von 1.0-1.5 auf 100 000 Einwohner (1). Patienten mit CML, die gut auf eine der modernen Therapieoptionen mit TKI ansprechen, haben heute eine zur Normalbevölkerung vergleichbare Lebenserwartung (2). Dadurch wird sich die Prävalenz von Patienten mit CML weltweit und auch in der Schweiz bis 2050 vervierfachen (3). Der einzige bekannte Risikofaktor, eine CML zu entwickeln, sind ionisierende Strahlen, wie sie einige Jahre nach Reaktorunfällen beobachtet wurden (4).
Die CML ist eine klonale, hämatopoietische Stammzell-Erkrankung, deren Zellen durch eine Translokation zwischen den langen Armen der Chromosomen 9 und 22 [t(9;22)(q34;q11.2)] charakterisiert ist. Zytogenetisch wird das verkürzte Chromosom 22 als Philadelphia-Chromosom (Ph) (nach dem Entdeckungsort) genannt. Die Translokation t(9;22) führt zur Fusion des ABL1 Gens mit dem BCR Gen, was zur Aktivierung der Tyrosinkinase des onkogenen Fusionsproteins BCR-ABL1 führt mit der Folge von erhöhter Proliferation, reduzierter Apoptose, abnormaler Adhäsion und Migration der klonalen Zellen sowie deren genetischer Instabilität (5). Auch wenn bei der CML noch andere Signalwege eine Rolle spielen und aktiviert sind, ist BCR-ABL1 allein ausreichend für die Entwicklung einer CML.
Diagnose und initiales Work-up
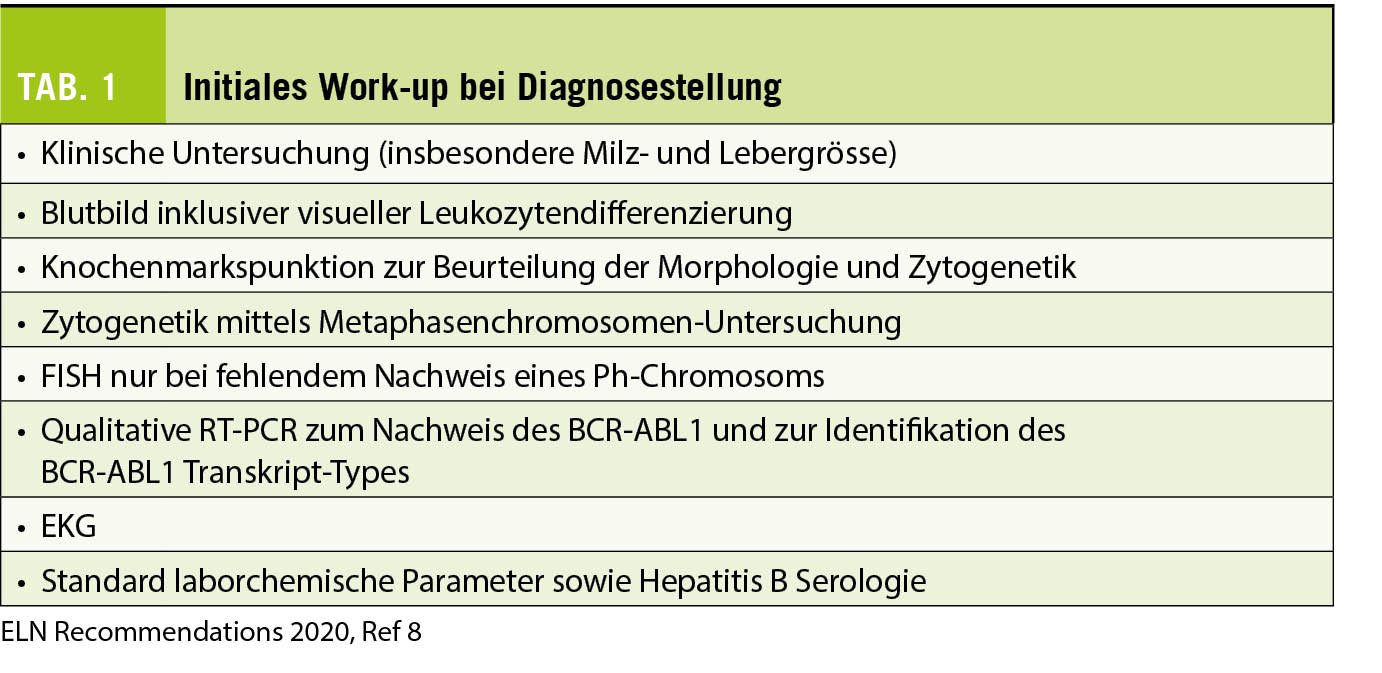
Über 50% der Patienten mit der Diagnose CML werden heute zufällig entdeckt. Symptome bei CML sind eher unspezifisch wie vermehrte Müdigkeit, Gewichtsverlust, nächtliches Schwitzen sowie bei Milzvergrösserung Völlegefühl und abdominelle Beschwerden. Ein Verdacht auf eine CML muss aufkommen, wenn sich im Blutbild eine Leukozytose mit zahlreichen myeloiden Vorstufen, eine milde Anämie und meist eine Thrombozytose zeigen. Sehr typisch ist eine Basophilie und z.T. eine Eosinophilie. Die Funktion der hämatopoietischen Zellen ist in der Regel erhalten, weshalb Patienten mit CML in einer chronischen Phase (CP) nicht ein höheres Infektions- oder Blutungsrisiko aufweisen. Zur Prognosestellung (siehe nächster Abschnitt), ist es relevant, die Blutwerte und die Grösse der Milz (in cm unter dem untersten Rippenbogen) vor Beginn der Therapie zu erfassen. Die Diagnosestellung einer CML kann mittels qualitativer RT-PCR (reverse transcription polymerase chain reaction) für BCR-ABL1 Transkripte (primär e13a2, auch b2a2 genannt, oder e14a2, auch b3a2 genannt) aus dem peripheren Blut erfolgen. Zur Bestimmung der Krankheitsphase (CP oder akzelerierte Phase (AP) oder Blastenkrise (BC)) braucht es initial eine Knochenmarkspunktion. Zur Einschätzung des Krankheitsrisikos braucht es zudem eine Zytogenetik mittels Metaphasenkaryotypisierung (mindestens 20 Metaphasen sind aus Qualitätsgründen gefordert) aus dem Knochenmark oder, bei fehlendem Aspirat, aus dem peripheren Blut (siehe Tabelle 1). In der Knochenmarksuntersuchung geht es um die Anzahl der Blasten und Promyelozyten, die Basophilie und Fibrose zur Abgrenzung einer CML in CP (in über 95% der Fälle) gegenüber der AP und BC oder anderer myeloproliferativer Erkrankungen (6). Bei der Zytogenetik geht es nebst dem Ph-Chromosom auch um zusätzliche klonale zytogenetische Aberrationen, welche prognostisch eine Bedeutung (z.B. Trisomie 8, 7q-, zusätzliches Ph-Chromosom, Isochromosom 17q mit schlechter Prognose) haben können (7). Handelt es sich um eine CML in AP oder BC, wird auch eine BCR-ABL1 Mutationsanalyse und allenfalls andere myeloide Marker empfohlen, da diese gehäuft vorkommen und relevant sind für die Prognose (8).
Risikostratifizierung
Verschiedene Risiko-Scores (Sokal, Euro, Eutos, ELTS) basierend auf initial erhobenen Befunden (Alter, Milzgrösse, Basophilie, Blastenzahl, Thrombozytose, Eosinophilie) wurden in den letzten Jahren etabliert (8). Auf der Website: https://www.kompetenznetz-leukaemie.de/content/aerzte/cml/scores/eutos_score/ und https://www.kompetenznetz-leukaemie.de/content/aerzte/cml/scores/elts/ des Kompetenznetzwerk Leukämien können diese durch Eingabe der Parameter einfach ermittelt werden. Der ELTS Score wurde basierend auf Daten von CML Patienten unter Therapie mit TKI etabliert und berücksichtigt, dass die Patienten heute meist nicht an CML-bedingten Ursachen sterben. Als Prognose-Score wird der ELTS Score deshalb primär empfohlen.
Therapieoptionen
BCR-ABL1 spezifische TKIs gelten heute als Standardtherapie für die Behandlung von neu diagnostizierten Patienten mit CML. Aktuell stehen 5 verschiedene TKIs (Imatinib, Nilotinib, Dasatinib, Bosutinib, Ponatinib) in der Schweiz zur Verfügung. Bei Imatinib handelt es sich um die Erstgeneration, Nilotinib, Dasatinib und Bosutinib gehören zur Zweitgeneration und Ponatinib zur Drittgeneration von TKIs. Die verschiedenen TKIs unterscheiden sich in ihrer Wirkungsstärke, Wirkung auf andere Kinasen, Aktivität gegen ABL1 Mutanten, Pharmakokinetik sowie dem Nebenwirkungsprofil.
Erstgeneration TKI Imatinib
Durch die IRIS Studie (International Randomized Study of Interferon and STI571) um die Jahrtausendwende, welche Imatinib 400 mg/d peroral (p.o.) mit der damaligen Standardtherapie, einer Kombination von IFN-α mit niedrig dosiertem Cytarabine, verglich, revolutionierte sich die Therapie der CML, da sich sowohl das Überleben als auch die Lebensqualität der Patienten enorm verbesserten (9). Aufgrund verschiedener Studien (CML IV, SPIRIT) zeigte sich, dass eigentlich Imatinib 600mg/d p.o. die optimale Dosis wäre, was für die Behandlung von Patienten mit CML in AP und BP auch empfohlen wird, nicht aber für Patienten in CP (400mg/d Imatinib p.o.) (10, 11). Unter Imatinib können bei einem Teil der Patienten niedrig-gradige Nebenwirkungen (z.B. Hautödeme, Muskelkrämpfe, Knochenschmerzen, Leberwerterhöhungen) auftreten, welche auf die Dauer die Lebensqualität beeinträchtigen. Diese sollten aktiv erfragt und angegangen werden; zusätzliche Langzeitnebenwirkungen unter Imatinib haben sich nicht ergeben (12). Imatinib ist zudem heute in generischer Form erhältlich und dadurch billiger als das Original.
Zweitgeneration TKI Nilotinib
Die Behandlung mit Nilotinib, ein selektiverer und potenterer Inhibitor von BCR-ABL1, führte bei Patienten mit CML in CP und AP, die auf Imatinib nicht angesprochen hatten, zu eindrücklichem Erfolg. 2005 wurde Nilotinib (2 x 400mg/d p.o.) deshalb als Zweitlinientherapie bei vorangegangener Resistenz oder Intoleranz auf TKI zugelassen (13). Aufgrund der guten Resultate von Nilotinib 2 x 300mg/d und 2 x 400mg/d im Vergleich zu Imatinib 400mg/d in der ENESTnd Studie (Evaluating Nilotinib Efficacy and Safety in Clinical Trails – Newly Diagnosed) erhielt die Therapie mit Nilotinib 2 x 300mg/d die Zulassung auch als Erstlinientherapie (14). Bei dieser Studie verbesserten sich das molekulare Ansprechen und das progressionsfreie Überleben unter beiden Dosierungen, das Gesamtüberleben aber nur mit der 2 x 400mg/d Dosierung.
Unter Nilotinib muss ein Anstieg der Leber- und Bauchspeicheldrüsenwerte, der Blutzuckerspiegel und der Lipide beachtet werden. Zudem kann es längerfristig zu arteriellen Gefässverschlüssen kommen. Deshalb ist Nilotinib weniger geeignet für Patienten mit Diabetes oder Hyperlipidämien sowie bei Prädisposition zu oder vorliegender arteriellen Gefässerkrankung (12).
Zweitgeneration TKI Dasatinib
Dasatinib, ein potenter BCR-ABL1 und SRC Hemmer, ausgetestet in verschiedenen Dosen (70 mg/d, 100 mg/d, 140 mg/d) bei Patienten mit CML, die auf Imatinib ungenügend angesprochen haben oder intolerant waren, zeigte ebenfalls erstaunlich gute Ansprechraten. Dabei kristallisierte sich eine Dosis von 100mg/d p.o. für CML in CP und 2 x 70 mg/d p.o. für CML in AP/BC und für die Zweitlinientherapie bei CML in CP heraus. Durch die Phase 3 DASISION Studie (Dasatinib versus Imatinib Study in treatment-Naive CML Patients), bei welcher 100mg/d Dasatinib mit 400 mg/d Imatinib bei neu diagnostizierten CML Patienten in CP verglichen wurde, ergab sich die Zulassung für Dasatinib 100mg/d respektive 2 x 70 mg/d in der Erstlinie für CML in CP respektive in AP/BC. Die Studie zeigte eine deutliche Verbesserung des zytogenetischen und molekularen Ansprechens, jedoch nicht des Gesamtüberlebens (15).
Dasatinib ist assoziiert mit einem gewissen Risiko für pleurale Effusionen, und gelegentlich kann auch eine pulmonal arterielle Hypertonie auftreten, weshalb Patienten mit CML und pulmonalen Vorerkrankungen eher nicht mit Dasatinib therapiert werden sollten (12).
Zweitgeneration TKI Bosutinib
Bosutinib, ein potenter BCR-ABL1 und SRC Hemmer, wurde zuerst als Drittlinientherapie in einer Dosierung von 500 mg/d p.o. zugelassen. In der Studie für die Erstlinientherapie, welche Bosutinib 500 mg/d im Vergleich zu Imatinib 400 mg/d prüfte, wurde der primäre Endpunkt, ein komplettes zytogenetisches Ansprechen, trotz des besseren molekularen Ansprechens nicht erreicht, weshalb Bosutinib dafür vorerst nicht zugelassen wurde. Möglicherweise haben ungenügende Vorkehrungen zur Milderung von vor allem gastrointestinalen Nebenwirkungen zu vermehrtem Absetzen von Bosutinib geführt und damit zu einer Unterschätzung der Unterschiede zwischen den beiden Therapiearmen. Beim Vergleich (BEFORE Studie: Bosutinib Trial in First Line Chronic Myelogenous Leukemia Treatment) von 400 mg/d Bosutinib zu 400 mg/d Imatinib ergab sich eine deutliche Verbesserung des molekularen Ansprechens nach 12 Monaten, aber keine Verbesserung im Gesamt- und progressionsfreien Überleben (16).
Bosutinib kann als Nebenwirkung zu Diarrhoe, Lebertoxizität und Niereninsuffizienz führen, weshalb Patienten mit CML und Leber- oder Nierenvorerkrankungen nicht primär mit Bosutinib behandelt werden sollten (12).
Drittgeneration TKI Ponatinib
Ponatinib wurde spezifisch zur Therapie von Patienten mit einer T315I Mutation, welche unter Therapie mit Erst- und Zweitgenerationen TKI entstehen kann und zu einer hohen Therapieresistenz führt, entwickelt. Ponatinib ist der potenteste BCR-ABL1 Hemmer mit langer Halbwertszeit, jedoch weniger selektiv, weshalb auch andere Kinasen gehemmt werden. Initial wurde Ponatinib 45 mg/d p.o. bei Patienten mit rezidivierter oder refraktärer CML in allen Phasen sowie bei rezidivierter und refraktärer Ph+ akuter lymphatischer Leukämie (ALL) ausgetestet. Das Ansprechen war stabil für die CML in CP, jedoch labiler und transienter in höheren Phasen. Aufgrund von kardiovaskulären Nebenwirkungen unter fortgesetzter Therapie mit Ponatinib 45mg/d als Erstlinientherapie in der Phase 3 PACE Studie (Ponatinib Ph+ALL and CML Evaluation), wurde diese vorzeitig sistiert (17). Die Toxizität von Ponatinib ist dosis-abhängig und deshalb wird heute eine Dosisreduktion empfohlen, sobald ein molekulares Ansprechen des BCR-ABL1 auf 1% gemäss IS (internationaler Standardisierung) erreicht wird. Diese Empfehlung basiert auf Daten aus der OPTIC (Optimizing Ponatinib Treatment In CML) Studie, die gut aufzeigen konnte, dass ein Start mit 45 mg/d Ponatinib mit einer Reduktion auf 15mg/d (ausser bei Vorliegen einer T315I Mutation) nach Erreichen eines molekularen Ansprechens des BCR-ABL1 auf 1% IS, die kardiovaskulären Nebenwirkungen deutlich reduziert bei erhaltener Wirkung (18).
Wahl des Erstlinien TKI
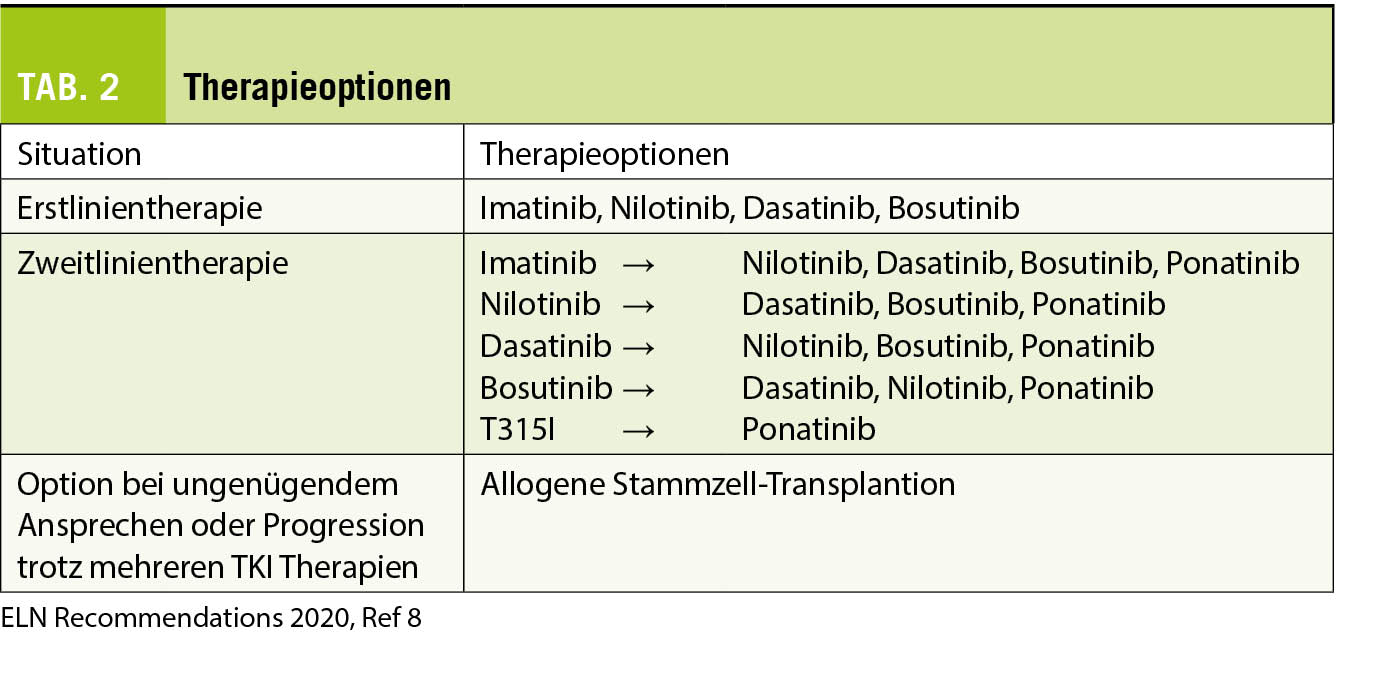
Die Wahl des Erstlinien-TKI bei Patienten mit neu diagnostizierter CML richtet sich primär nach dem Alter, dem Ziel der Therapie, den Komorbiditäten und dem potenziellen Nebenwirkungsprofil. Gemäss ELN 2020 Empfehlungen sind alle 4 TKI für die Erstlinientherapie geeignet (siehe Tabelle 2), wobei für Patienten mit einem hohen Risiko (siehe Risikostratifizierung und Zytogenetik) der Beginn mit einem Zweitgenerationen-TKI empfohlen wird (8).
Ziele, Monitoring, Meilensteine
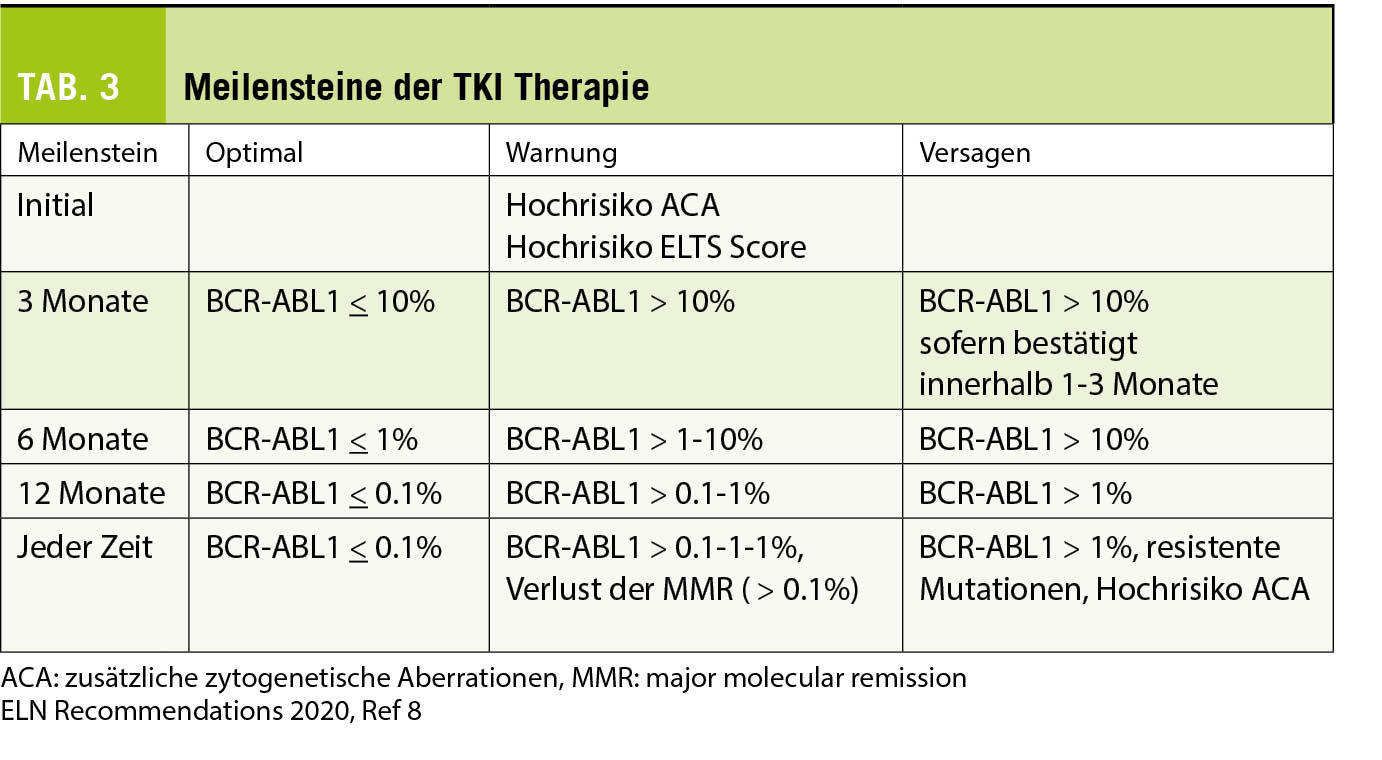
Nach Beginn der Erstlinientherapie mit einem TKI müssen das hämatologische und molekulare Ansprechen alle 3 Monate erfasst werden, damit beurteilt werden kann, ob der Patient die geforderten Ziele pro Meilenstein optimal erreicht oder ob die Therapie angepasst oder geändert werden muss. Vor einem Wechsel des TKI sollte jeweils eine ungenügende Medikamenteneinnahme ausgeschlossen werden. Nebenwirkungen, Interaktionen mit anderen Medikamenten oder Phytotherapeutika sowie vergessene Einnahmen können zu ungenügendem Therapieansprechen führen. In Tabelle 3 sind die Meilensteine und geforderten hämatologischen und molekularen Ziele dargestellt (8).
TKI-Resistenz
Spricht der Patient von Beginn weg nicht auf die TKI Therapie an, handelt es sich um eine primäre Resistenz; verliert der Patient hingegen das Ansprechen nach initialer Wirkung dann spricht man von sekundärer oder akquirierter Resistenz. Molekular kann der Verlust des Ansprechens auf Ebene der BCR-ABL1 Tyrosinkinaseaktivität (Reaktivierung) liegen oder es können BCR-ABL1-unabhängige Mechanismen dafür verantwortlich sein. Eine TKI-Resistenz ist mit einer schlechteren Prognose assoziiert.
Die häufigste Ursache einer TKI-Resistenz sind Mutationen in der Kinase-Domäne des BCR-ABL1, welche die Medikamentenbindung behindern. Die häufigsten sind in Tabelle 4 aufgelistet, ebenso die jeweilig kontraindizierten TKI (8, 19). Mutationen werden häufiger bei sekundärer TKI-Resistenz oder bei CML in AP und BC gefunden. Solche müssen bei ungenügendem Ansprechen, bei Rezidiv oder Progression von einer chronischen in eine höhergradige Phase der CML gesucht werden. Diese Mutationssuche sollte mittels der sensitiveren «Next-Generation Sequencing (NGS)» Technologie erfolgen. Unter Imatinib ergibt sich das breiteste Spektrum von Mutationen; bei den Zweitgenerationen-TKI ist das Mutationsspektrum bereits eingeschränkter, allerdings sind die wenigen Mutationen oft mit höherer TKI-Resistenz assoziiert. Insbesondere ist die hoch-resistente T315I Mutation zu erwähnen, welche nur durch eine Therapie mit dem dafür entwickelten Ponatinib angegangen werden kann (siehe Tabelle 2).
Therapieoptionen bei Versagen
Bei inadäquater Wirkung oder Verlust des Ansprechens auf einen TKI sollten durch eine eingehende Anamnese sowie durch eine TKI-Plasmaspiegelbestimmung eine allfällig ungenügende Einnahme des TKI, Medikamenten-Interaktionen oder tiefere TKI-Plasma-Spiegel ausgeschlossen werden. Zudem gehört eine Standortbestimmung mit klinischer Untersuchung, Differentialblutbild, Knochenmarksuntersuchung, Zytogenetik mit Metaphasen-Karyotyp aus dem Knochenmark sowie eine BCR-ABL1 Mutationssuche dazu. Bei einer TKI-Resistenz auf Imatinib kann auf einen Zweitgenerationen-TKI gewechselt werden solange der Patient in CP ist und keine T315I Mutation aufweist. Die Wahl des Zweitgenerationen-TKI hängt bei allfälligen Mutationen von deren Profil ab. Ponatinib ist die einzige medikamentöse Option bei einer T315I Mutation; zudem sollte eine Evaluation für eine allogene hämatopoietische Stammzell-Transplantation diskutiert und evaluiert werden.
Nach Wechsel der TKI-Therapie ist das Ansprechen wiederum regelmässig gemäss den vorgesehenen Meilensteinen zu kontrollieren. Wenn Patienten eine TKI-Resistenz auf einen Zweitgenerationen-TKI entwickeln, kann auf einen anderen Zweitgenerationen-TKI gewechselt werden. Allerdings sinkt die potenzielle Ansprechrate, und ein Wechsel auf den Drittgenerationen-TKI mit möglichem besserem Ansprechen sollte in Betracht gezogen werden. Der Nachteil von Ponatinib sind die gefürchteten potenziellen vaskulären Nebenwirkungen, die allerdings deutlich reduziert werden können durch eine dosis-adaptierte Strategie (initial 45mg/d, bei Erreichen eines BCR-ABL1 Wertes von 1% IS Reduktion auf 15mg/d, ausser bei Vorliegen einer T315I Mutation) (18). Die Auswahl an medikamentösen Therapien könnte sich bei TKI-Resistenz auf einen Zweitgenerationen-TKI bald um eine Option erweitern: Asciminib (ABL001) – siehe zukünftige Therapien.
Therapie-freie Remission
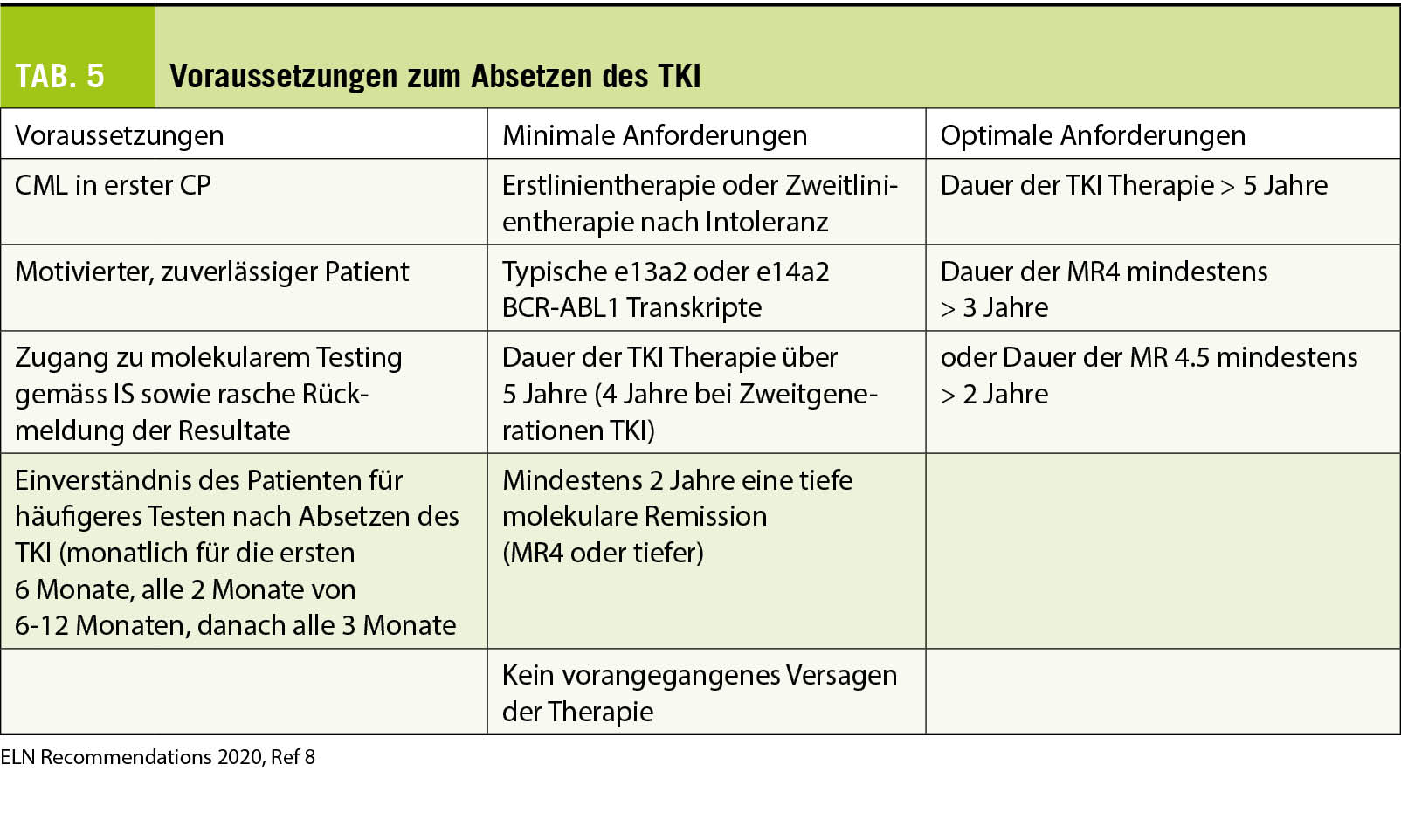
Vor allem für jüngere Patienten und um Langzeit-Nebenwirkungen unter TKI Therapie zu vermeiden, wird heute das Ziel einer TFR angestrebt (8). Durch die STIM Studien (Stopp Imatinib Studien) und weiteren Stopp TKI Studien in der Folge haben wir gelernt, dass ca. 40-60% der Patienten, welche ein BCR-ABL1 von mindestens einer MR4-4.5 IS über 2 Jahre erreicht haben, rezidiv frei bleiben (20). Längere TKI-Exposition sowie längere Dauer eines sehr tiefen molekularen Ansprechens erhöht die Wahrscheinlichkeit für eine TFR, wohingegen Patienten mit einem initial hohen Risiko-Score (Sokal) ein höheres Rezidivrisiko aufweisen. In Tabelle 5 sind die Voraussetzungen und Kriterien gemäss ELN Empfehlungen für ein TKI-Absetzen aufgelistet (8). Zweitgenerationen TKI als Erstlinientherapie führen schneller zu einer höheren Rate an Patienten mit tieferem molekularem Ansprechen, was beim Ziel TFR für den Einsatz der Zweitgenerationen-TKI spricht, jedoch können diese mit gewissen Risiken und Nebenwirkungen verbunden sein, so dass für den einzelnen Patienten eine Risiko-Nutzen Abwägung durchgeführt werden sollte. Die meisten Rückfälle nach Absetzen des TKI erfolgen in den ersten 6-12 Monaten, und bei Rezidiv führt der Wiederbeginn des entsprechenden TKI in der Regel wieder zu demselben molekularen Ansprechen. Zu beachten ist, dass ca. 20-30% der Patienten, insbesondere solche mit einer vorbestehenden Arthritis, ein TKI-Absetzsyndrom mit muskulo-skelettalen Schmerzen entwickeln können. Dieses kann mit antiinflammatorischen Schmerzmitteln und kurzzeitigem Einsatz von Steroiden behandelt werden (21).
Zukünftige Therapien
Phase 1 und 2 Studien in der Erstlinientherapie sowie Phase 3 Studien in höheren Therapielinien zeigen für Asciminib (ABL001), ein STAMP-Inhibitor (Specifically Targeting the BCR-ABL1 Myristoyl Pocket), der die Myristate-bindende Tasche des BCR-ABL1 blockiert und damit die inaktive Konformation der Tyrosinkinase stabilisiert, vielversprechende Wirksamkeit mit sehr geringer Toxizität (22). Eine Zulassung dieser Substanz ist für 2022 vorgesehen.
Copyright bei Aerzteverlag medinfo AG
Assoziierte Professorin der Universität Bern
FMH Innere Medizin und Hämatologie
FAMH Hämatologie, inkl. DNA/RNA
Murtenstrasse 40
3008 Bern
gabriela.baerlocher@hematology.ch
Incyte Corporation: Beratertätigkeit, Unterstützung eines Projektes zur Fortbildung von Medizinalpersonal.
1. Siegel, R.L., et al, Cancer Statistics, 2017. CA Cancer J Clin, 2017. 67(1): p. 7-30.
2. Bower, H., et al., Life Expectancy of Patients With Chronic Myeloid Leukemia Approaches the Life Expectancy of the General Population. J Clin Oncol, 2016. 34(24): p. 2851-7.
3. Delord, M., et al., The rising prevalence of chronic myeloid leukemia in France. Leuk Res, 2018. 69: p. 94-99.
4. Little M.P. , et al, Risks of leukemia in Japanese atomic bomb survivors, in women treated for cervical cancer, and in patients treated for ankylosing spondylitis. Radiat Res 1999 Sep;152(3):280-92.
5. Chereda B, et al, Natural course and biology of CML. Ann Hematol 2015 Apr;94 Suppl 2:S107-21. doi: 10.1007/s00277-015-2325-z.
6. Thiele J, et al, et al. Bone marrow features and clinical findings in chronic myeloid leukemia–a comparative, multicenter, immunohistological and morphometric study on 614 patients. Leuk Lymphoma 2000 Jan;36(3-4):295-308.
7. Fabarius A., et al, Impact of additional cytogenetic aberrations at diagnosis on prognosis of CML: long-term observation of 1151 patients from the randomized CML Study IV. Blood 2011 Dec 22;118(26):6760-8. doi: 10.1182/blood-2011-08-373902. Epub 2011 Oct 28.
8. Hochhaus A., et al, European LeukemiaNet 2020 recommendations for treating chronic myeloid leukemia. Leukemia 2020 Apr;34(4):966-984. doi: 10.1038/s41375-020-0776-2. Epub 2020 Mar 3.
9. Druker B.J. et al, Efficacy and safety of a specific inhibitor of the BCR-ABL tyrosine kinase in chronic myeloid leukemia. N Engl J Med 2001 Apr 5;344(14):1031-7. doi: 10.1056/ NEJM200104053441401.
10. Hoffmann V.S., et al, Systematic review and meta-analysis of standard-dose imatinib vs. high-dose imatinib and second generation tyrosine kinase inhibitors for chronic myeloid leukemia. J Cancer Res Clin Oncol 2017 Jul;143(7):1311-1318. doi: 10.1007/s00432-017-2385-7.
11. Preudhomme C, et al, Imatinib plus peginterferon alfa-2a in chronic myeloid leukemia. N Engl J Med 2010 Dec 23;363(26):2511-21.
12. Steegmann J.L., et al, European LeukemiaNet recommendations for the management and avoidance of adverse events of treatment in chronich myeloid leukaemia. Leukemia 2016;30(8):1648-71
13. Kantarjian H., et al, Nilotinib in imatinib-resistant CML and Philadelphia chromosome-positive ALL. N Engl J Med 2006 Jun 15;354(24):2542-51. doi: 10.1056/NEJMoa055104.
14. Saglio G., et al, Nilotinib versus imatinib for newly diagnosed chronic myeloid leukemia. N Engl J Med. 2010 Jun 17;362(24):2251-9. doi: 10.1056/NEJMoa0912614.
15. Kantarjian H.M., et al, Dasatinib or imatinib in newly diagnosed chronic-phase chronic myeloid leukemia: 2-year follow-up from a randomized phase 3 trial (DASISION). Blood 2012 Feb 2;119(5):1123-9. doi: 10.1182/blood-2011-08-376087. Epub 2011 Dec 9.
16. Cortes J.E., et al, Bosutinib Versus Imatinib for Newly Diagnosed Chronic Myeloid Leukemia: Results From the Randomized BFORE Trial. J Clin Oncol 2018 Jan 20;36(3):231-237.
17. Lipton J.H., et al, Ponatinib versus imatinib for newly diagnosed chronic myeloid leukaemia: an international, randomised, open-label, phase 3 trial, Lancet Oncol 2016 May;17(5):612-21. doi: 10.1016/S1470-2045(16)00080-2. Epub 2016 Apr 12.
18. Kantarjian H.M., et al, Efficacy and safety of ponatinib (PON) in patient with chronic-phase chronic Myeloid Leukemia (CP-CML) who failed one ore more second-generation (2G) tyrosine kinase inhibitors (TKIs): Analyses based on PACE and OPTIC. Blood 2020;136(Supplement 1):43-4
19. Shah N.P., et al, Multiple BCR-ABL kinase domain mutations confer polyclonal resistance to the tyrosine kinase inhibitor imatinib (STI571) in chronic phase and blast crisis chronic myeloid leukemia, Cancer Cell 2002 Aug;2(2):117-25. doi: 10.1016/s1535-6108(02)00096-x.
20. Mahon F.X., et al, Discontinuation of imatinib in patients with chronic myeloid leukaemia who have maintained complete molecular remission for at least 2 years: the prospective, multicentre Stop Imatinib (STIM) trial, Lancet Oncol 2010 Nov;11(11):1029-35. doi: 10.1016/S1470-2045(10)70233-3.
21. Richter J., et al, Muskuloskeletal pain in patients with chronic myeloid leukemia after discontinuation of imatinib: a tyrosine kinase inhibitor withdrawal syndrome?, J Clin Oncol 2014;32(25):2821-3
22. Hughes T.P., et al, Asciminib in chronic Myeloid Leukmeia after ABL kinase inhibitor failure. N Engl J Med 2019;381(24):2315-26