La pandémie due au virus SARS-CoV-2 sévit depuis maintenant plus d’ un an et a causé plus de 3 millions de décès dans le monde à la fin avril 2021. Alors que la stratégie vaccinale massive a été adoptée par de nombreux pays, la question de la priorisation de l’ accès à la vaccination est centrale. Les populations vulnérables ont été unanimement considérées comme prioritaires dans la lutte contre cette pandémie. La Suisse fait partie des pays qui ont choisi de considérer et protéger les femme enceintes par la vaccination contre le COVID-19.
Risque de développer une forme sévère de COVID-19 pendant la grossesse
Il est maintenant bien décrit dans la littérature que les femmes enceintes ont un risque plus élevé de développer une forme grave de COVID-19 comparativement aux femmes non enceintes du même âge, avec notamment un risque deux à trois fois plus élevé d’ admission aux soins intensifs selon les auteurs des plus grandes séries (1, 2).
L’ augmentation du risque de forme sévère de COVID-19 pendant la grossesse est particulièrement important chez les femmes présentant certaines comorbidités. L’ hypertension artérielle chronique, les maladies pulmonaires chroniques, le diabète préexistant à la grossesse ainsi que l’ âge maternel et l’ obésité, sont associés à une majoration significative du risque de forme sévère (1).
Concernant la grossesse, le risque d’ accouchement prématuré semble majoré, sans qu’ il soit possible encore aujourd’ hui d’ estimer avec précision cette augmentation. Le taux d’ accouchement prématuré dans les plus grandes séries de patientes enceintes infectées par le SARS-CoV-2 atteint 15 à 20 % incluant notamment la prématurité induite des formes sévères de COVID-19 nécessitant une césarienne en urgence. La transmission verticale de l’ infection est peu fréquente mais possible, estimée à moins de 5 %, avec un risque de forme néonatale de COVID-19 sévère très rare (3, 4).
L’ augmentation des complications en cas d’ infection à COVID-19 place donc la femme enceinte dans un groupe à risque en particulier lorsque celle-ci présente les facteurs de risque de maladie sévère.
Vaccination et grossesse
Plusieurs vaccins sont recommandés pendant la grossesse notamment contre la coqueluche et la grippe, jugés sûrs et bénéfiques pour la mère, son fœtus et le futur nouveau-né. Ce sont des vaccins inactivés n’ ayant aucun pourvoir infectieux. Les vaccins vivants atténués sont en revanche contre indiqués pendant la grossesse du fait de leur potentiel pouvoir pathogène résiduel théorique.
Nouvelles technologies vaccinales
Les nouvelles technologies vaccinales telles que l’ utilisation d’ acides ribonucléiques, de sous-unités protéiques, et de vecteurs viraux ont été développées ces dernières années. Ces technologies ont été utilisées de manière expérimentale contre le virus de la grippe, HIV, CMV et des études cliniques de phases I et II ont notamment eu lieu contre les virus Zika et Ebola.
Les deux vaccins disponibles à ce jour contre le SarS-CoV-2 en Suisse sont le Pfizer/BNT162b2 et le Moderna/mRNA-1273, tous deux utilisant la technologie de l’ ARNm et consistent en deux injections intramusculaires.
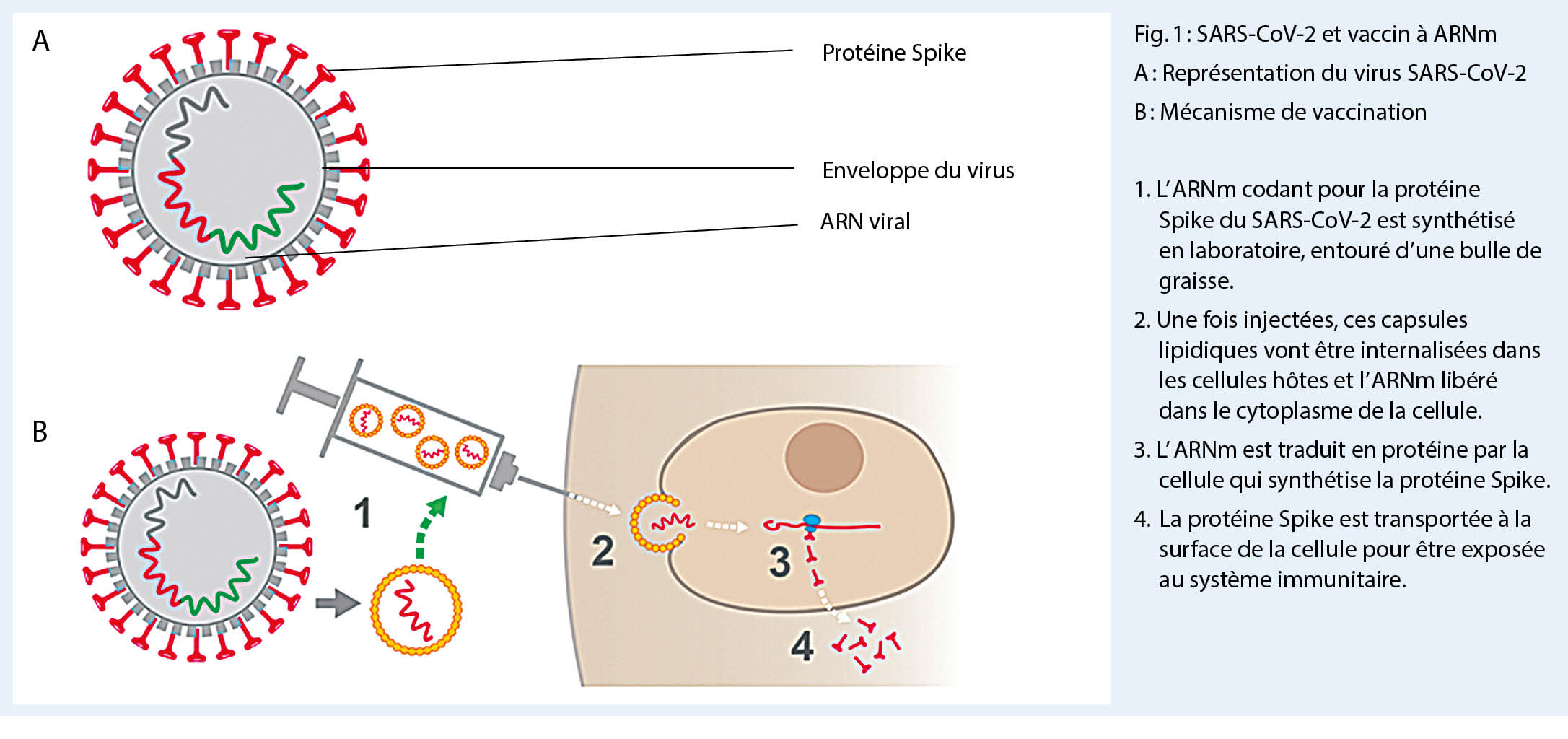
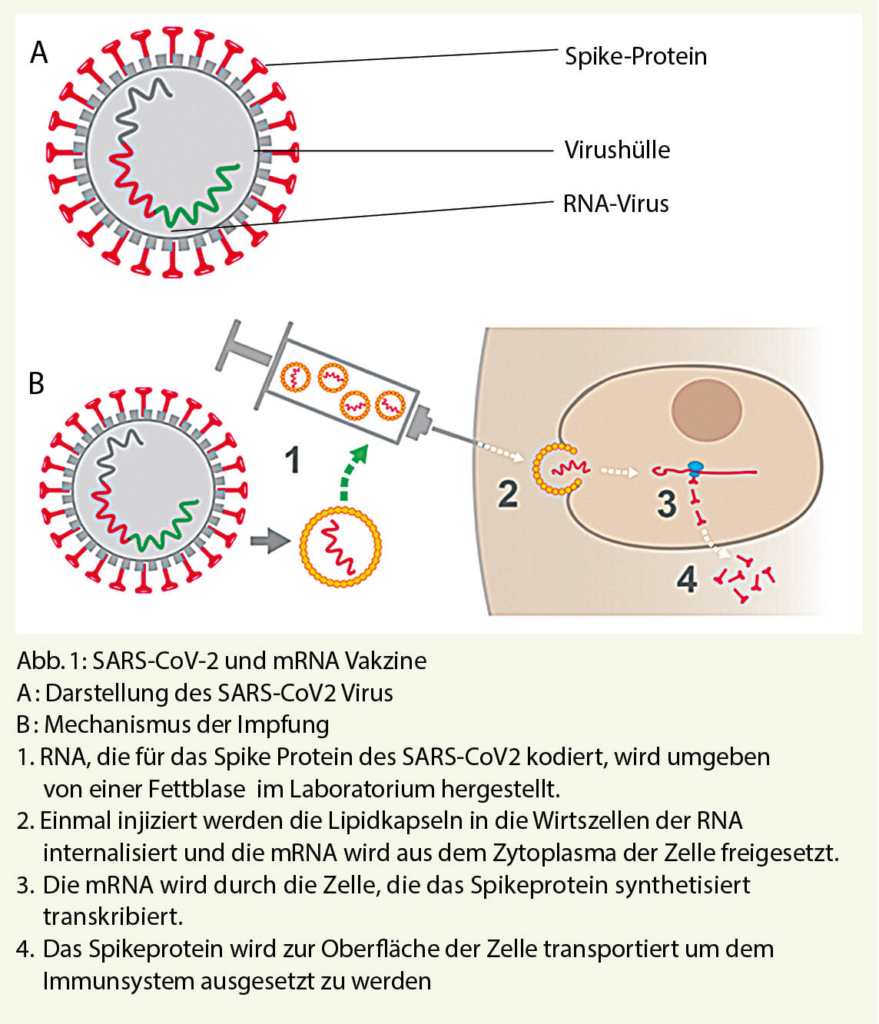
Après injection, l’ ARNm enveloppé dans une capsule lipidique, va rentrer dans les cellules hôtes sans pénétrer dans le noyau de celles-ci. L’ ARNm codant pour la protéine Spike du SARS-CoV-2, va être traduit dans le cytoplasme de la cellule. Une fois la protéine Spike synthétisée, elle sera transportée à la surface des cellules pour y être présentée au système immunitaire et ainsi créer une immunité contre le SARS-CoV-2. L’ ARNm ne contient pas le virus mais seulement le code génétique permettant la fabrication d’ une protéine de surface de l’ enveloppe du virus (Figure 1).
L’ efficacité des vaccins à ARNm Pfizer et Moderna est de 95 % dans la prévention de l’ infection COVID-19 chez les adultes (> 70 000 participants), avec des effets secondaires légers à modérés fréquents et des réactions allergiques graves rares estimées à 1 / 100 000 principalement chez des patients ayant des antécédents de réactions allergiques sévères (5, 6).
Données concernant les femmes enceintes et la vaccination contre le COVID-19
Les femmes enceintes ont été exclues des essais cliniques des vaccins autorisés en Suisse. Les données d’ expérimentation précliniques sur des rates et des macaques n’ ont montré aucun effet indésirable sur le développement embryonnaire et le déroulement de la gestation (7, 8). Par ailleurs, le profil de ces vaccins ne présente aucun sur-risque théorique chez la femme enceinte et la balance bénéfice risque penche rapidement en faveur de la vaccination chez ce groupe de patientes à risque de complications.
Pendant les études de phases III (efficacité) des vaccins à ARNm, 53 patientes ont reçu le vaccin ou le placebo sans savoir qu’ elles étaient enceintes. Un nombre égal de grossesses sont survenues dans les groupes vaccinés et placebos, ce qui montre que le vaccin n’ a pas
d’ impact sur la fertilité. Le nombre de fausses couches a été identique dans chacun des deux groupes.
Le 10 février 2021, le Dr Anthony Fauci, directeur du National Institute of Allergy and Infectious Disease (NIAID) a annoncé lors d’ une conférence de presse à la Maison Blanche, que plus de 20 000 femmes enceintes ont été vaccinées aux Etats-Unis, sans aucun signe d’ appel inquiétant (9).
Au 1er mars 2021, les registres V-safe (10) et Vaccine Adverse Event Reporting System (VAERS)(11) mis au point par le Center for Disease Control and Prevention (CDC) et la Food and Drug Administration (FDA) aux Etats-Unis rapportent des données de plus de 30000 femmes enceintes exposées au vaccin sans augmentation notable des complications de grossesse.
En terme d’ efficacité, une étude prospective contrôlée publiée en mars 2021 montre une réaction sérologique identique chez les femmes enceintes (n = 84), allaitantes (n = 31) et non enceintes (n = 16), laissant espérer une efficacité similaire du vaccin pendant la grossesse et l’ allaitement (12).
Tous les échantillons de sang du cordon et de lait maternel des patientes vaccinées contenaient des anticorps (12) laissant entrevoir une potentielle immunité passive des enfants à la naissance, qu’ il reste encore à démontrer.
Par ailleurs, le groupe Pfizer BioNTECH a annoncé le 18 février 2021 le lancement d’ une étude de phase II/III chez la femme enceinte.
En Suisse, la vaccination est ouverte aux femmes enceintes présentant des facteurs de risque depuis le 05 mars 2021. Les femmes enceintes ou allaitantes qui présentent les critères d’ éligibilité peuvent, dès le deuxième trimestre de grossesse, demander une prescription spéciale à leur gynécologue traitant. Toutes les informations sont disponibles sur le site de la société suisse de gynécologie (https://www.sggg.ch/). Dans le même temps, les patientes se verront proposer la participation à l’ étude de suivi de la vaccination qui a pour but de monitorer la sécurité des vaccins contre le COVID-19 chez les femmes enceintes.
Adhésion des femmes enceintes à la vaccination
Si la méfiance vis-à-vis des vaccins en général chez la femme enceinte et de surcroît avec un vaccin nouvellement développé peut s’ avérer légitime, le COVID-19 représente un risque non négligeable de complications potentiellement sévères pendant la grossesse, alors que les premières données concernant la vaccination sont extrêmement rassurantes. Les femmes enceintes ont habituellement plus d’ hésitation à recourir aux traitements médicamenteux (13) et ce pour de multiples raisons dont le manque d’ information spécifique à la grossesse (14). Une récente étude a rapporté une hésitation à la vaccination contre le COVID-19 chez les 40 à 50 % des femmes enceintes, due notamment à un manque d’ information. Ceci renforce l’ importance de communiquer aux patientes les données dont nous disposons, certes limitées mais très rassurantes quant à l’ efficacité et la sécurité de la vaccination (15).
Par ailleurs, de nombreuses sociétés savantes dont le CDC (16), l’ American College of Obstetrics and Gynecology (ACOG) (17), la Society of Materno-Foetal Medicine (SMFM) (18), le Collège National des Gynécologues Obstétriciens Français (CNGOF) (19) et le Royal College of Obstetrics and Gynecology (RCOG) (20) se sont prononcées en faveur de la vaccination des femmes enceintes.
Copyright bei Aerzteverlag medinfo AG
Département femme-mère-enfant
CHUV
Rue du Bugnon 2
1011 Lausanne
Karine.Lepigeon@chuv.ch
Département femme-mère-enfant
CHUV
Rue du Bugnon 2
1011 Lausanne
Département femme-mère-enfant
CHUV
Rue du Bugnon 2
1011 Lausanne
Les auteurs ont déclaré n’avoir aucun conflit d’intérêts en rapport avec cet article.
1. Allotey J, Stallings E, Bonet M, Yap M, Chatterjee S, Kew T, et al. Clinical manifestations, risk factors, and maternal and perinatal outcomes of coronavirus disease 2019 in pregnancy: living systematic review and meta-analysis. BMJ. 1 sept 2020;m3320.
2. Zambrano LD, Ellington S, Strid P, Galang RR, Oduyebo T, Tong VT, et al. Update: Characteristics of Symptomatic Women of Reproductive Age with Laboratory-Confirmed SARS-CoV-2 Infection by Pregnancy Status — United States, January 22–October 3, 2020. MMWR Morb Mortal Wkly Rep. 6 nov 2020;69(44):1641‑7.
3. Raschetti R, Vivanti AJ, Vauloup-Fellous C, Loi B, Benachi A, De Luca D. Synthesis and systematic review of reported neonatal SARS-CoV-2 infections. Nat Commun. 15 oct 2020;11(1):5164.
4. Vivanti AJ, De Luca D, Raschetti R, Benachi A. Obstetric and neonatal literature is complex and should be merged to understand perinatal SARS-CoV-2 infection. Ultrasound Obstet Gynecol Off J Int Soc Ultrasound Obstet Gynecol. févr 2021;57(2):351‑2.
5. Poland GA, Ovsyannikova IG, Kennedy RB. SARS-CoV-2 immunity: review and applications to phase 3 vaccine candidates. Lancet Lond Engl. 14 nov 2020;396(10262):1595‑606.
6. InfoVac.ch. Coronavirus (COVID-19) [Internet]. [cité 14 avr 2021]. Disponible sur: https://www.infovac.ch/fr/les-vaccins/par-maladie/coronavirus-covid-19#securite-vaccinale
7. Rasmussen SA, Kelley CF, Horton JP, Jamieson DJ. Coronavirus Disease 2019 (COVID-19) Vaccines and Pregnancy: What Obstetricians Need to Know. Obstet Gynecol. mars 2021;137(3):408‑14.
8. Pfizer-BioNTech. COVID-19 Vaccine VRBPAC Briefing Document [Internet]. [cité 6 avr 2021]. Disponible sur: https://www.fda.gov/media/144246/download
9. Nunez-Smith, M. & Fauci, A. Press Briefing [Internet]. Press briefing by White House COVID-19 response team and public health officials, 10 February 2021. Disponible sur: https://www.whitehouse.gov/briefing-room/press-briefings/2021/02/10/press-briefing-by-white-house-covid-19-response-team-and-public-health-officials-3/
10. Centers for disease Control and Preventio. V-Safe [Internet]. Disponible sur: https://www.cdc.gov/coronavirus/2019-ncov/vaccines/safety/vsafe.html
11. Center for Disease control (CDC) et la Food and Drug Administration (FDA). The Vaccine Adverse Event Reporting System [Internet]. [cité 14 avr 2021]. Disponible sur: https://vaers.hhs.gov/
12. Gray KJ, Bordt EA, Atyeo C, Deriso E, Akinwunmi B, Young N, et al. COVID-19 vaccine response in pregnant and lactating women: a cohort study. Am J Obstet Gynecol. 24 mars 2021;
13. Nordeng H, Koren G, Einarson A. Pregnant Women’ s Beliefs About Medications—A Study Among 866 Norwegian Women. Ann Pharmacother. sept 2010;44(9):1478‑84.
14. Hayakawa S, Komine-Aizawa S, Takada K, Kimura T, Yamada H. Anti-SARS-CoV-2 vaccination strategy for pregnant women in Japan. J Obstet Gynaecol Res [Internet]. 23 mars 2021 [cité 5 avr 2021]; Disponible sur: https://onlinelibrary.wiley.com/doi/10.1111/jog.14748
15. Ceulemans M, Foulon V, Panchaud A, Winterfeld U, Pomar L, Lambelet V, et al. Vaccine Willingness and Impact of the COVID-19 Pandemic on Women’ s Perinatal Experiences and Practices—A Multinational, Cross-Sectional Study Covering the First Wave of the Pandemic. Int J Environ Res Public Health. janv 2021;18(7):3367.
16. Centers for Disease Control and Preventio. Pregnancy and Breastfeeding/COVID-19 [Internet]. Disponible sur: https://www.cdc.gov/coronavirus/2019-ncov/vaccines/recommendations/pregnancy.html
17. American College of Obstetricians and Gynecologist. Coronavirus (COVID-19), Pregnancy, and Breastfeeding [Internet]. Disponible sur: https://www.acog.org/womens-health/faqs/coronavirus-covid-19-pregnancy-and-breastfeeding
18. The Society for Maternal-Fetal Medicine. Publications & Clinical Guidance [Internet]. Disponible sur: https://www.smfm.org/covidclinical
19. Collège national des gynécologues et obstétriciens français. Vaccination anti-COVID-19 des femmes enceintes : Le CNGOF et Le GRIG rappellent leur position. [Internet]. 2021. Disponible sur: http://www.cngof.fr/patientes/presse/740-covid-19-vaccination-femmes-enceintes-3ars-2021
20. Royal College of Obstetricians and Gynaecologist. COVID-19 vaccines, pregnancy and breastfeeding [Internet]. Disponible sur: https://www.rcog.org.uk/en/guidelines-research-services/coronavirus-covid-19-pregnancy-and-womens-health/covid-19-vaccines-and-pregnancy/covid-19-vaccines-pregnancy-and-breastfeeding/