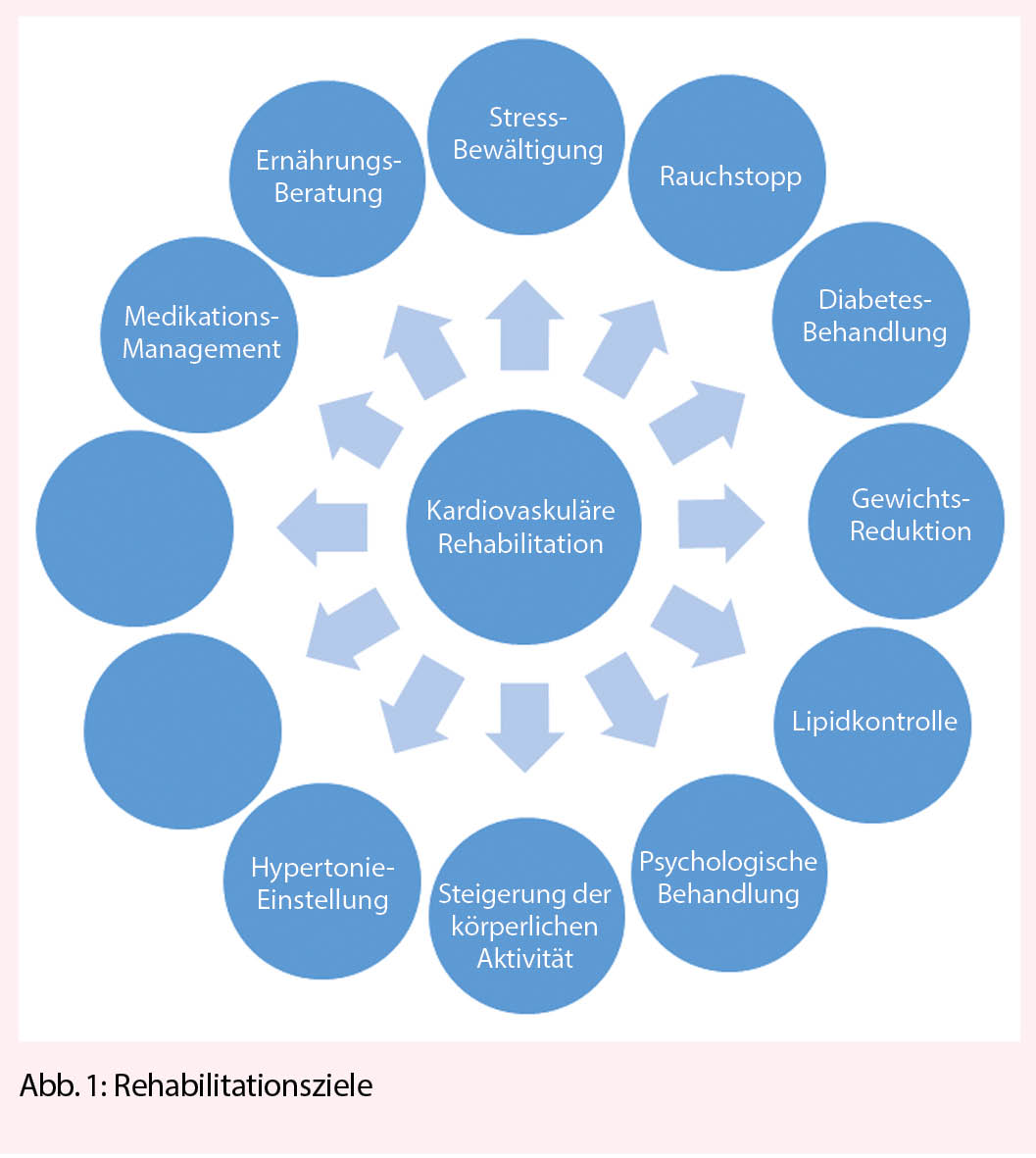
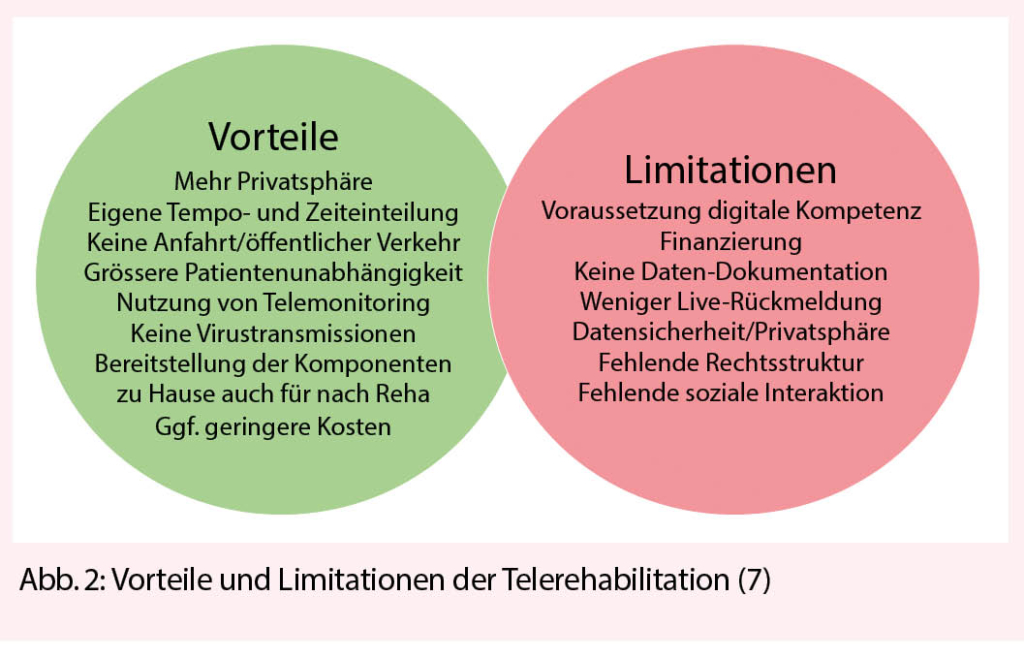
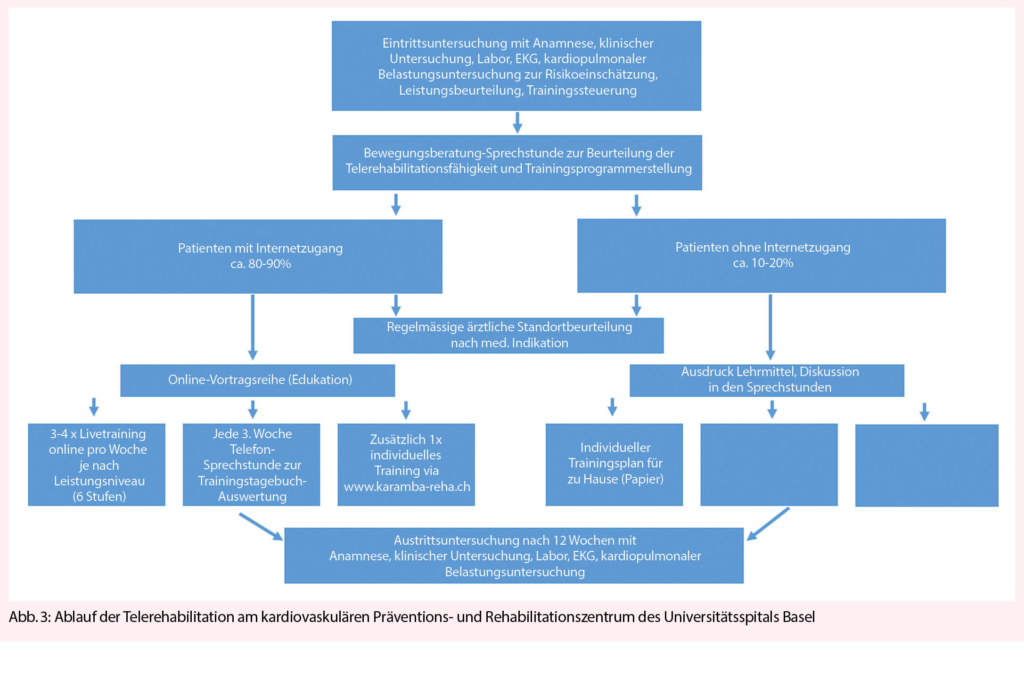
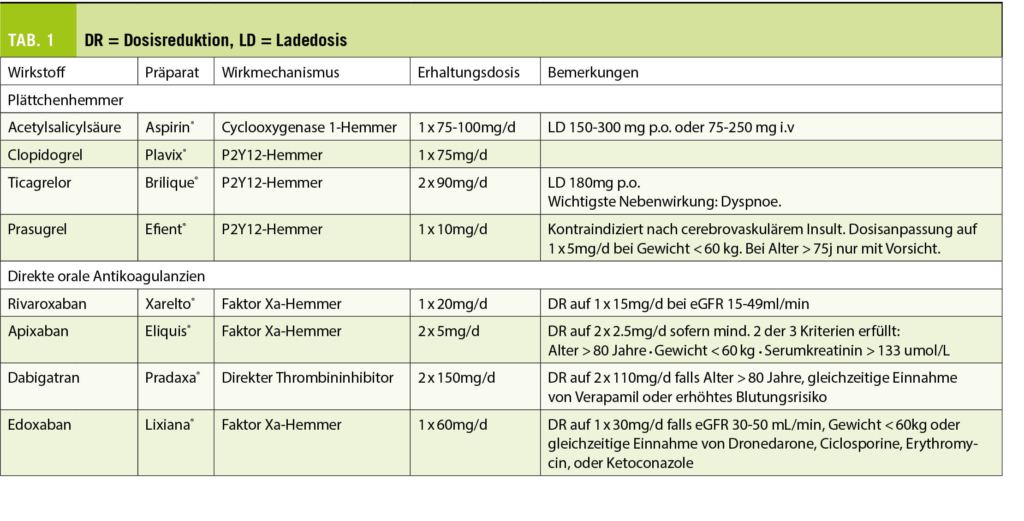
La polyarthrose de l’ articulation de la base du pouce et des articulations interphalangiennes est la cause la plus fréquente de douleur et de déficience fonctionnelle de la main, surtout chez les femmes ménopausées. Le traitement conservateur comprend l’ ergothérapie, les anti-inflammatoires topiques et les injections intra-articulaires de stéroïdes à effet retard. Sur le plan chirurgical, on pratique généralement une arthroplastie sur les articulations IPP, une arthrodèse sur les articulations IPD et une trapézectomie combinée à une interposition de suspension sur l’ articulation de la base du pouce.
La polyarthrose des articulations des doigts est l’ une des maladies les plus courantes de la main, entraînant des douleurs et une gêne fonctionnelle. Bien qu’ elle ne réduise pas la mobilité, elle réduit considérablement la qualité de vie. La prévalence des signes radiographiques de polyarthrose avec rétrécissement de l’ interligne articulaire, ostéophytes et sclérose sous-chondrale est globalement élevée mais varie fortement selon les régions (de 21 % aux États-Unis à 92 % au Japon). La polyarthrose symptomatique, en revanche, est beaucoup moins fréquente, avec une prévalence de
3 à 16 %. Le risque à vie de développer une polyarthrose symptomatique à l’ âge de 85 ans est de 47 % pour les femmes et de 25 % pour les hommes, avec un pic pour les femmes à l’ âge de 50 ans (1).
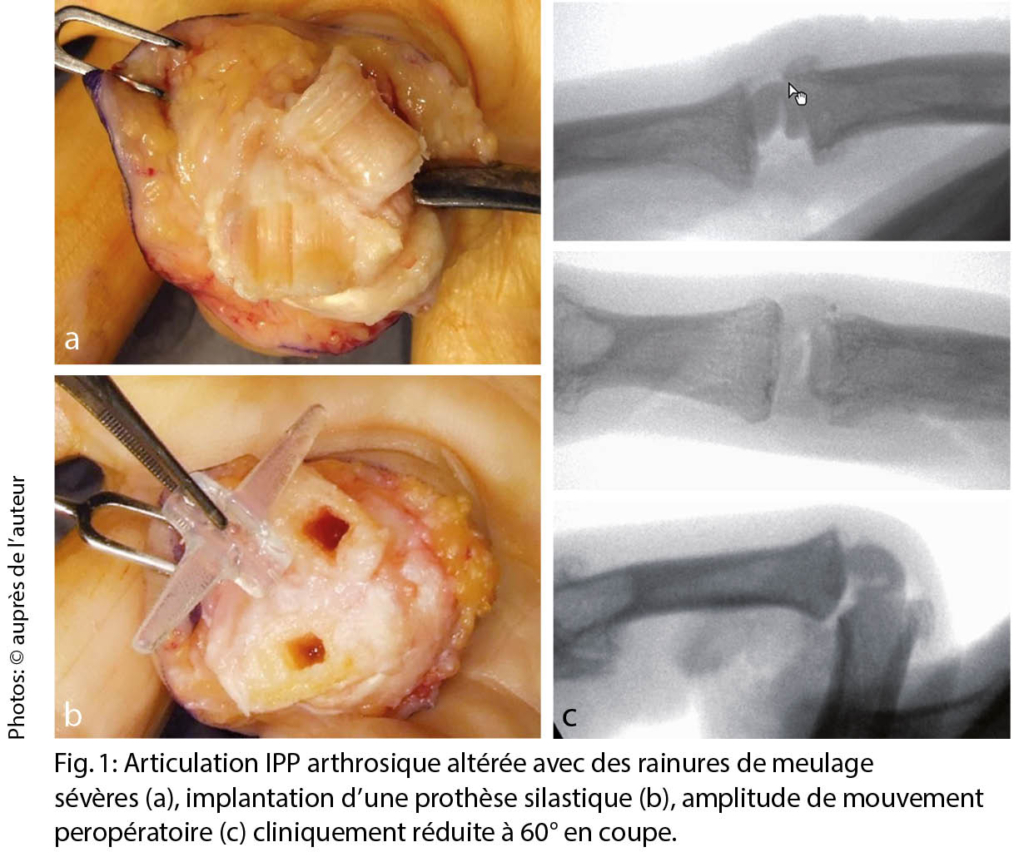
La pathogenèse de la polyarthrose des doigts est multifactorielle, mais les détails sont encore inconnus. L’ arthrose des doigts est la plus héréditaire, puisqu’ elle représente environ 60 %. La réponse inflammatoire, qui est présente mais beaucoup plus modérée que dans la polyarthrite rhumatoïde, reste controversée en tant que facteur pathogénique et est également considérée comme une conséquence de la destruction des articulations. Outre la génétique, le stress mécanique excessif est probablement le facteur connu le plus important, comme en témoigne la main dominante plus fréquemment touchée. La destruction du cartilage s’ accompagne de la formation d’ ostéophytes marginaux qui peuvent irriter la capsule articulaire et provoquer des douleurs. Au stade final, les composantes articulaires s’ écrasent l’ un sur l’ autre avec des sillons parfois profonds (fig. 1), affectant la mobilité plus que la stabilité. La forme érosive de la polyarthrose, en revanche, présente une destruction plus rapide des parties osseuses également, ce qui entraîne plus fréquemment une instabilité articulaire (1).
Cliniquement, on observe une enflure, des déformations et la formation de nodosités dorsolatérales de plusieurs articulations terminales (d’ Heberden) et médianes (de Bouchard) des doigts ; très rarement, une articulation métacarpophalangienne peut être atteinte de manière isolée. Des ganglions (kystes mucoïdes) peuvent se former au niveau des articulations terminales, qui se perforent dans de rares cas et déversent un liquide gélatineux. Au stade avancé, notamment dans la forme érosive, il peut en résulter une instabilité, une subluxation et une luxation, mais aussi une fusion spontanée, ce qui entraîne une gêne fonctionnelle considérable. Dans le cas d’ une arthrose de l’ articulation de la base du pouce (rhizarthrose), la douleur est proéminente lors de la prise en tenaille ou en pince. La douleur palpatoire est plus facilement provoquée dans la zone de l’ articulation palmo-radiale, un test beaucoup plus sensible que le test par broyage. Au stade avancé, on peut observer une subluxation de l’ articulation de la base du pouce dans le sens radial-dorsal, une contracture d’ adduction du métacarpien I et une hyperextension compensatoire de l’ articulation métacarpophalangienne (déformation en Z), ce qui est associé à un handicap fonctionnel sévère, car la 1ère commissure ne peut pratiquement plus être ouverte. La rhizarthrose accompagne souvent l’ arthrose de l’ articulation STT, mais elle est moins souvent symptomatique et peut être différenciée de la première par une extension du poignet et une abduction radiale douloureuses. Les symptômes et la douleur ne sont que modérément corrélés avec la gravité radiographique de l’ arthrose. Si la chirurgie est indiquée et planifiée, des radiographies conventionnelles dans 2 plans (doigt, pouce exactement postérieur-antérieur latéralement) ainsi que le poignet exactement postérieur-antérieur latéralement sont nécessaires pour l’ évaluation de l’ articulation STT.
Traitement conservateur
Le traitement conservateur consiste à préserver les fonctions, à réduire la douleur et à fournir un suivi et une éducation à long terme au patient. La mesure la plus durable pour préserver la fonction de la main est d’ encourager le patient à utiliser ses mains régulièrement et de manière aussi diversifiée que possible, que ce soit dans la vie quotidienne ou pour les travaux manuels, mais aussi pour le sport ou le jardinage. L’ ergothérapie (conseils ergonomiques, distribution d’ aides, pose d’ attelles et d’ orthèses de stabilisation) (fig. 2) peut compenser une détérioration temporaire ou rétablir des fonctions, mais n’ est souvent pas disponible à long terme. Par conséquent, la motivation du patient à rester indépendant et actif, à maintenir un programme d’ exercices quotidiens gérables par lui-même (mobilisation et renforcement avec de la pâte à modeler/une balle en mousse plastique) est très importante et a un impact significatif sur l’ indépendance et la qualité de vie (2).

L’ évolution de la polyarthrose est généralement cyclique, avec des intervalles prolongés oligosymptomatiques. Les épisodes douloureux sont accompagnés d’ une augmentation de la raideur et de l’ enflure des articulations des doigts. La douleur doit être réduite par le port de doigtiers compressibles la nuit, et la mobilité doit être entraînée avec des bandages élastiques de type Quengel ainsi qu’ au moyen de pâte à pétrir en silicone. L’ application locale d’ onguents contenant des AINS et de la capsaïcine doit être préférée à l’ administration systémique (2, 3).
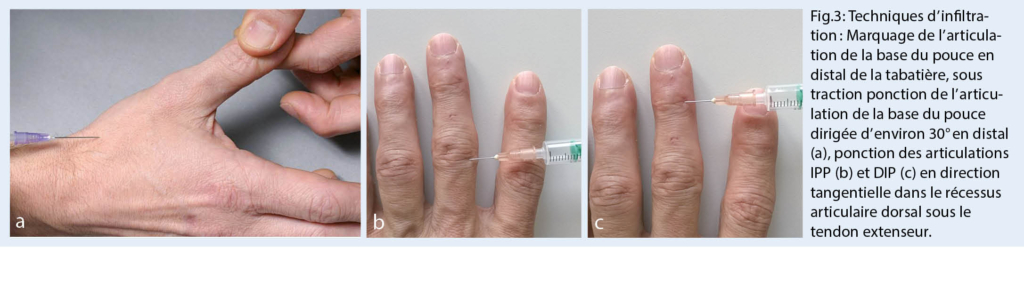
Les exacerbations de la douleur, surtout lorsqu’ elles sont associées à des douleurs de repos et de nuit, peuvent être efficacement réduites par des injections intra-articulaires d’ une préparation de cortisone retard. Bien que cet effet soit controversé dans la littérature (4), notre expérience est très bonne à cet égard. L’ infiltration d’ une articulation de la base du pouce douloureuse est efficace au bout de 2 à 3 jours et produit souvent un effet sur plusieurs mois. De nombreux patients se débrouillent à plus long terme avec 2 ou 3 infiltrations par an. Les infiltrations au niveau des articulations IPD et IPP et celles avec des préparations d’ acide hyaluronique sont un peu moins efficaces (fig. 3).
Traitement chirurgical
Un traitement conservateur de la douleur ayant perdu son efficacité est la principale indication de la chirurgie, ainsi que la destruction prononcée et l’ instabilité subséquente des articulations (forme souvent érosive). Les ganglions articulaires/kystes mucoïdes ne sont excisés que s’ ils sont douloureux, très gros ou perforants. Cela peut être combiné avec une synovectomie, l’ ablation des ostéophytes et la dénervation. En règle générale, l’ arthroplastie (remplacement de l’ articulation) est effectuée sur l’ articulation IPP. La plupart de l’ expérience a été acquise avec les prothèses silastiques utilisées depuis les années 1960, des charnières flexibles et monoblocs en silicone, qui sont insérées dans les cavités médullaires adjacentes sans ostéointégration (fig. 1). Elles présentent un faible taux de complications, permettent une amplitude de mouvement moyenne de 60° (fortement dépendante de l’ amplitude de mouvement préopératoire) et gardent un effet thérapeutique à 10 ans d’ environ 90 % (5, 6). Le remplacement de la prothèse est plus facile que celui des prothèses de surface (2 pièces, couple d’ usure PE métal ou pyrocarbone) car il n’ y a pas de connexion fixe à l’ os. Le seul avantage des prothèses de remplacement de surface est une plus grande stabilité (surtout latérale), c’ est pourquoi elles sont installées surtout à l’ articulation IPP de l’ index ou du majeur. Le taux de révision est légèrement plus élevé, et la mobilité et le taux de survie sont légèrement moins bons qu’ avec les prothèses silastiques (7). Si le profil de charge est élevé (travailleur manuel), on peut également envisager une arthrodèse, qui est très stable et présente un faible taux de révision (8). Au niveau de l’ articulation DIP, une arthrodèse est généralement réalisée à 0°, mais dans le cas d’ un profil de charge spécial/élevé (artisan), elle peut être réalisée en légère flexion de 10-30°. Si une mobilité est nécessaire au niveau de l’ articulation IPD (musicien, instrument à cordes), une prothèse silastique peut également être utilisée. La durabilité est similaire à celle de l’ articulation IPP, et l’ amplitude de mobilité est d’ un bon 30° (9).
Au niveau de l’ articulation de la base du pouce, la trapézectomie, généralement associée à une suspension et à des interpositions avec un tendon autologue, est l’ intervention la plus courante avec une réduction fiable de la douleur et un faible taux de révision (10). De même, l’ arthrose coexistante de l’ articulation STT peut être co-traitée. L’ inconvénient potentiel de la trapézectomie est la réduction résiduelle de la force de préhension lors de la pince pouce-index et de la prise en tenaille. Les prothèses de la base du pouce de différents types (joint à rotule en 2 parties, interposition pyrocardienne, remplacement du trapèze) peuvent avoir une bonne fonction initiale mais ne sont toujours pas standard en raison du taux de révision plus élevé (11).
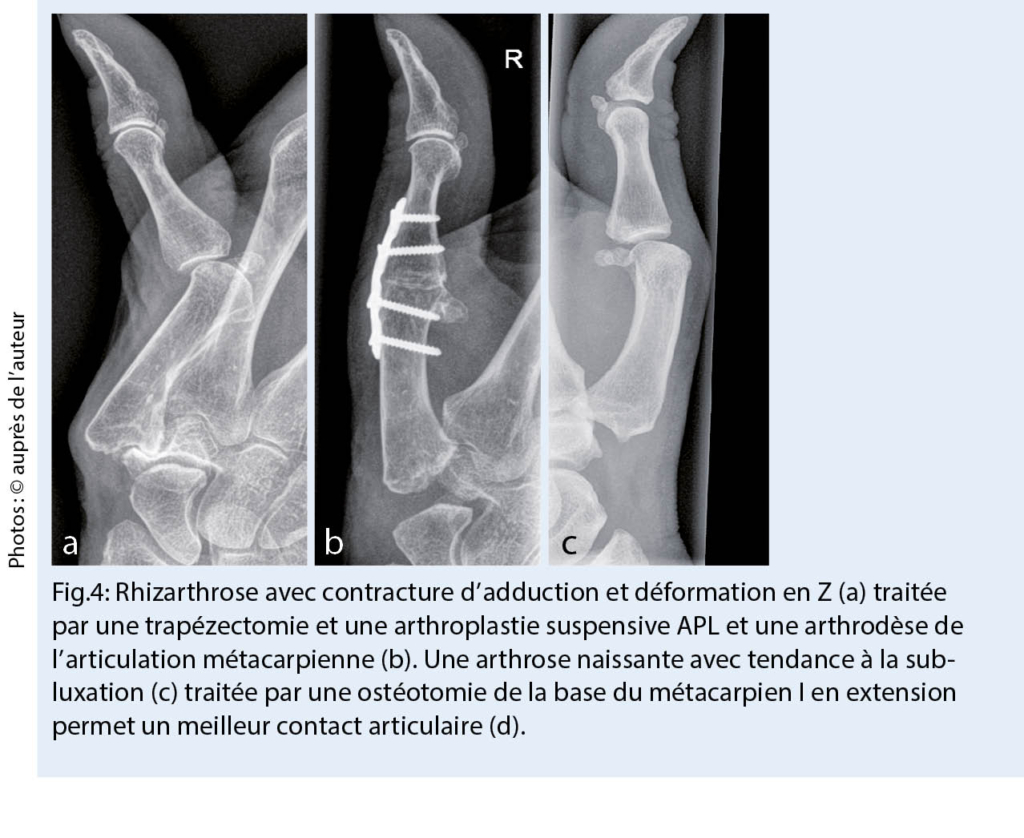
Si une rhizarthrose sévère avec subluxation et déformation en Z est présente, elle doit être stabilisée en plus par une capsulodèse ou une arthrodèse dans l’ articulation métacarpienne (fig. 3). Dans le cas d’ un profil de charge élevé (artisan, agriculteur), l’ arthrodèse robuste de l’ articulation de la base du pouce est souvent utilisée. En ce qui concerne les résultats cliniques, aucune différence significative n’ a été constatée à ce jour entre les techniques susmentionnées (10). Au stade initial de la rhizarthrose, une ostéotomie basale étendue de l’ os metacarpien I (fig. 4) peut augmenter la surface de contact de l’ articulation et ainsi obtenir une réduction de la douleur (12). La stabilisation ligamentaire (lig. intermetacarpale I-II) de l’ articulation a un effet similaire en améliorant la congruence des surfaces articulaires. Malgré de bons résultats, ces interventions ne sont pas très courantes car elles doivent être réalisées à un stade plus précoce.
Article traduit de « der informierte arzt » 04_2021
Copyright bei Aerzteverlag medinfo AG
Hôpital universitaire Balgrist
Forchstrasse 340
8008 Zurich
andreas.schweizer@balgrist.ch
L’ auteur a déclaré recevoir de Medacta des honoraires de consultation par cas pour les ostéotomies par guide 3D.
1. Marshall M, Watt FE, Vincent TL et al. Hand osteoarthritis: clinical phenotypes, molecular mechanisms and disease management. Nat Rev Rheumatol, 2018 Nov;14(11):641-656.
2. Kloppenburg M, Kroon FP, Blanco FJ et al. 2018 update of the EULAR recommendations for the management of hand osteoarthritis. Ann Rheum Dis 2019 Jan;78(1):16-24.
3. Valdes K, Marik T. A systematic review of conservative interventions for osteoarthritis of the hand. J Hand Ther, 2010 Oct-Dec;23(4):334-50.
4. Kroon FP, Rubio R, Schoones JW et al. Intra-Articular Therapies in the Treatment of Hand Osteoarthritis: A Systematic Literature Review, Drugs Aging. 2016 Feb;33(2):119-33.
5. Bales JG, Wall LB, Stern PJ. Long-term results of Swanson silicone arthroplasty for proximal interphalangeal joint osteoarthritis. J Hand Surg Am. 2014 Mar;39(3):455-61.
6. Takigawa S, Meletiou S, Sauerbier M et al. Long-term assessment of Swanson implant arthroplasty in the proximal interphalangeal joint of the hand. J Hand Surg Am. 2004 Sep;29(5):785-95.
7. Yamamoto M, Malay S, Fujihara Y et al. A Systematic Review of Different Implants and Approaches for Proximal Interphalangeal Joint Arthroplasty. Plast Reconstr Surg. 2017 May;139(5): 1139e-1151e.
8. Vitale MA, Fruth KM, Rizzo M et al. Prosthetic Arthroplasty Versus Arthrodesis for Osteoarthritis and Posttraumatic Arthritis of the Index Finger Proximal Interphalangeal Joint. J Hand Surg Am. 2015 Oct;40(10):1937-48.
9. Sierakowski A, Zweifel C, Sirotakova M et al. Joint replacement in 131 painful osteoarthritic and post-traumatic distal interphalangeal joints. J Hand Surg Eur Vol. 2012 May;37(4):304-9.
10. Wajon A, Vinycomb T, Carr E et al. Surgery for thumb (trapeziometacarpal joint) osteoarthritis. Cochrane Database Syst Rev. 2015 Feb 23;2015(2):CD004631.
11. Gay AM, Cerlier A, Iniesta A et al. Surgery for trapeziometacarpal osteoarthritis. Hand Surg Rehabil. 2016 Sep;35(4):238-249.
12. Wilson JN. Basal osteotomy of the first metacarpal in the treatment of arthritis of the carpometacarpal joint of the thumb. Br J Surg 1973;60:854–8.