In Europa sterben 20% der Frauen und 19% der Männer an den Folgen eines chronischen Koronarsyndroms, welches die wichtigste Todesursache überhaupt darstellt (1). Frauen mit chronischem Koronarsyndrom sind stärker symptomatisch, weisen mehr Komorbiditäten und ein schlechteres therapeutisches Outcome auf als Männer, haben aber seltener obstruktive atherosklerotische Koronarläsionen (2). Dies sollte bei der Diagnostik und Behandlung entsprechend berücksichtigt werden.
Menopause und kardiovaskuläres Risiko
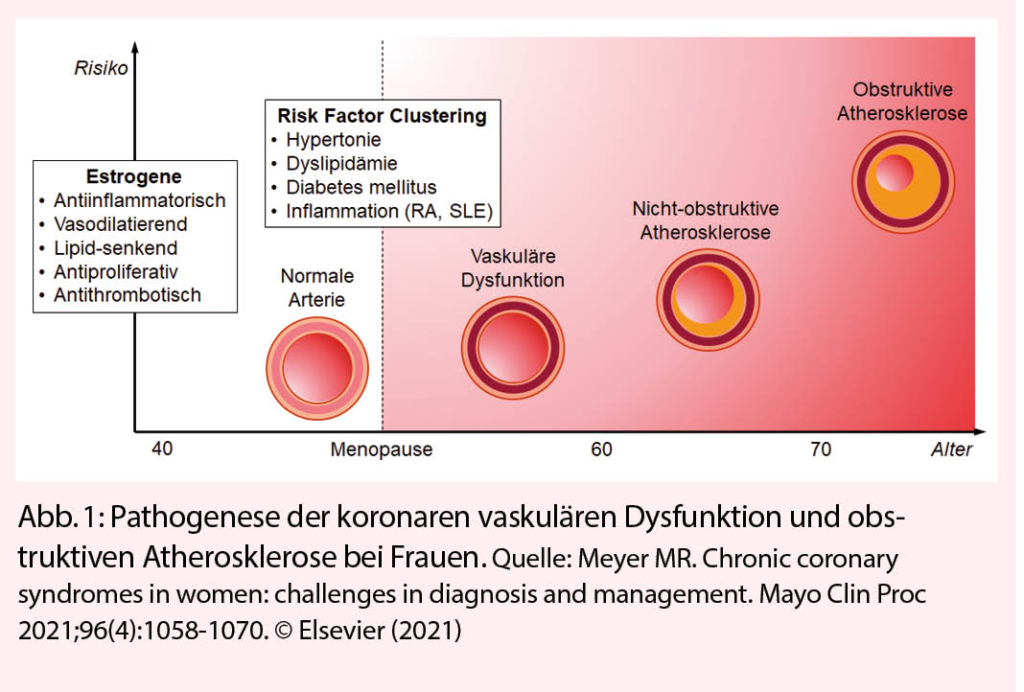
Bereits in frühen Stadien unterscheidet sich die koronare Atherogenese bei Frauen und Männern. So lassen sich im jungen Erwachsenenalter bei Männern zahlreichere und weiter fortgeschrittene atherosklerotische Läsionen nachweisen (3). Entsprechend sind Männer bei der klinischen Erstmanifestation einer obstruktiven Koronaratheromatose 8-10 Jahre jünger als Frauen (4). Dieser Geschlechtsunterschied lässt sich hauptsächlich auf den atheroprotektiven Effekt endogener Estrogene zurückführen, welche vasodilatierend, lipidsenkend, antiinflammatorisch, antioxidativ, antiproliferativ und antithrombotisch wirken (5). Insofern beginnt nach der Menopause ein besonders vulnerabler Abschnitt im Leben einer Frau (2). Ab dem Alter von 50 Jahren steigen der systolische Blutdruck und das HbA1c stärker als bei Männern, und Frauen weisen in den folgenden 3 Dekaden durchschnittlich um 0.3 mmol/L höhere LDL-Cholesterin-Werte auf (6). Mit diesem Clustering von Risikofaktoren, eventuell aggraviert durch entzündliche, vorwiegend Frauen betreffende Erkrankungen wie ein systemischer Lupus erythematodes oder eine rheumatoide Arthritis, werden inflammatorische und funktionelle Veränderungen in Koronararterien begünstigt (7). Man geht dabei von einer Schädigung der Vasoreaktivität von epikardialen Koronarien (v.a. Reduktion der NO Bioaktivität) und der koronaren Mikrozirkulation sowie einem positiven Remodeling der Arterienwand aus (7). Dies kann dazu führen, dass sich unter Belastung die myokardiale Perfusion nicht mehr adäquat steigern lässt. Folge davon ist eine Myokardischämie ohne obstruktive atherosklerotische Koronarläsion, auch ischemia with no obstructive coronary artery disease (INOCA) genannt (8). Obschon diese funktionellen Veränderungen häufig mit einer diffusen Koronaratheromatose einhergehen, bilden sich obstruktive, fluss-limitierende Läsionen bei Frauen in der Regel erst ab der siebten Lebensdekade (Abb. 1).
Das Risiko für eine koronare Atherosklerose steigt bei Frauen durch einen Diabetes mellitus, eine arterielle Hypertonie oder Nikotinkonsum stärker als bei Männern (9, 10). Zusätzliche Risikofaktoren bei Frauen sind eine frühere Chemotherapie mit Anthracyclinen oder Trastuzumab, eine Radiotherapie der linken Brust (und damit eine Exposition der Koronararterien gegenüber ionisierender Strahlung), sowie hormonelle Erkrankungen, welche mit einem Estrogenmangel einhergehen (prämature Ovarialinsuffizienz, polyzystisches Ovarialsyndrom, hypothalamische Amenorrhoe, chirurgische Ovarektomie) (9-11). Auch hypertensive Schwangerschaftserkrankungen, eine Frühgeburt oder ein Schwangerschaftsdiabetes sind assoziiert mit einem höheren kardiovaskulären Risiko im späteren Leben. Obwohl kein klinischer Risikoscore diese Faktoren beinhaltet, sollten sie bei der Abklärung von Patientinnen mit möglichem chronischem Koronarsyndrom berücksichtigt werden (9, 10).
Geschlechtsunterschiede in Abklärungs-Algorithmen
Obschon sich das chronische Koronarsyndrom bei Frauen und Männern in vielerlei Hinsicht unterscheidet, fokussieren die aktuellen Guidelines auf die Diagnostik und Therapie von obstruktiven Atheromen, der typischen Entität bei Männern (12, 13). Geschlechtsspezifische Aspekte werden erst in einem Unterkapitel («specific circumstances») diskutiert, was wohl der disproportional tiefen Einschlussquote von Frauen (~30%) in klinischen Studien und einem daraus resultierenden evidence gap geschuldet ist (14).
Aktuelle Abklärungs-Algorithmen räumen der Abschätzung der Vortestwahrscheinlichkeit für das Vorliegen eines chronischen Koronarsyndroms basierend auf Geschlecht, Alter und Art der Angina pectoris einen hohen Stellenwert ein (12, 13). Allerdings korreliert die Einteilung in typische Angina, atypische Angina und nicht-anginöse Thoraxschmerzen bei Frauen – anders als bei Männern – schlecht mit dem Befund einer obstruktiven Koronaratheromatose (15). Mögliche Gründe sind das häufigere Vorliegen einer koronaren mikrovaskulären Dysfunktion, welche atypische Angina pectoris begünstigt, sowie vielfältigere und deshalb möglicherweise atypisch imponierende Schilderungen der thorakalen Beschwerden (2). Die American Heart Association empfiehlt deshalb, die Abschätzung der Vortestwahrscheinlichkeit bei Frauen basierend auf ihrem Alter (und damit Zeit seit der Menopause) und dem Vorliegen von Komorbiditäten, aber unabhängig von der Art der Thoraxschmerzen vorzunehmen (Abb. 2) (16).
Weiterführende Abklärungen sind gemäss den Europäischen Guidelines indiziert, wenn die Vortestwahrscheinlichkeit > 15% beträgt (was < 70-jährige Frauen lediglich mit typischer Angina pectoris erreichen können), wobei nicht-invasive Diagnostik auch im Bereich von 5-15% unter Inkaufnahme vermehrter falsch-positiver Testresultate erwogen werden kann (12). Eine Ergometrie kann zur Abschätzung der Prognose anhand der körperlichen Leistungsfähigkeit und zur Beurteilung des Kreislaufverhaltens hilfreich sein. Als Ischämietest weist sie bei Frauen aber eine noch geringere Sensitivität und Spezifität als bei Männern auf, was die diagnostische Wertigkeit reduziert und nicht selten zu diagnostischer Unsicherheit und weiteren Tests führt (16). Voraussetzungen für eine Ergometrie sollten eine ausreichende Leitungsfähigkeit (> 5 METs) und ein normales Ruhe-EKG sein. Fällt dann eine Ergometrie bei Frauen mit tiefer Vortestwahrscheinlichkeit unauffällig aus, unterscheidet sich die Prognose im Vergleich zu Patientinnen mit einer negativen Szintigraphie nicht (17). Da der positiv-prädiktive Wert einer Ergometrie bei Frauen aber < 50% beträgt (bei Männern 77%), d.h. weniger als die Hälfte der Patientinnen mit pathologischer Ergometrie tatsächlich eine obstruktive Koronarläsion aufweisen, ist ihre Aussagekraft deutlich eingeschränkt (16).
Verglichen mit der Ergometrie weisen bildgebende Ischämietests eine bessere Sensitivität zur Detektion einer obstruktiven Koronaratheromatose auf (18). Das kardiale MRI hat bei Frauen eine diagnostische Treffsicherheit für eine Myokardischämie oder –narbe von 92% (bei Männern 86%) (19) und ist möglicherweise die Kosten-effizienteste Modalität (20). Eine Stress-Echokardiographie ist demgegenüber stärker abhängig vom Untersucher und dem Vorliegen eines guten Schallfensters (18). Die diagnostische Zuverlässigkeit einer Myokardszintigraphie bei Frauen ist wegen der kleineren Herzgrösse sowie Attenuationsartefakten durch Brust- und Fettgewebe eingeschränkt, und verursacht zudem die grössten Kosten und die höchste Strahlenbelastung (16, 18). Als anatomischer Test erfreut sich die CT-Koronarangiographie zunehmender Beliebtheit zum Ausschluss eines chronischen Koronarsyndroms (12, 13). Einschränkend muss hier aber erwähnt werden, dass in einer grossen randomisierten Studie die Durchführung einer CT-Koronarangiographie zusätzlich zur Standardtherapie nach 6 Monaten zu keiner Verbesserung der thorakalen Beschwerden, der körperlichen Leistungsfähigkeit oder der Lebensqualität geführt hat (21). Dies könnte zumindest teilweise darauf zurückzuführen sein, dass mit einer anatomischen Teststrategie eine INOCA als Ursache der thorakalen Beschwerden verpasst wird (2).
Invasive Diagnostik von INOCA
Von INOCA sind mehrheitlich Frauen betroffen (8), wobei das Stellen einer korrekten Diagnose auch bei einer kompatiblen Anamnese schwierig ist. Einerseits ist die Mikrozirkulation zu klein für eine bildgebende Darstellung – mit einer Koronarangiographie sind 95% der Gefässe des Herzens nicht zu sehen. Andererseits stellt die Mikrozirkulation ein komplexes System verschiedener Kompartimente – Prä-Arteriolen, Arteriolen, Kapillaren – dar, welches sich anatomisch und funktionell von den epikardialen Arterien unterscheidet, aber über humorale und physikalische Faktoren trotzdem eng mit der Makrozirkulation interagiert. Zuletzt ist auch die INOCA-Pathophysiologie vielfältig und umfasst sowohl strukturelle (mikrovaskuläre Obstruktion, Rarefizierung von Kapillaren) als auch funktionelle (erhöhter Gefässtonus, Spasmen) Veränderungen (8, 22, 23).
Typische oder atypische Angina pectoris ist das häufigste INOCA-Symptom, aber auch Anstrengungsdyspnoe und eine eingeschränkte Leistungsfähigkeit sind Manifestationen der Erkrankung. Nach Ausschluss einer obstruktiven Koronaratheromatose sollten zunächst weitere Ursachen für eine myokardiale Ischämie, z.B. eine schwere Aortenstenose, Tachykardie, Anämie oder Schilddrüsenfunktionsstörung, als Differentialdiagnose ausgeschlossen werden (22). Für INOCA sprechen das Vorliegen von klassischen kardiovaskulären Risikofaktoren (v.a. eines Diabetes mellitus), und häufig besteht begleitend eine Koronarsklerose. Aufwändig und nicht immer verfügbar sind nicht-invasive Messungen zur Beurteilung einer funktionellen Koronarpathologie, beispielsweise eine Bestimmung des myocardial perfusion reserve index mittels kardialem MRI oder der koronaren Flussreserve (CFR) mittels PET-CT (24, 25).
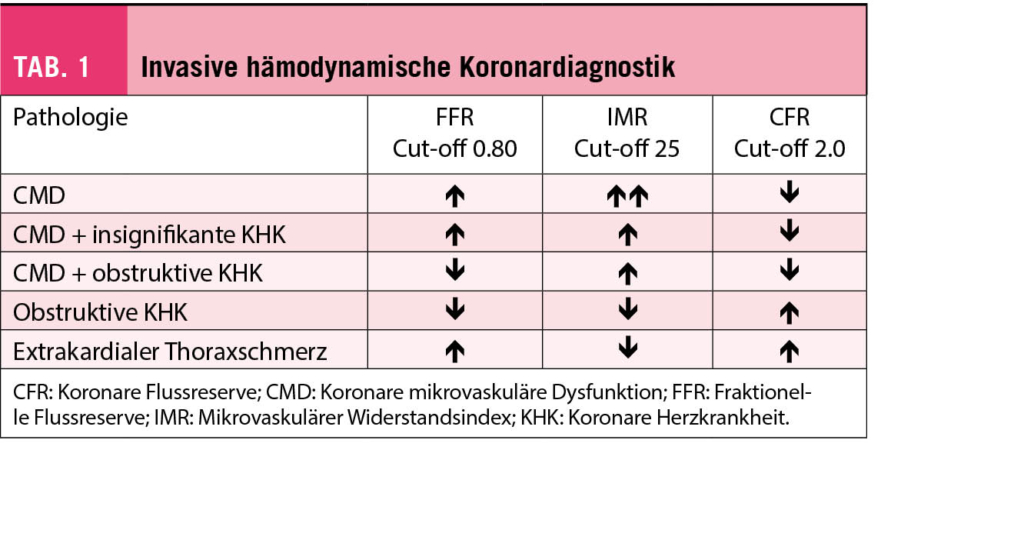
Bei Verdacht auf INOCA wird deshalb eine invasive Beurteilung der Koronarphysiologie im Hinblick auf das Vorliegen einer koronaren mikrovaskulären Dysfunktion zunehmend beliebter (ESC-Klasse IIa B Empfehlung (12)). Als Erweiterung der routinemässig durchgeführten Bestimmung der fraktionellen Flussreserve (FFR) können mit vergleichbarem Aufwand die CFR und der mikrovaskuläre Widerstandsindex (IMR) bestimmt werden, welche sich aus der FFR-basierten Druckmessung und einer Quantifizierung des Koronarflusses mittels Thermodilution errechnen lassen (Tab. 1) (23, 26). Somit ist eine Koronarangiographie nicht nur diagnostischer Goldstandard für den Nachweis einer obstruktiven Atherosklerose, sondern erlaubt gleichzeitig auch diagnostische Klarheit für das Vorliegen einer INOCA zu schaffen. Dies ist nicht trivial: prognostisch entspricht INOCA einer koronaren Eingefässerkrankung und geht mit einem erhöhten Risiko für myocardial infarction with no obstructive coronary arteries (MINOCA) sowie einer Herzinsuffizienz mit erhaltener systolischer Funktion (HFpEF) einher (27-29). Betroffene haben eine eingeschränkte Lebensqualität und werden wiederholt abgeklärt, weshalb eine korrekte Diagnosestellung auch aus ökonomischer Sicht relevant ist (8). Dies können Gründe für eine invasive Abklärung und gegen die Verwendung von INOCA als «Ausweichdiagnose» sein, obwohl bislang nicht das eine Medikament oder spezifische Therapieverfahren zur Verfügung steht.
Geschlechtsunterschiede in der Therapie
Die Koronarangiographie bietet bei Nachweis einer obstruktiven Koronarläsion gleichzeitig die Option einer PCI. Die modernen drug-eluting stents weisen dabei vergleichbare Langzeitresultate bei Frauen und Männern auf (30). Der radiale Zugang hat zudem die bei Frauen häufigeren Blutungskomplikationen nach femoraler Punktion entschärft (31). Der meist diffuse atherosklerotische Befall und der dünnere Gefässdurchmesser bei Frauen führen aber häufiger als bei Männern zu einer inkompletten Koronarrevaskularisation, dies sowohl mittels PCI als auch mittels AC-Bypass-Operation. Letztere geht bei Frauen auch mit höherer Morbidität und Langzeit-Mortalität als bei Männern einher (32, 33).
Basis jeder Behandlung des chronischen Koronarsyndroms bildet die medikamentöse Therapie, wobei auch hier wichtige Geschlechtsunterschiede zu beachten sind (34). Diese sind einerseits in der Pharmakodynamik begründet, indem Frauen eine andere Absorption, Verteilung, metabolische Aktivität (z.B. der CYP450-Enzyme) und Elimination als Männer aufweisen, was bei der Einnahme einer gleichen Dosis zahlreicher kardiovaskulärer Wirkstoffe zu höheren Plasmaspiegeln als bei Männern führt. Andererseits gibt es Geschlechts-Unterschiede in der Pharmakodynamik, d.h. der Wirkung von Arzneimitteln am Zielgewebe (34, 35). Daraus potentiell resultierende unerwünschte Wirkungen sind für Substanzklassen, die beim chronischen Koronarsyndrom eingesetzt werden, in Tabelle 2 zusammengefasst.
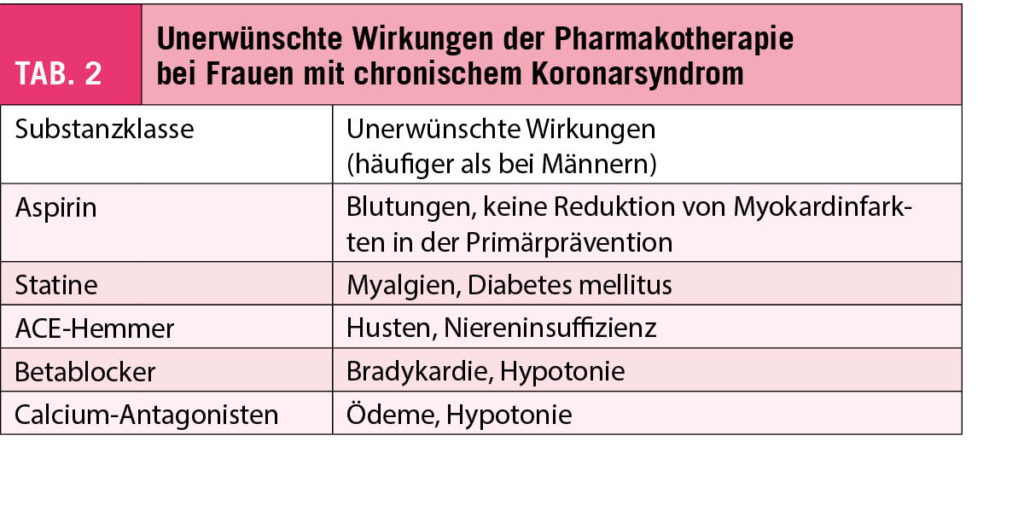
Für die Behandlung von INOCA fehlt bislang die Evidenz aus grösseren klinischen Studien. Empfohlen werden primär Betablocker (z.B. Nebivolol), Calcium-Antagonisten, kurzwirksame Nitrate als Anfallstherapie und –prophylaxe, sowie eine Therapie der kardiovaskulären Risikofaktoren (ACE-Hemmer, Statine, Antidiabetika) (2, 22, 26). Langwirksame Nitrate sollten vermieden werden. Erwogen werden können Nicorandil, trizyklische Antidepressiva und nicht-pharmakologische Massnahmen, z.B. ein kardiales Rehabilitationsprogramm, zur Lifestyle-Modifikation. Ein derart strukturiertes INOCA-Behandlungsprogramm im Anschluss an eine invasive Diagnostik verbesserte die Angina pectoris und die Lebensqualität in einer randomisierten Studie gegenüber dem Standardmanagement (36).
Obwohl die kardiovaskuläre Sekundärprävention bei Frauen und Männern gleich wirksam ist, werden Risikofaktoren bei Frauen seltener kontrolliert und insbesondere das LDL-Cholesterin weniger erfolgreich medikamentös behandelt (6). Dies kann eine Folge vermehrter unerwünschter Wirkungen auf Grund fehlender Geschlechts-spezifischer Behandlungsrichtlinien sein (34). Den Unterschieden in Effizienz und Sicherheit von diagnostischen und therapeutischen Massnahmen zwischen Frauen und Männern mit chronischem Koronarsyndrom sollte deshalb künftig grössere Bedeutung eingeräumt werden (2).
Copyright bei Aerzteverlag medinfo AG
Leitender Arzt Kardiologie
Stadtspital Triemli
Birmensdorferstrasse 497
8063 Zürich
matthias.meyer@triemli.zuerich.ch
Der Autor hat keine Interessenskonflikte in Zusammenhang mit diesem Artikel.
1. Timmis A, Townsend N, Gale C, Grobbee R, et al. European Society of Cardiology: cardiovascular disease statistics 2017. Eur Heart J 2018;39(7):508-579.
2. Meyer MR. Chronic coronary syndromes in women: challenges in diagnosis and management. Mayo Clin Proc 2021;96(4):1058-1070.
3. McGill HC, McMahan CA. Determinants of atherosclerosis in the young. Am J Cardiol 1998;82(10):30-36.
4. Berger JS, Elliott L, Gallup D, Roe M, et al. Sex differences in mortality following acute coronary syndromes. JAMA 2009;302(8):874-82.
5. Meyer MR, Barton M. Estrogens and coronary artery disease: new clinical perspectives. Adv Pharmacol 2016;77:307-60.
6. Rachamin Y, Grischott T, Rosemann T, Meyer MR. Inferior control of low-density lipoprotein cholesterol in women is the primary sex difference in modifiable cardiovascular risk: A large-scale, cross-sectional study in primary care. Atherosclerosis 2021:published online.
7. Shaw LJ, Bugiardini R, Merz CN. Women and ischemic heart disease: evolving knowledge. J Am Coll Cardiol 2009;54(17):1561-75.
8. Bairey Merz CN, Pepine CJ, Walsh MN, Fleg JL. Ischemia and no obstructive coronary artery disease (INOCA): developing evidence-based therapies and research agenda for the next decade. Circulation 2017;135(11):1075-1092.
9. McSweeney JC, Rosenfeld AG, Abel WM, Braun LT, et al. Preventing and experiencing ischemic heart disease as a woman: state of the science: a scientific statement from the American Heart Association. Circulation 2016;133(13):1302-31.
10. Schmidt KMT, Nan J, Scantlebury DC, Aggarwal NR. Stable ischemic heart disease in women. Curr Treat Options Cardiovasc Med 2018;20(9):72.
11. Bradshaw PT, Stevens J, Khankari N, Teitelbaum SL, et al. Cardiovascular disease mortality among breast cancer survivors. Epidemiology 2016;27(1):6-13.
12. Knuuti J, Wijns W, Saraste A, Capodanno D, et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J 2020;41(3):407-477.
13. Fihn SD, Gardin JM, Abrams J, Berra K, et al. 2012 ACCF/AHA/ACP/AATS/PCNA/SCAI/STS guideline for the diagnosis and management of patients with stable ischemic heart disease: a report of the American College of Cardiology Foundation/American Heart Association task force on practice guidelines, and the American College of Physicians, American Association for Thoracic Surgery, Preventive Cardiovascular Nurses Association, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. Circulation 2012;126(25):e354-471.
14. Gong IY, Tan NS, Ali SH, Lebovic G, et al. Temporal trends of women enrollment in major cardiovascular randomized clinical trials. Can J Cardiol 2019;35(5):653-660.
15. Cheng VY, Berman DS, Rozanski A, Dunning AM, et al. Performance of the traditional age, sex, and angina typicality-based approach for estimating pretest probability of angiographically significant coronary artery disease in patients undergoing coronary computed tomographic angiography: results from the multinational coronary CT angiography evaluation for clinical outcomes: an international multicenter registry (CONFIRM). Circulation 2011;124(22):2423-32, 1-8.
16. Mieres JH, Gulati M, Bairey Merz N, Berman DS, et al. Role of noninvasive testing in the clinical evaluation of women with suspected ischemic heart disease: a consensus statement from the American Heart Association. Circulation 2014;130(4):350-79.
17. Shaw LJ, Mieres JH, Hendel RH, Boden WE, et al. Comparative effectiveness of exercise electrocardiography with or without myocardial perfusion single photon emission computed tomography in women with suspected coronary artery disease: results from the What Is the Optimal Method for Ischemia Evaluation in Women (WOMEN) trial. Circulation 2011;124(11):1239-49.
18. Baldassarre LA, Raman SV, Min JK, Mieres JH, et al. Noninvasive imaging to evaluate women with stable ischemic heart disease. JACC Cardiovasc Imaging 2016;9(4):421-35.
19. Hamada S, Gotschy A, Wissmann L, Paetsch I, et al. Multi-centre study of whole-heart dynamic 3D cardiac magnetic resonance perfusion imaging for the detection of coronary artery disease defined by fractional flow reserve: gender based analysis of diagnostic performance. Eur Heart J Cardiovasc Imaging 2017;18(10):1099-1106.
20. Walker S, Cox E, Rothwell B, Berry C, et al. Cost-effectiveness of cardiovascular imaging for stable coronary heart disease. Heart 2021;107(5):381-388.
21. Williams MC, Hunter A, Shah A, Assi V, et al. Symptoms and quality of life in patients with suspected angina undergoing CT coronary angiography: a randomised controlled trial. Heart 2017;103(13):995-1001.
22. Taqueti VR, Di Carli MF. Coronary microvascular disease pathogenic mechanisms and therapeutic options: JACC state-of-the-art review. J Am Coll Cardiol 2018;72(21):2625-2641.
23. Kunadian V, Chieffo A, Camici PG, Berry C, et al. An EAPCI Expert Consensus Document on Ischaemia with Non-Obstructive Coronary Arteries in Collaboration with European Society of Cardiology Working Group on Coronary Pathophysiology & Microcirculation Endorsed by Coronary Vasomotor Disorders International Study Group. EuroIntervention 2021;16(13):1049-1069.
24. Panting JR, Gatehouse PD, Yang GZ, Grothues F, et al. Abnormal subendocardial perfusion in cardiac syndrome X detected by cardiovascular magnetic resonance imaging. N Engl J Med 2002;346(25):1948-53.
25. Murthy VL, Naya M, Taqueti VR, Foster CR, et al. Effects of sex on coronary microvascular dysfunction and cardiac outcomes. Circulation 2014;129(24):2518-27.
26. Ford TJ, Berry C. How to diagnose and manage angina without obstructive coronary artery disease: lessons from the British Heart Foundation CorMicA trial. Interv Cardiol 2019;14(2):76-82.
27. Jespersen L, Hvelplund A, Abildstrom SZ, Pedersen F, et al. Stable angina pectoris with no obstructive coronary artery disease is associated with increased risks of major adverse cardiovascular events. Eur Heart J 2012;33(6):734-44.
28. Maddox TM, Stanislawski MA, Grunwald GK, Bradley SM, et al. Nonobstructive coronary artery disease and risk of myocardial infarction. JAMA 2014;312(17):1754-63.
29. Kenkre TS, Malhotra P, Johnson BD, Handberg EM, et al. Ten-year mortality in the WISE study (Women’s Ischemia Syndrome Evaluation). Circ Cardiovasc Qual Outcomes 2017;10(12).
30. Stefanini GG, Kalesan B, Pilgrim T, Raber L, et al. Impact of sex on clinical and angiographic outcomes among patients undergoing revascularization with drug-eluting stents. JACC Cardiovasc Interv 2012;5(3):301-10.
31. Chacko Y, Parikh RV, Tremmel JA. Vascular access-related complications in women: temporal trends, emerging data, and the current state of interventional cardiology practice. Curr Atheroscler Rep 2018;20(8):41.
32. Swaminathan RV, Feldman DN, Pashun RA, Patil RK, et al. Gender differences in in-hospital outcomes after coronary artery bypass grafting. Am J Cardiol 2016;118(3):362-8.
33. Johnston A, Mesana TG, Lee DS, Eddeen AB, et al. Sex differences in long-term survival after major cardiac surgery: a population-based cohort study. J Am Heart Assoc 2019;8(17):e013260.
34. Tamargo J, Rosano G, Walther T, Duarte J, et al. Gender differences in the effects of cardiovascular drugs. Eur Heart J Cardiovasc Pharmacother 2017;3(3):163-182.
35. Rosano GM, Lewis B, Agewall S, Wassmann S, et al. Gender differences in the effect of cardiovascular drugs: a position document of the Working Group on Pharmacology and Drug Therapy of the ESC. Eur Heart J 2015;36(40):2677-80.
36. Ford TJ, Stanley B, Good R, Rocchiccioli P, et al. Stratified medical therapy using Invasive coronary function testing in angina: the CorMicA trial. J Am Coll Cardiol 2018;72(23 Pt A):2841-2855.