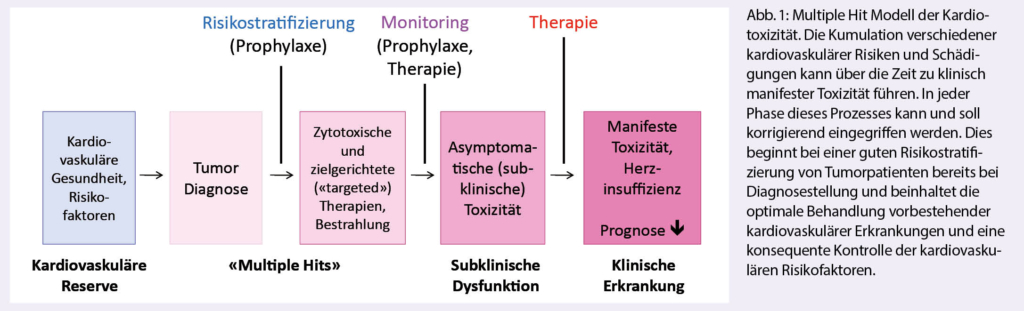
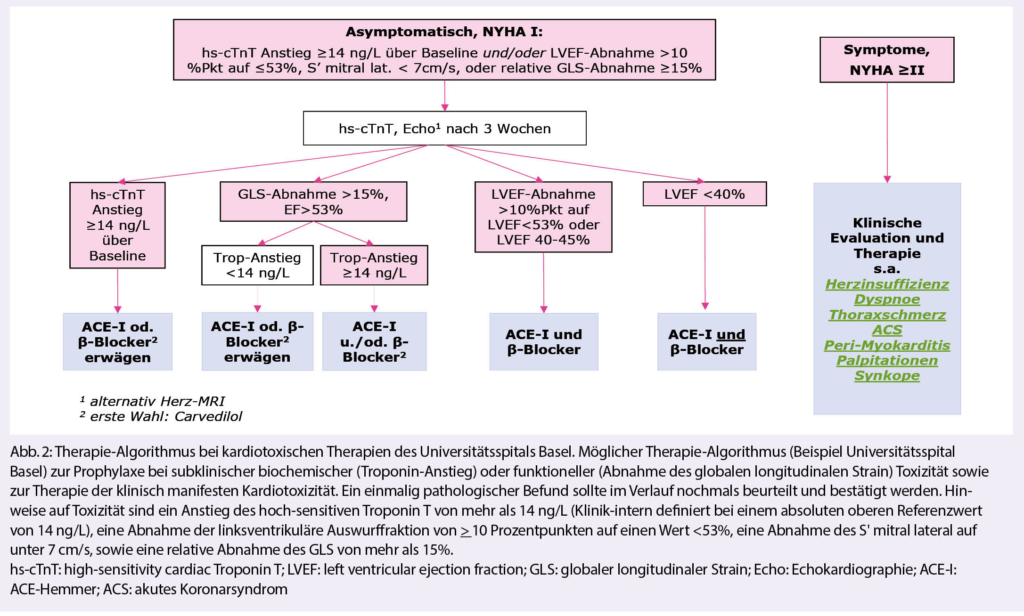
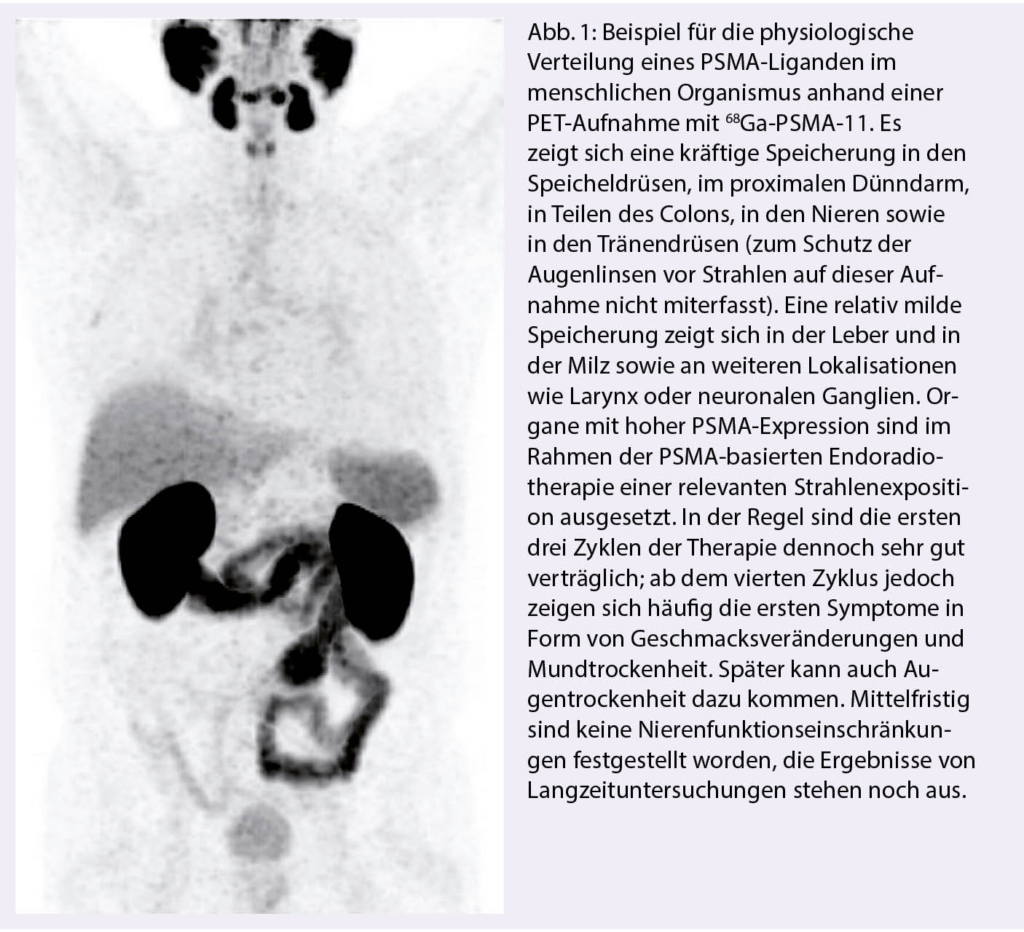
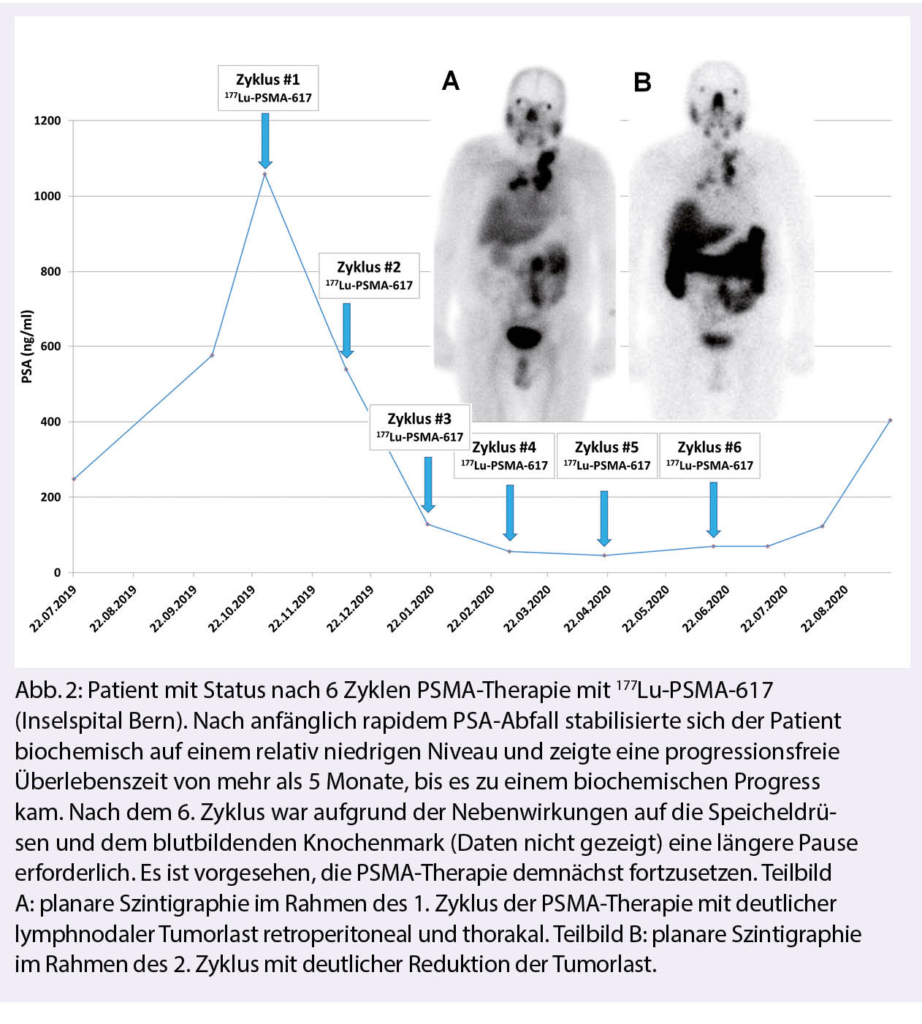
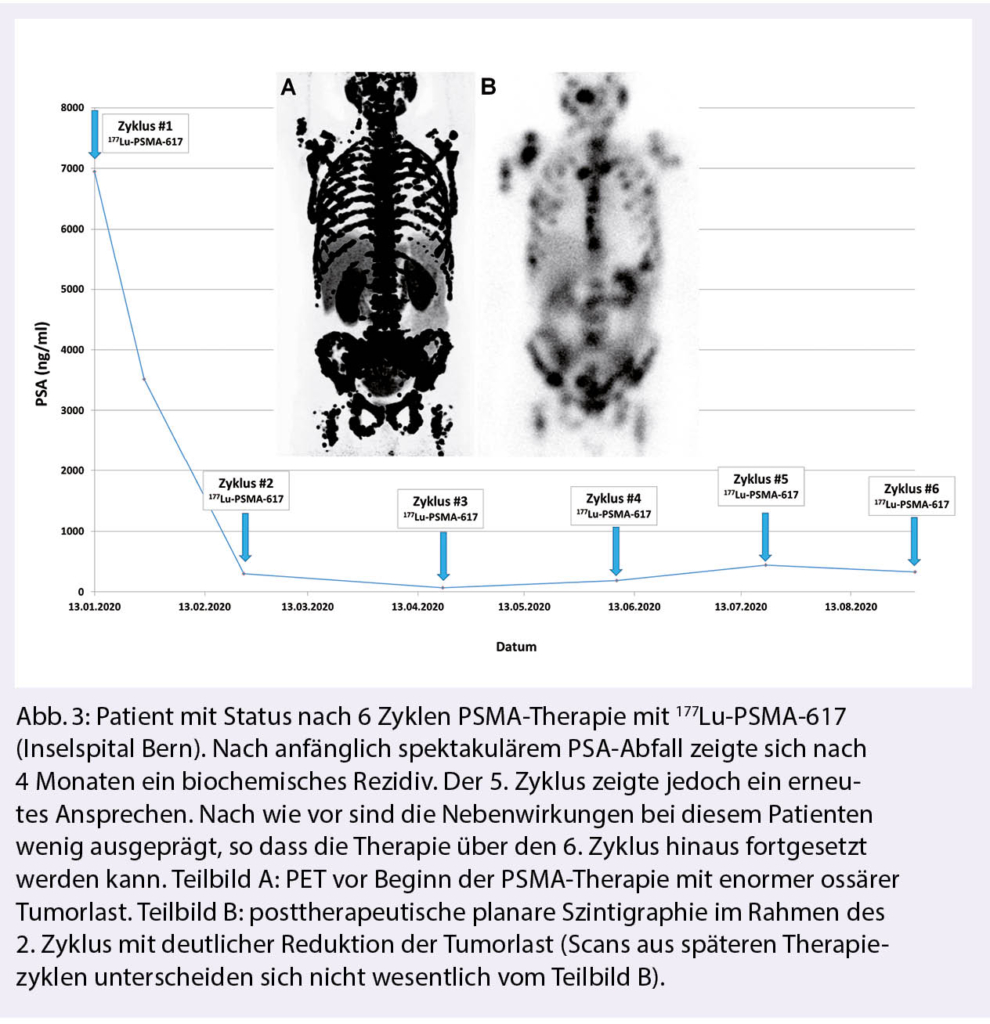
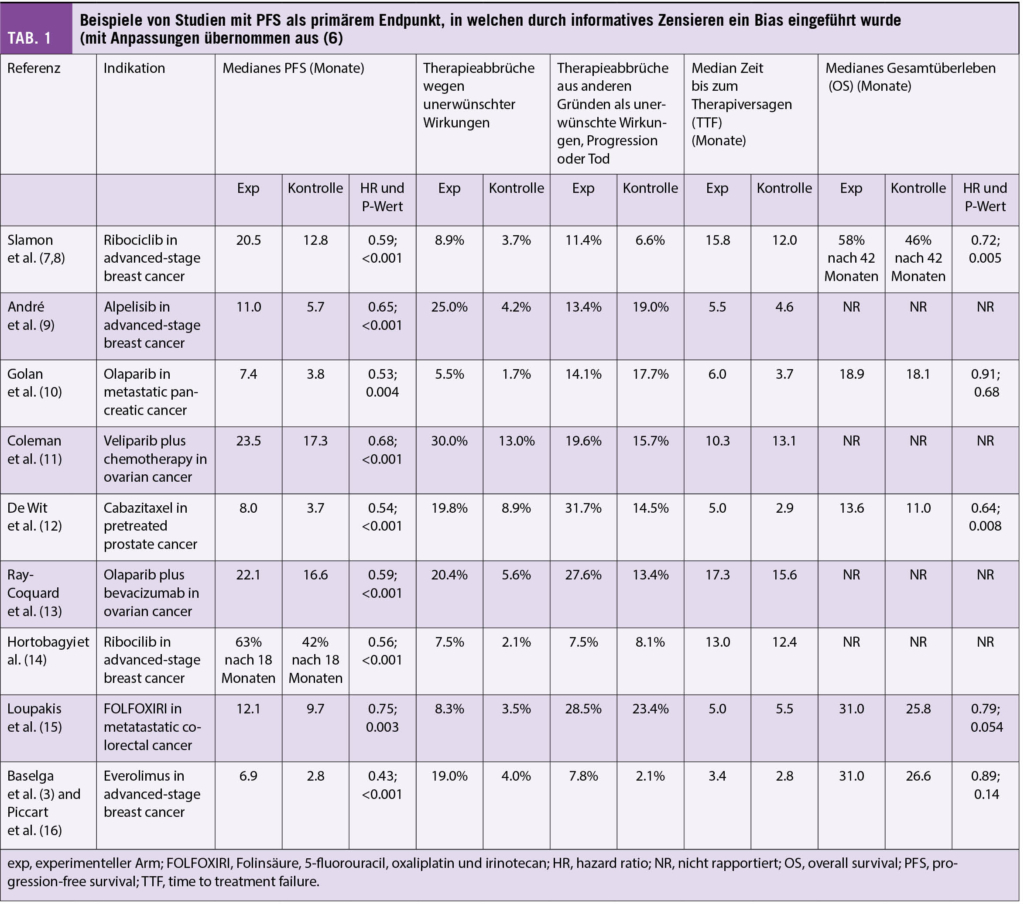
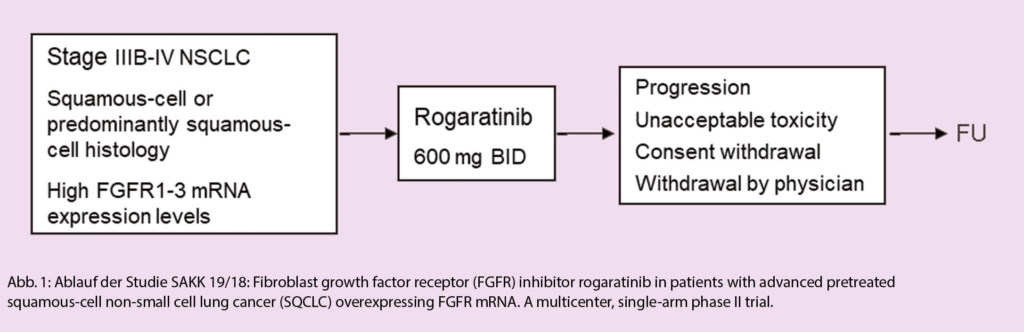
Azacitidin und Venetoclax bei zuvor unbehandelter akuter myeloischer Leukämie
Quelle: DiNardo CC et al. Azacitidine and Venetoclax in Previously Untreated Acute Myeloid LeukemiaC.D. N Engl J Med 2020;383:617-29. DOI: 10.1056/NEJMoa2012971
Hintergrund
Ältere Patienten mit akuter myeloischer Leukämie (AML) haben eine ungünstige Prognose, selbst nach Behandlung mit einer hypomethylierenden Therapie. In einer früheren Phase-1b-Studie zeigte die Azacitidin-Venetoclax Kombination eine vielversprechende Wirksamkeit.
Methoden
Die Autoren randomisierten zuvor unbehandelte Patienten mit bestätigter AML, die aufgrund koexistierender Erkrankungen nicht für eine Standardinduktionstherapie in Frage kamen und/oder weil sie 75 Jahre alt oder älter waren, zu Azacitidin plus entweder Venetoclax oder Placebo. Alle Patienten erhielten eine Standarddosis Azacitidin (75 mg pro Quadratmeter Körperoberfläche subkutan oder intravenös an den Tagen 1 bis 7 in einem 28-tägigen Zyklus); Venetoclax (Zieldosis 400 mg) oder das entsprechende Placebo wurde oral einmal täglich in 28-tägigen Zyklen verabreicht. Der primäre Endpunkt war das Gesamtüberleben.
Resultate
431 Patienten (286 in der Azazitidin-Venetoclax-Gruppe und 145 in der Azazitidin-Placebo-[Kontroll-]gruppe) gehörten zur intention-to-treat Patientenpopulation. Das mittlere Alter betrug in beiden Gruppen 76 Jahre (Bereich 49 bis 91). Bei einem medianen Follow-up von 20.5 Monaten betrug die mediane Gesamtüberlebenszeit 14.7 Monate in der Azazitidin-Venetoclax-Gruppe und 9.6 Monate in der Kontrollgruppe (Hazard-Ratio für Tod, 0,66; 95% Konfidenzintervall, 0,52 bis 0,85; P<0,001). Die Inzidenz einer vollständigen Remission war in der Azazitidin-Venetoclax-Gruppe höher als bei der Kontrollgruppe (36,7% vs. 17,9%; P<0,001), ebenso wie die zusammengesetzte vollständige Remission (komplette Remission oder komplette Remission mit unvollständiger hämatologischer Regeneration) (66,4% vs. 28,3%; P<0,001). Zu den wichtigsten unerwünschten Ereignissen gehörten Übelkeit jeden Grades (bei 44% der Patienten in der Azazitidin-Venetoclax-Gruppe und 35% der Patienten in der Kontrollgruppe) und Thrombozytopenie Grad 3 oder höher (bei 45% bzw. 38%), Neutropenie (bei 42% bzw. 28%) und fieberhafte Neutropenie (bei 42% bzw. 19%). Bei 84% der Patienten in der Azacitidin-Venetoclax-Gruppe und 67% der Patienten in der Kontrollgruppe traten Infektionen jeden Grades auf, und bei 83% bzw. 73% traten schwerwiegende unerwünschte Ereignisse auf.
Schlussfolgerung
Bei zuvor unbehandelten AML Patienten, die für eine intensive Chemotherapie nicht in Frage kamen, war das Gesamtüberleben länger und die Inzidenz von Remissionen höher bei Patienten, die Azacitidin plus Venetoclax erhalten hatten, als bei Patienten, die eine Azacitidin Monotherapie erhielten. Fieber in Neutropenie war in der Venetoclax-Azacitidin-Gruppe häufiger als in der Kontrollgruppe.
10-Tage-Decitabin mit Venetoclax bei neu diagnostizierter, für intensive Chemotherapie nicht geeigneter und rezidivierter oder therapierefraktärer akuter myeloischer Leukämie: eine monozentrische Phase-2-Studie
Quelle: Di Nardo CD et al. 10-day decitabine with venetoclax for newly diagnosed intensive chemotherapy ineligible, and relapsed or refractory acute myeloid leukaemia: a single-centre, phase 2 trial. Lancet Haematol 2020, published online September 4, 2020 https://doi.org/10.1016/ S2352-3026(20)30210-6
Hintergrund
Venetoclax in Kombination mit einer hypomethylierenden Therapie ist ein neuer Behandlungsstandard für Patienten mit neu diagnostizierter akuter myeloischer Leukämie (AML), die 75 Jahre oder älter sind oder für eine intensive Chemotherapie nicht in Frage kommen. Pharmakodynamische Studien haben eine Überlegenheit des längeren 10-Tage-Regimes mit Decitabin suggeriert, welches bei Patienten mit Hochrisiko-AML in Phase 2-Studien vielversprechende Ergebnisse gezeigt hat. In dieser Studie wurde untersucht, ob Venetoclax in Kombination mit 10-Tage-Decitabin die Aktivität bei Patienten mit neu diagnostizierter AML und bei solchen mit rezidivierter oder therapieresistenter AML, insbesondere in Hochrisiko-Subgruppen, verbessern könnte.
Methoden
Diese monozentrische Phase 2-Studie wurde an der University of Texas MD Anderson Cancer Center (Houston, TX, USA) durchgeführt. In die Studie wurden ältere Patienten (Alter >60 Jahre) mit neu diagnostizierter AML, die nicht für eine intensive Chemotherapie in Frage kamen, Patienten mit sekundärer AML (nach myelodysplastischem Syndrom oder chronischer myelomonozytärer Leukämie) und Patienten mit rezidivierter oder therapieresistenter AML eingeschlossen. Die Patienten mussten einen ECOG-Score von 3 oder weniger, eine Leukozytenzahl von weniger als 10×10⁹ pro L und eine adäquate Endorganfunktion aufweisen. Patienten mit günstiger Risikozytogenetik (z.B. t[15;17] oder CBF-AML) oder die zuvor eine BCL2-Inhibitor-Therapie erhalten hatten, wurden ausgeschlossen. Die Patienten erhielten Decitabin 20 mg/m² intravenös während 10 Tagen mit oralem Venetoclax 400 mg täglich zur Induktion, gefolgt von Decitabin während 5 Tagen mit täglichem Venetoclax zur Konsolidierung. Der primäre Endpunkt war das Gesamtansprechen. Zu den sekundären Endpunkten, die im Rahmen dieser Studie analysiert wurden, gehörten Sicherheit, Gesamtüberleben und Ansprechdauer in Übereinstimmung mit den Empfehlungen der Leitlinien des Europäischen Leukämienetzwerks 2017. Alle Patienten, die mindestens eine Behandlungsdosis erhielten, kamen für eine Beurteilung der Sicherheit und des Ansprechens in Frage. Die Studie wurde unter ClinicalTrials.gov (NCT03404193) registriert und schliesst weiterhin Patienten ein.
Resultate
168 Patienten wurden zwischen dem 19. Januar 2018 und dem 16. Dezember 2019 in die Studie eingeschlossen; 70 (42%) hatten eine neu diagnostizierte AML, 15 (9%) eine unbehandelte sekundäre AML, 28 (17%) eine behandelte sekundäre AML und 55 (33%) eine rezidivierte oder therapierefraktäre AML. Das mediane Alter betrug 71 Jahre (IQR 65-76) und 30% der Patienten hatten einen ECOG-Leistungsstatus von 2 oder höher. Die mediane Nachbeobachtung betrug 16 Monate (95% CI 12-18; tatsächliche Nachbeobachtung 6.5 Monate; IQR 3.4-12.4). Das Gesamtansprechen betrug 74% (125 von 168 Patienten; 95% CI 67-80) und in den Subgruppen: 89% bei neu diagnostizierter AML (62 von 70 Patienten; 79-94), 80% bei unbehandelter sekundärer AML (12 von 15 Patienten; 55-93), 61% bei vorbehandelter sekundärer AML (17 von 28 Patienten; 42-76) und 62% bei rezidivierter oder refraktärer AML (34 von 55 Patienten; 49-74). Zu den häufigsten therapiebedingten unerwünschten Ereignissen gehörten Infektionen mit Neutropenie Grad 3 oder 4 (n=79, 47%) und Fieber in Neutropenie (n=49, 29%). 139 (83%) von 168 Patienten hatten schwerwiegende unerwünschte Ereignisse, am häufigsten Fieber in Neutropenie (n=63, 38%), gefolgt von Pneumonie (n=17, 10%) und Sepsis (n=16, 10%). Die 30-Tage-Mortalität betrug 3.6% (n=6, 95% CI 1.7-7.8). Das mediane Gesamtüberleben betrug 18.1 Monate (95% CI 10.0-nicht erreicht) bei neu diagnostizierter AML, 7.8 Monate (2.9-10.7) bei unbehandelter sekundärer AML, 6.0 Monate (3.4-13.7) bei behandelter sekundärer AML und 7.8 Monate (5.4-13.3) bei rezidivierter oder refraktärer AML. Die mediane Dauer des Ansprechens wurde bei neu diagnostizierter AML nicht erreicht (95% CI 9.0-nicht erreicht), war 5.1 Monate (95% CI 0.9-nicht erreicht) bei unbehandelter sekundärer AML, wurde nicht erreicht (95% CI 2.5-nicht erreicht) bei zuvor behandelter sekundärer AML und betrug 16.8 Monate (95% CI 6.6-nicht erreicht) bei rezidivierter oder refraktärer AML.
Schlussfolgerung
Die Kombination aus Venetoclax und 10-Tage-Decitabin weist ein vertretbares Sicherheitsprofil auf und zeigte eine hohe Aktivität bei neu diagnostizierter AML und molekular definierten Subgruppen bei rezidivierter oder refraktärer AML. Zukünftige grössere und randomisierte Studien sind erforderlich, um die Aktivität in Hochrisiko AML-Subgruppen zu definieren.
Zentrum für Hämatologie und Onkologie
UniversitätsSpital Zürich
Zentrum für Hämatologie und Onkologie
UniversitätsSpital Zürich
Alexandre.Theocharides@usz.ch