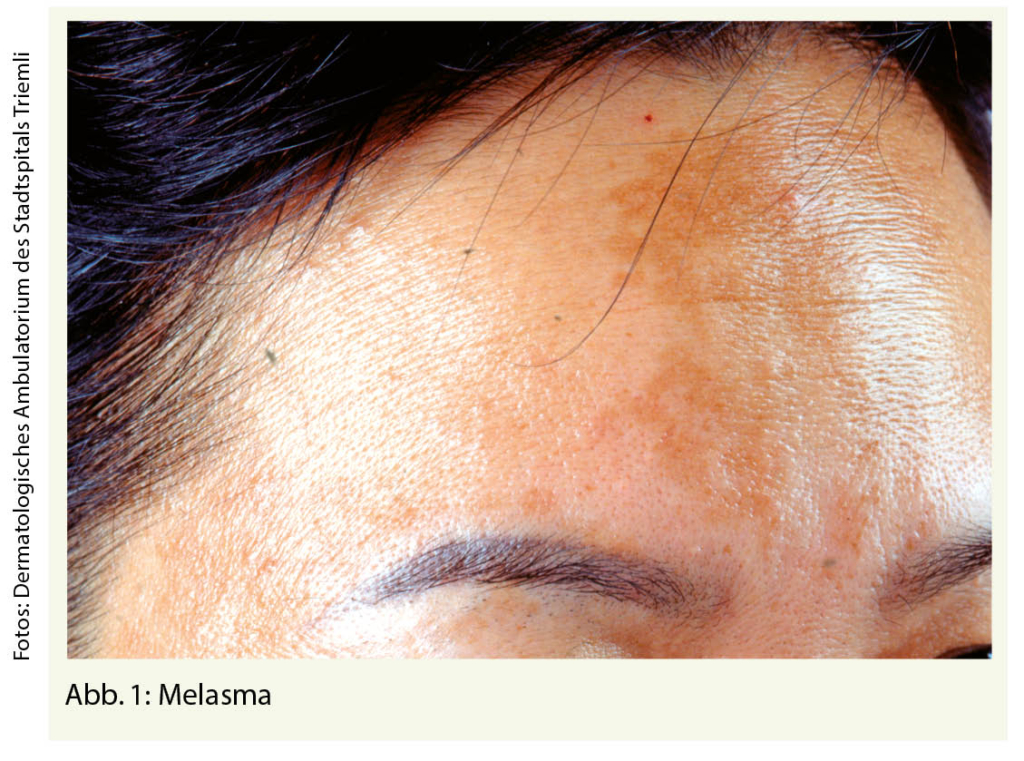
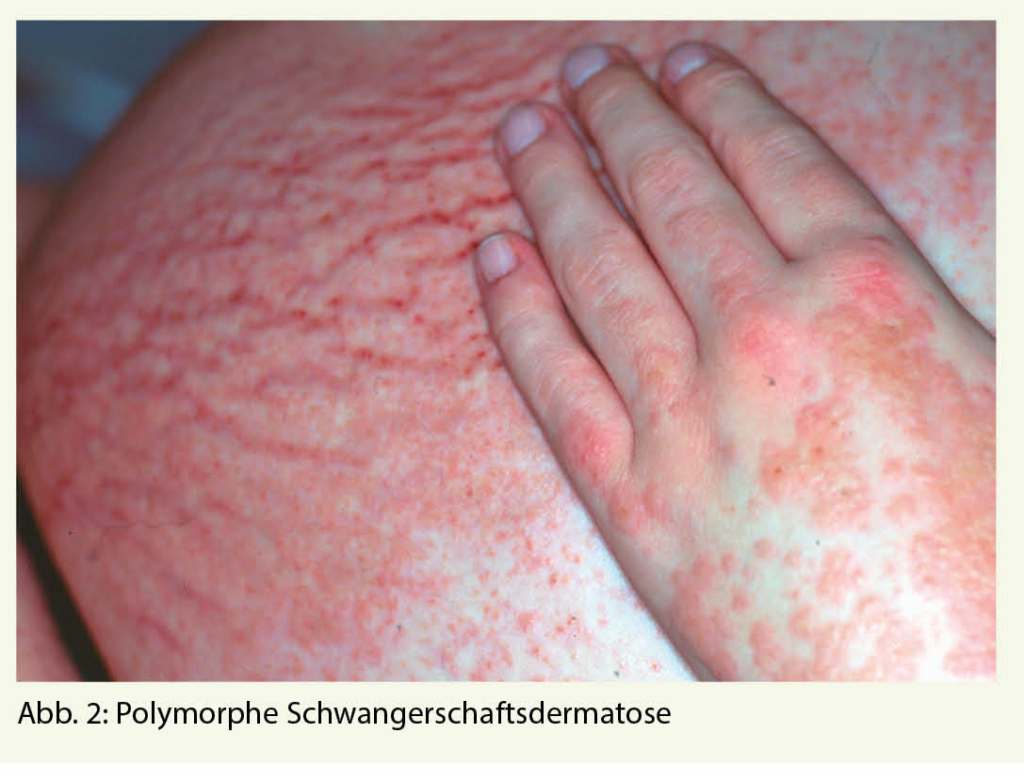
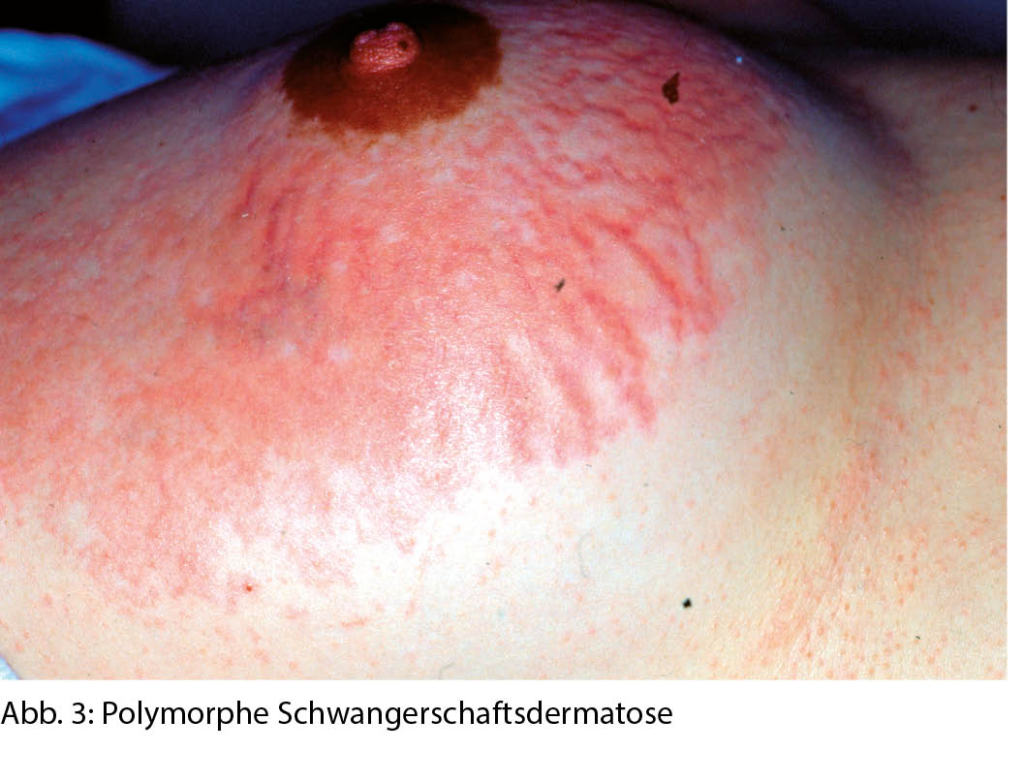
Eisen ist das vierthäufigste Element der Erdkruste, das in vielen Nahrungsmitteln ausreichend vorhanden ist. Dennoch ist Eisenmangel die häufigste Mangelerkrankung, an der zwei Milliarden Menschen leiden (1). Dabei ist Eisen für alle Zellen lebenswichtig. Dessen Mangel führt nicht nur zu einer Beeinträchtigung der Hämproduktion, sondern hat Auswirkung auf den gesamten Organismus und ist die pathophysiologische Grundlage vieler klinischer Symptome. Warum ist der Eisenmangel dennoch so häufig? In einem ersten Teil, publiziert in der informierte arzt von September, wurden die kritischen Punkte der Diagnostik eines Eisenmangels dargestellt, dieser aktuelle Teil ist der Substitution gewidmet.
Zunächst muss man betonen, dass der Therapie eines Eisenmangels immer eine Ursachenabklärung vorangehen muss. Wegen klinischer Relevanz muss dabei in erster Linie ein chronischer Blutverlust aus einer gastrointestinalen Blutungsquelle ausgeschlossen werden. Bei entsprechender Anamnese (Ernährung, Hypermenorrhoe, Teerstuhl) steht nach Möglichkeit die Beseitigung der Ursache des Eisenmangels im Vordergrund. So muss insbesondere eine ausreichende Eisenzufuhr mit der Nahrung als erster Schritt der Behandlung betrachtet werden. Die medikamentöse Eisensubstitution erfolgt abhängig von der klinischen Situation erst später, oder parallel.
Wann ist eine Therapie indiziert?
Es gibt wohl keinen Zweifel daran, dass eine ungenügende Eisenversorgung der Erythropoese bzw. sonstiger Körperzellen und Körpersysteme keinen klinisch optimalen Zustand darstellt. Eine Therapieindikation besteht dementsprechend nicht erst bei Vorliegen einer Eisenmangelanämie, sondern bereits bei Nachweis einer eisendefizitären Erythropoese. Ein reiner Speichereisenmangel ist nicht unbedingt substitutionsbedürftig, solange die betroffene Person keine klinischen Symptome zeigt und völlig beschwerdefrei ist. Ausnahmen sind sicher Patienten mit zuvor behandelter Eisenmangelanämie bei erneutem Auftreten eines Speichereisenmangels, Patienten unter Therapie mit ESA und Schwangere. Um im Verlauf einer Schwangerschaft erst gar nicht in den Zugzwang einer Eisensubstitution zu kommen ist es jedoch sinnvoller, die Problematik mit Frauen im gebärfähigen Alter vorher zu besprechen und durch entsprechende Massnahmen vor Eintreten der Schwangerschaft zu regeln.
Nachdem in einer grossen, randomisierten Studie gezeigt werden konnte, dass die intravenöse Gabe von Eisencarboxymaltose bei Patienten mit Herzinsuffizienz mit und ohne Anämie die Lebensqualität und die Leistungsfähigkeit verbessert und die Hospitalisierung reduziert, gehört die intravenöse Eisengabe bei Herzinsuffizienz zum therapeutischen Standardrepertoire (6). Entsprechend den ESC-Guidelines sollen diese Patienten bei einem Ferritin < 100 µg/l, bzw. bei einem Ferritin von 100-299 µg/l und gleichzeitiger Transferrinsättigung < 10% eine Infusion von Eisencarboxymaltose erhalten (7).
Im klinischen Alltag wird man immer wieder mit Patienten konfrontiert die über Beschwerden und Symptome klagen die erfahrungsgemäss durch einen Eisenmangel hervorgerufen werden können, deren Hämoglobin und Ferritin aber normal sind – solange man Ferritinwerte von 15 - 50 µg/l als normal betrachtet. Angesichts der Tatsache, dass diese Symptome meist nur bei einem Ferritin < 50 µg/l beobachtet werden, ist in solchen Fällen eine probatorische Eisensubstitution mit dem Ziel, das Serumferritin über 50 µg/l anzuheben nicht nur gerechtfertigt, sondern indiziert. Damit verbleibt der Ferritinwert immer noch im unteren Referenzbereich und die Eisenspeicher werden damit nicht überfüllt. Klinisch gesehen ist dieses Vorgehen sicherlich ein kleineres Problem als zum Beispiel der Einsatz von Psychopharmaka, die ohne grössere Bedenken in solchen Fällen probatorisch verabreicht werden.
Wie sollte man einen Eisenmangel therapieren?
Perorale Substitution bevorzugt
Eine medikamentöse Eisensubstitution soll vorzugsweise oral erfolgen. Dazu stehen zahlreiche Präparate zur Verfügung, in denen traditionell verschiedene Eisensalze mit unterschiedlicher Galenik zur Anwendung kommen. Dabei sind wegen besserer Wirksamkeit Fe(II)-Salze den Fe(III)-Salzen zu bevorzugen. Der Eisenanteil pro Dragee schwankt zwischen 25 und 100 mg, die Anfangsdosis der peroralen Eisensubstitution beträgt 50 - 100 mg Eisen pro Tag. Die Einnahme sollte vorzugsweise nüchtern, mindestens ½ bis 1 Stunde vor oder nach dem Essen erfolgen. Da die orale Eisengabe die Hepcidinkonzentration regulatorisch erhöht und damit die Eisenaufnahme aus dem Darm für die nächsten 24 Stunden inhibiert, sollte die Tagesdosis nicht gesplittet, sondern einmal täglich eingenommen werden. Um die Eisenaufnahme zu optimieren, wird inzwischen sogar eine Substitution an jedem zweiten Tag diskutiert. Als Kriterium für ein adäquates Ansprechen wird nach einer dreiwöchigen Behandlung ein Hämoglobinanstieg um 20 g/l erwartet. Nach Korrektur der Anämie sollte die Substitution 3-6 Monate fortgesetzt werden, bis das Serumferritin 50 µg/l übersteigt (Tabelle 1 des ersten Teils, Patient 3). Dadurch werden nicht nur die Eisenspeicher etwas aufgefüllt, es macht aber auch das Auftreten eines Eisenmangelsyndroms (IDS, siehe Teil 1) unwahrscheinlich.
Verträglichkeit
Die meisten Patienten tolerieren die orale Eisensubstitution ohne Schwierigkeiten. Bei etwa einem Drittel kommt es jedoch zu verschiedenen gastrointestinalen Beschwerden, die meist ein bis zwei Stunden nach der Eiseneinnahme auftreten und die Compliance des Patienten stark beeinträchtigen. Diese Beschwerden korrelieren mit dem Anteil an ionisiertem Eisen im oberen Gastrointestinaltrakt und weisen darauf hin, dass die orale Eisensubstitution trotz des physiologischen Aufnahmeweges offensichtlich «nicht ganz physiologisch» ist. Da es keine natürlichen Nahrungsmittel gibt, die 100 mg Eisen auf einen Schlag freisetzen, ist der menschliche Organismus dafür auch nicht vorbereitet und der natürliche Aufnahmeweg damit überfordert. So werden mehr als 90% der eingenommenen Dosis nicht resorbiert und belasten den Gastrointestinaltrakt, unter anderem indem sie im Dickdarm Veränderungen des Mikrobioms bewirken. Ein dosisabhängiger Teil des Eisens gelangt durch passive Aufnahme auf parazellulärem Weg direkt ins Blut, was zu Überforderung der Transferrinkapazität und schliesslich zu oxidativem Stress mit den bekannten klinischen Symptomen führt. Dementsprechend sind Eisenpräparate, die eine langsame Freigabe von Eisen gewährleisten wie das Eisen(II)-Fumarat, oder retardierte Fe(II)-Präparate bei der oralen Eisensubstitution zu bevorzugen, deren bessere Verträglichkeit bei vergleichbarer Wirksamkeit ist durch Studien gut belegt.
Eine andere Strategie wurde bei neueren oralen Eisenformulierungen verfolgt, in denen nicht Eisensalze, sondern komplex gebundenes dreiwertiges Eisen zum Einsatz kommt. Dabei ist insbesondere der in der Schweiz zugelassene Fe(III)-Hydroxid-Polymaltose-Komplex (Maltofer®) zu nennen, der eine ferritinähnliche Struktur aufweist, indem er aus einem polynuklearen Fe(III)-Hydroxid-Kern besteht, der oberflächlich von nicht kovalent gebundenen Polymaltosemolekülen umgeben ist. Die Formulierung ermöglicht eine langsame Freisetzung von Eisen, interagiert im Unterschied zu den Eisensalzen nicht mit Nahrungsmitteln oder Medikamenten und weist bei vergleichbarer Wirksamkeit kaum gastrointestinale Nebenwirkungen auf. Das Medikament ist jedoch deutlich teurer als die herkömmlichen Fe(II)-Präparate.
Intravenöse Substitution
Patienten, die zwei verschiedene orale Eisenpräparate nicht vertragen haben, eine Eisenresorptionsstörung aufweisen oder solche, die an einer chronischen entzündlichen Erkrankung leiden, sollten intravenös substituiert werden. Auch Tumorpatienten und insbesondere diejenigen, die zur Korrektur einer tumor- oder chemotherapiebedingten Anämie ESA erhalten, sollten grundsätzlich intravenös substituiert werden. Um dabei eine Eisenüberladung zu vermeiden, wird zur Berechnung des Eisendefizit häufig die sog. Ganzoni-Formel empfohlen (8). Man kann den Eisenbedarf jedoch auch schnell überschlagen, wenn man weiss, dass bei Erwachsenen etwa 200 mg Eisen netto benötigt werden, um das Hämoglobin um 10 g/L anzuheben. So braucht eine Person mit einem Hb von 90 g/L mindestens 1000 mg Eisen netto, um einen Hb-Anstieg auf 120-130 g/l zu erreichen und etwas Speichereisen anzulegen. Besteht bei einem Patienten ohne Anämie bei weitgehend entleerten Eisenspeichern der klinische Verdacht auf ein IDS, so ist die parenterale Gabe von 500 mg Eisen ausreichend um das Ferritin über 50 µg/l anzuheben und damit die Verdachtsdiagnose zu beweisen, bzw. auszuschliessen.
Ähnlich aber nicht gleich
Für die intravenöse Eisensubstitution stehen mehrere Präparate zur Verfügung. Bei diesen handelt es sich um kolloidal gelöste Nanopartikel, die aus einem Eisen(III)-haltigen Kern und einer Kohlenhydrathülle bestehen. Nach intravenöser Applikation werden diese Partikel vorwiegend vom retikuloendothelialen System der Leber, des Knochenmarks und der Milz aufgenommen und aufgespalten und das freigewordene Eisen im Ferritin gespeichert, bzw. via Transferrin im Körper verteilt. Dank der Kohlenhydratverpackung wird das Eisen wie physiologisch vorgesehen dem Ferritin-Transferrin-System zugeführt, ohne den Körper toxischen Konzentrationen von freiem, ungebundenem Eisen auszusetzen. Die Kohlenhydrathülle ist jedoch keine reine Verpackung, sie ist von erheblicher Bedeutung für die pharmakologischen Eigenschaften der Präparate und auch für deren Verträglichkeit. So sind die gefürchteten allergischen und anaphylaktischen Reaktionen der intravenösen Eisenpräparate in erster Linie auf deren Kohlenhydratanteil zurückzuführen. Besonders problematisch ist in diesem Zusammenhang das früher verwendete hochmolekulare Dextran. Eisenkomplexe mit niedrigmolekularem Dextran (Cosmofer®, derzeit in der Schweiz nicht erhältlich) oder die Dextran-basierte Eisen(III)-Derisomaltose (MonoFer®) sind zwar wesentlich verträglicher und prinzipiell gut anwendbar, das Überempfindlichkeitsrisiko ist jedoch höher als bei den Dextran-freien Formulierungen. Die Herstellung der intravenösen Eisenpräparate ist generell sehr anspruchsvoll, deren genauer Nachbau ist nur bei exakter Einhaltung der Originalrezeptur möglich. Dementsprechend sind die Nachahmerprodukte nur ähnlich wie das Originalpräparat und mit diesem nicht 1:1 gleichzusetzen.
Es gibt mehrere Dextran-freie Originalpräparate, die eine sichere, nebenwirkungsarme intravenöse Eisensubstitution erlauben: der Eisen(III)-Glukonat-Komplex (Ferrlecit®, derzeit in der Schweiz nicht erhältlich), der Eisen(III)-Hydroxid-Saccharose-Komplex (Venofer®) und die Eisencarboxymaltose (Ferinject®). Bei diesen Formulierungen besteht eine lineare Korrelation zwischen Molekularmasse und Stabilität und damit der maximal applizierbaren Eisenmenge. Für das niedrigmolekulare Eisen-Glukonat beträgt die tägliche Höchstdosis nur 62,5 mg, so dass dieses Präparat trotz guter Verträglichkeit (3,5 AEs/1 Mio. 100 mg Äquivalentdosen) zunehmend an Bedeutung verliert und durch stabilere Präparate ersetzt wird. Weltweit am häufigsten wurde bei der intravenösen Eisensubstitution bisher wohl der Eisen(III)-Hydroxid-Saccharose-Komplex verwendet. Dieser erlaubt die Applikation von 200 mg Eisen in einer Sitzung und ist ähnlich komplikationsarm (USA: 3,5 AEs/1 Mio. 100 mg Äquivalentdosen) wie das Eisen-Glukonat. In Europa liegt die berichtete Komplikationsrate zwar etwas höher (12,6 AEs/1 Mio. 100 mg Äquivalentdosen), dies wird jedoch den Nachahmer-Präparaten zugeschrieben, die im Unterschied zu USA in Europa als Generikum des Originalpräparates (Venofer®) zugelassen wurden. Diese Nachahmer unterscheiden sich zum Teil erheblich vom Original und sind mit diesem bezüglich Wirkung und Sicherheit nicht gleichzusetzen (9). Zunehmende Bedeutung gewinnt die 2007 in Europa zugelassene Eisencarboxymaltose (Ferinject®), die dank ihrer hohen Stabilität eine Applikation von bis zu 1000 mg Eisen erlaubt, was in der Regel die Korrektur des Eisenmangels in einer einzigen Sitzung ermöglicht. Die Inzidenz von akuten Überempfindlichkeitsreaktionen ist bei vorschriftsmässiger Handhabung bezüglich Dosis und Infusionsgeschwindigkeit nach den bisherigen Erfahrungen gering (10-13). Bei hochdosierten Mehrfachgaben oder bei einer Langzeitbehandlung mit Eisencarboxymaltose ist jedoch eine Kontrolle des Serumphosphats angezeigt, weil die Rate an Hypophosphatämien bei dieser Formulierung höher ist als bei den anderen Eisenpräparaten.
Bedeutung der Infusionsgeschwindigkeit
Bei zu schneller intravenöser Applikation können alle Eisenpräparate die Transferrin-Bindungskapazität überfordern und durch das freie, ungebundene Eisen eine Flush-Symptomatik hervorrufen. Diese Nebenwirkung kann durch eine protrahierte Gabe vermieden werden, so dass intravenöse Eisengabe vorzugsweise als Kurzinfusion erfolgen sollte. Für das Eisen-Glukonat wird vom Hersteller empfohlen, den Inhalt einer 5 ml Ampulle mit 62,5 mg in 100-250 ml 0,9% NaCl zu verdünnen und über 20-30 Minuten zu infundieren. Die empfohlene Verdünnungsmenge für 200 mg der Eisen-Saccharose beträgt maximal 200 ml 0,9% NaCl, die Infusionszeit mindestens 30 Minuten. Die wesentlich stabilere Eisencarboxymaltose kann bis zu 200 mg als Bolusinjektion über 1-2 Minuten verabreicht werden, eine Testdosis ist nicht erforderlich. Höhere Einzeldosen werden als Kurzinfusion appliziert: 200-500 mg in maximal 100 ml 0,9% NaCl über mindestens 6 Minuten, 500-1000 mg in maximal 250 ml 0,9% NaCl über mindestens 15 Minuten. Höhere Verdünnungen mit weniger als 2 mg/ml sollen aus Stabilitätsgründen vermieden werden.
Risikobewertungsverfahren der EMA
Im Jahr 2013 hat die Europäische Arzneimittelagentur (EMA) in einem Risikobewertungsverfahren festgestellt, dass der therapeutische Nutzen der intravenösen Eisenpräparate bei entsprechenden Vorsichtsmassnahmen deren mögliche Risiken überwiegt. Die Infusion soll jedoch nur vorgenommen werden, wenn in der Erkennung und Behandlung anaphylaktischer Reaktionen geschulte Fachkräfte unverzüglich verfügbar sind und die kardiopulmonale Reanimation durch eine entsprechende Ausrüstung sichergestellt ist. Der Patient soll während der Infusion überwacht werden, nach erfolgter Eisengabe wird ausserdem eine Nachbeobachtungszeit von 30 Minuten empfohlen.
In der Schwangerschaft sollen intravenöse Eisenpräparate nur wenn zwingend erforderlich angewandt werden, die Gabe vor dem zweiten Trimenon ist kontraindiziert. Eine Überempfindlichkeitsreaktion nach intravenöser Eisengabe stellt eine Kontraindikation für eine Therapie mit jeglichen intravenösen Eisenpräparaten dar. Ausserdem ist zu beachten, dass Patienten mit allergischen, immunologischen und inflammatorischen Erkrankungen, sowie solche mit Asthma bronchiale, Ekzemen und anderen atopischen Erkrankungen in der Vorgeschichte, ein erhöhtes Risiko einer Überempfindlichkeitsreaktion aufweisen. Diese Stellungnahme hat die intravenöse Eisensubstitution insbesondere für die hausärztliche Praxis sicher erschwert. Dennoch wird die intravenöse Eisengabe dank der niedrigen Nebenwirkungsrate der modernen Eisenformulierungen immer häufiger angewandt, denn sie hat unübersehbare Vorzüge. So wird der Eisendefizit des Patienten umgehend behoben, ohne dass der Darm einer monatelangen Eisenbelastung ausgesetzt wird und ohne dass man auf eine gute Compliance des Patienten angewiesen ist. Dank der hohen Stabilität der modernen Präparate wird das Eisen erst in der Leber freigegeben und kann dementsprechend «physiologisch» versorgt und verwertet werden, ohne einen nennenswerten oxidativen Stress zu verursachen. Ein weiterer Grund für die zunehmende Anwendung der parenteralen Eisensubstitution ist sicher auch darauf zurückzuführen, dass diese trotz ihrer höheren Kosten offensichtlich bei bestimmten Patientengruppen wie denjenigen mit Herzinsuffizienz ökonomisch gesehen kostengünstiger ist, da sie die Hospitalisierung reduziert.
Während die Frage orale versus intravenöse Eisensubstitution früher kontrovers bis dogmatisch gesehen wurde, haben die neuen Erkenntnisse in der Pathophysiologie des Eisenstoffwechsels und die positive Erfahrung mit den modernen, Dextran-freien Eisenpräparaten zu einer Normalisierung der Diskussion beigetragen und eine, der klinischen Situation und den individuellen Bedürfnissen des Patienten angepasste Eisensubstitution ermöglicht. Unabhängig von der angewandten Applikationsart sollte jedoch vor Einleitung einer Substitutionstherapie immer eine sorgfältige Diagnostik erfolgen.
Copyright bei Aerzteverlag medinfo AG
Universitätsklinikum Mannheim
Medizinische Klinik III
Hämatologie und Internistische Onkologie
Theodor-Kutzer-Ufer 1-3
D-68167 Mannheim
jan.hastka@umm.de
Universitätsklinikum Mannheim
Medizinische Klinik III
Hämatologie und Internistische Onkologie
Theodor-Kutzer-Ufer 1-3
D-68167 Mannheim
Die Autoren haben Vorträge für die Firma Vifor Pharma gehalten.
1. McLean E, Cogswell M, Egli I, Wojdyla D, de Benoist B. Worldwide prevalence of anaemia, WHO Vitamin and Mineral Nutrition Information System, 1993-2005. Public health nutrition. 2009 Apr;12(4):444-54.
2. Hastka J, Metzgeroth G, Gattermann N. Eisenmangel und Eisenmangelanämie. Leitlinien der DGHO. Onkopedia 2019.
3. Aapro M, Osterborg A, Gascon P, Ludwig H, Beguin Y. Prevalence and management of cancer-related anaemia, iron deficiency and the specific role of i.v. iron. Annals of oncology : official journal of the European Society for Medical Oncology / ESMO. 2012 Aug;23(8):1954-62.
4. Hastka J, Metzgeroth G. Rationale Anämieabklärung. J Lab Med. 2015;39(5):273-89.
5. Labbe RF, Vreman HJ, Stevenson DK. Zinc protoporphyrin: A metabolite with a mission. Clinical chemistry. 1999 Dec;45(12):2060-72.
6. Anker SD, Comin Colet J, Filippatos G, Willenheimer R, Dickstein K, Drexler H, et al. Ferric carboxymaltose in patients with heart failure and iron deficiency. The New England journal of medicine. 2009 Dec 17;361(25):2436-48.
7. McMurray JJ, Adamopoulos S, Anker SD, Auricchio A, Bohm M, Dickstein K, et al. ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail. 2012 Aug;14(8):803-69.
8. Ganzoni AM. [Iron deficiency and iron deficiency anemia]. ZFA Zeitschrift fur Allgemeinmedizin. 1977 Apr 20;53(11):613-7.
9. Toblli JE, Cao G, Oliveri L, Angerosa M. Comparison of oxidative stress and inflammation induced by different intravenous iron sucrose similar preparations in a rat model. Inflamm Allergy Drug Targets. 2012 Feb;11(1):66-78.
10. Auerbach M, Ballard H. Clinical use of intravenous iron: administration, efficacy, and safety. Hematology / the Education Program of the American Society of Hematology American Society of Hematology Education Program. 2010;2010:338-47.
11. Bailie GR, Mason NA, Valaoras TG. Safety and tolerability of intravenous ferric carboxymaltose in patients with iron deficiency anemia. Hemodialysis international International Symposium on Home Hemodialysis. 2010 Jan;14(1):47-54.
12. Chertow GM, Mason PD, Vaage-Nilsen O, Ahlmen J. Update on adverse drug events associated with parenteral iron. Nephrology, dialysis, transplantation : official publication of the European Dialysis and Transplant Association – European Renal Association. 2006 Feb;21(2):378-82.
13. Keating GM. Ferric carboxymaltose: a review of its use in iron deficiency. Drugs. 2015 Jan;75(1):101-27.