Bluthochdruck ist in der Schweiz die häufigste in der Arztpraxis gestellte Diagnose, stellt die Schweizerische Herzstiftung fest (1). Personen mit hohem Blutdruck sind nicht krank und spüren in der Regel keine Beschwerden. Personen mit Bluthochdruck haben aber ein hohes Risiko zu erkranken: Menschen mit unbehandeltem Bluthochdruck haben je nach Schweregrad ein doppelt bis zehnmal erhöhtes Risiko für Hirnschlag, Herzinfarkt oder Herzinsuffizienz.
Die Praxis des Hausarztes ist der ideale Ort für eine frühzeitige Diagnose und Therapie des Bluthochdrucks. Erfahrungsgemäss benötigen die meisten Hypertoniker eine Kombination von nicht-pharmakologischen und pharmakologischen Strategien zur Erreichung eines normalen Blutdrucks. Dieser Artikel fasst die Themen rund um Bluthochdruck zusammen, die sowohl für Kardiologen als auch für Hausärzte wichtig sind.
Wie wird die Diagnose arterielle Hypertonie bestätigt?
Liegen die Blutdruckwerte bei einer einzigen Messung in der Praxis über 140/90 mmHg, sollen mindestens drei weitere Messungen innerhalb weniger Wochen die erhöhten Blutdruckwerte bestätigen, um sicher zu sein, dass ein Bluthochdruck vorliegt. Eine einzelne Messung oder Messungen, die nicht in Ruhe erfolgen, dienen zur Diagnose nicht. Zudem empfehlen die aktuellen Richtlinien (2, 3) Personen zu motivieren, Blutdruckwerte gemäss schriftlichen Instruktionen zu messen und wenn möglich sollte eine 24-Stunden-Blutdruckmessung erfolgen. Diese Untersuchung hilft spezielle Formen der Hypertonie (wie z.B. Weisskittel- oder die maskierte Hypertonie) zu identifizieren. Zudem kann damit eine nächtliche Hypertonie entdeckt werden.
Bei vielen Patienten ist es aber nicht einfach, die Diagnose zu stellen, weil ihre Blutdruckwerte stark schwanken oder nur in bestimmten Lebenssituationen zu hoch sind. Blutdruckwerte gemessen bei Symptomen (Kopfschmerzen, Angst, Palpitationen…) dürfen nicht mit den Normwerten in Ruhe verglichen werden.
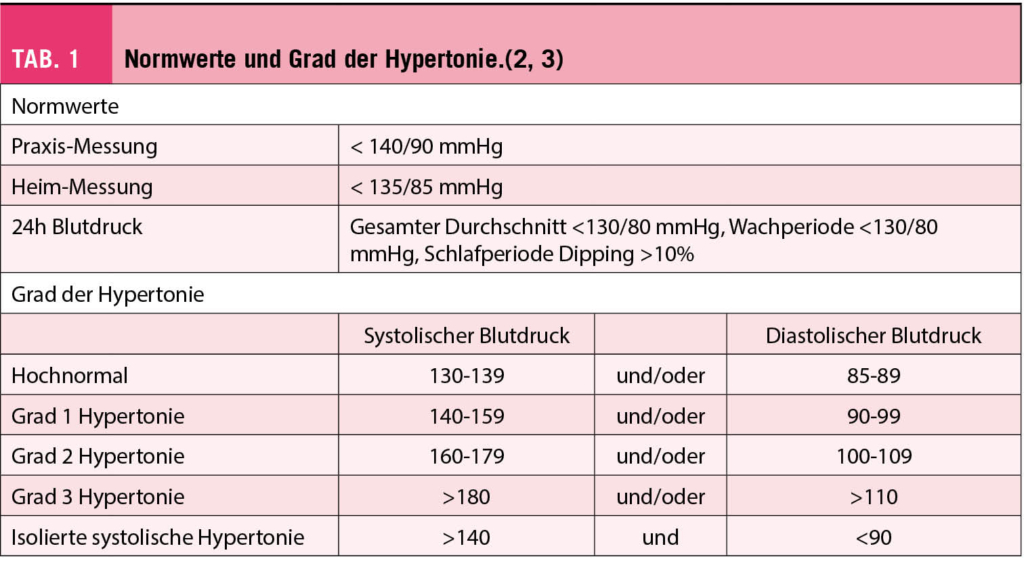
Die normalen Blutdruckwerte sind in Tabelle 1 zusammengefasst.
Abklärungen bei bestätigtem Bluthochdruck
Nach Bestätigung der Diagnose arterielle Hypertonie ist es wichtig, den Grad der Hypertonie zu bestimmen (Tab. 1), eine evtl. vorhandene Ursache des Bluthochdrucks auszuschliessen, das gesamte kardiovaskuläres Risiko zu beurteilen und die möglichen Organschäden zu evaluieren.
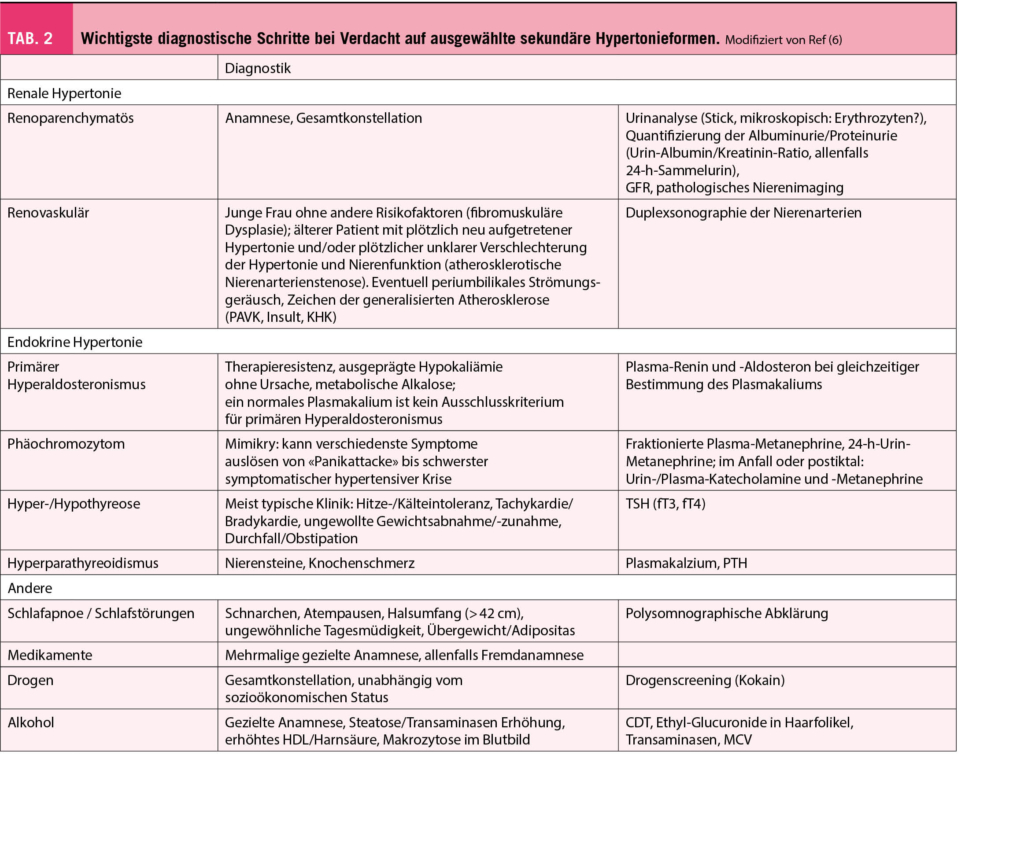
Die detaillierten Tests, die zur Diagnose der verschiedenen Formen der sekundären Hypertonie dienen, sind in Tabelle 2 zusammengefasst.
Evaluation des kardiovaskulären Risikos
Zur Ermittlung des gesamten kardiovaskulären Risikos sollen bei jedem Patienten mit arterieller Hypertonie die folgenden zusätzlichen kardiovaskulären Risikofaktoren evaluiert werden: Herz-Kreislauferkrankungen in der Familie, Alter (Männer > 55-jährig, Frauen > 65-jährig), Tabak/Nikotin-Konsum, Adipositas, körperliche Inaktivität, Diabetes mellitus und Dyslipidämie. Als Hilfe dient der AGLA Score (4), der das absolute Risiko berechnet, innerhalb von 10 Jahren ein tödliches Koronarereignis oder einen nicht-tödlichen Myokardinfarkt zu erleiden oder der SCORE der Europäischen Gesellschaft für Kardiologie (5), der das absolute Risiko für einen tödlichen Herzinfarkt innerhalb der nächsten 10 Jahre berechnet.
Hypertonie-bedingter Endorganschaden
Ein 12-Kanal-EKG, Labor (Nierenfunktion und Urinanalyse mit mikroskopischer Urin-Untersuchung), Mikroalbuminurie (Albumin/Kreatinin-Ratio) und Proteinurie sollen bei jedem Patienten mit arterieller Hypertonie gemacht werden. Eine erweiterte Suche nach Hypertonie-bedingtem Endorganschaden soll basierend auf der Anamnese, dem klinischen Untersuch und den folgenden technischen Routine-Untersuchungen durchgeführt werden.
Spezifisch (2, 3):
- Echokardiographie wird empfohlen bei hypertensiven Patienten mit EKG-Auffälligkeiten oder Symptomen/Befunden einer Herzinsuffizienz und kann erwogen werden, wenn eine linksventrikuläre Hypertrophie das weitere Management beeinflusst.
- Nierensonografie und Nierenarterien-Doppler sollte erwogen werden bei Patienten mit eingeschränkter Nierenfunktion, Albuminurie/Proteinurie oder bei Verdacht auf eine sekundäre Hypertonie.
- Kognitive Funktionstests: sollten bei jedem hypertensiven Patienten über 75 Jahre erwogen werden.
Therapie der arteriellen Hypertonie
Ziel der antihypertensiven Therapie
Ziel der Behandlung von Hypertonikern ist die langfristige Senkung des kardiovaskulären Risikos. Für eine optimale Risikoreduktion ist die Erfassung und Behandlung aller zusätzlichen beeinflussbaren Risikofaktoren notwendig.
Generell gilt, dass der Blutdruck < 140/90 mmHg (Praxismessung) sein soll. Bei den meisten Patienten soll der Blutdruck innerhalb der idealen Range von 120-130/70-80 mmHg gesenkt werden (2, 3).
Änderungen des Lebensstils
Bei jedem Patienten mit arterieller Hypertonie sollen Änderungen des Lebensstils empfohlen werden, unabhängig vom Grad der Hypertonie und des kardiovaskulären Risikos. Diese Faktoren beeinflussen den Zeitpunkt der Anfang einer pharmakologischen Therapie (2, 3). Zusätzlich zu den bekannten Lebensstil-Änderungen (Nikotinabstinenz, Ernährung ohne Salz-Exzess, reich an Früchten und Gemüse, Alkoholeinschränkung, Körperausdauertraining, Gewicht- und Stress-Reduktion) sollen auch weitere Faktoren wie z.B. Lärm- oder Licht-Exposition, Schlafrhythmus berücksichtigt werden.
Pharmakologische Therapie
5 verschiedenen Klassen von Medikamenten werden als Erstlinien-Behandlung von Bluthochdruck empfohlen: Angiotensin-Converting-Enzym (ACE)-Hemmer, Angiotensin-II-Rezeptorblocker (ARBs), Betablocker, Calciumkanalblocker (CCBs) und Diuretika (Thiazide und Thiazid-ähnliche Diuretika wie Chlortalidon und Indapamid) (2, 3).
ACE-I oder ARBs allein oder in Kombination mit einem Calciumantagonisten oder einem Diuretikum sind erste Wahl (Thiazid-ähnlich gegenüber Hydrochlorothiazid wird bevorzugt, Schleifendiuretika nur bei eingeschränkter Nierenfunktion). Die Verwendung von Betablockern ist auf spezielle Indikationen beschränkt (2, 3). Medikamente wie Aldosteron-Antagonisten, Alfa-Blocker oder zentrale Antihypertensiva kommen bei Therapie-resistenter Hypertonie zum Einsatz.
Welche Patienten mit Hypertonie sollen eine pharmakologische Therapie erhalten und wie schnell soll diese etabliert sein?
Die Entscheidung, eine medikamentöse Therapie einzuleiten, sollte individualisiert werden. Die Patienten sollen in eine solche Entscheidung aktiv involviert werden.
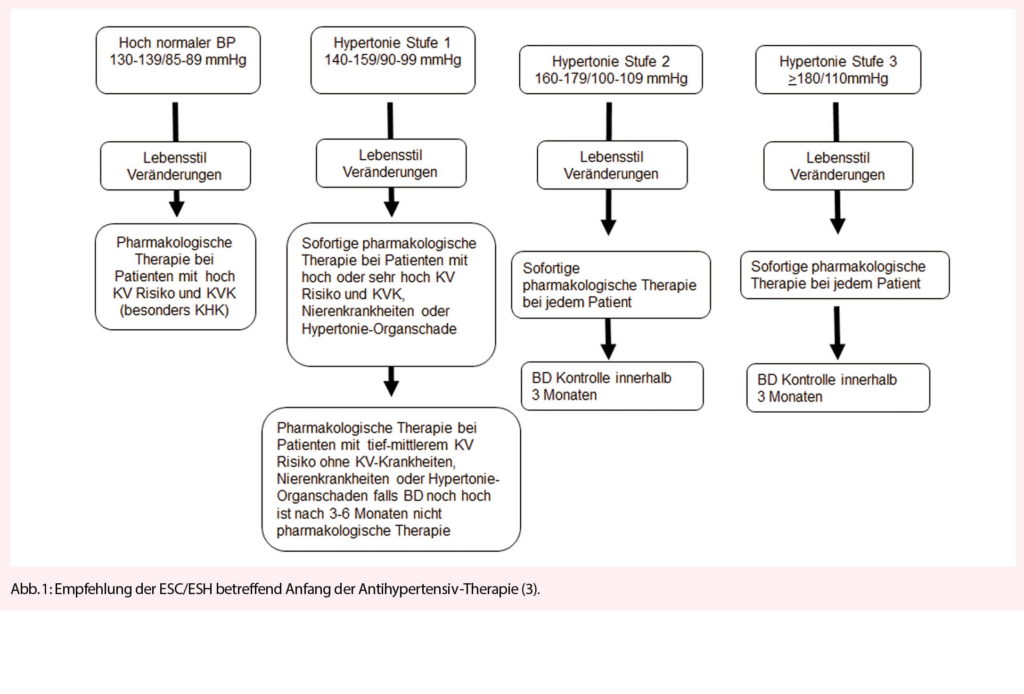
Gemäss den ESC/ESH-Richtlinien (3) sollte bei Patienten mit Hypertonie Grad 2 oder 3 die blutdrucksenkende pharmakologische Therapie gleichzeitig mit den Lebensstilveränderungen unverzüglich initiiert werden. Bei Personen mit hoch-normalem Blutdruck oder Hypertonie Grad 1 und sehr hohem kardiovaskulärem Risiko soll eine medikamentöse Therapie oder nach einiger Zeit eine nicht-pharmakologische Therapie eingeleitet werden (Abb. 1).
Bei den meisten Patienten bleibt der Blutdruck unter Monotherapie ausserhalb des Zielbereichs. Zudem hat die Kombinationstherapie mit Medikamenten aus verschiedenen Klassen eine wesentlich stärkere blutdrucksenkende Wirkung als die Verdoppelung der Dosis eines einzelnen Wirkstoffs (6).
Infolgedessen wird in den neuen Richtlinien zur Behandlung von Bluthochdruck vorgeschlagen, die Kombinationstherapie in einem frühen Stadium und, wenn möglich, als Einzelpillen-Kombinationsmedikation mit fester Dosis zu verwenden, um die Adhärenz des Patienten zu verbessern (2, 3).
Wenn eine Kombinationstherapie benötigt wird, empfehlen die Guidelines als erstes eine Therapie mit einem langwirksamen ACE-Hemmer oder ARB in Kombination (fix, wenn dies möglich ist) mit einem langwirksamen Dihydropyridin-CCB oder einem Diuretikum. Die Kombination eines ACE-Inhibitors oder ARBs mit einem Thiazid-Diuretikum wird als vorteilhafter angesehen, wenn ein Thiazid-ähnliches Diuretikum (Chlortalidon oder Indapamid) anstelle von Hydrochlorothiazid verwendet wird (3, 7).
Selbst wenn Kopf-an-Kopf-Studien fehlen, legen die verfügbaren Daten nahe, dass Thiazid-ähnliche Diuretika wie Chlortalidon und Indapamid gegenüber klassischen Thiaziddiuretika (z. B. Hydrochlorothiazid und Bendrofluazid) bevorzugt werden sollten (3, 7, 8).
Der nächste Schritt ist die Kombination von RAAS-Blocker, Ca-Antagonisten und Thiazid/Thiazid-ähnlichen Diuretika (3).
Bleibt der Blutdruck unter dieser Dreifachkombinationstherapie unkontrolliert, kann ein Mineralocorticoidrezeptor (MR)-Antagonist (d.h. Spironolacton oder Eplerenon) hinzugefügt werden (9). Bei Patienten mit schwer zu behandelnder/resistenter Hypertonie könnten Betablocker, Alphablocker oder direkte Vasodilatatoren hinzugefügt werden. Im Allgemeinen sollte die gleichzeitige Anwendung von Betablockern und Nicht-Dihydropyridin-CCBs vermieden werden, da beide Wirkstoffklassen die Herzfrequenz senken (3).
Organschäden von Bluthochdruck lassen sich aber nur vermeiden, wenn der Blutdruck dauerhaft und langfristig gesenkt wird.
Der Umstand, dass die nicht-pharmakologische/pharmakologische antihypertensive Therapie ein lebenslanger Begleiter sein muss, ist für viele Patienten schwierig zu akzeptieren. Offene Arzt-Patienten Gespräche über die positiven Effekte, Wirkmechanismus und mögliche Nebenwirkungen der Medikamente sowie regelmässigen Kontrollen sind für die zukünftige Adhärenz essentiell.
Folgekontrollen bei Patienten mit Bluthochdruck
Vor und kurzfristig nach Anfang einer antihypertensiven Therapie ist es notwendig, dass die Patienten beim Arzt kontrolliert werden. In diesen Phasen sind die Praxis-Messungen sowie evtl. die 24h Blutdruck Messung für die Diagnose und die Einstellung der Therapie sehr wichtig. Beim Einsatz von gewissen Medikamenten kann auch eine Labor-Kontrolle sinnvoll sein (Kreatinin bei RAAS Blockers, Kalium bei Diuretika…). Die Häufigkeit der weiteren Kontrollen hängt vom Schweregrad des Bluthochdrucks, der Dringlichkeit Kontrolle des Blutdrucks zu erreichen, und der evtl. vorhandenen Komorbiditäten ab.
Copyright bei Aerzteverlag medinfo AG
Hypertonie-, Lipid-, Tabakentwöhnungssprechstunde
Kardiovaskuläre Forschung
Universitäres Herzzentrum, Klinik für Kardiologie
UniversitätsSpital Zürich
Rämistrasse 100
8091 Zürich
isabella.sudano@usz.ch
Consulting fees, travel grant and honoraria from: Amgen, Daiichi Sankyo, Medtronic, MSD, Recordati, Sanofi und Servier