Fallvorstellung 1
Ein 24-jähriger Maurer stellt sich notfällmässig an einem Freitagnachmittag in Ihrer Hausarztpraxis vor, da er seit 1 Woche unter zunehmenden Halsschmerzen leidet. Er fühlt sich subjektiv auch etwas fiebrig, weswegen er vor zwei Tagen einen Covid-19-Test durchführen liess, der dann negativ ausgefallen war. Zurzeit fühlt er sich insgesamt in einem guten Allgemeinzustand, hat jedoch erhebliche Halsschmerzen und kann nur noch schlecht schlucken. Er hat keinen Husten und riecht normal.
Persönliche Anamnese: Unterschenkelfraktur links nach Motorradunfall vor 3 Jahren, sonst gesund. Nichtraucher. Keine Allergien.
Medikation: Keine regelmässigen Medikamente
Vitalparameter: BD 135/85, Puls 78, regelmässig, SO2 98%, Temperatur: 38.3 °C., Grösse 184 cm, Gewicht 84 kg
Klinischer Status: Leicht vergrösserte und leicht dolente Halslymphknoten beidseits, keine Rötung, keine Überwärmung. Kein Exanthem. Herz-, Lungen- und Abdomen-Untersuchung bland.
Fragen:
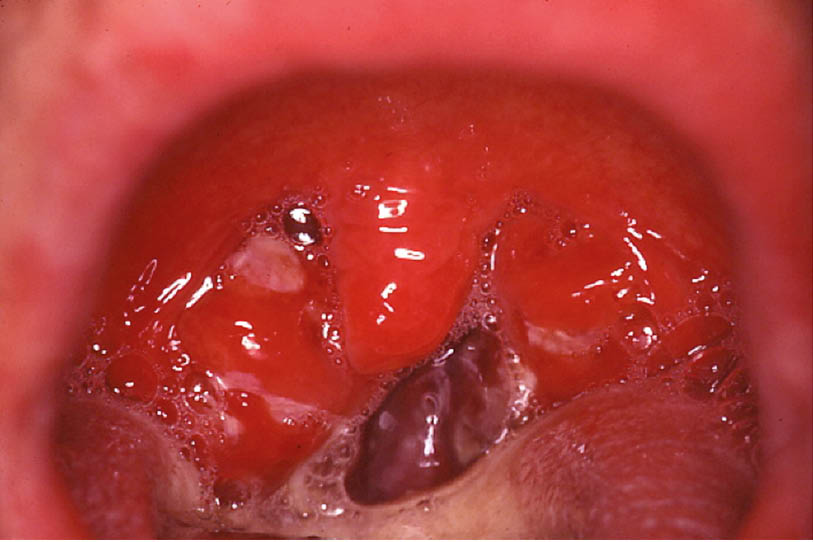
1. Welche Form einer akuten Tonsillitis liegt am ehesten vor?
A. Mononukleose
B. Unspezifischer viraler Infekt der oberen Luftwege
C. Herpangina (Coxsackie-Viren)
D. Streptokokkenangina
Richtig ist Antwort D. Es zeigt sich das klassische Bild einer Streptokokken-Tonsillitis im Stadium der Angina lacunaris.
Welche diagnostischen Abklärungen führen Sie durch?
A. Keine
B. Streptokokken-Schnelltest
C. Hämatogramm mit differenziertem Blutbild, Leberwerte
D. Rachenabstrich
Beste Antwort ist B. Mit 4 Punkten im McIsaac-Score hat der Patient eine Wahrscheinlichkeit von gut 50% für einen Streptokokkeninfekt. C ist allerdings je nach klinischer Situation ebenfalls zusätzlich möglich. Ein Lymphozyten-/Leukozytenquotient von > 0.35 und erhöhte Leberwerte könnten differentialdiagnostisch für das Vorliegen einer Mononukleuose sprechen
Welche Behandlung empfehlen Sie?
A. Körperliche Schonung, ausreichende Trinkmenge (z.B. heisser Tee)
B. Körperliche Schonung, ausreichende Trinkmenge (z.B. heisser Tee), Ibuprofen
C. Körperliche Schonung, ausreichende Trinkmenge (z.B. heisser Tee), Ibuprofen, Nachkontrolle in 3 Tagen
D. Körperliche Schonung, ausreichende Trinkmenge (z.B. heisser Tee), Ibuprofen, Nachkontrolle in 3 Tagen, orales Penicillin für 10 Tage
Richtig ist C. Unter symptomatischer Therapie besteht bei diesem jungen Mann ohne Grundkrankheiten eine hohe Wahrscheinlichkeit für eine komplikationslose Spontanheilung der akuten Tonsilliti
Fallvorstellung 2
Zwei Stunden später meldet sich nochmals eine Patientin notfallmässig in Ihrer Praxis. Diesmal ist es eine 32-jährige Coiffeuse, welche seit 4 Tagen unter starken Halsschmerzen leidet, eher linksbetont. Sie hat eine ausgeprägte Odynophagie, vor allem beim Essen von sauren Speisen, und kann sich kaum noch ernähren. Sie gibt weder Husten, Schnupfen noch Kopfschmerzen an.
Persönliche Anamnese: Atopische Dermatitis. Keine Allergien.
Medikation: Keine regelmässigen Medikamente
Vitalparameter: BD 115/65, Puls 84, regelmässig, SO2 98%, Temperatur: 37,4 °C., Grösse 172 cm, Gewicht 62kg
Klinischer Status: Halspalpation unauffällig. Kein Exanthem. Herz-, Lungen- und Abdomen-Untersuchung bland.
Frage:
1. Welche primären diagnostischen Abklärungen führen Sie durch?
A. Serologische Abklärungen
B. Streptokokken-Schnelltest
C. Hämatogramm mit differenziertem Blutbild, Leberwerte
D. Rachenabstrich mit Gram-Färbung
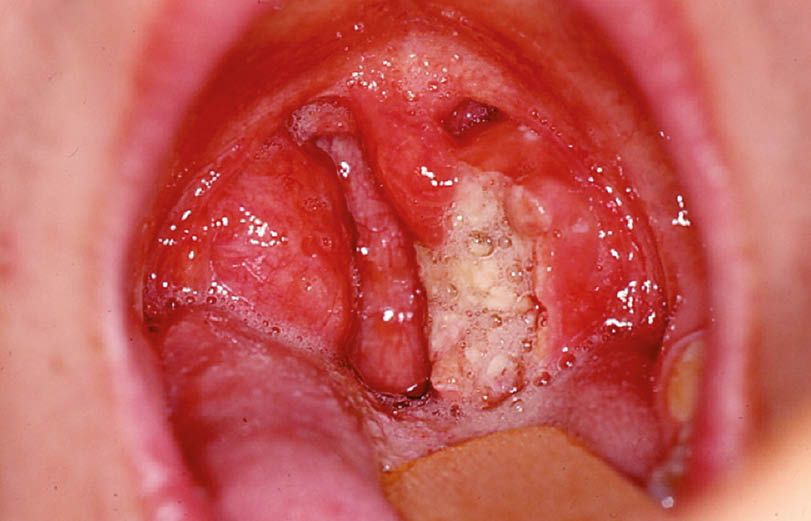
Die beste Antwort ist D. Wenn sich in der Gram-Färbung Spirochäten und fusiforme Bakterien zeigen, kann die Diagnose einer Angina Plaut-Vincent gestellt werden. Antwort A ist ebenfalls richtig. Differentialdiagnostisch kommt bei einer einseitigen, ulcerösen Tonsillitis z.B. auch ein luetischer Primäraffekt in Frage, so dass eine Lues-Serologie angezeigt ist. Sekundär müssen im Verlauf unter anderem ein Lymphom oder ein Tonsillenkarzinom ausgeschlossen werden.
Diskussion
Bei Patienten mit einer akuten Tonsillitis stellt sich grundsätzlich die Frage, ob neben einer suffizienten symptomatischen Therapie die Behandlung mit einem Antibiotikum notwendig ist. Da es bei der Inspektion schwierig ist, eine virale von einer bakteriellen Tonsillitis zu unterscheiden, insbesondere von einer Streptokokken-Gruppe-A-Tonsillitis, kann als erster Schritt z.B. der McIsaac-Score zu Hilfe genommen werden. Bei einem hohen Score wird die Wahrscheinlichkeit grösser, dass ein positiver Rachenabstrich für Gruppe-A-Streptokokken vorliegt. Differenzialdiagnostisch ist immer auch eine Mononukleose möglich. Bei einem McIsaac-Score von 3 oder mehr Punkten wird empfohlen, ergänzend einen Streptokokken-Schnelltest durchzuführen. Ist dieser Schnelltest positiv, darf von einer Tonsillitis der Streptokokken-Gruppe A ausgegangen werden. Kann nun also die Behandlung mit einem Antibiotikum den Krankheitsverlauf günstig beeinflussen, sprich, wird eine raschere Heilung erreicht und werden Komplikationen vermieden? Es konnte gezeigt werden, dass eine Streptokokkenangina unter symptomatischer Therapie eine hohe Spontanheilung aufzeigt. Bei der Behandlung mit einem Antibiotikum kann die Spontanheilung innert durchschnittlich 7 Tagen auf 6 Tage reduziert werden, was also einem Gewinn von etwa einem Tag entspricht. Zudem kann eine Therapie mit einem Antibiotikum Komplikationen wie einen Peritonsillarabszess nicht verhindern. Daneben ist das akute rheumatische Fieber, ursprünglich der Hauptgrund für die Behandlung der Streptokokkenangina mit einem Antibiotikum, in unseren Breitengraden zu einer Rarität geworden.
Zusammengefasst wird heute empfohlen, eine akute Tonsillitis primär rein symptomatisch zu behandeln. Im Sinne einer rationalen Antibiotikatherapie ist bei der Streptokokkenangina die Behandlung mit einem Antibiotikum in den meisten Fällen nicht oder nur zeitlich verzögert indiziert. Hingegen gehört neben einer suffizienten Analgesie bei der Behandlung der akuten Tonsillitis auch die Aufklärung des Patienten dazu, weshalb kein Antibiotikum notwendig ist, und welche Vorteile er hat, wenn nicht mit einem Antibiotikum behandelt werden muss. Selbstredend müssen immer die klinische Situation berücksichtigt werden (schwere Erkrankung, Immunsuppression, ungewöhnlicher Verlauf, akutes rheumatisches Fieber in der Anamnese, u. a. m.) und Warnsignale wie einseitig vorgewölbter Gaumenbogen, einseitig geschwollener und geröteter Hals, schwere Allgemeinerkrankung (Peritonsillarabszess, Abszedierung der Halslymphknoten, Lemierre-Syndrom etc.) erkannt werden.
Beim zweiten Notfall, dem der Patientin mit einer unilateralen ulzerösen Tonsillitis, liegt eine Angina Plaut-Vincent vor. Der Name stammt vom deutschen Bakteriologen H.C. Plaut und dem französischen Arzt und Epidemiologen J.H. Vincent. Diese Mischinfektion wird durch Spirochäten und Fusobakterien ausgelöst, welche am einfachsten in einer Gram-Färbung nachgewiesen werden können. Die Erkrankung ist relativ selten und zeigt meist einen eindrücklichen lokalen Befund. Die Behandlung hängt vom klinischen Zustandsbild ab und reicht von lokalen Antiseptika bis hin zu einer Therapie mit oralen Antibiotika, zum Beispiel mit Penicillin. Differenzialdiagnostisch muss man bei einer einseitigen ulzerösen Tonsillitis unter anderem auch an einen syphilitischen Primäraffekt denken und eine Lues-Serologie veranlassen. Je nach Verlauf müssen zudem ein Tonsillenkarzinom oder ein Lymphom ausgeschlossen werden.
Copyright bei Aerzteverlag medinfo AG
Klinik für Hals-Nasen-Ohren- und Gesichtschirurgie (HNO)
Luzerner Kantonsspital
Spitalstrasse
6004 Luzern
christoph.schlegel@luks.ch
Keiner in Zusammenhang mit diesen Fallbesprechungen.
1. Hofmann Y, Berger H et al. Behandlung der Streptokokkenangina. Swiss Med Forum. 2019;19(2930):481-488
2. ESCMID Sore Throat Guideline Group, Pelucchi C, Grigoryan L, et al. Guideline for the management of acute sore throat. Clin. Microbiol. Infect. 2012;1–28.
3. McIsaac WJ et al. A clinical score to reduce unnecessary antibiotic use in patients with sore throat. CMAJ. 1998 Jan 13; 158(1): 75–83