L’ Association Suisse contre l’ Ostéoporose (ASCO) classifie désormais le risque de survenue d’ une fracture ostéoporotique majeure en quatre catégories différentes et établit des recommandations de prise en charge claires pour chacun de ces groupes de risque. Les recommandations de l’ ASCO publiées en septembre 2020 peuvent aider les médecins à identifier des patients exposés à un risque de fracture élevé et très élevé ainsi qu’ à choisir le traitement qui convient (1).
Das idiopathische Parkinsonsyndrom
Das idiopathische Parkinsonsyndrom (iPS) zählt mit rund zehn Millionen Betroffenen zu den häufigsten neurodegenerativen Erkrankungen weltweit. Alleine in der Schweiz leiden mehr als 15 000 Menschen unter den fortschreitenden Symptomen, die unter anderem auf eine Degeneration der Dopamin-produzierenden Zellen der Substantia nigra zurückzuführen sind. Die frühe Diagnosestellung und der frühe Beginn der medikamentösen und nicht-medikamentösen Therapien führen zu einer signifikanten Steigerung der Lebensqualität und längerfristig zu einer Verlängerung der Selbstständigkeit.
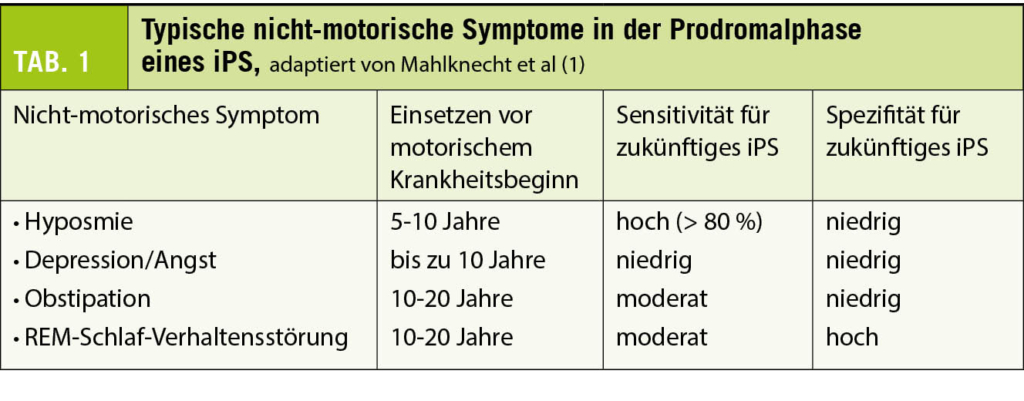
Der degenerative Prozess beginnt bereits Jahre bis Jahrzehnte vor dem krankheitsdefinierenden motorischen Symptombeginn. Diese Phase mit dezenten vor allem nicht-motorischen Symptomen wird auch Prodromalphase genannt. Aufgrund der fehlenden motorischen Symptomatik werden diese sehr unspezifischen Beschwerden meist nicht mit einem beginnenden Parkinson-Syndrom in Verbindung gebracht. Beim Vorliegen erster motorischer Symptome erweist sich die Prodromalphase retrospektiv jedoch als hilfreich. Durch eine gezielte Anamnese und Fremdanamnese der häufigsten nicht-motorischen Symptome (Tab. 1) lässt sich der Verdacht eines Parkinson-Syndroms oft bereits früh erhärten.
Erste motorische Symptome
Erst ab einem Zellverlust der Substantia nigra pars compacta von über 60% manifestieren sich motorische Symptome (2). Die Patienten stellen sich häufig mit unspezifischen Beschwerden vor. So berichten sie beispielsweise von allgemeiner Schwäche, kleiner und unleserlichen Handschrift, Schulter-Armschmerzen oder neu aufgetretenem Zittern. Den Angehörigen können eine leisere Sprache, eine Hypomimie oder eine Änderung des Gangbildes auffallen. Die Diagnose des idiopathischen Parkinsons wird klinisch gestellt. Obligat benötigt es verlangsamte Bewegungen – Bradykinese. Zusätzlich ist ein weiteres «Kardinal-Symptom» wie 4-6Hz Ruhetremor und/oder Rigor für die Diagnosestellung gefordert. In der Regel beginnen die beschriebenen Beschwerden einseitig an einem Arm, breiten sich auf das gleichseitige Bein aus und gehen im Verlauf auch nach kontralateral über. Die Asymmetrie bleibt zumeist auch in fortgeschrittenen Stadien bestehen.
Die Bradykinese macht sich in den repetitiven Bewegungen der Hände und Füsse (Finger-/Foot-tapping) durch ein Frequenz-/Amplitudendekrement bemerkbar. In der weiteren klinischen Untersuchung sollte besonders auf das Gangbild des Patienten geachtet werden. Der meist einseitig reduzierte Mitschwung des Armes in Verbindung mit einer verkürzten Schrittlänge und einer nach vorne übergebeugten Haltung fallen oft als frühe motorische Symptome auf. Ein weiterer hilfreicher Teil der Untersuchung ist es, den Patienten mehrere Sätze schreiben zu lassen. Hierbei lässt sich häufig eine undeutliche Schrift, welche gegen Ende des Satzes kleiner wird, objektivieren. Die Mikrographie bemerken die Patienten meist schon lange vor dem Arztbesuch selber. Des Weiteren können auch anamnestisch Hinweise auf eine Bradykinese erfragt werden. Viele Parkinsonpatienten leiden bereits früh unter diskreten Feinmotorikstörungen. Häufig bejahen sie beispielsweise Probleme beim Zuknöpfen von Hemden. Falls möglich sollte immer eine Fremdanamnese eingeholt werden. Die Angehörigen können zu Symptomen, welche den Patienten selber nicht auffallen, meist bessere Auskunft geben. So lässt sich auf Nachfrage eine Veränderung der Stimme und der Mimik bestätigen.
Bei Bewegungen einzelner Gelenke durch den Untersucher macht sich der Rigor häufig durch das Zahnradphänomen bemerkbar. Ein subklinischer Rigor kann durch Bewegungen der kontralateralen Extremität demaskiert werden. Das Zittern ist ausgeprägter in ruhender Position (Ruhetremor) und nimmt üblicherweise bei Gebrauch der Hand ab, im Gegensatz zu anderen Tremorformen.
Medikamentöse Behandlungs-möglichkeiten motorischer Symptome
Die medikamentöse Therapie sollte begonnen werden, sobald der Patient einen negativen Einfluss der motorischen Symptome auf seine Lebensqualität beklagt. Lange Zeit galt es, bei frühem Krankheitsbeginn ein möglichst Dopamin-sparendes Therapieregime zu führen, um die gefürchteten L-Dopa-induzierten Dyskinesien hinauszuzögern. Deshalb wurde für die initiale Behandlung eine Therapie mit Dopaminagonisten bevorzugt. Neuere Studien konnten jedoch zeigen, dass eine frühe Behandlung mit L-Dopa im Gegensatz zu einer L-Dopa-sparenden Therapie keinen relevanten Einfluss auf die Ausbildung von motorischen Fluktuationen hat, gleichzeitig aber zu einer Verbesserung der Lebensqualität führt (3 - 5). Zusätzlich wird das positive. Ansprechen der motorischen Symptome auf L-Dopa als unterstützendes Kriterium in der Diagnosestellung angesehen (6). Die Behandlung mit L-Dopa kann durch andere Substanzgruppen bei Bedarf ergänzt werden. Bei Auftreten von Fluktuationen kann mit Zugabe von Dopaminagonisten, COMT-Hemmern oder MAO-B-Hemmern eine Stabilisierung erreicht werden. Hierbei sollte je nach Komorbiditäten und nicht-motorischen Symptomen des Patienten auf das Nebenwirkungsspektrum der einzelnen Substanzen geachtet werden. Im Falle von störenden Dyskinesien kann eine Therapie mit Amantadin erwogen werden.
Die subkutane Apomorphin-Injektion und die duodenale L-Dopa-Infusion mit Hilfe von Pumpen bieten aufgrund der kontinuierlichen Medikamentenapplikation gute Alternativen zur oralen medikamentösen Therapie beim fortgeschrittenen Parkinsonpatienten mit schweren Fluktuationen.
Wichtigste Nicht-Motorische Symptome
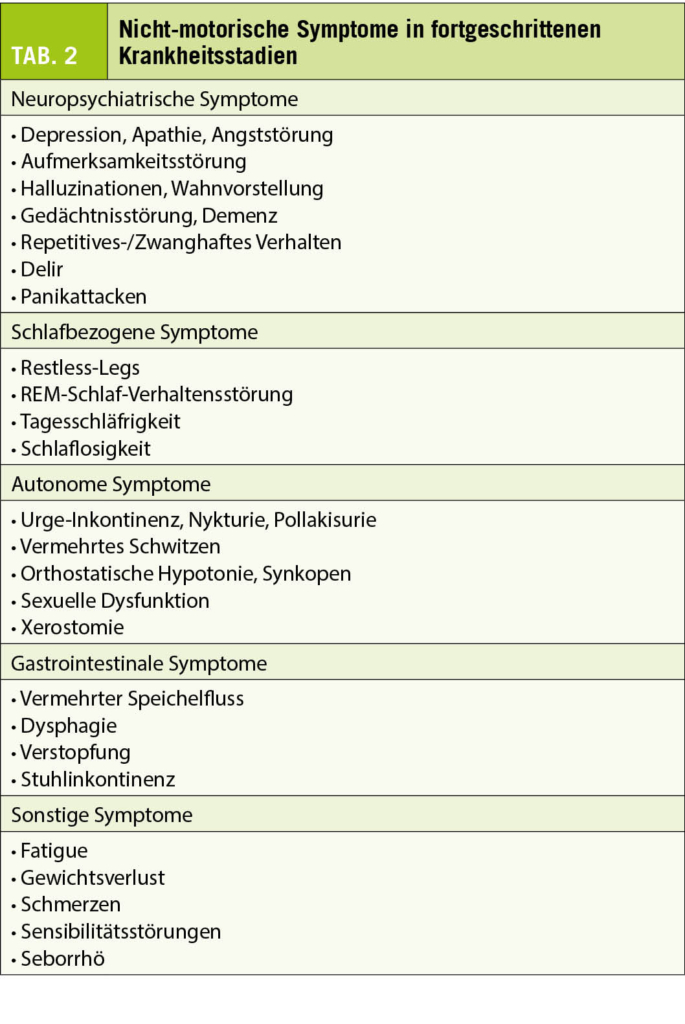
Im fortgeschrittenen Krankheitsstadium kommt es zu einer stetigen Zunahme der nicht-motorischen Symptome. Sie führen zur eingeschränkten Lebensqualität, Invalidität und verkürzten Lebenserwartung der Patienten. Darum ist es wichtig, diese Symptome zu erkennen und zu behandeln (Tab. 2).
Medikamentöse Therapie nicht-motorischer Symptome
Da die meisten nicht-motorischen Symptome zumindest teilweise auf die dopaminerge Therapie ansprechen (u.a. Schmerzen, Depression…), steht eine möglichst gute Einstellung der motorischen Parkinsonsymptome immer am Anfang. Auch das Wissen und die Evaluation nicht-motorischer Fluktuationen sind hier von entscheidender Bedeutung (z.B. ängstlich depressive Zustände in Off Phasen). Bleibt auch bei optimaler Behandlung der motorischen Parkinsonsymptome eine Depression manifest, empfiehlt sich der Einsatz eines selektiven Serotonin-Wiederaufnahmehemmers.
Die Therapie mit Rivastigmin, als Pflaster oder Kapsel, zeigt einen positiven Effekt auf kognitive Beeinträchtigungen bzw. Parkinsondemenz. Psychosen und Delir beim Parkinsonpatienten sollten primär mit Clozapin behandelt werden. Alternativ kann auf Quetiapin zurückgegriffen werden.
Eine orthostatische Hypotonie kann neben allgemeinen Massnahmen wie Flüssigkeits-/Salzzufuhr und Stützstrümpfen medikamentös versuchsweise mit Fludrocortison behandelt werden. Wichtig ist hierbei, ein Blutdruckprotokoll zu führen, um die medikamentöse Therapie gut zu überwachen. Obstipation sollte mit den gängigen Pro- und Präbiotika therapiert werden. Bedarfsweise können zusätzlich Laxantien wie Macrogol zum Einsatz kommen. Bei Übelkeit und Erbrechen ist Domperidon das Medikament erster Wahl (7).
Invasive Behandlungsmethoden – Tiefe Hirnstimulation (Deep Brain Stimulation – DBS)
Bei Patienten mit medikamentös nicht mehr ausreichend beherrschbaren Wirkfluktuationen sollte eine operative Behandlung mittels tiefer Hirnstimulation in Betracht gezogen werden. Die tiefe Hirnstimulation führt zu einer eindrücklichen Stabilisierung motorischer und teilweise auch nicht-motorischer Symptome und einer damit verbundenen Verbesserung der Lebensqualität.
Copyright bei Aerzteverlag medinfo AG
Klinik für Neurologie, Kantonsspital St. Gallen
Rorschacher Strasse 95
9007 St. Gallen
patrick.dorin@kssg.ch
Klinik für Neurologie, Kantonsspital St. Gallen
Rorschacher Strasse 95
9007 St. Gallen
Die Autoren haben im Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
1. P Mahlknecht et al. / The Concept of Prodromal Parkinson’s Disease. Journal of Parkinson’s Disease 5 (2015) 681–697
2. MB Stern et al. / Toward a redefinition of Parkinson’s disease. Mov Disord (2012), 27, 54-60.
3. R Cilia et al. / The modern pre-levodopa era of Parkinson’s disease: insights into motor complications from sub-Saharan Africa. Brain (2014): 137; 2731–2742
4. CVM Verschuur et al. / Randomized Delayed-Start Trial of Levodopa in Parkinson’s Disease. N Engl J Med (2019);380:315-24.
5. RMA de Bie et al. / Initiation of pharmacological therapy in Parkinson’s disease: when, why, and how. Lancet Neurol 2020
6. G Deuschl, W Oertel, H Reichmann et al. / DGN-Leitlinien Idiopathisches Parkinson-Syndrom (2016)
7. K Seppi et al. / Update on Treatments for Nonmotor Symptoms of Parkinson’s Disease—An Evidence-Based Medicine Review (2019)
Das Fibromyalgie-Syndrom
Beim Fibromyalgie-Syndrom handelt es sich um einen klinischen Beschwerdekomplex, bei dem multilokuläre Schmerzen in unterschiedlichen Körperbereichen im Vordergrund stehen und gleichzeitig keine ursächlich erklärende strukturelle Schädigungen oder biochemische Abweichungen von rheumatologischer, orthopädischer oder neurologischer Seite festgestellt werden können. In diesem ersten Teil des Beitrags werden die Grundlagen des Krankheitsbildes, die Epidemiologie sowie die Pathogenese unter besonderer Berücksichtigung der zentralen Sensitivierung besprochen, während ein zweiter Teil, der im Schwerpunkt der Januar-Ausgabe erscheinen wird, den prädisponierenden Faktoren, der Diagnostik und Therapie gewidmet sein wird.
Wenn beim Fibromyalgie-Syndrom auch keine ursächlich erklärende strukturelle Schädigungen oder biochemische Abweichungen von rheumatologischer, orthopädischer oder neurologischer Seite festgestellt werden können, bestehen oft zusätzliche weitere funktionelle und vegetative Beschwerden: funktionelle Herz- und Atembeschwerden, Colon irritabile, Dysmenorrhoe und Dysurie, Schlafstörungen, chronische Kopfschmerzen sowie Parästhesien, die keiner radikulären Ausbreitung entsprechen. Hinzu kommen bei den meisten Patienten eine allgemeine Ermüdbarkeit bzw. Erschöpfbarkeit sowie eine Verstärkung der Symptome durch Stress, Angst und körperliche Aktivität. Diese zusätzlichen Beschwerden wurden bereits in den 1980er Jahren beschrieben (1, 2) und wiesen insofern früh darauf hin, dass Probleme der Stressverarbeitung pathogenetisch bedeutsam sein könnten. Ursprünglich wurde die Diagnose «Fibromyalgie» (im deutschsprachigen Raum «generalisierte Tendomyopathie») von Rheumatologen eingeführt und dann gestellt, wenn nach sorgfältiger rheumatologischer Abklärung eine inflammatorische Verursachung der multilokulären Schmerzen ausgeschlossen werden konnte (1).
Vor genau 30 Jahren wurde von einer Arbeitsgruppe der Amerikanischen Rheumatologischen Gesellschaft (ACR) erstmals eine Operationalisierung der «Fibromyalgie» versucht, um die Erforschung der Entstehungsmechanismen zu intensivieren (3). Danach mussten die Schmerzen länger als 3 Monate bestehen und sich auf verschiedene Körperbereiche (Achsenskelett, rechte und linke Körperhälfte sowie oberhalb und unterhalb der Taille) verteilen. Darüber hinaus mussten von 18 vordefinierten 11 Sehnenansatzpunkten die Palpation bei festgelegter Druckstärke (mit dem Daumen) schmerzhaft sein (Tender Points). Diese sog. ACR-Kriterien, die ursprünglich nicht zur Definition eines umschriebenen Krankheitsbildes, sondern nur als Forschungskriterien gedacht waren, wurden ab Mitte der 1990er Jahre von Rheumatologen und Patientenorganisationen zunehmend wie «Definitionskriterien» gehandhabt. Schliesslich wurde das Störungsbild auch in das ICD-10 (M79.70) aufgenommen. Damit wurde die Fibromyalgie als eine rheumatologische Erkrankung interpretiert und klassifiziert, deren Zuständigkeit in der Behandlung in erster Linie beim Rheumatologen liegt.
Die Prüfung der Tender Points im Sinne der ursprünglichen ACR-Kriterien von 1990 wurde bereits 2003 von der ACR wieder zurückgenommen (4), ohne dass dies im deutschsprachigen Raum in der Praxis zu Veränderungen führte. Wissenschaftliche Studien hatten gezeigt, dass Tender Points in ihrer anatomisch definierten Ausschliesslichkeit diagnostisch nicht hinreichend reliabel sind. Grundsätzlich ist aber die erhöhte Druckempfindlichkeit der Tender Points (sowie natürlich auch an anderen Druckpunkten ausserhalb von Muskel-Sehnenansätzen) ein wertvolles klinisches Zeichen hinsichtlich einer insgesamt erniedrigten Schmerzschwelle (generalisierte Hyperalgesie).
2010 wurde von Wolfe et al mittels zweier Scores (Widespread Pain Index und Symptom Severity Score) eine neue Definition vorgeschlagen, welche auf die Tender-Points verzichtet und stattdessen das Ausmass der Schmerzlokalisationen des Patienten in definierten Körperregionen sowie die Berücksichtigung zusätzlicher Beschwerden zugrunde legt (5). Da dies jedoch zu einer ganz erheblichen Ausweitung der FMS-Diagnose führte (6), erfolgte 2016 eine Korrektur dieses Definitionsvorschlags, indem zusätzlich eine Mindestzahl von betroffenen Körperbereichen aufgenommen wurde (7).
Aufgrund dieser erweiterten Definition wird das Fibromyalgie-Syndrom (FMS) heute konsensbasiert als generalisierte Schmerzstörung verstanden, wobei die dominierenden Beschwerden im Bereich des muskuloskelettalen Apparates auf dem Mechanismus einer generalisierten Hyperalgesie basieren. Die zusätzlich in die Definition aufgenommenen neurokognitiven, vegetativen und depressiven Symptome weisen ätiopathogenetisch auf eine Stresserkrankung hin. Stress und Schmerz stehen bei Fibromyalgie-Patienten in einer komplexen Wechselwirkung (8, 9), die am besten unter dem Gesichtspunkt der «stressinduzierten Hyperalgesie» beschrieben werden kann. Diagnostisch kommt einer rheumatologischen Ausschlussdiagnostik dabei eine grosse Bedeutung zu.
Epidemiologie
Unter Zugrundelegung der oben genannten ursprünglichen Definition von 1990, liegt die Prävalenz eines FMS bei 2 - 6% (10). Frauen sind im Vergleich zu Männern 20-mal häufiger betroffen (Mas et al 2008). Der Altersgipfel liegt in den meisten Studien zwischen dem 45. und 60. Lebensjahr. Ein Beginn bereits in der Kindheit ist selten (11 - 13).
Pathogenese
Biologische Parameter
Viele Jahrzehnte wurden immer wieder unterschiedliche morphologische oder metabolische Veränderungen als Ursache eines peripher nozizeptiven Geschehens in Betracht gezogen. Entsprechende Untersuchungen belegten jedoch dann, dass diese durch den mangelnden körperlichen Trainingszustand infolge eines Schonverhaltens bedingt sind (14). Eine strukturell bedingte muskuläre Verursachung eines FMS wurde bereits Mitte der 1990er Jahre ausgeschlossen (15). Ebenfalls gut gesichert ist, dass virale Infektionen keine erklärende Ursache für die Entwicklung eines FMS darstellen (16 - 23). Das Auftreten einer FMS infolge einer Borrelien-Infektion ist wissenschaftlich bisher ebenfalls nicht belegt (24), auch wenn nach solchen Infektionen zunächst durchaus für eine gewisse Zeit muskuloskelettale Schmerzen und Erschöpfung bestehen können. Differentialdiagnostisch ist vor allem eine Neuroborreliose in Betracht zu ziehen. Diese spräche jedoch auf eine antibiotische Behandlung an (25, 26).
Bei entzündlich-rheumatischen Erkrankungen (rheumatoide Arthritis, Lupus erythematodes, Sjögren-Syndrom) besteht hingegen eine erhöhte Wahrscheinlichkeit, gleichzeitig an einem FMS zu erkranken (27). Früher wurde deshalb zwischen einer primären und einer (im Zusammenhang mit einer rheumatischen Grunderkrankung auftretenden) sekundären Fibromyalgie unterschieden.
Serologische und immunologische Auffälligkeiten
Bei der Suche nach spezifischen serologischen und biochemischen Auffälligkeiten wurde von zahlreichen Arbeitsgruppen eine ganze Reihe von verschiedenen Parametern im Serum und im Liquor mit dem Ziel untersucht, klinisch verwendbare «Marker» für FMS zu finden. Dies ist bis heute nicht gelungen. Von FMS-Patienten häufig berichtete Gewebeschwellungen, v.a. in den Händen, können über die gefässdilatatorische Wirkung von Neuropeptiden (z.B. Substanz P) erklärbar sein. Erhöhte Werte von Substanz P werden heute als Ausdruck einer umfassenden psychischen Stressreaktion gesehen (28). Auch die Aktivierung verschiedener proinflammatorischer Zytokine (v.a. IL-6 und IL-8) und deren erhöhte Werte in Liquor und Serum (29 - 31) kann mit stressinduzierten neurogenen Entzündungsprozessen zusammenhängen, die neben Schlafstörungen eine verstärkte Schmerzwahrnehmung induzieren können (32, 33). Die verstärkte Aktivierung proinflammatorischer Zytokine kann möglicherweise auch die bei einzelnen FMS-Patienten beobachtete «Small Fiber Neuropathie» erklären (28, 34).
Biologische Stressmechanismen
Hinsichtlich der Reagibilität des autonomen Nervensystems wurden vor allem Untersuchungen zur Herzratenvariabilität (HRV) durchgeführt, die für FMS-Patienten konsistent und reproduzierbar eine signifikante Verringerung im Vergleich zu Kontrollpersonen erbrachten (35 - 37) und möglicherweise als prädisponierender Faktor für ein FMS anzusehen sind (38, 39). Eine wesentliche Rolle bei der Aktivierung des autonomen Nervensystems wie auch der HPA-Achse ebenso wie der deszendierend-hemmenden Schmerzbahnen spielt Corticotropin Releasing Hormone/Factor (CRH/CRF) im Serum bzw. im Liquor (40 - 43).
Hinsichtlich der Aktivierung der HPA-Achse sind die Ergebnisse in den meisten Studien auffällig, d. h. eine Dysfunktion der HPA-Achse gilt heute als gesichert. Allerdings gehen die beobachteten Auffälligkeiten in gegensätzliche Richtungen: Einige Studien erbringen eine Über-, andere eine Unteraktivierung – darin spiegeln sich beim FMS unterschiedliche Krankheitsstadien wider (Übersicht bei 44).
Im EEG wurde im Schlaf ein Persistieren von Alpha-Wellen zu Lasten der für den erholsamen Tiefschlaf wichtigen Delta-Wellen bei FMS-Patienten beobachtet (45 - 47). Dies führt am nächsten Tag zu Symptomen eines nicht hinreichend erholsamen Schlafs. In prospektiven Studien waren Schlafprobleme ein Risikofaktor für die Entwicklung eines FMS (38, 48), welche Folge der verstärkten Aktivierung proinflammatorischer Zytokine sein können (49). Die zentrale Aktivierung von Glia-Zellen und die Ausschüttung von Zytokinen (IL-1β, IL-6, IL-8, TNFα, BDNF) löst proinflammatorische Prozesse aus, welche über zentrale Sensitivierungsmechanismen zu einer Dysfunktion des Schmerz- und des Stresssystems führen und Schlafstörungen auslösen können (33, 50).
Zentrale Sensitivierung
All die genannten Mosaiksteine konnten in den letzten Jahren durch die Ergebnisse von Neurobildgebungsstudien zu einem zunehmend klareren pathogenetischen Bild integriert werden: Es besteht eine Dysfunktion des schmerzmodulierenden Systems auf ZNS-Ebene (51). Auch für andere sensorische Reize (z. B. für Lärm und für unangenehme Gerüche) besteht eine erhöhte Sensibilität (52, 53). Cook et al. (54) konnten eine eingeschränkte Aktivierung des periaquäduktalen Grau (PAG) im Hirnstamm zeigen, das Ausgangspunkt des deszendierend-hemmenden Schmerzsystems ist (vgl. 55). Eine dysfunktionale «Top-Down-Regulation» infolge einer weitgehend fehlenden Aktivierung aller an der Stressverarbeitung beteiligten Hirnareale und des deszendierend-hemmenden Schmerzsystems wurde bei Patienten mit FMS im Vergleich zu Gesunden beobachtet (56). Schädigungen im Bereich des Hippokampus, der Amygdalae und des medialen Präfrontalkortex treten durch erhöhte Glukokortikoidspiegel infolge anhaltender Stresssituationen auf (57).
Klinisch äussert sich der Aspekt der zentralen Sensitivierung u.a. in den Symptomen einer Hyperalgesie, Allodynie, Lärm-, Lichtüberempfindlichkeit oder allgemeinen Reizüberempfindlichkeit.
Erhöhte Schmerzvulnerabilität infolge ungünstiger psychosozialer Bedingungen in der Kindheit
Eine Metaanalyse zum Zusammenhang von belasteter Kindheit und dem späteren Auftreten verschiedener funktioneller Syndrome kommt für Fibromyalgie zu einer 2,5-fach, für multilokulären Schmerz zu einer 3,4-fach erhöhten Vulnerabilität (58). Zahlreiche Studien belegen, dass ein erheblicher Teil der FMS-Patienten in der Kindheit einem Familienklima ausgesetzt war, das von körperlicher Gewalterfahrung und emotionaler Vernachlässigung geprägt war (59 - 63). Auch Daten der prospektiven britischen Kohortenstudie von 1958 (N > 17000), belegen eine erhöhte Vulnerabilität für die spätere Entwicklung eines multilokulären Schmerzsyndroms aufgrund früher Stresserfahrungen (64, 65).
Studien bei Kindern und Jugendlichen mit Fibromyalgie-Syndrom erbrachten, dass sie – auch im Vergleich zu anderen chronisch kranken Altersgenossen – bei Gleichaltrigen sozial schlechter integriert sind und – ebenso wie ihre Eltern – signifikant erhöhte Werte für Angst und Depression aufweisen. Auch litten gehäuft die Eltern unter chronischen Schmerzen (66 - 68).
Prof. Dr. med. Ulrich T. Egle, 1
PD Dr. med. Niklaus Egloff, 2
Dr. med. Christian Seeher, 1
Prof. Dr. med. Katja Cattapan, 1,3
1 Psychiatrische Klinik Sanatorium Kilchberg/ZH
2 Kompetenzbereich Psychosomatische Medizin, Inselspital Bern
3 Psychiatrische Univ.-Klinik Bern
Copyright bei Aerzteverlag medinfo AG
Senior Consultant Schmerz und Psychosomatik
Psychiatrische Klinik Sanatorium Kilchberg
Alte Landstrasse 70
8802 Kilchberg
UlrichT.Egle@sanatorium-kilchberg.ch
Die Autoren haben in Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
1. Yunus MB (1983) Fibromyalgia syndrome: a need for uniform classification. J Rheumatol 10: 841–844
2. Müller W, Lautenschläger J (1990) Generalized tendomyopathy. I: Clinical aspects, follow-up and differential diagnosis. Z Rheumatol 49: 11–21
3. Wolfe F, Smythe HA, Yunus MB, et al. (1990) The American College of Rheumatology 1990 criteria for the classification of fibromyalgia. Arthritis Rheum 33: 160–172
4. Wolfe F (2003) Stop using the American College criteria in the clinic. J Rheumatol 30: 1671–1672
5. Wolfe F, Clauw DJ, Fitzcharles MA et al. The American College of Rheumatology preliminary diagnostic criteria for fibromyalgia and measurement of symptom severity. J Arthritis Care Res 2010; 62: 600–10.
6. Wolfe, F, Clauw DJ, Fitzcharles MA et al. (2016). 2016 Revisions to the 2010/2011 fibromyalgia diagnostic criteria. Semin Arthritis Rheum;46(3):319-329.
7. Egloff N, von Känel R, Müller V, Egle UT, Kokinogenis G, Lederbogen S, Durrer B, Stauber S (2015) Implications of proposed fibromyalgia criteria across other functional pain syndromes. Scand J Rheumatol 44: 416-24.
8. Van Houdenhove B, Egle UT (2004) Fibromyalgia: A stress disorder? Piecing the biopsychosocial puzzle together. Psychother Psychosom 73: 267–275
9. Van Houdenhove B, Egle UT, Luyten P (2005) The role of life stress in fibromyalgia. Curr Rheumatol Rep 7: 365–370
10. Cabo-Meseguer A, Cerda-Olmedo G, Trillo-Mata JL. Fibromyalgia: prevalence, epidemiologic profiles and economic costs. Med Clin (Barc). 2017;149: 441–8.
11. Buskila D, Press J, Gedalia A, et al. (1993) Assessment of nonarticular tenderness and prevalence of fibromyalgia in children. J Rheumatol 20: 368–370
12. Mikkelsson M, Kaprio J, Salminen JJ, et al. (2001) Widespread pain among 11-year-old Finnish twin pairs. Arthritis Rheum 44: 481–485
13. Clark P, Burgos-Vargas R, Medina-Palma C, et al. (1998) Prevalence of fibromyalgia in children: a clinical study of Mexican children. J Rheumatol 25: 2009–2014
14. Henriksson KG, Bäckman E, Henriksson C, de Laval JH (1996) Chronic regional muscular pain in women with precise manipulation work. A study of pain characteristics, muscle function, and impact on daily activities. Scand J Rheumatol 25: 213–223
15. Simms RW, Roy SH, Hrovat M, et al. (1994) Lack of association between fibromyalgia syndrome and abnormalities in muscle energy metabolism. Arthritis Rheum 37: 794–800
16. Buchwald D, Goldenberg DL, Sullivan JL, Komaroff AL (1987) The »chronic, active Epstein-Barr virus infection” syndrome and primary fibromyalgia. Arthritis Rheum 30: 1132–1136
17. Fye KH, Whiting-O’Keefe QE, et al. (1988) Absence of abnormal Epstein-Barr virus serologic findings in patients with fibrositis. Arthr Rheum 31: 1455–1456
18. Narváez J, Nolla JM, Valverde J (2005) No serological evidence that fibromyalgia is linked with exposure to human parvovirus B19. Joint Bone Spine 72: 592–594.
19. Wittrup IH, Christensen LS, Jensen B, et al. (2000) Search for Borna disease virus in Danish fibromyalgia patients. Scand J Rheumatol 29: 387–390
20. Buskila D, Neumann L (1997) Fibromyalgia (FM) and nonarticular tenderness in relatives of patients with FM. J Rheumaol 24: 941–944
21. Rivera J, de Diego A, Trinchet M, García Monforte A (1997) Fibromyalgia-associated hepatitis C virus infection. Br J Rheumatol 36: 981–985
22. Goulding C, O’Connell P, Murray FE (2001) Prevalence of fibromyalgia, anxiety and depression in chronic hepatitis C virus infection: Relationship to RT-PCR status and mode of acquisition. Eur J Gastroenterol Hepatol 13: 507–511
23. Kozanoglu E, Canataroglu A, Abayli B, et al. (2003) Fibromyalgia syndrome in patients with hepatitis C infection. Rheumatol Int 23: 248–251
24. Cairns V, Godwin J (2005) Post-Lyme borreliosis syndrome: A meta-analysis of reported symptoms. Int J Epidemiol 34: 1340–1345.
25. Hsu VM, Patella SJ, Sigal LH (1993) »Chronic Lyme disease” as the incorrect diagnosis in patients with fibromyalgia. Arthritis Rheum 36: 1493–500
26. Steere AC, Taylor E, McHugh GL, Logigian EL (1993) The overdiagnosis of Lyme disease. JAMA 269: 1812–1826
27. Weir PT, Harlan GA, Nkoy FL, et al. (2006) The incidence of fibromyalgia and its associated comorbidities: A population-based retrospective cohort study based on International Classification of Diseases, 9th Revision codes. J Clin Rheumatol 12: 124–128
28. Littlejohn G (2015) Neurogenic neuroinflammation in fibromyalgia and complex regional pain syndrome. Nat Rev Rheumatol 11: 639-48.
29. Wallace D, Bowman RL, Wormsley SB, Peter JB (1989) Cytokines and immune regulation in patients with fibrositis. Arthritis Rheum 32: 1334–1335
30. Gur A, Cevik R, Sarac AJ, et al. (2004) Hypothalamic-pituitary-gonadal axis and cortisol in young women with primary fibromyalgia: The potential roles of depression, fatigue, and sleep disturbance in the occurrence of hypocortisolism. Ann Rheum Dis 63: 1504–1506
31. Kadetoff D, Lampa J,Westman M, Andersson M, Kosek E (2012) Evidence of central inflammation in fibromyalgia-increased cerebrospinal fluid interleukin-8 levels. J Neuroimmunol 242: 33–38.
32. Xanthos DN, Sandkühler J. Neurogenic neuroinflammation: inflammatory reactions in response to neuronal activity. Nat Rev Neurosci 2014; 15: 43–53.
33. Littlejohn G, Guymer E (2018) Neurogenic inflammation in fibromyalgia. Sem Immunopathol 40: 291-300.
34. Üçeyler N, Zeller D, Kahn AK, Kewenig S, Kittel-Schneider S, Schmid A, Casanova-Molla J, Reiners K, Sommer C. Small fibre pathology in patients with fibromyalgia syndrome. Brain 2013; 136:1857-67.
35. Martinez-Lavin M, Hermosillo AG, Rosas M, Soto ME (1998) Circadian studies of autonomic nervous balance in patients with fibromyalgia: A heart rate variability analysis. Arthritis Rheum 41: 1966–1971
36. Cohen H, Neumann L, Shore M, et al. (2000) Autonomic dysfunction in patients with fibromyalgia: Application of power spectral analysis of heart rate variability. Semin Arthritis Rheum 29: 217–227
37. Cohen H, Buskila D, Neuman L, Ebstein RP (2002) Confirmation of an association between fibromyalgia and serotonin transporter promoter region (5-HTTLPR) polymorphism, and relationship to anxiety-related personality traits. Arthritis Rheum 46: 845–847
38. Glass JM, Lyden A, Petzke F, Clauw D (2004) The effect of brief exercise cessation on pain, fatigue, and mood symptom development in healthy, fit individuals. J Psychosom Res 57: 391–398
39. McBeth J, Chiu YH, Silman AJ, et al. (2005) Hypothalamic pituitary adrenal stress axis function and the relationship with chronic widespread pain and its antecedents. Arthritis Res Ther 7: R992–1000
40. Chrousos GP, Gold PW (1992) The concepts of stress and stress system disorders. Overview of physical and behavioral homeostasis. JAMA 267: 1244–1252
41. Arlt J, Jahn H, Kellner M, et al. (2003) Modulation of sympathetic activity by corticotropin-releasing hormone and atrial natriuretic peptide. Neuropeptides 37: 362–368
42. Riedel W, Schlapp U, Leck S, et al. (2002) Blunted ACTH and cortisol responses to systemic injection of corticotropin-releasing hormone (CRH) in fibromyalgia: Role of somatostatin and CRH-binding protein. Ann NY Acad Sci 966: 483–490
43. McLean SA, Williams DA, Stein P, et al. (2006) Cerebrospinal fluid corticotropin-releasing factor concentration is associated with pain but not fatigue symptoms in patients with fibromyalgia. Neuropsychopharmacol 31: 2776–2782
44. Dadabhoy D, Crofford LJ, Spaeth M, et al. (2008) Biology and therapy of fibromyalgia. Evidence-based biomarkers for fibromyalgia syndrome. Arthritis Res Ther 10: 211–229.
45. Moldofsky H, Scarisbrick P, England R (1975) Musculoskeletal symptoms and non-REM sleep disturbances in patients with »fibrositis syndrome” and healthy subjects. Psychosom Med 34: 341–351
46. Branco J, Atalaia A, Paiva T (1994) Sleep cycles and alpha-delta sleep in fibromyalgia syndrome. J Rheumatol 6: 1113–1117
47. Roizenblatt S, Moldofsky H, Benedito-Silva AA, Tufik S (2001) Alpha sleep characteristics in fibromyalgia. Arthritis Rheum 44: 222–230
48. Mundal I, Gråwe RW, Bjørngaard JH, Linaker OM, Fors EA (2014) Psychosocial factors and risk of chronic widespread pain: an 11-year follow-up study–the HUNT study. Pain 155: 1555-61.
49. Palagini L, Carmassi C, Conversano C, Gesi C, Bazzichi L, Giacomelli C, Dell’Osso L (2016) Transdiagnostic factors across fibromyalgia and mental disorders: sleep disturbances may play a key role. A clinical review. Clin Exp Rheumatoln34(2 Suppl 96): S140-4.
50. Nijs J , Loggia ML, Polli A, Moens M, Huysmans E, Goudman L, Meeus M, Vanderweeën L, Ickmans K, Clauw D (2017) Sleep disturbances and severe stress as glial activators: key targets for treating central sensitization in chronic pain patients? Exp Opin Therap Targ 21: 8, 817-826.
51. Clauw DJ, Crofford LJ (2003) Chronic wide-spread pain and fibromyalgia, what we know and what we need to know. Best Pract Res Clin Rheumatol 17: 685–701
52. McDermid AJ, Rollman GB, McCain GA (1996) Generalized hypervigilance in fibromyalgia: evidence of perceptual amplification. Pain 66: 133–144
53. Schweinhardt P, Sauro KM, Bushnell MC (2008) Fibromyalgia: A disorder of the brain? Neuroscientist 14: 415–421
54. Cook DB, Lange G, Ciccone DS, et al. (2004) Functional imaging of pain in patients with primary fibromyalgia. J Rheumatol 31: 364–378
55. Heinricher MM, Tavares I, Leith JL, Lumb BM (2009) Descending control of nociception: Specificity, recruitment and plasticity. Brain Res Rev 60: 214–225
56. Jensen KB, Srinivasan P, Spaeth R, Tan Y, Kosek E, Petzke F, Carville S, Fransson P, Marcus H, Williams SC, Choy E, Vitton O, Gracely R, Ingvar M, Kong J (2013) Overlapping structural and functional brain changes in patients with long-term exposure to fibromyalgia pain. Arthritis Rheum 65: 3293-303.
57. Roozendaal B, McEwen BS, Chatarij S (2009) Stress, memory and the amygdala. Nat Neurosci Rev 10: 423–433
58. Afari N, Ahumada SM, Wright LJ, Mostoufi S, Golnari G, Reis V, Cuneo JG (2014) Psychological trauma and functional somatic syndromes: A systematic review and meta-analysis. Psychosomatic Medicine 76 :2-11.
59. Imbierowicz K, Egle UT (2003) Childhood adversities in patients with fibromyalgia and somatoform pain disorder. Eur J Pain 7: 113–119
60. Van Houdenhove B, Neerinckx E, Lysens R, et al. (2001) Victimization in chronic fatigue syndrome and fibromyalgia in tertiary care: A controlled study on prevalence and characteristics. Psychosomatics 42: 21–28
61. Goldberg RT, Pachas WN, Keith D (1999) Relationship between traumatic events in childhood and chronic pain. Disabil Rehabil 21: 23–30.
62. Walker EA, Keegan D, Gardner G, et al. (1997) Psychosocial factors in fibromyalgia compared with rheumatoid arthritis: II. Sexual, physical, and emotional abuse and neglect. Psychosom Med 59: 572–577
63. Boisset-Pioro MH, Esdaile JM, Fitzcharles MA (1995) Sexual and physical abuse in women with fibromyalgia syndrome. Arthritis Rheu 38: 235–241
64. Macfarlane GJ, Norrie G, Atherton K, et al. (2009) The influence of socioeconomic status on the reporting of regional and widespread musculoskeletal pain: Results from the 1958 British Birth Cohort Study. Ann Rheum Dis 68: 1591–1595
65. Jones GT, Power C, Macfarlane GJ (2009) Adverse events in childhood and chronic widespread pain in adult life: Results from the 1958 British Birth Cohort Study. Pain 143: 92–96
66. Schanberg LE, Keefe FJ, Lefebvre JC, et al. (1998) Social context of pain in children with juvenile primary fibromyalgia syndrome: parental pain history and family environment. Clin J Pain 14: 107–115
67. Conte PM, Walco GA, Kimura Y (2003) Temperament and stress response in children with juvenile primary fibromyalgia syndrome. Arthritis Rheum 48: 2923–2930
68. Kashikar-Zuck S, Lynch AM, Graham TB, et al. (2007) Social functioning and peer relationships of adolescents with juvenile fibromyalgia syndrome. Arthritis Rheum 57: 474–480
Kardiopsychologie in der Behandlung kardiovaskulärer Erkrankungen
Der Satz in Fernando Pessoas Werk «Das Buch der Unruhe» beschreibt die Verbindung von Herz und Psyche in durchschlagender Weise. Dieser Satz vermag die Bedeutung des Symbolorgans Herz und seine Verbindung zum Gefühlsleben prägnanter zu erfassen, als diese in bildhaften alltäglichen Redensarten wie «Es hat mir das Herz gebrochen», «schweren Herzens», «mein Herz springt vor Freude» oder «er hat das Herz am richtigen Fleck» zum Ausdruck gelangt.
Das Herz bringt emotionale Zustände organisch zum Vorschein. Man hält sich die Hand bei starken Gefühlsregungen davor und nicht wenige meinen, es sei der Sitz der Seele und mit ihm deshalb tatsächlich fühlen zu können. Das Herz ist zweifelsfrei nicht einfach ein Hohlmuskel, der über Jahrzehnte wartungsfrei stündlich 7000 Liter Blut durch das Gefässsystem pumpt. Es bedeutet für viele Menschen der Ort, wo das Leben pulsiert. Entsprechend sind neben den somatischen die psychischen Auswirkungen, wenn das Herz erkrankt und in seiner vitalen Funktion beeinträchtigt ist. Seit Jahrtausenden stehen Herz und Psyche in Beziehung. Angst, Wut, Ärger, Freude und Trauer sind psychische Befindlichkeitszustände, die in unmittelbarer Verbindung mit dem Organ Herz perzeptiert und apperziert werden.
Die Kardiopsychologie umfasst verschiedenste Disziplinen wie Kardiologie, Psychiatrie, Psychologie, Psychosomatik, Soziologie, Epidemiologie, Arbeitsmedizin und Gesundheitswissenschaft. Auch die Grundlagenforschung verbindet kardiopsychologische Erkenntnisse und Fragen mit epigenetischen, endokrinologischen Phänomenen und mit der Immunologie, um beispielsweise die Aetiopathogenese der Arteriosklerose besser verstehen zu können.
Trotz vielen Publikationen und Metaanalysen, die sich mit psychischen Faktoren im Zusammenhang mit Hypertonie befassen und trotz zahlreichen Studien beispielsweise über die Verschlechterung der Prognose nach Myokardinfarkt bei depressiven Patienten, fanden bis vor wenigen Jahren deren Ergebnisse nur selten den Weg in den klinischen Alltag und in die Behandlung von kardiologischen Patienten. Die Kardiopsychologie ist jedoch die Schnittstelle zwischen Herz und Psyche und das psychologisch-psychotherapeutische Instrument bei kardiologischen Erkrankungen. Sie stellt das medizinische Angebot zu deren besseren Akzeptanz und Verarbeitung und damit zur Wiedererreichung einer guten Lebensqualität dar. Sie stärkt und fördert darüber hinaus die Therapieadhärenz und entsprechend die Genesung bei Patienten mit Herz-Kreislauferkrankungen (Kasten 1).
Psychosoziale Faktoren bei kardiologischen Erkrankungen
Neben einer familiären Belastung (Kardiogenetik), erhöhtem Cholesterin, der arteriellen Hypertonie, dem Diabetes, dem Rauchen und dem Bewegungsmangel belegen zahlreiche Studien die psychischen bzw. psychosozialen Risikofaktoren für kardiologische Erkrankungen und Eingriffe und seit 40 Jahren gibt es Untersuchungen zu deren psychischen Verarbeitung.
Es gibt zwar grosse Fortschritte in der interventionellen und medikamentösen Therapie kardiologischer Erkrankungen, die auch deren psychische Risiken zu vermindern vermochten. Doch bleiben psychische bzw. psychosoziale Einflussgrössen wie die berufliche und private Lebenssituation, sozialer Status, soziale Beziehungen und vorbestehende emotionale Befindlichkeitsstörungen wie z.B. Angst und Depression für den Krankheitsverlauf bei kardiologischen Patienten unverändert von eminenter Bedeutung. Diese erfahren heute zunehmend eine adäquate medizinisch-therapeutische Berücksichtigung bei kardiologischen Patienten.
Ein erhöhtes Stressniveau bei der Arbeit mit vitaler Erschöpfung kann die Wahrscheinlichkeit einer KHK-Entwicklung begünstigen, dies gilt ebenso für Schichtarbeit und chronische berufliche Überbelastung. Distress, der sich mit Angst oder stark anhaltendem Ärger verbindet, kann über die Aktivierung von Stresshormonen, dem Immun- und Gerinnungssystem Plaquerupturen hervorrufen und so zu einem Myokardinfarkt führen. Die genauen Mechanismen dafür sind bis heute jedoch noch nicht geklärt.
Umgekehrt treten nach einem Myokardinfarkt Angst und Depression als Belastungsreaktionen gehäuft auf. Bis zu 40 Prozent der Patienten leiden nach einem Infarkt an einer depressiven Verstimmung, 20 bis 40 Prozent an einer Angstsymptomatik, 12 Prozent an einer PTBS (posttraumatischer Belastungsstörung). 55 Prozent der Bypass-Patienten zeigen klinisch relevante Angst vor dem Eingriff, 32 Prozent noch 3 Monate danach. Wiederum erhöhen Angst und Depression das 5-Jahres-Risiko für kardiovaskuläre Ereignisse nach Bypass-Operationen, führen bei Infarktpatienten zu einem erhöhten Mortalitätsrisiko und bei CHF (chronic heart failure) zu einer erhöhten Rehospitalisationsrate.
Patienten mit ausgeprägterem Schweregrad eines CHF zeigen eine stärkere depressive Symptomatik und deren Lebensqualität ist entsprechend reduziert. Während akute Belastungsreaktionen innert der ersten Tage nach Bypass-Interventionen auftreten, entwickelt sich eine PTBS im Verlauf von Wochen oder Monaten. Beides erhöht die Mortalitätsrate und das Risiko einer Reinfarzierung. Auch Delirien nach Bypass-Operationen sind nicht selten. Ältere Patienten mit dementieller Entwicklung und/oder vorbestehender psychischer Symptomatik sind hier besonders gefährdet.
Primärpersönlichkeit und psychosoziale Faktoren haben Einfluss auf die Krankheitsentwicklung bei herztransplantierten Patienten, Patienten mit Schrittmacher bzw. Pacemaker und bei Patienten mit Herzrhythmusstörungen sowie mit arterieller Hypertonie. Eine Wechselwirkung zwischen Affekt und elektrophysiologischen Abläufen sind bekannt, stark negative, aber auch ausgeprägt positive Gefühle vermögen Herzrhythmusstörungen auszulösen. Patienten, die medizinische Interventionen traumatisch erlebt haben, zeigen vermehrt Angst und Depression, was die Krankheitsbewältigung erschwert.
Schlechter Schlaf und anhaltend erhöhter Arbeitsstress sind Prädiktoren bei der Entstehung einer arteriellen Hypertonie, im Gegenzug bestehen bei Patienten mit erhöhtem Blutdruck öfters depressive Vorerkrankung oder eine Angststörung. Dies gilt auch für das Broken-Heart-Syndrom. Patienten mit angeborenen Herzvitien sind gefährdeter im Hinblick auf die Entstehung von psychischen Störungen. So zeigen über 30 Prozent dieser Patienten aufgrund der hier einwirkenden Stressfaktoren wie geringere Lebenserwartung und überdauernd geforderter Adaptation an die eingeschränkten und verunsichernden Lebensverhältnisse eine klinisch relevante Psychopathologie. Unter den somatoformen autonomen Störungen sind Patienten mit Symptomen des kardiovaskulären Systems besonders häufig. Psychische Belastungsfaktoren und schwierige Lebensumstände können, müssen jedoch nicht vorhanden sein, sodass die Diagnosestellung hier erschwert sein kann. Solche Patienten sind nicht durch die Aussage «Sie haben nichts» oder durch die Zuteilung zum supranasal beeinträchtigten Patientenstamm zu beruhigen, geschweige denn zu heilen. Diese Patienten bedürfen meist einer intensiven ärztlichen Langzeitbegleitung, die die Geduld und Motivationskonstanz der Behandler erfordert.
Kardiopsychologische Kompetenz und Behandlung
Um kardiologische Patienten über die rein somatische Behandlung hinaus adäquat zu therapieren, ist psychologisch-psychosoziale und psychosomatische Kompetenz Voraussetzung. Die spezifische, umfassende Anamnese und eine authentisch-professionelle Kommunikation des Behandlers mit dem Patienten geht damit einher. Unverändert ist es aber auch die insuffiziente Vergütung für ausführliche Gespräche, die bei Ärzten eine Bereitschaft, sich mit den relevanten psychosozialen Faktoren im Zusammenhang mit kardiologischen Erkrankungen auseinanderzusetzen, nicht begünstigen. Fragen nach der psychischen Befindlichkeit führen bei den Patienten oft zu erweiterten Schilderungen von Beschwerden und Lebensumständen, was die Logistik und die zeitlichen Abläufe im medizinischen Betrieb bald stört und deshalb möglichst abgewendet werden muss. Ausführlicheres Fragen zu den Lebensumständen und psychosozialen Belastungen und betreffend mögliche Ängste und depressive Phasen bedeuten immer einen höheren Zeitaufwand. Solche Informationen über die Einwirkungsmechanismen von psychischen und psychosozialen Faktoren sind jedoch von hohem Wert und Nutzen, um bei einer bedeutsamen Anzahl von kardiologischen Patienten den Therapie-Outcome und damit die Gesundheitsprognose verbessern zu können. Auch in der ärztlichen Kunst gilt, dass wir nur erkennen, was wir vorwegnehmen. Eine patientenorientierte, umfassende Gesprächsführung in der medizinisch-kardiopsychologisch ausgerichteten Behandlung berücksichtigt die heutigen Erkenntnisse der Zusammenhänge von kardiologischen Erkrankungen und psychischer Befindlichkeit. Das immer wieder so betont wichtige, vertrauensvolle Arzt-Patientenverhältnis führt sodann zu einer stärkeren Therapieadhärenz und damit zu günstigerem bzw. komplikationsfreierem Krankheitsverlauf.
Patienten profitieren von einer kardiopsychologischen Intervention nicht nur während der Rehabilitation durch eine kognitiv-verhaltenstherapeutische bzw. systemisch-lösungsorientierte Behandlung bei negativen Erlebens-, Reaktions- und Verhaltensbereitschaften. Auch in der Akutphase ist die Berücksichtigung von psychischen, psychosomatischen und psychosozialen Faktoren von erheblicher Tragweite für die Genesung. Hierfür ist kardiopsychologische Kompetenz Voraussetzung, die sich mit kardiologischer Kompetenz zu jedem Zeitpunkt einer kardiologischen Erkrankung interdisziplinär verbindet. Bei Akutpatienten, z.B. nach Myokardinfarkt, kann eine frühe medizinisch-psychotherapeutische Intervention in Form eines Konsiliums oder einer Kurzzeitbehandlung erfolgen. Die oft vorhandenen Ängste (oft auch Todesangst) werden rechtzeitig und gezielt angegangen, eine depressive Symptomatik anbehandelt, dysfunktionale Krankheitskonstrukte korrigiert, Stressreduktion erzielt und situationsgerechtes, krankheitsbezogenes Wissen beim Patienten geschaffen.
Die Kombination von Kardiologie, medizinisch-psychotherapeutischen Gesprächen und bei Bedarf Antidepressiva zeigen laut neuesten Studien z.B. bei depressiven Patienten mit KHK einen deutlich begünstigenden Effekt auf den Krankheitsverlauf und damit auf die Gesundheitsprognose. Als mögliches antidepressives und längerfristig auch angstreduzierendes Medikament kann als Vertreter der SSRI-Gruppe Sertralin zur Anwendung gelangen. Bei Kombination mit Thrombozytenaggregationshemmern besteht jedoch die Möglichkeit einer erhöhten Blutungsneigung. Andere SSRI präsentieren sich vom Nebenwirkungsprofil her weniger günstig (Hypokaliämie, QT-Verlängerung, Tachykardien, Hyper-/Hypotonie). Tetrazyklika können eine Steigerung des Appetits hervorrufen, Trizyklika haben einen anticholinergen und adrenolytischen Effekt.
Neben der Kardiologie ist die Hausarztmedizin in der Betreuung und Behandlung von kardiologischen Patienten immer mehr involviert (kürzere Hospitalisationsdauer, Altersstruktur, Multimorbidität, Lebensstil) und somit zunehmend bedeutsam. Da kardiologische Patienten oft chronische Patienten werden, ist es in deren langjähriger Begleitung gerade der Hausarzt, der die psychosozialen Einflussgrössen erfragen, ansprechen und die notwendigen sekundärpräventiven Massnahmen koordinieren und die Überweisung zu kardiopsychologisch ausgebildeten Fachärzten oder Psychologen vorschlagen kann.
Copyright bei Aerzteverlag medinfo AG
Zentrum für Psychiatrie und
Psychotherapie rechter Zürichsee Küsnacht
Dorfstrasse 5
8700 Küsnacht
Der Autor deklariert, in Zusammenhang mit diesem Artikel keine Interessenskonflikte zu haben.
beim Verfasser
Genitourinary syndrome of the menopause (GSM)
Rund 50% aller Frauen in der Peri- und Postmenopause haben Symptome des «Genitourinary syndrome of the menopause» (GSM). Dieses Syndrom umfasst, ergänzend zur vulvovaginalen Atrophie (VVA), zusätzlich die durch absinkende Hormonspiegel entstehenden Symptome der ableitenden Harnwege. Die Lebensqualität der betroffenen Frauen kann als Folge der Gewebeveränderungen stark eingeschränkt sein. Ziel dieser Übersicht ist die Darstellung der aktuellen Therapiemöglichkeiten und deren stufenweiser Einsatz.
Zu den typischen Symptomen des GSM gehören genitale Trockenheit, Dyspareunie, Irritation des Gewebes, Brennen und Juckreiz an der Vulva und Vagina sowie Dysurie, vermehrter Harndrang und Urge-Symptomatik. Die gängigen Behandlungsmethoden sind nur bei einem Teil der Patientinnen erfolgreich. Daher hat die Entwicklung neuer Methoden eine besondere Bedeutung.
Terminologie: VVA und GSM
Das «Genitourinary syndrome of the menopause» (GSM) ist ein Komplex von Symptomen der Vulva, der Vagina und der ableitenden Harnwege, welche bei postmenopausalen Frauen auftritt (1). Der neue Begriff wurde 2014 eingeführt. Die neue Terminologie GSM beinhaltet alle urogenitalen Symptome, die in der Menopause durch den Hormonabfall hervorgerufen werden können und sich an den Labien, am Introitus, an der Vagina, der Urethra und der Blase manifestieren. Ergänzend zu den Symptomen der VVA sind Belastungsinkontinenz, Dranginkontinenz und Bakteriurie typische Symptome des GSM. Sowohl die VVA als auch das GSM sind häufig unterdiagnostiziert und auch untertherapiert. Deshalb soll im ärztlichen Gespräch gezielt nach Beschwerden des GSM gefragt werden, zumal diese von vielen Frauen nicht offen kommuniziert werden (2).
Veränderungen des Gewebes und Konzepte zur Behandlung
Infolge der menopausal absinkenden Östrogenspiegel entwickelt sich eine progrediente, chronische Involution des vaginalen Gewebes. Die daraus entstehenden Symptome sind Ausdruck der morphologischen und funktionellen Veränderungen. Die Haut der Vagina wird dünner und weniger elastisch. Die Vagina wird insgesamt enger und kürzer. Die Oberfläche der Vagina erscheint trocken und es können Blutungen nach minimalem Trauma entstehen. Die Vulva wird atrophisch und leichter vulnerabel, insbesondere im Bereich der Klitoris. Die Atrophie der Vagina kann mit der Zeit zunehmen und die Lebensqualität deutlich negativ beeinflussen. Etwa 50 % der postmenopausalen Frauen entwickeln eine VVA (3). Da die Lebenserwartung immer mehr zunimmt, können die Beschwerden für die Dauer von mehr als einem Drittel der Lebenszeit bestehen.
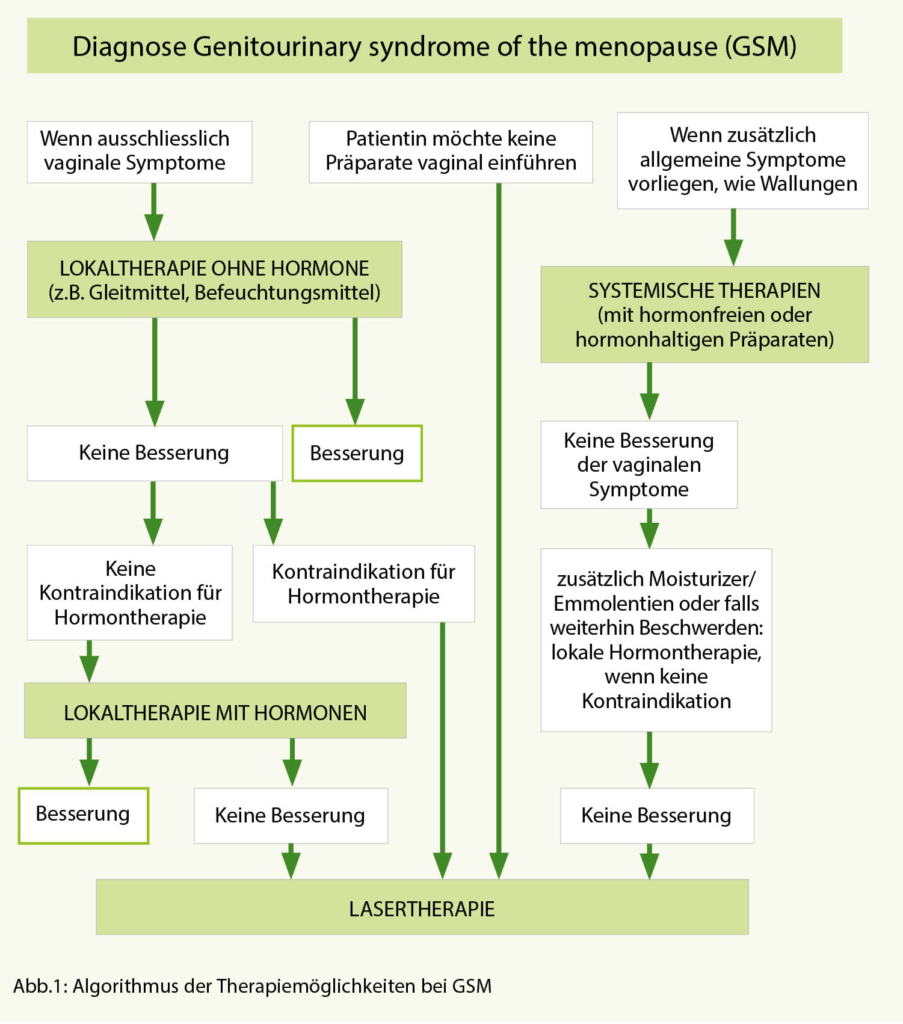
Zur Behandlung der Symptome der VVA werden meist folgende lokale Behandlungsoptionen genutzt (Abb. 1):
a) hormonfreie Produkte zur Lokaltherapie in Form von Gleitmitteln oder Befeuchtungsmitteln
b) lokale Hormontherapie.
Als weiteres Konzept etabliert sich momentan zunehmend die Lasertherapie der Vagina und der Vulva. Mit DHEA gibt es zudem ein neues, weiteres Konzept zur lokalen Behandlung.
Gleitmittel und Befeuchtungsmittel
Internationalen Leitlinien entsprechend sind Gleitmittel und Befeuchtungsmittel die Therapie der ersten Wahl zur Therapie der VVA. Der Hauptunterschied zwischen vaginalen Gleitmitteln und Befeuchtungsmitteln ist der Zeitpunkt der Anwendung.
Vaginale Gleitmittel sind indiziert bei Frauen, deren Hauptsorge die vaginale Trockenheit beim Geschlechtsverkehr ist. Gleitmittel können die Trockenheit kurzfristig lindern und die Dyspareunie lindern. Vaginale Befeuchtungsmittel sind nicht-lösliche hydrophile Polymere mit der Eigenschaft der Bioadhäsivität. Sie können häufiger verwendet werden als allein in Zusammenhang mit sexueller Aktivität, sind länger wirksam, verbessern die Feuchtigkeit der Vaginalhaut und reduzieren den pH-Wert.
Die initiale Dosierung besteht in der lokalen Anwendung am Abend, vor dem Schlafengehen, an 7 bis 10 aufeinanderfolgenden Tagen. Anschliessend erfolgt meist eine Erhaltungstherapie durch zwei Applikationen pro Woche. Die am häufigsten verwendeten Befeuchtungsmittel basieren auf Hyaluronsäure. Bei bestimmungsgemässer Anwendung können die auf Hyaluronsäure basierenden Produkte die Symptome der vaginalen Trockenheit lindern.
Hormonelle Behandlungen
Internationale Leitlinien empfehlen zur Behandlung der VVA, einschliesslich Dyspareunie, die lokale Hormontherapie als zweiten Schritt für den Fall, dass vaginal applizierte Gleit- und Befeuchtungsmittel nicht die gewünschte Wirkung haben (4).
Für die lokale Therapie stehen Estriol und Estradiol zur Verfügung, die Applikation erfolgt in Form von Gels, Cremes, Ovula, Tabletten, oder Ringen. Vaginal applizierte Estrogene zeigten sich in Studien mit 6- bis 12-monatiger Dauer wirksamer als Gleit- und Befeuchtungsmittel.
Die häufigste Empfehlung zur Dosierung ist die tägliche einmalige Applikation vaginal für die Dauer von 2 Wochen und anschliessend eine Erhaltungstherapie durch die Anwendung zweimal pro Woche (5).
Bei Anwendung in niedriger Dosierung innerhalb der Empfehlung für das verwendete Präparat ist es nicht erforderlich, zusätzlich ein Progesteronpräparat zur Endometriumprotektion einzusetzen. In grossen Observationsstudien zeigte sich kein erhöhtes Risiko für ein Endometriumkarzinom bei Frauen, die Estrogene vaginal verwendeten.
Bei erhöhtem Risiko für ein Endometriumkarzinom oder bei höher dosierter vaginaler Oestrogengabe werden Kontrollen mittels Transvaginalsonographie oder der intermittierende Einsatz von Progesteron empfohlen. Vaginale Blutungen oder Spotting bei postmenopausalen Frauen unter lokaler Hormontherapie müssen unbedingt abgeklärt werden mit Ultraschall und/oder einer Histologie. Ein bestehendes oder früheres Mammakarzinom bzw. entsprechender Verdacht gelten als Kontraindikation. 12-13% der Frauen zeigen trotz lokaler Hormontherapie weiterhin Beschwerden eines GSM.
DHEA
Die Wirksamkeit von DHEA (Dehydroepiandrosteron) als Lokaltherapie ist durch mehrere Studien belegt, unter anderem durch eine prospektive randomisierte Placebo-kontrollierte Phase III-Studie (9). DHEA führt nicht zu Veränderungen am Endometrium, weder sonographisch noch histologisch. DHEA führt nicht zur Erhöhung der Estrogenspiegel. Jedoch ist auch DHEA für Frauen mit Mammakarzinom kontraindiziert. DHEA ist in der Schweiz zur Lokalbehandlung seit September 2020 zugelassen.
Vaginale Lasertherapie
Die Lasertherapie ist ein neues Konzept bei Patientinnen mit VVA, sie hat eine wachsende Akzeptanz und Verbreitung. Der grundsätzliche Mechanismus des Lasereffekts basiert auf der Bildung supraphysiologischer Hitze mit nachfolgender lokaler Hitzeschockreaktion. Zur vaginalen Lasertherapie wurden verschiedene Systeme eingesetzt. Die meisten wissenschaftlichen Daten basieren auf der CO2-Lasertechnologie. Dieser Laser besteht aus infraroten Strahlen, die Hitze erzeugen und das Wasser in den Zellen des behandelten Gewebes vaporisieren.
Die CO2-Lasertechnologie wird in der vaginalen Therapie eingesetzt, um eine Regeneration mit minimalem Aufwand zu erreichen. So werden die Elastizität und die Hydratation der Vaginalwand verbessert, was zu einer Linderung der Beschwerden führt.
Das fraktionierte Lasersystem kann in tieferen Schichten der Haut der Vagina wirken und sowohl die extrazelluläre Matrix reaktivieren als auch die Bildung von Kollagen, was zu Veränderungen des vaginalen Gewebes führt, mit nur minimalem Trauma der oberflächlichen Schicht.
Studienergebnisse zur vaginalen Lasertherapie
Salvatore et al. veröffentlichten eine Studie zur Behandlung der VVA bei postmenopausalen Frauen (6). Die Linderung der Symptome der vaginalen Trockenheit, des vaginalen Brennens und des vaginalen Juckens, der Dyspareunie und der Dysurie war statistisch signifikant (p< 0,001).
Weitere Studien zeigten ebenfalls positive Ergebnisse zur Praktikabilität und Wirksamkeit. Dies konnte durch eigene Resultate mit dem für diese Indikation zugelassenen CO2-Laser MonaLisa Touch (Fa. Lasermed AG, Roggwil) bestätigt werden (7).
Aktuell wurde die grösste Studie zur Wirksamkeit der CO2-Lasertherapie bei VVA veröffentlicht, eine Multicenterstudie mit den Daten von 645 Patientinnen. Bei allen Patientinnen fand sich nach der Laserapplikation im Vergleich zu der Situation vor der Therapie eine signifikante Verbesserung der Symptome Dyspareunie, Schmerzen im Introitus vaginae, vaginale Trockenheit, Jucken, Brennen und pH-Wert-Veränderung bei gleichzeitig guter Toleranz der Behandlung (8).
Randomisierte kontrollierte Studien mit Langzeitdaten zur Sicherheit und Wirksamkeit der Lasertherapie liegen noch nicht vor und dementsprechend machte die amerikanische FDA 2018 darauf aufmerksam, dass die Lasertherapie des GSM nicht freigegeben oder genehmigt sei (11). Dieser Hinweis war wichtig, um einer Ausweitung von Indikationen jenseits der Zulassung entgegenzuwirken. Jedoch ist er nicht sehr präzise – es gibt unterschiedliche Lasergeräte mit unterschiedlicher FDA-Zulassung. Heute wird die Warnung aufgrund von Sicherheitsdaten als fraglich begründet diskutiert (12).
Praktische Aspekte der Lasertherapie
Die Laserbehandlung wird gut toleriert. Nebenwirkungen sind selten. Die meisten Patienten erleben die vaginale Anwendung nicht als schmerzhaft. Es ist keine Vorbehandlung und keine Nachbehandlung erforderlich. Zumeist werden 3 Lasertherapien im Abstand von 4 Wochen durchgeführt, gefolgt von einer Auffrischung nach Ablauf eines Jahres in Form von einer Sitzung.
Die Lasertherapie der Vulva wird im Vergleich zu vaginaler Lasertherapie mit einem anderen Applikator durchgeführt. Um auch die Lasertherapie der Vulva schmerzfrei durchführen zu können hat sich die Vorbehandlung mit Emla® Creme 5% unmittelbar vor der Laserbehandlung bewährt. Die Lasertherapie ist aktuell noch keine Pflichtleistung der Krankenkassen, dies muss den Patientinnen unbedingt mitgeteilt werden.
Zum Schluss sei erwähnt, dass weitere nichtpharmakologische Therapieoptionen zur Verfügung stehen, wie insbesondere Sexualtherapie und Becken-Bodentherapie, welche gemäss amerikanischer Konsensusempfehlungen bei durch GSM verursachten sexuellen Beschwerden zum Einsatz kommen können (10).
Copyright bei Aerzteverlag medinfo AG
Spezialarzt Gynäkologie und Geburtshilfe FMH
Praxis am Bahnhof Rüti
Dorfstrasse 43, 8630 Rüti
meden@praxisambahnhof.ch
Der Autor hat deklariert, dass in Zusammenhang mit diesem Artikel keine Interessenskonflikte bestehen.
1. Portman DJ et al.: Genitourinary syndrome of menopause: new terminology for vulvovaginal atrophy from the International Society for the Study of Women’s Sexual Health and the North American Menopause Society. J Sex Med. 2014 Dec;11(12):2865-72.
2. Kingsberg S, Wysocki S, Magnus L, Krychman M. J. Sex Med. 2013 Jul;10(7) 1790-9
3. Nappi RE, Kokot-Kierepa M. Women’s voices in the menopause: results from an international survey on vaginal atrophy. Maturitas 2010;67:233–8.
4. The NAMS 2017 Hormone Therapy Position Statement Advisory Panel. The 2017 hormone therapy position statement of the North American Menopause Society. Menopause 2017, 24, 728–753
5. Salwowska, NM et al.: Physiochemical properties and application of hyaluronic acid: A systematic review. J. Cosmet. Dermatol. 2016, 15, 520–526
6. Salvatore S et al.: A 12-week treatment with fractional CO2 laser for vulvovaginal atrophy: a pilot study. Climacteric 2014;17:363–9.
7. Meden H, Zeller C.: Vulvovaginale Atrophie (VVA): CO2-Lasertherapie als neues Konzept. In: Rabe T (Hrsg.). Seminar in Gynäkologischer Endokrinologie – Band 6: Update, Trends & Fallberichte. Ein Praxisleitfaden, Baier Digitaldruck Heidelberg 2017, S. 300-304, ISBN 978-3-00-053173-6.
8. Filippini M et al.: Efficacy of fractional CO2 laser treatment in postmenopausal women with genitourinary syndrome: a multicenter study. Menopause. 2020 Jan;27(1):43-49.
9. Labrie, F et al. Efficacy of intravaginal dehydroepiandrosterone (DHEA) on moderate to severe dyspareunia and vaginal dryness, symptoms of vulvovaginal atrophy, and of the genitourinary syndrome of menopause. Menopause 2018, 25, 1339–1353
10. Faubion St. S et al: Consensus Recommendations: Management of genitourinary syndrome of menopause in women with or at high risk for breast cancer: consensus recommendations from The North American Menopause Society and The International Society for the Study of Women’s Sexual Health. Menopause: June 2018;25:596-608
11. https://www.fda.gov/medical-devices/safety-communications/fda-warns-against-use-energy-based-devices-perform-vaginal-rejuvenation-or-vaginal-cosmetic.
12. Guo J. et al.: Vaginal laser treatment of genitourinary syndrome of menopause: does the evidence support the FDA safety communication? Menopause 2020;27: 1177-1184
Einmal Vorhofflimmern, immer Vorhofflimmern

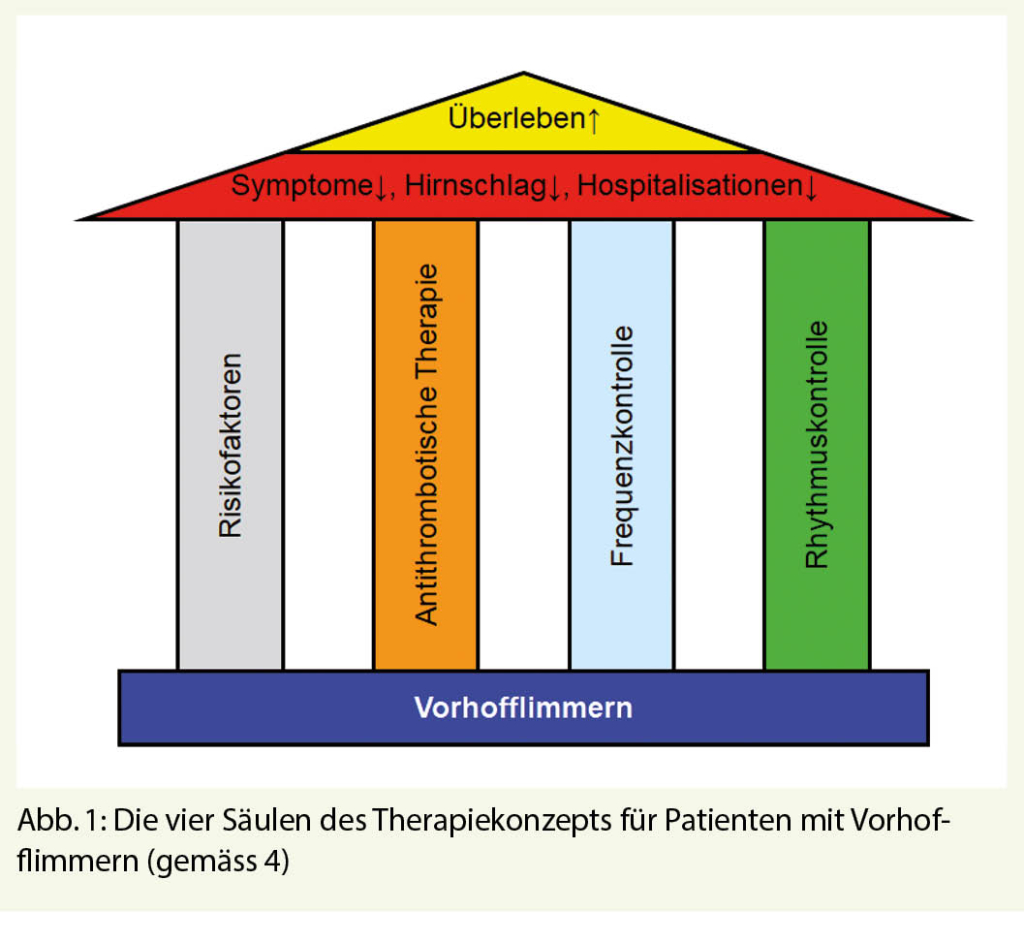
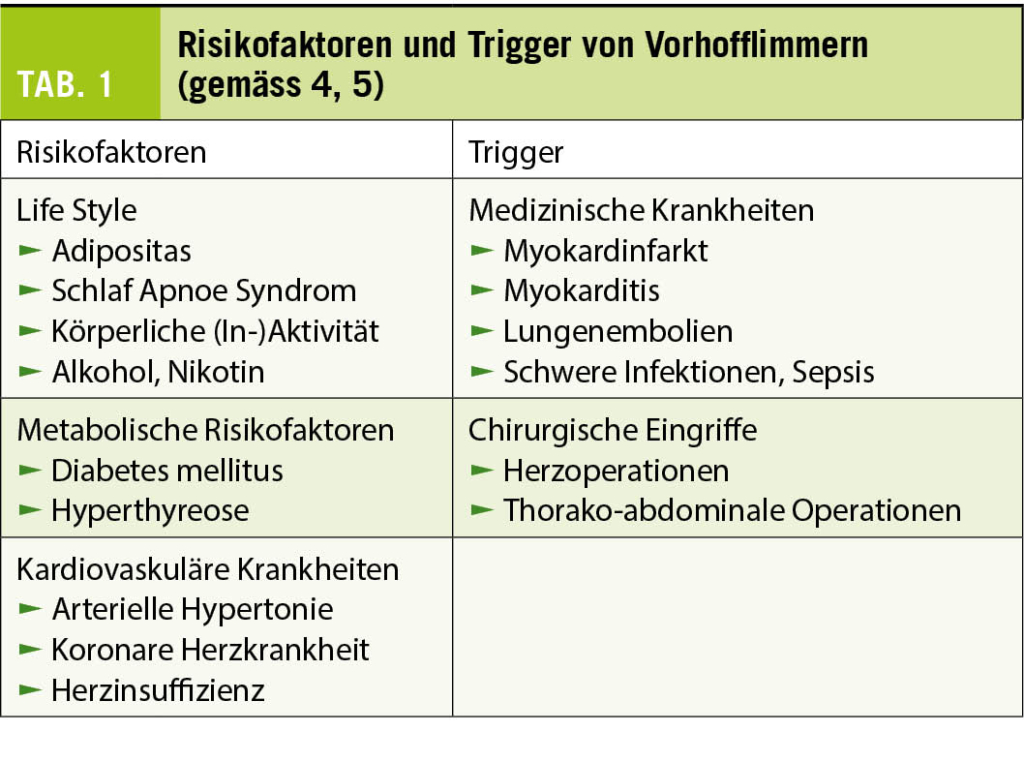
Vorhofflimmern ist die häufigste anhaltende Herzrhythmusstörung und mit einer erhöhten Mortalität und Morbidität assoziiert. Die Prävalenz dieser Rhythmusstörung nimmt im Alter stark zu. Die wichtigsten Risikofaktoren und Trigger für das Auftreten von Vorhofflimmern sind in Tabelle 1 zusammengefasst. Die Behandlung von Patienten mit Vorhofflimmern basiert auf vier Säulen (Abb. 1) (1 - 4). Die Massnahmen zur Reduktion der Risikofaktoren wie Adipositas und Bewegungsmangel haben nicht nur einen günstigen Einfluss auf das Auftreten und die Progression des Vorhofflimmerns (4), sondern auch auf viele andere kardiovaskuläre Krankheiten. Bei der Frequenz- und Rhythmuskontrolle handelt es sich primär um symptomatische Behandlungen, deren Timing und Intensität durch die Anfallshäufigkeit und Symptomatik des Vorhofflimmerns bestimmt wird. Nach einer ersten Episode eines symptomatischen Vorhofflimmerns kann man darum in ausgewählten Fällen mit dem Beginn der Behandlung bis zum Rezidiv zuwarten, ohne dass man dadurch die Prognose des Patienten beeinträchtigt (1).
Anders sieht es bei der Thromboembolieprophylaxe aus. Hier gibt es mit der Antikoagulation eine Therapie, die nicht nur die Morbidität, sondern auch die Mortalität verbessert und dies unabhängig davon, ob der Patient ein paroxysmales oder persistierendes Vorhofflimmern hat. So beträgt die relative Risikoreduktion für einen ischämischen Hirnschlag etwa 66% und für die Gesamtmortalität etwa 25%. Dies bei einem Risiko für relevante Blutungen unter der Behandlung von ca. 3% pro Jahr (1). Aus diesem Grund stellt sich schon bei der ersten EKG dokumentierten Episode eines Vorhofflimmerns die Frage: Profitiert dieser Patient von einer langfristigen Antikoagulation?
Indikation für die Antikoagulation bei Vorhofflimmern
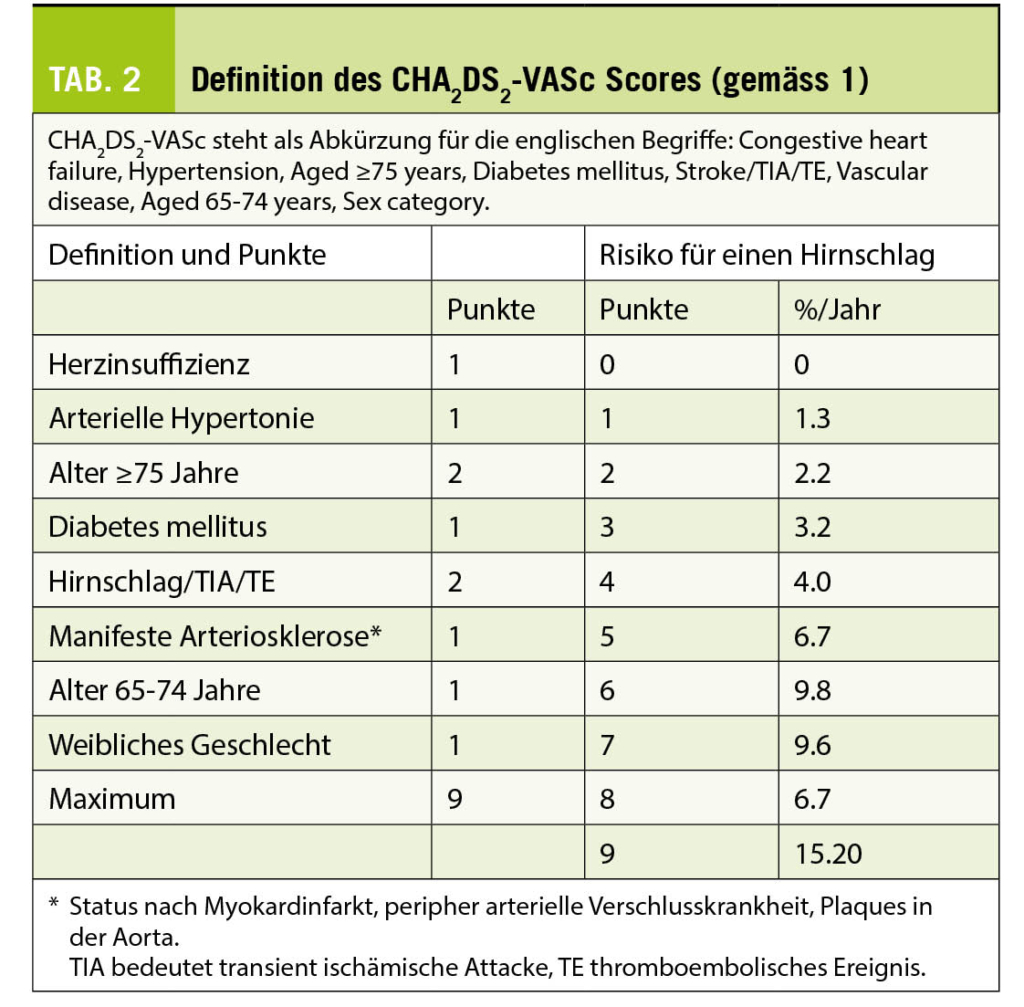
In den aktuellen Richtlinien findet man als Entscheidungshilfe für die Indikation zur Antikoagulation bei Patienten mit Vorhofflimmern den CHA2DS2-VASc Score (Tab. 2) (1). So wird für Männer mit ≥1 und für Frauen mit ≥2 Punkten der Einsatz einer oralen Antikoagulation empfohlen. Die klinische Präsentation des Vorhofflimmerns, Erstdiagnose, paroxysmales, persistierendes oder permanentes Vorhofflimmern, wird dagegen nicht für die Indikationsstellung berücksichtigt.
Anhand der drei eingangs beschriebenen Patientenbeispiele werden in den nächsten Abschnitten die Argumente für diese Empfehlungen diskutiert.
Patienten mit primärem Vorhofflimmern
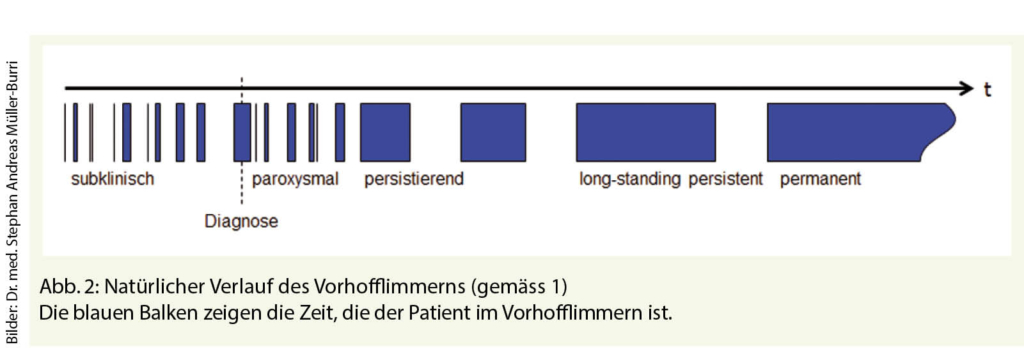
Wie beim Patienten A tritt das Vorhofflimmern in den meisten Fällen bei Patienten mit prädisponierenden Risikofaktoren, aber ohne erkennbaren Trigger auf. Gewisse Autoren sprechen von primärem Vorhofflimmern. Da es sich beim Alter und den anderen Risikofaktoren um irreversible oder chronische Gesundheitsprobleme handelt, zeigt auch das Vorhofflimmern einen chronisch progredienten Verlauf (Abb. 2) (1). Dementsprechend begann das Vorhofflimmern oft schon vor der ersten im EKG dokumentierte Episode und das Auftreten des nächsten Rezidivs ist nur eine Frage der Zeit. Basierend auf klinischen Daten (6), die bezüglich des thromboembolischen Risikos keinen Unterschied zwischen den verschiedenen Stadien des Vorhofflimmerns nachweisen konnten, empfehlen die Guidelines beim Patienten A zum Zeitpunkt der Diagnosestellung die Indikation für eine Antikoagulation zu beurteilen (1).
Patienten mit sekundärem Vorhofflimmern
Bei der Patientin B wurde das Vorhofflimmern erstmals im Rahmen einer akuten Infektion dokumentiert. Man spricht in diesem Fall von einem sekundärem Vorhofflimmern oder neu von Atrial Fibrillation Occuring Transiently with Stress (AFOTS)(7). Da die in Tabelle 1 aufgeführten Trigger oft reversibel oder nur passager vorhanden sind, stellt sich die Frage, ob das Vorhofflimmern im weiteren Verlauf wieder auftreten wird und darum, wie primäres Vorhofflimmern, langfristig behandelt werden muss?
Bis jetzt gibt es zu dieser Form des Vorhofflimmerns nur wenig klinische Daten und in den aktuellen Richtlinien findet diese im Alltag häufige Form des Vorhofflimmerns keine Erwähnung (1- 4, 8). Nur für Patienten mit Vorhofflimmern nach einer Herzoperation wird eine Antikoagulation unter Abwägung von Nutzen und Risiken empfohlen (1).
In der Framingham Population hatten von den Patienten mit sekundärem Vorhofflimmern 42% nach 5 Jahren ein Rezidiv der Rhythmusstörung. Im Vergleich dazu lag die Rezidivrate bei Patienten mit primärem Vorhofflimmern nur wenig höher bei 59% (9). Auch bei den Risikofaktoren unterscheiden sich Patienten mit sekundärem Vorhofflimmern kaum von Patienten mit primärem Vorhofflimmern (9 - 12). Das Auftreten von Vorhofflimmern im Rahmen einer akuten Erkrankung oder einer Operation ist in der Regel mit einer kurz- und langfristig erhöhten Morbidität und Mortalität assoziiert. Es gibt aber noch keine klinischen Daten aus Interventionsstudien, die zeigen, ob und wie man diese Risiken durch therapeutische Massnahmen günstig beeinflussen kann (7, 13). Im Alltag wird man sich darum bei diesen Patienten entweder für ein engmaschiges ambulantes EKG Monitoring zur Dokumentation eines Rezidivs des Vorhofflimmerns oder direkt für eine Antikoagulation gemäss CHA2DS2-VASc Score entscheiden.
Patienten nach erfolgreicher Katheterablation des Vorhofflimmerns
Die Katheterablation mit Isolation der Lungenvenen ist heute die effektivste Behandlung zur Rhythmuskontrolle bei Patienten mit Vorhofflimmern (1 - 4, 16). Je nach Patientenpopulation, Behandlungs- und Monitoringtechnik sind 1 Jahr nach einer solchen Behandlung 50-85% der Patienten frei von einem Rezidiv des Vorhofflimmerns (14, 15). Gleichzeitig bringt die Katheterablation eine Reduktion der Zeit im Vorhofflimmern, dem sogenannten Vorhofflimmerburden, um >90%. Im Langzeitverlauf sind nach 5 Jahren und wenn nötig mehreren Katheterablationen zwischen 63% und 82% der Patienten in einem stabilen Sinusrhythmus (17 - 21).
Aus Studien mit Antiarrhythmika weiss man, dass das Risiko für thromboembolische Ereignisse nicht durch die Behandlungsstrategie, Rhythmus- oder Frequenzkontrolle, beeinflusst wird (22). Die aktuellen Richtlinien (1, 16) empfehlen darum für den Patienten C nach Abheilen der durch die Ablationen im linken Vorhof entstandenen Endothelläsionen, d.h. nach ≥ 2 Monaten, nur anhand des CHA2DS2-VASc Score und unabhängig vom Erfolg der Katheterablation über die Fortsetzung der Antikoagulation zu entscheiden.
Es gibt allerdings Hinweise, dass Patienten nach einer erfolgreichen Katheterablation des Vorhofflimmerns ein geringeres Risiko für thromboembolische Ereignisse haben als unbehandelte Patienten. In einer Metaanalyse mit > 25 000 Patienten zeigte sich, dass die langfristige Antikoagulation im Vergleich zum Stoppen der Antikoagulation nach der Katheterablation nur mit einer Zunahme der Blutungskomplikationen, nicht aber mit einer Reduktion der thromboembolischen Ereignisse assoziiert war (23). Zurzeit laufen zwei randomisierte Studien, die untersuchen, unter welchen Umständen nach einer Katheterablation des Vorhofflimmerns die Antikoagulation gestoppt werden kann. Bis zur Publikation dieser Daten dürfte sich die Mehrheit der Elektrophysiologen weiter an den aktuellen Empfehlungen orientieren und die Antikoagulation bei einem CHA2DS2-VASc Score ≥ 2 für Männer und ≥3 für Frauen nur in Ausnahmefällen absetzen (1, 16).
Copyright bei Aerzteverlag medinfo AG
Klinik für Kardiologie, Stadtspital Triemli
Birmensdorferstrasse 497
8063 Zürich
andreas.mueller@triemli.zuerich.ch
Der Autor hat in Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert. Unabhängig davon haben der Autor und seine Institution für Aus- und Weiterbildung finanzielle Unterstützung von Biotronik, Boston Scientific, Medtronic, Abbott und Biosense Webster, Vortragshonorare von Biosense Webster, Medtronic, Abbott, AstraZeneca, Daiichi Sankyo, Biotronik und MicroPort erhalten sowie Consultant- und Proktoring-Honorare von Biosense Webster, Medtronic und Abbott.
1. Kirchhof P, Benussi S, et al. 2016 ESC guidelines for the management of atrial fibrillation. EHJ 2016;37:2893-962.
2. Craig TJ, et al. 2014 AHA/ACC/HRS Guidelines for the management of patients with atrial fibrillation. JACC 2014;64:e1-76.
3. January CT, et al. 2019 AHA/ACC/HRS Focused Update of the 2014 AHA/ ACC/HRS Guideline for the Management of Patients With Atrial Fibrillation. Circulation 2019;140:e125-e151.
4. Chung MK, et al. Circulation 2020;141. DOI: 10.1161/CIR.0000000000000748.
5. Savelieva I and Camm J. Clin Cardiol 2008;31:55-62.
6. Friberg L. et al. EHJ 2010;31:967-75.
7. McIntyre WF, Healey J. JAFIB 2017;9:1475.
8. Ibanez B, et al. EHJ 2018;39:119-77.
9. Lubitz SA, et al. Circulation 2015;131:1648-55.
10. Kosmidou I, et al. JACC 2018;71:739-48.
11. Guenancia C, et al. Europace 2018;20:e179-88.
12. McIntyre WF, et al. EHJ: Acute Cardiovascular Care 2019;8:130-41.
13. Rath B, et al. Herzschr Elektrophys 2019;30:256-61.
14. Duytschaever M, et al. Heart Rhythm 2019, doi.org/10.1016/j.hrthm.2019.11.004.
15. Andrade JG, et al. Circulation 2019;140:1779-88.
16. Calkins H, et al. Europace 2018;20:e1-e160.
17. Ouyang F, et al. Circulation 2010;122:2368-77.
18. Weerasooriya R, et al. JACC 2011;57:160-6.
19. Scherr D, et al. Circ Arrhythm Electrophiol 2015;8:18-24.
20. Nielsen JC, et al. Heart 2017;103:368-76.
21. Saguner AM, et al. Europace 2018;20:58-64.
22. Wyse DG, et al. NEJM 2002;347:1825-33.
23. Proietti R, et al. J Cardiovasc Electrophysiol 2019;30:468-78.