Der Veganismus erfährt zunehmende Aufmerksamkeit in den Medien, da er als Lebensstil weit über eine gesundheitsfördernde, rein pflanzliche Ernährung hinausgeht und alle Formen der Tierausbeutung ablehnt. Basierend auf einem kürzlich erschienenen Bericht der Eidgenössischen Ernährungskommission EEK (1) stellt dieser Artikel dar, dass die aktuellen wissenschaftlichen Erkenntnisse nicht ausreichen, um solche Diäten für die Prävention und Behandlung ischämischer Herz-Kreislauf-Erkrankungen zu empfehlen.
Der 1944 in Grossbritannien entstandene Veganismus als Lebensstil beinhaltet eine ausschliesslich pflanzliche Ernährung. Über diese einfache Wahl des Essens hinaus lehnt der Veganismus aus ethischen und philosophischen Prinzipien die Legitimität jeder Form von Tierausbeutung ab. Seinen militantesten Befürwortern zufolge ist der Veganismus die bevorzugte Option, welche Tiere und Umwelt respektiert und gleichzeitig eine ausgewogene Ernährung als Quelle der Gesundheit und des Wohlbefindens der Menschen fördert. In den letzten Jahren haben die Aktivitäten und Forderungen der Bewegung der Veganerinnen und Veganer in den Medien immer mehr Aufmerksamkeit erhalten, was zu Debatten und Unsicherheit bei den Konsumenten geführt hat, die sich zunehmend für die gesundheitlichen Folgen ihrer Ernährung interessieren.
Die jüngste Veröffentlichung des Berichts der Eidgenössischen Ernährungskommission mit dem Titel «Vegane Ernährung: Analyse von Nutzen und Schaden für Ernährung und Gesundheit» bildete die Grundlage für diesen Artikel, der sich auf das kardiovaskuläre Risiko veganer Ernährung und Empfehlungen zur Prävention ischämischer Herz-Kreislauf-Erkrankungen (HKE) konzentriert (1).
Merkmale der veganen Ernährung
Per Definition schliesst eine «vegane» Ernährung jeden Bestandteil tierischen Ursprungs aus, aber das Spektrum der anderen Nährstoffe kann variieren. Diese Art der Ernährung unterscheidet sich daher von anderen fleischlosen Ernährungformen wie:
a) «vegetarisch» oder «ovo-lacto-vegetarisch», wenn keine Zutaten oder Verarbeitungshilfsstoffe tierischen Ursprungs enthalten sind, mit Ausnahme von Milch, Milchbestandteilen wie Laktose, Eiern, Eibestandteilen und Honig
b) «ovo-vegetarisch», wenn keine Zutaten oder Verarbeitungshilfsstoffe tierischen Ursprungs enthalten sind, mit Ausnahme von Eiern, Eibestandteilen und Honig
c) «lakto-vegetarisch», wenn keine Zutaten oder Verarbeitungshilfsstoffe tierischen Ursprungs enthalten sind, mit Ausnahme von Milch, Milchbestandteilen und Honig.
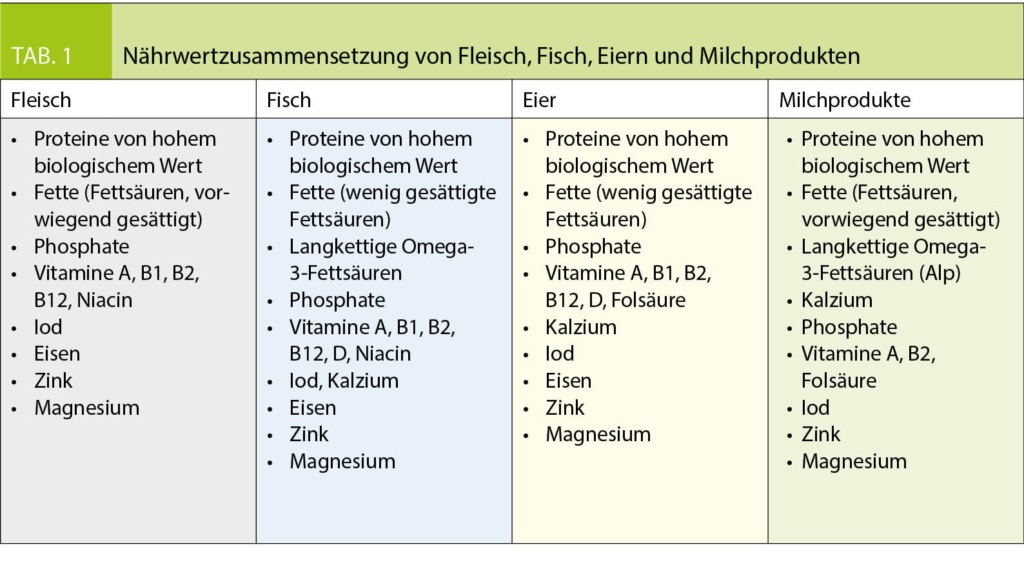
Der Verzicht auf Fleisch, Fisch, Eier und Milchprodukte ist mit einem Verlust von Makro- und Mikronährstoffen verbunden, die durch andere Nahrungsquellen oder durch Supplementierung ersetzt werden müssen, um eine ausgewogene Ernährung zu gewährleisten (Tabelle 1).
Zahlreiche europäische Studien, die seit 2015 veröffentlicht wurden, haben die vegane Ernährung untersucht und die Nährstoffzufuhr auf der Grundlage länderspezifischer Lebensmittellisten berechnet.
Bei Makronährstoffen entsprechen die durchschnittlichen Verzehrswerte oft den allgemeinen Ernährungsempfehlungen. Ihre Variabilität ist jedoch sehr gross, was im Falle von Proteinaufnahmen problematisch sein kann. Aus den wenigen Studien, die Daten über die Aufnahme von Obst und Gemüse gesammelt haben, geht hervor, dass im Durchschnitt die empfohlene Tagesdosis (drei Portionen Gemüse und zwei Portionen Obst) abgedeckt wird, allerdings wiederum mit einer sehr hohen Variabilität dieses Verzehrs. Dies deutet darauf hin, dass es keinen Beweis dafür gibt, dass eine vegane Ernährung immer mit einem hohen Obst- und Gemüsekonsum verbunden ist. Daher ist es schwierig anzunehmen, dass eine vegane Ernährung de facto gesundheitliche Vorteile bietet. Dies ist eines der Axiome der meisten Befürworter einer veganen Ernährung (1, 2).
Mikronährstoffdaten sind oft durch den Mangel an spezifischen Informationen über die Ernährungswahl der Studienteilnehmer und die Art und Dosis der Supplementierung begrenzt. Die meisten Studien zeigen, dass eine Vitamin-B12-Supplementierung zwar notwendig ist, aber nur teilweise befolgt wird (50 - 70% der Teilnehmer), was zu einem erhöhten kardiovaskulären Risiko führen kann. Während andere Mangelzustände möglich sind (Vitamin D, Kalzium, Zink usw.), weisen Veganer umgekehrt im Vergleich zu Omnivoren eine höhere Aufnahme und ein höheres Blutprofil von Mikronährstoffen wie Magnesium, Vitamin C, B1 und B6, Folsäure, Carotinoiden und Polyphenolen auf, was der Gesundheit zuträglich sein kann.
Zusammenfassend lässt sich sagen, dass eine gut geplante vegane Ernährung den Energie- und Nährstoffbedarf decken kann, sie erfordert aber sehr gute ernährungswissenschaftliche Kenntnisse sowie eine Supplementierung auf der Grundlage einer regelmässigen Blutüberwachung der wichtigsten Mikronährstoffe.
Prävalenz des Veganismus, Charakteristika und Motivationen seiner Anhänger
In Europa ernähren sich schätzungsweise 2-5% der Bevölkerung vegetarisch, darunter auch Veganer. In der Schweiz ergab die jüngste Umfrage des Verbands Swissveg, dass im Jahr 2017 unter den 1296 befragten Personen im Alter von 15 bis 74 Jahren 11% Vegetarier und 3% Veganer waren. Diese Ergebnisse stehen in Kontrast zu den Daten der menuCH-Studie von 2015 mit 2000 erwachsenen Teilnehmern, in der die Prävalenz von Vegetariern 1,77% und die von Veganern 0,38% betrug. Genauere Daten fehlen, aber gemäss den Schweizerischen Gesundheitsbefragungen scheint sich der Anteil der Personen, die angeben, nie Fleisch gegessen zu haben, von 1992 bis 2017 von 2 auf 6% verdreifacht zu haben.
Die verschiedenen Umfragen zeigen, dass auch in der Schweiz sich vor allem junge, gut ausgebildete Frauen, die in Städten leben oder arbeiten, vegan ernähren. Ihre Hauptgründe für den Verzicht auf Fleisch sind der Tierschutz (78%) sowie ethische (60%) und ökologische Erwägungen (58%). Allerdings gaben nur 35% von ihnen die Gesundheit als Grund an.
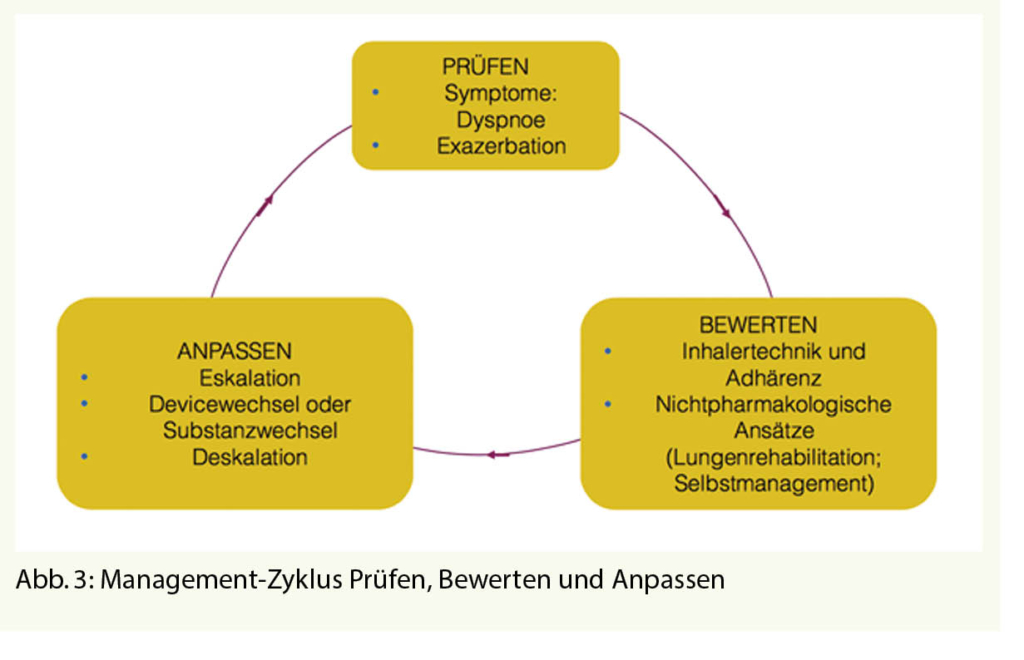
Vegane Ernährung und ihre Auswirkungen auf das kardiovaskuläre Risiko
Durch Bevorzugung von Obst, Gemüse, Ballaststoffen und Kohlenhydraten und den reduzierten Verzehr von Fett und gesättigten Fettsäuren und die Vermeidung von tierischem Eiweiss, insbesondere von rotem Fleisch und Wurstwaren, hat die vegane Ernährung im Vergleich zu einer omnivoren Ernährung eher positive Auswirkungen auf Blutfette, Gewicht und Blutzuckereinstellung gezeigt. Dies kann einen günstigen Einfluss auf das Risiko einer HKE ausüben, wie einer ischämischen Herzerkrankung (IHK) oder eines Schlaganfalls (CVI).
Historisch gesehen veröffentlichten Key TJ et al. 1999 eine Meta-Analyse von 5 prospektiven Kohortenstudien, die einen, wenn auch nicht signifikanten, Rückgang der Mortalitätsraten infolge HKE (-26%) bei Veganern und (-34%) bei den übrigen Vegetariern im Vergleich zu Omnivoren zeigten (3). Trotz erheblicher methodischer Einschränkungen werden diese Daten weithin als günstig bewertet, dennoch wäre es dringend notwendig, das Niveau der wissenschaftlichen Evidenz bezüglich des Veganismus zu verbessern. Leider ergibt die Durchsicht der wissenschaftlichen Literatur bis 2018 keine Interventionsstudien vom RCT-Typ, die es ermöglichen würden, den Nutzen veganer Ernährung für das Risiko einer HKE adäquat zu validieren. Tatsächlich basiert der grösste Teil des derzeitigen Wissens auf Beobachtungsstudien.
Bis heute liegen uns leider keine Interventionsstudien vor, die geklärt haben, ob eine vegane Ernährung mit einer verringerten Inzidenz eines ersten kardiovaskulären Ereignisses, sei es eine IHK oder ein CVI, verbunden sei. Obwohl die allgemeine Meinung und auch Grundsatzerklärungen die Vorteile einer veganen Ernährung grosszügig propagieren, sind entschieden weitere Forschungen notwendig, um den potenziellen Nutzen einer solchen Ernährung für die Prävention oder Behandlung von HKE nachzuweisen (2).
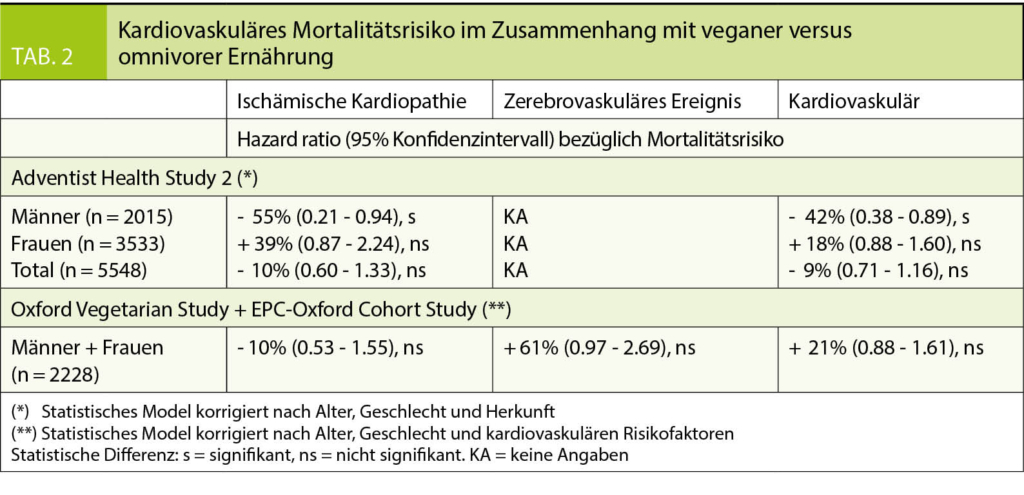
Andererseits wurde das Risiko der Gesamtmortalität im Zusammenhang mit veganer Ernährung in den drei in Tabelle 2 aufgeführten Studien analysiert (4 - 5). Basierend auf Daten aus der «Adventist Health Study-2», einer grossen prospektiven Kohortenstudie mit 73 308 Mitgliedern der nordamerikanischen adventistischen Gemeinschaft, darunter 5 548 Veganer und 35 359 Omnivoren, berichteten Orlich MJ et al. nach 5,6 Jahren Nachbeobachtung über widersprüchliche Ergebnisse (4). Während bei Männern ein statistisch signifikanter Rückgang der Gesamtmortalität um -42% und der koronaren Mortalität um -55% beobachtet wurde, stiegen diese Risiken bei Frauen um nicht signifikante 18% resp. 39% an.
Diese Daten kontrastieren zu den Ergebnissen von Appleby PN et al. aus den beiden prospektiven Kohortenstudien «the Oxford Vegetarian Study» und «the EPIC-Oxford cohort» (5). Für diese Analyse wurden diese beiden Kohorten zusammengenommen und insgesamt 60 310 Personen aus der britischen Bevölkerung rekrutiert, von denen 2 228 sich ausschliesslich vegan ernährten und 18 431 omnivor, und über 15 Jahre oder länger nachverfolgt. Insgesamt war das Risiko der Koronarsterblichkeit bei Veganerinnen und Veganern im Vergleich zu Omnivoren leicht reduziert (-10%), während das Risiko sowohl für die Schlaganfallsterblichkeit (+ 61%) als auch für die gesamte kardiovaskuläre Mortalität (+ 21%) erhöht war, wobei alle Resultate keine statistische Signifikanz erreichten.
Alle drei dieser Kohortenstudien weisen verschiedene methodische Einschränkungen auf, die das Evidenzniveau zugunsten der Vorteile oder sogar Nachteile veganer Ernährung für das kardiovaskuläre Risiko reduzieren.
Zusammenfassend lässt sich sagen, dass die bisher vorliegenden wissenschaftlichen Erkenntnisse noch zu unsicher sind, um eine vegane Ernährung sowohl zur Prävention als auch zur Behandlung von ischämischen kardiovaskulären Erkrankungen zu empfehlen. Dies ist wahrscheinlich einer der Hauptgründe, warum solche Diäten nicht in die Ernährungsempfehlungen zur Vorbeugung von Herz-Kreislauf-Erkrankungen aufgenommen wurden, die von der Schweizerischen, Europäischen und Amerikanischen Gesellschaft für Kardiologie herausgegeben werden.
Beim Artikel handelt es sich um einen aus dem Französischen übersetzten Zweitabdruck des in «la gazette médicale» 02-2019 erschienenen Originalartikels.
Copyright bei Aerzteverlag medinfo AG
Chemin des Fleurs 5
1007 Lausanne
roger.darioli@unisante.ch
Der Autor hat kein finanzielles Interesse oder Verbindungen mit der Veganerbewegung, Tierbefürwortern, Fleischproduzenten oder der Lebensmittelindustrie. Ausserdem wurde dieser Artikel unabhängig verfasst, ohne jegliche finanzieller Beitrag. Auch der Bericht der Expertengruppe der Eidgenössischen Lebensmittelkommission, an welchem der Autor mitgewirkt hat, wurde unabhängig auf der Grundlage der zwischen 2007 und 2018 veröffentlichten wissenschaftlichen Erkenntnisse erstellt.
1. Bericht der Eidgenössischen Ernährungskommission EEK: Übersichtsarbeit zu
den ernährungsphysiologischen und gesundheitlichen Vor- und Nachteilen einer
veganen Ernährung (2018). https://www.blv.admin.ch/blv/de/home/das-blv/organisation/
kommissionen/eek/vor-und-nachteile-vegane-ernaehrung.html
2. Melina V, Craig W, Levin S.l. Position of the Academy of Nutrition and Dietetics:
Vegetarian Diets. J Acad Nutr Diet. 2016;116:1970-80.
3. Key TJ, Fraser GE, Thorogood M Appleby PN, Beral V, Reeves G, Burr ML,
Chang-Claude J, Frentzel-Beyme R, Kuzma JW, Mann J, McPherson K.Mortality
in vegetarians and nonvegetarians: detailed findings from a collaborative analysis
of 5 prospective studies. Am J Clin Nutr 1999; 70, 516S–524S.
4. Orlich MJ, Singh PN, Sabaté J, Jaceldo-Siegl K, et al. Vegetarian dietary patterns
and mortality in Adventist Health Study 2. JAMA Intern Med. 2013;173:1230-38.
5. Appleby PN, Crowe FL, Bradbury KE et al. Mortality in vegetarians and comparable
nonvegetarians in the United Kingdom. Am J Clin Nutr. 2016;103:218-30.