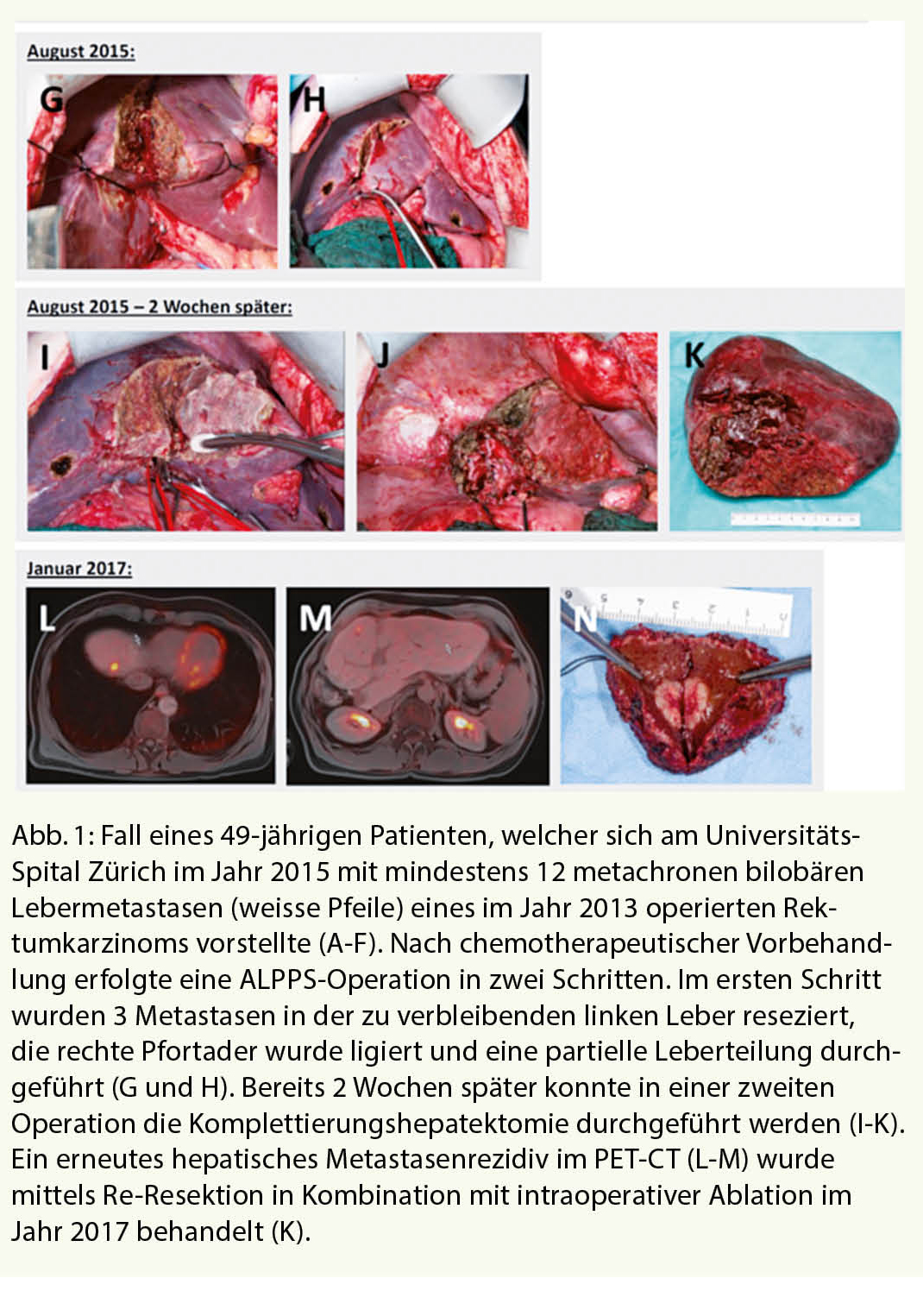
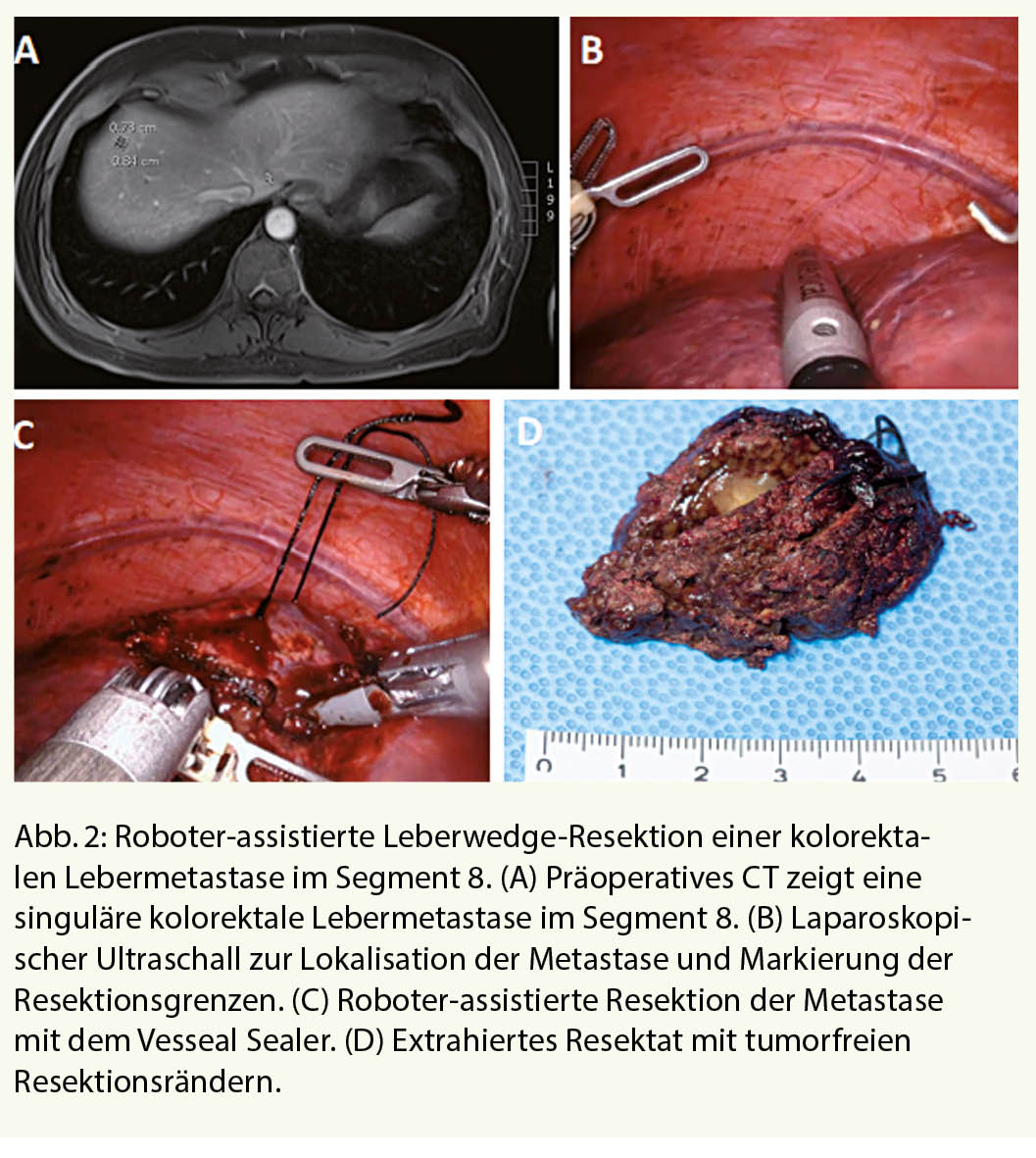
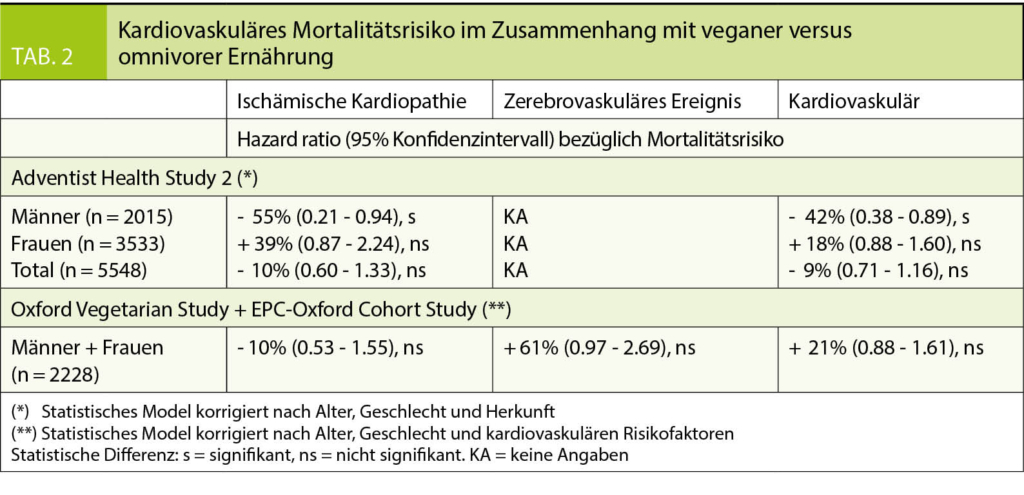
Störungen der Schilddrüsenfunktion gehören zu den häufigen Problemen in der Hausarztpraxis. Es handelt sich dabei um eine breite Differentialdiagnose, bei der die Autoimmunität der Schilddrüse im Mittelpunkt steht. Neue Immuntherapien in der Onkologie haben das Bewusstsein über die Rolle des Immunsystems bei Schilddrüsenerkrankungen geschärft. Eine zeitgemässe und übersichtliche Einteilung der entzündlichen Schilddrüsenerkrankungen bietet daher die Unterscheidung zwischen nicht Medikamenten-assoziierten und Medikamenten-assoziierten Entzündungen.
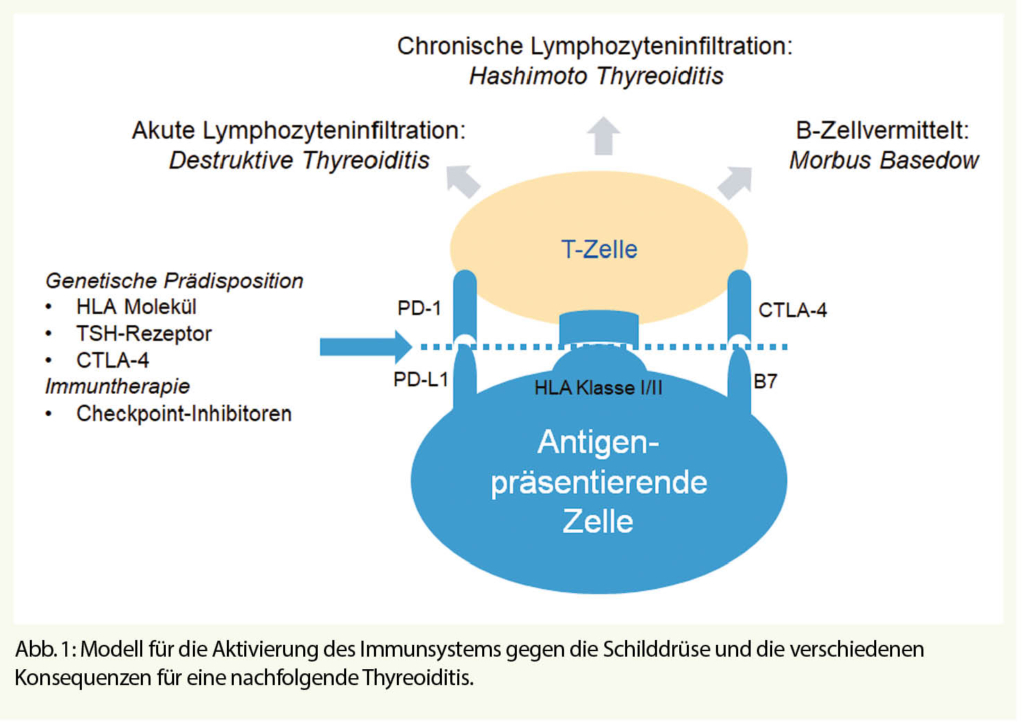
Die Prävalenz von laborchemisch manifesten Schilddrüsenerkrankungen in der Bevölkerung liegt bei 1% (1). Schilddrüsenstörungen gehören also nach dem Diabetes mellitus zu den häufigsten endokrinologischen Störungen in der Hausarztpraxis. Für die initiale Diagnostik liegt mit dem TSH-Wert ein sehr sensitiver und spezifischer Laborwert vor (2), der bei Abweichungen von der Norm um Messungen der freien, also nicht proteingebundenen, Schilddrüsenhormone ergänzt werden kann. Da das fT3 überwiegend aus der Peripherie durch Konversion aus T4 entsteht, kommt bei der Beurteilung einer primären Hypothyreose nur dem fT4 Bedeutung zu. Bei der Abklärung einer Hyperthyreose sollten aber immer beide Parameter, fT3 und fT4, zum Einsatz kommen. Die Verfügbarkeit des TSH-Tests als aussagekräftiger initialer Test ist von enormer Bedeutung, da Schilddrüsenhormon zwar für jedes Organ und Körperzelle wichtig ist, die meisten Beschwerden aber unspezifisch sind. Leitsymptom der Hypothyreose ist Müdigkeit (3), für die Hyperthyreose ist es das Schwitzen (4). Die Schilddrüse ist wie kaum ein anderes Organ Ziel des eigenen Immunsystems. Die Ursachen hierfür sind noch nicht verstanden, aber gerade neue Therapien in der Onkologie, die das Ziel haben, das eigene Immunsystem über eine Aktivierung der T-Zellen zu stimulieren, sind ein eindrucksvoller Beweis hierfür. Am Anfang der meisten Immunstörungen der Schilddrüse steht die Präsentation von Autoantigenen der Schilddrüse an T-Zellen (Abb.1).
Die Präsentation erfolgt über HLA-Moleküle und kann wahrscheinlich nicht nur über antigen-präsentierende Zellen (APC) erfolgen, sondern auch über die Epithelzellen der Schilddrüse (Thyreozyten) selbst (5). Frühe Hinweise für diesen ersten Schritt der Immunantwort, der gegen die Schilddrüse gerichtet ist, waren die Kenntnisse über die genetische Prädisposition für Autoimmunerkrankungen wie den Morbus Basedow durch Polymorphismen im HLA-Molekül oder dem TSH-Rezeptor (6). Immer häufiger werden aber auch als Nebenwirkung einer Immuntherapie mit sogenannten Checkpoint-Inhibitoren Störungen der Schilddrüsenfunktion beobachtet. Diese Therapien stimulieren T-Zellen über die Inhibierung von Molekülen an der T Zelle, PD-1 oder CTLA-4 (6). Diese Aktivierung wirkt vermutlich als Beschleunigung der in der Bevölkerung weit verbreiteten Autoimmunität gegen die Schilddrüse und ist eindrucksvoller Beweis für die autoimmun-basierte Ursache der Schilddrüsenstörungen. 5-10% der Patienten mit einem CTLA-4 Inhibitor (z.B. Ipilimumab) entwickeln eine Schilddrüsenstörung und 10-20% der Patienten mit einem PD-1-Inhibitor (z.B. Nivolumab, Pembrolizumab) (7). Bei Kombinationstherapien liegt die Inzidenz sogar über 20% (7). Diese Daten werden dadurch unterstützt, dass auch Polymorphismen im CTLA-4, dem Ziel einiger Checkpoint-Inhibitoren, für eine Schilddrüsenstörung prädisponieren (6). Interesssanterweise liegt den meisten entzündlichen Schilddrüsenerkrankungen ein gemeinsamer erster Schritt bei der Aktivierung des Immunsystems zu Grunde. Im zweiten Schritt, nach der Aktivierung der T Zellen, kommt es dann aber zu einer Verzweigung, deren Ursache noch nicht verstanden ist (Abb. 1). Eine Aktivierung von B-Zellen führt zur Produktion von Antikörpern gegen den TSH-Rezeptor und somit zum Morbus Basedow, eine chronische Infiltration der Schilddrüse führt zur Hashimoto Thyreoiditis, während eine akute Lymphozyteninfiltration zu einer Zerstörung von Thyreozyten und Freisetzung von Schilddrüsenhormon führt. Diese sogenannte destruktive Thyreoiditis führt initial zu einer transienten Hyperthyreose, die oft klinisch mild ist und als Zufallsbefund im Routinelabor imponieren kann. Wir haben heute also ein Model welches auf Autoimmunität der Schilddrüse basiert und die meisten entzündlichen Erkrankungen der Schilddrüse vereinen kann. Dieses Model wird durch die beobachteten Effekte der Checkpoint-Inhibitoren an der Schilddrüse eindrucksvoll untermauert.
Einteilung
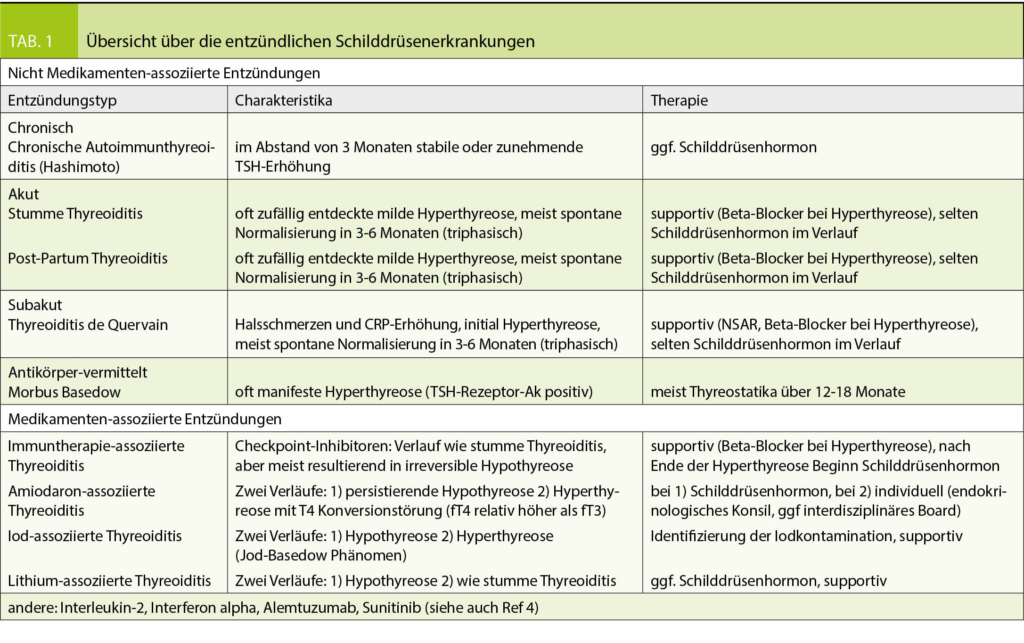
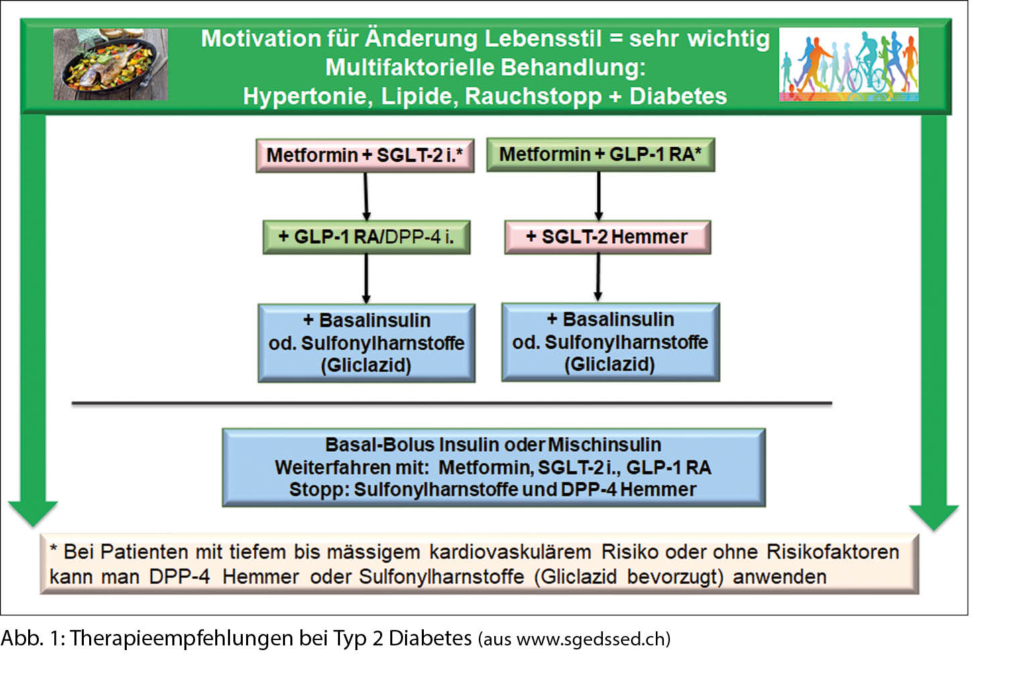
In früheren Zeiten konnte die persistierende Hypothyreose bereits differentialdiagnostisch eingegrenzt werden durch die Frage, ob der Patient an der Schilddrüse operiert wurde oder nicht. War die Antwort nein, dann verblieb, etwas vereinfacht gesagt, nur noch die chronische Autoimmunthyreoiditis als Differentialdiagnose. Die zunehmende Kenntnis von Wirkungen von Medikamenten bringt eine neue wichtige Dimension in die Anamnese bei Patienten in der Schilddrüsensprechstunde und soll hier zur Unterteilung in medikamenten- und nicht medikamenten-assoziierte entzündliche Schilddrüsenerkrankungen führen (Tab. 1).
Chronische Autoimmunthyreoiditis
Die häufigste Ursache der Hypothyreose ist mit Abstand (> 90%) die chronische Autoimmunthyreoiditis, auch Hashimoto Thyreoiditis genannt. In klaren Fällen, also zum Beispiel bei einer persistierenden manifesten Hypothyreose, handelt es sich um eine Ausschlussdiagnose, die klinisch und anamnestisch einfach zu stellen ist. Neben der Frage nach Schilddrüseninterventionen in der Vergangenheit (Operation, Radioiodtherapie) und einer Schilddrüsenpalpation ist eine Medikamentenanamnese wichtig sowie die klinische Suche nach Zeichen anderer glandulärer Autoimmunerkrankungen (Polyurie/Polydipsie (Diabetes mellitus), abdominale Probleme (Zöliakie)) oder damit assoziierten autoimmunologischen Prozessen (Vitiligo, Alopezia areata).
Akute Thyroiditis
Bei subklinischer Hypothyreose, also erhöhtem TSH-Wert bei normalem fT4, wird allgemein empfohlen den TSH-Test, ggf. zusammen mit fT4, nach 3 Monaten zu wiederholen (8). Dieser Verlauf ist wichtig, um die Hashimoto Thyreoiditis von den akuten Thyreoiditiden abzugrenzen, die sich meist spontan wieder normalisieren. Bei dieser kommt es wie bereits erwähnt initial zu einer schmerzlosen Zerstörung von Thyreozyten weshalb auch der Name stumme Thyreoiditis resultiert. Erscheint sie innerhalb von 12 Monaten nach der Entbindung spricht man auch von einer postpartum Thyreoiditis. In der hyperthyreoten Phase wirken Thyreostatika nicht, so dass hier bei klinisch relevanter Hyperthyreose vornehmlich Beta-Blocker zum Einsatz kommen. Hierbei handelt es sich um eine rein symptomatische Therapie, die weniger von der Ausprägung der Hyperthyreose im Labor abhängt als von Symptomen wie Herzrasen und innerer Unruhe. Wichtig sind regelmässige Verlaufskontrollen über 6 Monate. Die meisten Patienten werden nach initialer Hyperthyreose eine leichte hypothyreote Phase durchlaufen (Erholungsphase) und dann wieder euthyreot (triphasischer Verlauf).
Subakute Thyreoiditis
Differentialdiagnostisch keine Probleme bietet in der Regel die subakute Thyreoiditis (De Quervain), die immer mit Halsschmerzen und laborchemischen Entzündungszeichen einhergeht. Die Blutsenkungsgeschwindigkeit ist meist grösser als 50 mm/Stunde (9) und auch das C-reaktive Protein kann erhöht sein (10). Auch die subakute Thyreoiditis folgt dem triphasischen Verlauf mit sehr guter Prognose für eine spontane Wiedererlangung der normalen Schilddrüsenfunktion.
Morbus Basedow
Beim Morbus Basedow kommt es zur Bildung von Antikörpern gegen den TSH-Rezeptor (TRAK), die diesen für die Schilddrüse extrem wichtigen Rezeptor stimulieren. Der TSH-Rezeptor stimuliert die Schilddrüsenhormonproduktion, die Iodaufnahme in die Thyreozyten und kann dazu noch als Wachstumsreiz wirken. Die meisten Patienten entscheiden sich für eine thyreostatische Behandlung, deren Ziel ist, dass sich die TRAK nach 12-18 Monaten zurückbilden und es zu einer Normalisierung der Schilddrüsenfunktion kommt. Patienten, die diese Therapieform wählen, sollten darüber orientiert sein, dass im allgemeinen die Remissionswahrscheinlichkeit bei ca 60% liegt (11). Eine kürzliche Beobachtungsstudie aus Schweden über 8 Jahre zeigte sogar nur eine Remissionswahrscheinlichkeit von 50.3% (12). Die Hyperthyreose beim Morbus Basedow ist somit von längerer, mehrmonatiger Dauer und unterscheidet sich somit vom spontan limitierten (transienten) Verlauf der triphasischen
Thyreoiditis. Die Zeit bis zum Abfall der TRAK wird mit Thyreostatika überbrückt, um den TSH-Wert zu normalisieren. Es ist weiterhin Gegenstand der Diskussion, ob die Thyreostatika auch eine immunmodulatorische Wirkung haben und somit die Remission des Morbus Basedow fördern.
Medikamenten-assoziierte Thyreoiditiden
Die Medikamenten-assoziierten Schilddrüsenentzündungen zeigen interessanterweise sehr unterschiedliche Verlaufsformen. Die Checkpoint Inhibitor-assoziierte Thyreoiditis wird am häufigsten mit Inhibitoren des PD-1 beobachtet. Wie erwähnt werden bis zu 20% der Patienten, die Pembrolizumab erhalten, eine Thyreoiditis zeigen (7). Sie verläuft wie eine stumme Thyreoiditis, resultiert aber meistens in eine irreversible Hypothyreose, so dass bereits nach Ablauf der hyperthyreoten Phase mit Schilddrüsenhormon begonnen wird. Die Amiodaron-assoziierte Thyreoiditis kennt zwei Verlaufsformen. Es kann zu einer Hypothyreose kommen, bei der möglicherweise der hohe Iodgehalt des Amiodaron eine Rolle spielt. Hier kann pragmatisch mit einem Schilddrüsenhormonersatz begonnen werden sobald die Unterfunktion der Schilddrüse laborchemisch relevant wird. Die Amiodarontherapie kann dabei fortgesetzt werden. Ungleich komplizierter ist die durch Amiodaron-induzierte Hyperthyreose, die immer fachärztlich beurteilt werden sollte. Oft ist auch ein interdisziplinäres Schilddrüsenboard mit den Kardiologen sinnvoll. Meist wird das Amiodaron gestoppt. Die Therapieformen reichen von der notfallmässigen Thyreoidektomie bis zum expektativen Vorgehen unter supportiver Therapie (Beta-Blocker). Meist kommt es innerhalb von 6 Monaten zu einer Normalisierung der Schilddrüsenwerte (13). Da bei unseren Patienten oft eine destruktive Thyreoiditis unter Amiodaron die Ursache für die Hyperthyreose ist, kommen Thyreostatika oft nicht zum Einsatz. Ein wichtiger Punkt in der Abklärung von Schilddrüsenentzündungen ist die Suche nach Iodkontaminationen wie zum Beispiel Kontrastmittelexposition oder die Frage nach Einnahme von Lithium. Sowohl Iod als auch Lithium können die Schilddrüsenhormonproduktion bremsen. Eine hohe Iodexposition kann umgekehrt auch zu einer hartnäckigen Hyperthyreose führen, die nur ungenügend auf Thyreostatika anspricht. Auch hier ist die Auffindung der Iodquelle von übergeordneter Bedeutung. Die Einnahme von Lithium kann neben der Entwicklung einer Hypothyreose auch zu einer Entzündung führen, die dem Ablauf einer stummen Thyreoiditis ähnelt.
Diagnostik
Es soll betont werden, dass eine sorgfältige Anamnese und klinischer Status bereits bei einer Vielzahl von Fällen die Diagnose einer Schilddrüsenentzündung erlaubt. Dies gilt vor allem für die chronische Autoimmunthyreoiditis (Hashimoto). Bei der Abklärung der Hyperthyreose ist die Bedeutung der TRAK von übergeordneter Bedeutung, da die TRAK bei gesunden Menschen nur selten im Blut nachweisbar sind. Sie sind also sehr spezifisch für den Morbus Basedow. Bei unklaren Fällen, vor allem bei milden laborchemischen Veränderungen, können auch noch andere Tests zum Einsatz kommen. Antiköper gegen die Thyreoperoxidase (Anti-TPO-Ak) korrelieren in der Bevölkerung mit einer Hypothyreose (8) und können ein Puzzlestein bei der Diagnose der Hashimoto Thyreoiditis sein. Ihre Messung oder Vorhandensein ist aber nicht obligat für die Diagnose in klinisch eindeutigen Fällen. Ähnliches gilt für den Schilddrüsenultraschall. Auch er kann ein nützlicher Puzzlestein bei der Diagnose sein und zeigt bei Morbus Basedow und Hashimoto Thyreoiditis oft charakteristische Veränderungen. In ansonsten klaren Fällen ist aber auch der Ultraschall nicht obligat für die Diagnose. Zu erwähnen sei noch die Schilddrüsenszintigraphie mit Technetium-Pertechnetat. Die Schilddrüsenszintigraphie kommt bei Schilddrüsenentzündungen in der hyperthyreoten Phase zum Einsatz, wenn die klinische Situation die sofortige Unterscheidung zwischen einem Morbus Basedow (hoher Uptake) oder der hyperthyreoten Phase einer stummen Thyreoiditis oder Iodkontamination (kein Uptake) erfordert.
Copyright bei Aerzteverlag medinfo AG
UniversitätsSpital Zürich
Klinik für Endokrinologie
Diabetologie und Klinische Ernährung
Rämistrasse 100
8091 Zürich
jan.kruetzfeldt@usz.ch
Der Autor hat in Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
1. Garmendia Madariaga, A., Santos Palacios, S., Guillen-Grima, F., Galofre, J.C., 2014. The incidence and prevalence of thyroid dysfunction in Europe: a meta-analysis. J Clin Endocrinol Metab 99(3):923-931.
2. Hoermann, R., Eckl, W., Hoermann, C., Larisch, R., 2010. Complex relationship between free thyroxine and TSH in the regulation of thyroid function. Eur J Endocrinol 162(6):1123-1129.
3. Carle, A., Pedersen, I.B., Knudsen, N., Perrild, H., Ovesen, L., Laurberg, P., 2014. Hypothyroid symptoms and the likelihood of overt thyroid failure: a population-based case-control study. Eur J Endocrinol 171(5):593-602.
4. McDermott, M.T., 2020. Hyperthyroidism. Ann Intern Med 172(7):ITC49-ITC64.
5. Muixi, L., Alvarez, I., Jaraquemada, D., 2008. Peptides presented in vivo by HLA-DR in thyroid autoimmunity. Adv Immunol 99:165-209.
6. Inaba, H., Ariyasu, H., Takeshima, K., Iwakura, H., Akamizu, T., 2019. Comprehensive research on thyroid diseases associated with autoimmunity: autoimmune thyroid diseases, thyroid diseases during immune-checkpoint inhibitors therapy, and immunoglobulin-G4-associated thyroid diseases. Endocr J 66(10):843-852.
7. Burch, H.B., 2019. Drug Effects on the Thyroid. N Engl J Med 381(8):749-761.
8. Peeters, R.P., 2017. Subclinical Hypothyroidism. N Engl J Med 376(26):2556-2565.
9. Samuels, M.H., 2012. Subacute, silent, and postpartum thyroiditis. Med Clin North Am 96(2):223-233.
10. Pearce, E.N., Bogazzi, F., Martino, E., Brogioni, S., Pardini, E., Pellegrini, G., et al., 2003. The prevalence of elevated serum C-reactive protein levels in inflammatory and noninflammatory thyroid disease. Thyroid 13(7):643-648.
11. Torring, O., Tallstedt, L., Wallin, G., Lundell, G., Ljunggren, J.G., Taube, A., et al., 1996. Graves‘ hyperthyroidism: treatment with antithyroid drugs, surgery, or radioiodine–a prospective, randomized study. Thyroid Study Group. J Clin Endocrinol Metab 81(8):2986-2993.
12. Sjolin, G., Holmberg, M., Torring, O., Bystrom, K., Khamisi, S., de Laval, D., et al., 2019. The Long-Term Outcome of Treatment for Graves‘ Hyperthyroidism. Thyroid 29(11):1545-1557.
13. Cappellani, D., Papini, P., Pingitore, A., Tomisti, L., Mantuano, M., Di Certo, A.M., et al., 2020. Comparison Between Total Thyroidectomy and Medical Therapy for Amiodarone-Induced Thyrotoxicosis. J Clin Endocrinol Metab 105(1).