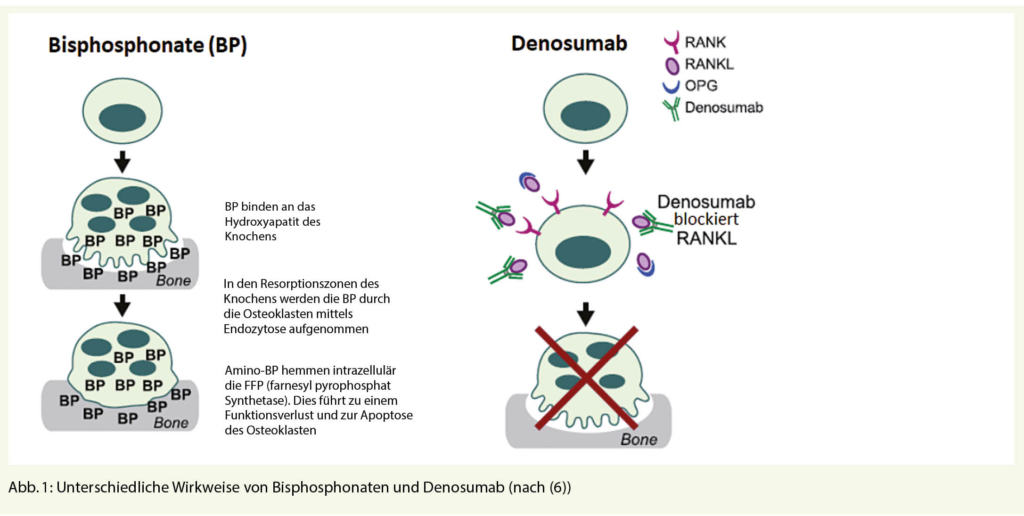
Das Bauchaortenaneurysma (BAA) bleibt trotz sinkender Prävalenz eine relevante Mortalitätsursache bei Männern über 65 Jahren. Entgegen der wissenschaftlichen Datenlage, welche für ein Screening spräche, konnte sich in der Schweiz bisher kein derartiges Programm etablieren. Im folgenden Artikel möchte ich eine Lanze für das Screening des BAAs in der Schweiz brechen. Auch möchte ich Ihnen die aktuellen Wissenslücken und Zweifel bezüglich des Screenings darlegen.
Männer über 65 Jahre, allen voran Raucher und ehemalige Raucher, sind am häufigsten von einem BAA betroffen. Die damit verbundene Gefahr einer Ruptur ist stark vom Aneurysmadurchmesser abhängig, welcher normalerweise über die Jahre zunimmt. Die Operationsindikation stellt man bei Symptomen, bei rascher Grössenzunahme (>1cm/Jahr) oder ab einem Durchmesser von 5.5 cm. Bei kleineren Aneurysmen ist die Gefahr einer Ruptur gering und rechtfertigt das Risiko eines Eingriffes nicht, weshalb man sonographische Kontrollen bevorzugt (1).
Leider muss man auch heute noch von einer hohen Mortalität im Falle einer Ruptur ausgehen. Ein Grossteil der Patienten verstirbt noch vor Erreichen des Spitals, und auch bei einer Notoperation ist die Sterblichkeit bei weit über 30% hoch (2). Im Jahre 2017 wurden in der Schweiz zirka 300 Personen mit der Diagnose eines rupturierten BAAs hospitalisiert (3). Im Unterschied zu anderen Europäischen Ländern wie zum Beispiel Dänemark oder Grossbritannien, verfügen wir über kein nationales Screening-Programm (4). Die Gründe hierfür sind für mich nicht offensichtlich, denken wir nur an bereits realisierte Screening-Programme für onkologische Krankheitsbilder. Gerne werde ich Ihnen in der Folge einen Einblick in die Evidenzlage des BAA-Screenings geben. Durch das Fehlen eines nationalen Screening-Programms hierzulande kommt dem Grundversorger eine zentrale Rolle bei der Früherkennung des BAAs zu.
Ein sinnvolles Screening-Programm sollte die folgenden Kriterien erfüllen (5):
- Die Erkrankung muss einen signifikanten Einfluss auf die Lebensqualität haben.
- Es müssen akzeptable Behandlungsmöglichkeiten vorhanden sein.
- Vorhandensein einer asymptomatischen Latenzzeit, während derer die Diagnose und Behandlung der Erkrankung zu einer Reduktion der Morbidität und Mortalität führt.
- Die Behandlung der Erkrankung in der Latenzphase muss zu einem besseren Resultat führen als jene nach Auftreten der Symptome.
- Die Diagnosestellung muss kostengünstig und wenig aufwendig sein.
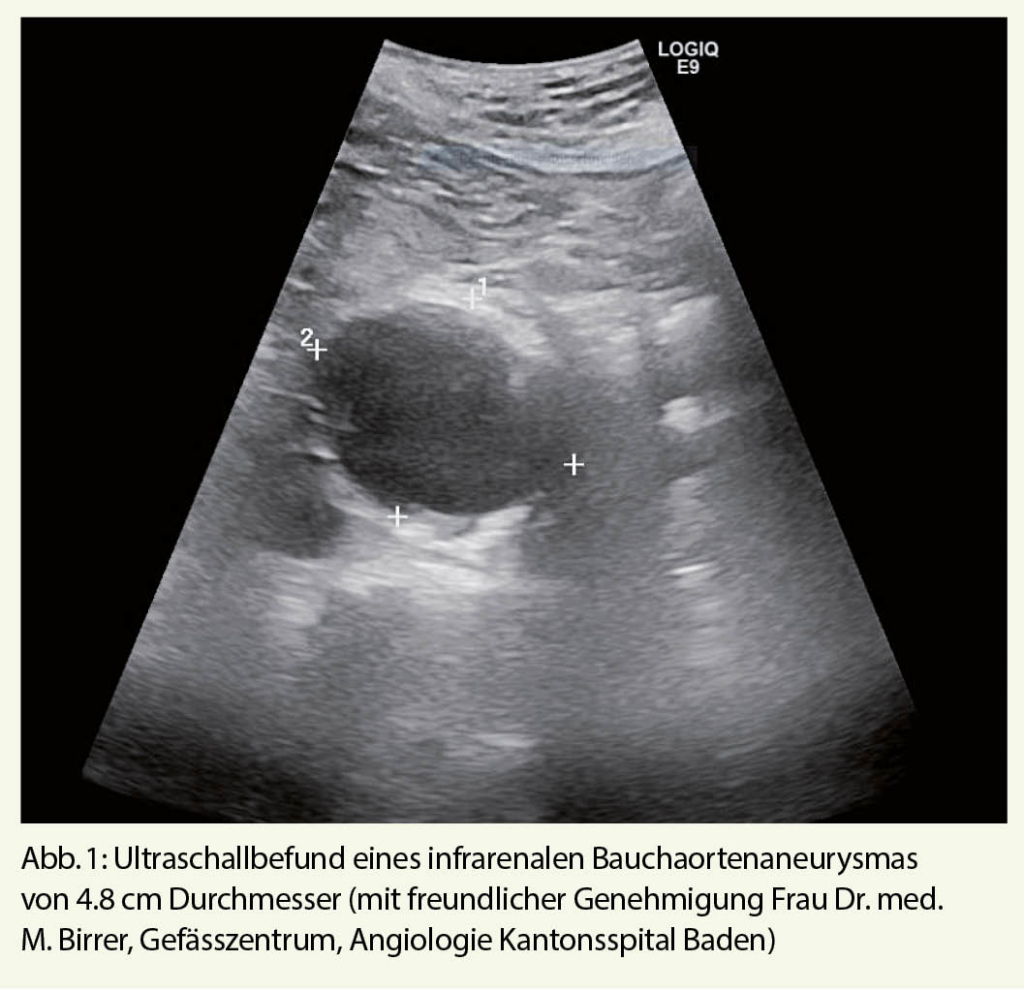
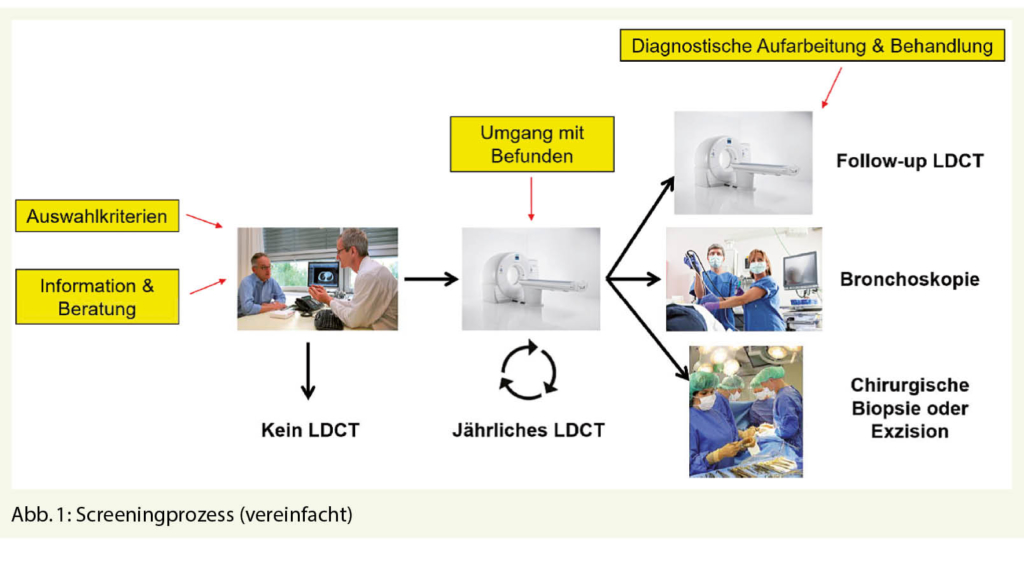
Nun, das Screening für das BAA erfüllt diese Kriterien in idealer Weise. Vier grosse randomisierte Studien haben sich in der Vergangenheit der Frage gewidmet, ob das Screening für das BAA die Aneurysma-spezifische, und die Gesamtmortalität bei der Zielgruppe, Männern über 65 Jahren, verringern kann (6-9). Zwei dieser Studien wurden in Grossbritannien, eine in Dänemark und eine weitere in Australien durchgeführt. Nur eine dieser vier Studien hat sich derselben Frage bei Frauen gewidmet (10). Als diagnostische Methode kam jeweils der Ultraschall zur Anwendung, welcher in 98.5% der Fälle eine genaue Diagnose stellen kann (Abb. 1) (11). Die Metaanalyse der Cochrane Bibliothek konnte nach einer Nachsorge von drei bis fünf Jahren eine deutliche Reduktion um zirka 40% der Aneurysma-spezifischen Mortalität bei Männern in den Screening-Gruppen ausmachen (Odds Radio 0.95, 95% CI 0.85-1.07)(12). Dies gilt ebenfalls, wenn auch nur in geringem Ausmass, für die Gesamtmortalität, welche in den Screening-Gruppen auch nach langer Nachsorge verringert werden konnte (Risk ratio 0.987, 95% CI 0.975-0.99, p=0.03) (13). Auf der Basis der Grossbritannischen MASS (Multicentre Aneurysm Screening Study)-Studiendaten kann man folgendes Model erstellen: In der Annahme dass 80% der aufgebotenen Patienten zum Screening erscheinen, und dass die postoperative Mortalität der elektiven Aneurysma-Operation 5% beträgt, was für heutige Verhältnisse eher hoch ist, muss man 240 Männer einladen, um einen frühzeitigen Aneurysma-bedingten Tod über 10 Jahre zu vermeiden (Number needed to Screen = 240) (14). Dies wurde von mehreren nationalen Gesundheitssystemen als kosteneffektiv angesehen (z. B. U. S. Preventive Services Task Force, NICE Guidelines).
Das Screening bei Frauen wurde, wie erwähnt, nur in kleinen Studien analysiert. Aufgrund der geringeren Prävalenz des BAAs bei Frauen und vor allem wegen ihrem späteren Auftreten im Alter konnte die Chichester Studie keine Reduktion der BAA-assoziierten Mortalität feststellen. Die im hohen Alter vermehrt bestehenden Komorbiditäten, welche das Operationsrisiko erhöhen, und auch die höhere Rupturrate, die sowohl in der Kontroll- wie auch in der Screening-Gruppe zu verzeichnen war, erklären dieses Resultat (10).
Kritiker verweisen auf potentielle Schäden, welche durch das Screening verursacht werden können. Diese sind zum einen in der Morbidität und Mortalität der elektiven Eingriffe zu suchen, die durch das Screening getriggert werden. Zum anderen sehen einige Studien einen negativen Einfluss des Screenings auf die Lebensqualität und fordern, auch wenn dieser Einfluss gering ist, mehr Daten diesbezüglich (15).
Ein weiterer Diskussionspunkt ist die Tatsache, dass in der Nachsorge der MASS-Studie eine Abnahme des protektiven Effekts des Screenings nach zirka acht Jahren beobachtet wurde. Dies aufgrund von Rupturen bei Patienten, welche beim Screening noch als normal beurteilt wurden. Die Hälfte dieser Patienten wies bei der Screeninguntersuchung bereits eine Aortenektasie auf (Durchmesser 2-2.9 cm). Um diesen Effekt aufzufangen tendiert man dazu, diesen Patienten nach 5-10 Jahren eine Kontrolle anzubieten. Da es sich dabei um sehr wenige Personen handelt, ist der Ressourcenaufwand gering (16).
Alle randomisierten kontrollierten Landmarkstudien wurden im letzten Jahrhundert begonnen und wir wissen, dass die Prävalenz (damals 4-7%), wie auch die Inzidenz des rupturierten BAAs eher rückläufig sind (17). Durch die breitere Anwendung endovaskulärer Techniken, welche in der MASS-Studie kaum angewendet wurde, kam es zu einer Reduktion der perioperativen Mortalität. Weiter führen CT und MRI-Untersuchungen anderer Fachgebiete zu einer steten Zunahme der opportunistischen Frühdiagnosen von BAAs. Die Lebenserwartung der Gesamtbevölkerung ist gestiegen. Es fragt sich daher, ob aus den obigen Gründen die Resultate der Studien heutzutage noch gültig sind.
In Schweden konnte man dies eindrücklich zeigen. Die Abnahme der Prävalenz des BAAs auf 1.5% (CI 1.5%-1.6%) wird durch eine Abnahme der perioperativen Mortalität in der Screening-Gruppe auf 0.9% sozusagen wettgemacht. Es wird so ein Mehrkosteneffektivitätsverhältnis von 7770.- Euro pro QUALY (Quality adjusted life year gain) errechnet, was für ein Screening Programm (<25‘000.- Euro) als effektiv gilt (18). In der aktuellen Dänischen VIVA-Studie konnte darüber hinaus eine Reduktion der Gesamtmortalität durch das Screening in der Bevölkerung nachgewiesen werden (19). Es gibt somit viele Hinweise auf eine gesundheitspolitische Relevanz des BAA-Screenings in der modernen Bevölkerung. Diese beiden Studien widersprechen somit auch der geläufigen Meinung, die BAAs würden heutzutage sowieso früher oder später während einer anderen radiologischen Untersuchung (mit-)entdeckt.
Drei Subgruppen gebührt spezielle Betrachtung:
- Seit Jahren werden familiäre Häufungen von BAA-Erkrankungen beschrieben. Wissenschaftlich belegt wurde diese Beobachtung von Emma Larsson und ihren Mitarbeitern, welche bei erstgradigen Verwandten eine Verdoppelung des Risikos einer Aneurysma Erkrankung festgestellt haben (20). Daraus resultiert für die Betroffenen die Empfehlung eines BAA Screenings ab dem Alter von 50 Jahren.
- Wegen der häufigen Vergesellschaftung von BAAs mit peripheren arteriellen Aneurysmen, ergeht die Empfehlung zum Screening bei Patienten mit poplitealen- und peripheren Aneurysmen. Ravn et al. haben in ihrem Patientengut eine bis zu 40% Ko-Inzidenz der beiden Erkrankungen entdeckt (21).
- Aufgrund der gemeinsamen Risikofaktoren wie Nikotinabusus, Hypertonie und Hypercholesterinämie liegt der Gedanke nahe, Patienten mit Karotisstenose, koronarer Herzkrankheit oder peripherer arterieller Erkrankung auf ein BAA zu untersuchen. Es gibt hierzu jedoch keine exakten Daten, und man muss davon ausgehen, dass die erhöhte BAA-Prävalenz in diesem Patientengut auch von vermehrten Ko-Morbiditäten und einer geringeren Lebenserwartung begleitet ist. Dies könnte den Nutzen eines Screenings vermindern. Deshalb ist es nicht bekannt, ob ein Screening dieser Subgruppe aus gesundheitsökonomischer Sicht besonders empfehlenswert ist (22).
Es sei an dieser Stelle jedoch auf den Stellenwert der optimalen sekundären Prophylaxe mittels Thrombozytenaggregationshemmer, Statinen und Blutdruckmedikation hingewiesen. Diese verbessert bei Patienten mit diagnostiziertem BAA oder Aortenektasie die Langzeitprognose deutlich (23, 24).
Fazit ist, dass es ein Screening für das BAA braucht. Ich empfehle Ihnen, bei männlichen Patienten über 65 Jahre eine einmalige Ultraschalluntersuchung der Aorta durchzuführen. Patienten mit Aorten von >5 cm im Durchmesser sollten direkt einem Gefässchirurgen vorgestellt werden. Bei normalkalibrigen Aorten von unter 2 cm im Durchmesser ergibt sich keine Empfehlung zur Kontrolle. Alle anderen sollten regelmässig sonographisch nachkontrolliert werden. Ein nationales Screening Programm hätte zweifelsohne das Potential einer Reduktion der Aneurysma-bezogenen Mortalität in unserem Land.
Gefässzentrum, Kantonsspital Baden
Im Ergel 1
5401 Baden
Stephan.engelberger@ksb.ch
Der Autor hat in Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
1. Wanhainen A, Verzini F, Van Herzeele I, Allaire E, Bown M, Cohnert T, et al. Editor’s Choice – European Society for Vascular Surgery (ESVS) 2019 Clinical Practice Guidelines on the Management of Abdominal Aorto-iliac Artery Aneurysms. Eur J Vasc Endovasc Surg. 2019;57(1):8-93.
2. Investigators IT, Powell JT, Sweeting MJ, Thompson MM, Ashleigh R, Bell R, et al. Endovascular or open repair strategy for ruptured abdominal aortic aneurysm: 30 day outcomes from IMPROVE randomised trial. BMJ. 2014;348:f7661.
3. Bundesamt für Statistik Medizinische Statistik der Krankenhäuser. Online Daten Statistisches Lexikon der Schweiz. 2018.
4. Engelberger S, Rosso R, Sarti M, Del Grande F, Canevascini R, van den Berg JC, et al. Ultrasound screening for abdominal aortic aneurysms. Swiss Med Wkly. 2017;147:w14412.
5. Frame PS, Carlson SJ. A critical review of periodic health screening using specific screening criteria. The Journal of Family Practice 1975;2(1):29-36.
6. Scott RA, Wilson NM, Ashton HA, Kay DN. Influence of screening on the incidence of ruptured abdominal aortic aneurysm: 5-year results of a randomized controlled study. Br J Surg. 1995;82:1066-70.
7. Scott RAP. The Multicentre Aneurysm Screening Study (MASS) into the effect of abdominal aortic aneurysm screening on mortality in men: a randomised controlled trial. The Lancet. 2002;360(9345):1531-9.
8. Lindholt JS, Juul S, Fasting H, Henneberg EW. Screening for abdominal aortic aneurysms: single centre randomised controlled trial. BMJ. 2005;330(7494):750.
9. Norman PE, Jamrozik K, Lawrence-Brown MM, Le MT, Spencer CA, Tuohy RJ, et al. Population based randomised controlled trial on impact of screening on mortality from abdominal aortic aneurysm. BMJ. 2004;329(7477):1259.
10. Scott RA, Bridgewater S. G., Ashton H.A. . Randomized clinical trial of screening for abdominal aortic aneurysm in women. Britisch Journal of Surgery. 2002;89:283-5.
11. Lindholt J. S. VS, Juul S., Henneberg E. W. Fasting H. . The validity of ultrasonographic scanning as screening method for abdominal aortic aneurysm. European Journal of Vascular and Endovascular Surgery. 1999;17:472-5.
12. Cosford PA, Leng GC. Screening for abdominal aortic aneurysm. Cochrane Database Syst Rev. 2007(2):CD002945.
13. Lederle FA. The Last (Randomized) Word on Screening for Abdominal Aortic Aneurysms. JAMA Intern Med. 2016;176(12):1767-8.
14. Thompson SG, Ashton HA, Gao L, Scott RA, Multicentre Aneurysm Screening Study G. Screening men for abdominal aortic aneurysm: 10 year mortality and cost effectiveness results from the randomised Multicentre Aneurysm Screening Study. BMJ. 2009;338:b2307.
15. Cotter AR, Vuong K, Mustelin L, Yang Y, Rakhmankulova M, Barclay CJ, et al. Do psychological harms result from being labelled with an unexpected diagnosis of abdominal aortic aneurysm or prostate cancer through screening? A systematic review. BMJ Open. 2017;7(12):e017565.
16. Thompson SG, Ashton HA, Gao L, Buxton MJ, Scott RA, Multicentre Aneurysm Screening Study G. Final follow-up of the Multicentre Aneurysm Screening Study (MASS) randomized trial of abdominal aortic aneurysm screening. Br J Surg. 2012;99(12):1649-56.
17. Laine MT et al.: A Population-Based Study of Abdominal Aortic Aneurysm Treatment in Finland 2000 to 2014. Circulation. 2017 Oct 31;136:1726-1734
18. Wanhainen A, Hultgren R, Linne A, Holst J, Gottsater A, Langenskiold M, et al. Outcome of the Swedish Nationwide Abdominal Aortic Aneurysm Screening Program. Circulation. 2016;134(16):1141-8.
19. Lindholt JS, Søgaard R. Population screening and intervention for vascular disease in Danish men (VIVA): a randomised controlled trial. The Lancet. 2017;390(10109):2256-65.
20. Larsson E, Granath F, Swedenborg J, Hultgren R. A population-based case-control study of the familial risk of abdominal aortic aneurysm. J Vasc Surg. 2009;49(1):47-50; discussion 1.
21. Ravn H, Wanhainen A, Björk M. Risk of new aneurysms after surgery for popliteal artery aneurysm. Britisch Journal of Surgery. 2008;95:571-5.
22. Wanhainen A, Lundkvist J, Bergqvist D, Bjorck M. Cost-effectiveness of different screening strategies for abdominal aortic aneurysm. J Vasc Surg. 2005;41(5):741-51; discussion 51.
23. Piepoli MF, Hoes AW, Agewall S, Albus C, Brotons C, Catapano AL, et al. 2016 European Guidelines on cardiovascular disease prevention in clinical practice: The Sixth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of 10 societies and by invited experts)Developed with the special contribution of the European Association for Cardiovascular Prevention & Rehabilitation (EACPR). Eur Heart J. 2016;37(29):2315-81.
24. Erbel R, Aboyans V, Boileau C, Bossone E, Bartolomeo RD, Eggebrecht H, et al. 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases: Document covering acute and chronic aortic diseases of the thoracic and abdominal aorta of the adult. The Task Force for the Diagnosis and Treatment of Aortic Diseases of the European Society of Cardiology (ESC). Eur Heart J. 2014;35(41):2873-926.