Die Betreuung von Frauen in der Nachsorge bei gynäkologischen Tumorerkrankungen stellt vielfältige Ansprüche. Neben der frühen Erkennung eines Rezidivs sind mögliche Langzeitnebenwirkungen sowie psychoonkologische und psychosoziale Themen für die Betroffenen von hoher Relevanz. Aufgrund der ungünstigen Langzeitprognose des Ovarialkarzinoms sowie der Seltenheit der epithelialen / mesenchymalen Tumore des Corpus uteri richten wir unser Augenmerk im Beitrag lediglich auf das glanduläre Endometrium- und das epitheliale Zervixkarzinom.
Während bei Frauen mit der Diagnose einer gynäkologischen Tumorerkrankung in der Betreuung die oft beeinträchtigenden Therapien und deren Nebenwirkungen im Zentrum stehen, rückt in der Nachsorge insbesondere auch die Lebensqualität in den Fokus. In der Nachsorgephase beginnt für die Patientin häufig erst die intensivere Auseinandersetzung mit sich selbst, der Prognose und der Angst vor dem Rezidiv.
Standardisierte versus symptomorientierte Nachsorge – weniger ist oft mehr
Die Nachsorge wird einheitlich empfohlen, obwohl die Datenlage zur Nachsorge bei gynäkologischen Malignomen spärlich ist. Es liegen keine prospektiven oder gar randomisierten Studien vor, welche die Wirksamkeit einer standardisierten Untersuchung von asymptomatischen Frauen im Vergleich zu einer symptomorientierten Nachsorge untersuchen.
Endometriumkarzinom – Rezidivrisiko und Nachsorge
Die Rezidivrate des Endometriumkarzinoms ist insgesamt niedrig und liegt über alle Stadien verteilt bei 13%, wobei die Rückfallrate für die Patientinnen mit niedrigem Risiko bei lediglich knapp 3% liegt. In den vergangenen Jahren verbesserte sich die mittlere 5- bzw. 10-Jahresüberlebensrate auf 77% bzw. 70% (1). Die serösen oder klarzelligen Karzinome (Typ-II-Karzinome) sind insgesamt zwar seltener (10-15%), dennoch sind sie auf Grund ihre aggressiveren Biologie für 50% der Rückfälle verantwortlich. (2). Die Mehrheit der Patientinnen mit einem Rezidiv äussert Symptome und nur 30% aller Rezidive sind klinisch asymptomatisch. Bedenkt man, dass sich die Rezidive in etwa gleichen Teilen auf loko-regionäre Rezidive und auf Fernmetastasen aufteilen, erklären sich auch die häufigsten Symptome wie vaginale Blutungen, unspezifische Abdominalbeschwerden, Gewichtsverlust, Lymphödem und persistierender Husten (3). Je nach Studie traten 68-100% der Rezidive innerhalb der ersten drei Jahre nach Ende der Primärtherapie auf. Die PORTEC-1 Studie zeigt, dass die 3-Jahres-Überlebensrate bei einem isolierten Vaginalrezidiv nach Endometriumkarzinom mit 73% deutlich günstiger ist als bei einem pelvinen Rezidiv (14%) oder bei Fernmetastasierung (8%) (4). Nicht einheitlich ist die Studienlage bezüglich der Frage, ob die Überlebensdauer bei asymptomatischen Frauen mit Rezidiv länger ist als bei symptomatischen Rezidiven (5).
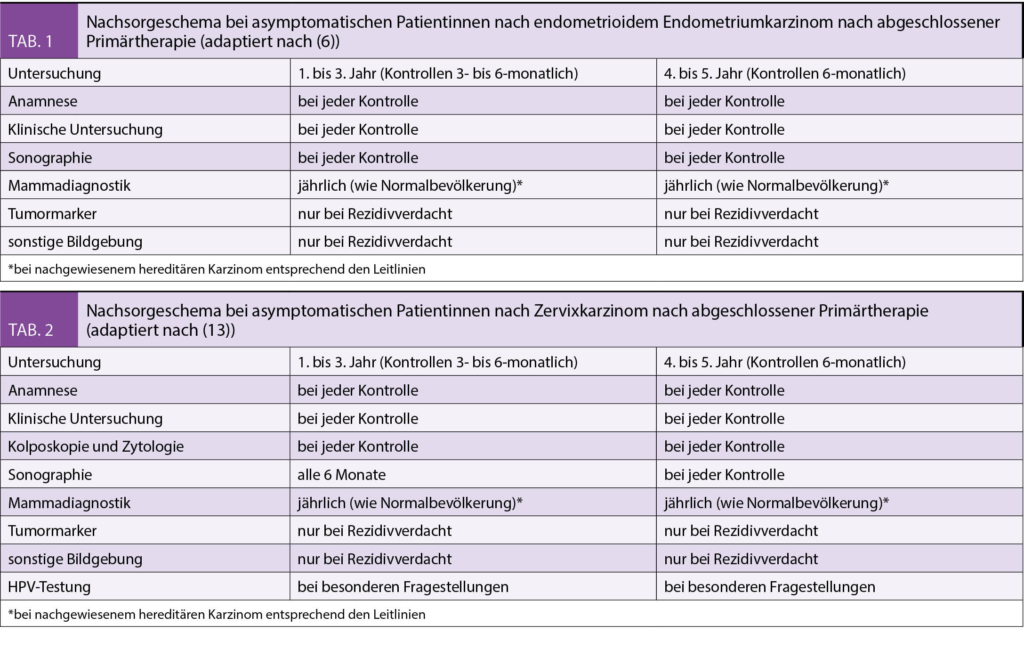
Beim Endometriumkarzinom beginnt die leitliniengerechte Nachsorge nach Abschluss der Primärtherapie und sollte in den ersten drei Jahren viertel – bis halbjährlich und in den Jahren vier und fünf in sechsmonatigen Abständen durchgeführt werden (6).
Die Nachsorge umfasst eine sorgfältige Anamneseerhebung hinsichtlich Beschwerden eines Rezidivs sowie Evaluation von Spät-/Langzeitfolgen der Primärtherapien mit ihren Auswirkungen auf die Lebensqualität. In der körperlichen Untersuchung inklusive Allgemeinstatus, gynäkologischer Spekulumeinstellung und rektovaginaler Palpation sowie Vaginalsonographie beziehungsweise Sonographie der ableitenden Harnwege ist die Erkennung eines Rezidivs oder Spätfolgen (6) der Therapie möglich. In einigen Studien konnte bereits durch die gynäkologische Untersuchung inklusive rektovaginaler Palpation eine Detektionsrate für Vaginalrezidive von 35–68 % erreicht werden ohne weitere apparative Diagnostik (7). Auch der zytologische Abstrich wird beim Endometriumkarzinom nicht mehr empfohlen, da er nicht kosteneffizient ist und in nur ca. 10% zur Diagnose beim asymptomatischen Rezidiv führt.
Zervixkarzinom – Rezidivrisiko und Nachsorge
Das mittlere 5- bzw 10 Jahresüberleben beim Zervixkarzinom liegt derzeit in der Schweiz bei 70% bzw. 60% (1). Eine systematische Literaturübersicht von 17 eingeschlossenen retrospektiven Studien von kurativ therapiertem Zervixkarzinom zeigt ein mittleres Intervall bis zum Rezidiv von 7-36 Monaten, etwa ¾ aller Rezidive treten somit in den ersten 2 Jahren nach Abschluss der Primärtherapie auf (8). Die Rezidivrate betrug 8-26 %, davon 14-57 % mit lokalem Beckenrezidiv und 15-61% mit Fernmetastasen (9). Unbestritten ist dabei, dass die Rezidivrate abhängig vom primären Tumorstadium ist (10), wobei bereits ab dem FIGO-Stadium ≥ IIB von einem fortgeschrittenen Stadium gesprochen wird und das Rezidivrisiko über 25% liegt. Klinisch asymptomatisch sind 25% der Patientinnen (11). Insbesondere das lokale Rezidiv äussert sich mit Symptomen wie Ausfluss, Blutungen, Schmerzen und Lymphödem. Patientinnen mit Metastasen haben häufiger unspezifische Symptome. Bei Frauen mit einem lokalen Rezidiv kann die Therapie mit einem kurativen Ansatz erfolgen, deshalb sind diese möglichst frühzeitig zu diagnostizieren. Insgesamt sind die Überlebensraten nach Therapie eines Rezidivs sehr ernüchternd.
Entgegen der noch gültigen S3-Leitlinie 2014 wird an anderen Stellen keine routinemässige Zervixzytologieabnahme nach Radiotherapie im Rahmen der Nachsorge empfohlen. Die technische Auswertung der Zytologie nach erfolgter Radiotherapie ist aufgrund von radiogenen Veränderungen oft erschwert und nur bedingt aussagekräftig. Weiterhin empfohlen wird die Zytologie des Vaginalstumpfes hingegen bei Frühstadien des Zervixkarzinoms, welche mit Hysterektomie therapiert wurde (12). Zum Nutzen der Kolposkopie in der Nachsorge des Zervixkarzinoms gibt es keine publizierten Daten. Sie kann hilfreich sein zur Detektion beim zentralen Rezidiv oder bei Residualtumoren sowie bei präinvasiven Rezidiv-/Zweitläsionen (VIN, VAIN). Ebenfalls ist die HPV-Bestimmung speziellen Fragestellungen vorbehalten (13).
Bildgebung in der Nachsorge des Endometrium- und Zervixkarzinoms
Die in jeder gynäkologischen Praxis zu Verfügung stehende Sonographie kann in der Nachsorge eingesetzt werden (6, 13, 14). Die transvaginale Sonographie ist kosteneffizient und zeigt eine hohe Detektionsrate für Rezidive gynäkologischer Malignome. Zusätzlich ermöglicht die transabdominale Sonographie eine frühzeitige Entdeckung eines Harnstaus als Komplikation der Operation oder Strahlentherapie.
Erst beim Vorliegen des klinischen Verdachts auf ein Rezidiv ist die Durchführung weiterführender diagnostischer Massnahmen empfohlen. Das frühzeitige Erkennen von Fernmetastasen führte in keiner Studie zu einer Verbesserung des Überlebens (3, 15, 16). Bildgebende Untersuchungen wie PET-CT, CT, MRI und Tumormarkerbestimmungen sind daher in der Nachsorge asymptomatischer Patientinnen nicht indiziert (12, 13).
Im Falle eines lokalen Rezidivs oder einer Fernmetastasierung ist nach der histologischen Sicherung, die immer erfolgen soll, eine Festlegung des weiteren Procedere abhängig von der Art der Primärtherapie und der Lokalisation des Rezidivs interdisziplinär zu diskutieren.
Die Tabellen 1 und 2 zeigen je ein Schema der Nachsorge bei Patientinnen mit Endometriumkarzinom bzw. Zervixkarzinom (Tabellen 1 und 2 nach 6, 13).
Psychoonkologische, psychosoziale und sexualmedizinische Beratung
Mit der Rückkehr in den Alltag nimmt das Thema Lebensqualität, einschliesslich sexueller Bedürfnisse, wieder an Bedeutung zu. Betrachtet man die aktuellen Langzeitüberlebensdaten des Endometrium- und Zervixkarzinoms, beinhaltet die Tumornachsorge eine Langzeitbetreuung der Frau im Beziehungsfeld von Familie, Partnerschaft, Beruf. Bei Patientinnen mit einer gynäkologischen Tumorerkrankung finden sich Anpassungsstörungen mit etwa 13%, gefolgt von Angststörungen mit 12% sowie depressive Störungen von 8% (17).
Ziel ist, im Gespräch diese Thematik zu erkennen, anzusprechen und geeignete Massnahmen einzuleiten. Weiter sollen standardisierte und validierte Screeningverfahren (Bsp. NCCN Distress Thermometer) zur Feststellung der psychosozialen Belastung sowie des psychoonkologischen Behandlungsbedarfs eingesetzt werden (18). Sekundäre Prävention im Sinne eines gesundheitsfördernden Verhaltens mit Beratung hinsichtlich Ernährung, Nikotinabstinenz, Gewichtskontrolle, körperlicher Aktivität sowie Stressreduktion spielen eine wichtige Rolle. Gewichtsabnahme bei vorbestehender Adipositas und regelmässige körperliche Aktivität wirken sich positiv auf krebsassoziierte Mortalität und die Lebensqualität aus. Fatigue ist ein unterschätztes Problem, welches oft lange nach Therapieende persistiert und auch durch körperliche Aktivität reduziert werden kann (min. 150 Minuten pro Woche moderate körperliche Aktivität und / oder in Kombination von allgemeinem Krafttraining zwei Mal pro Woche) (12, 19). Analog zur individualisierten Therapie sollte auch die Nachbetreuung individualisiert werden und neben den wenigen empfohlenen klinischen Untersuchungen Zeit für die individuelle Beratung der Patientin bieten.
Stadtspital Triemli
Frauenklinik
Birmensdorferstrasse 497
8063 Zürich
karin.breu@triemli.zuerich.ch
Stadtspital Triemli
Frauenklinik
Birmensdorferstrasse 501
8063 Zürich
heike.passmann@triemli.zuerich.ch
Stadtspital Triemli
Frauenklinik
Birmensdorferstrasse 497
8063 Zürich
stephanie.vonorelli@zuerich.ch
Die Autorinnen haben in Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
1. Bundesamt für Statistik (BFS) Nationales Institut für Krebsepidemiologie und -registrierung (NICER) Schweizer Kinderkrebsregister (SKKR) Schweizerischer Krebsbericht 2015
2. Del Carmen MG. Recurrent endometrial cancer. Clin Obstet Gynecol 2011; 54:266.
3. Fung-Kee-Fung M. Follow-up after primary therapy for endometrial cancer: a systematic review. Gynecol Oncol, 2006. 101(3):520–529
4. Creutzberg C.L. Survival after relapse in patients with endometrial cancer: results from a randomized trial. Gynecol Oncol 2003. 89(2):201–209
5. Gadducci, A. An intensive follow-up does not change survival of patients with clinical stage I endometrial cancer. Anticancer Res, 2000. 20(3B): p. 1977-84.
6. Leitlinienprogramm Onkologie (Deutsche Krebs-gesellschaft, Deutsche Krebshilfe, AWMF) 2018.S3-Leitlinie Diagnostik, Therapie und Nachsorge der Patientinnen mit Endometriumkarzinom, Langversion 0.1, 2018, AWMF Registernummer: 032/034-OL.
7. Salani, R. Recurrence patterns and surveillance for patients with early stage endometrial cancer. Gynecol Oncol, 2011. 123(2): p. 205-7.
8. Bodurka-Bevers, D. Posttherapy surveillance of women with cervical cancer: an outcomes analysis. Gynecol Oncol, 2000. 78(2): p. 187-93.
9. Elit L. Follow-up for women after treatment for cervical cancer: a systematic review. Gynecol Oncol, 2009. 114(3): p. 528-35.
10. Perez. Int J Radiat Oncol Biol Phys 1995 31 (4) 703
11. Van Nagell J.R. Therapeutic implications of patterns of recurrence in cancer of the uterine cervix. Cancer, 1979. 44(6): p. 2354-61.
12. Straughn J.M. Invasive cervical cancer: patterns of recurrence and posttreatement surveillance, uptodate, Juli 2019.
13. Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF) 2014. S3-Leitlinie Diagnostik, Therapie und Nachsorge der Patientin mit Zervixkarzinom, Version 1.0, 2014, AWMF-Registernummer: 032/033OL.
14. Testa AC. et al (2005) The role of sonographic examination in the follow-up of gynecological neoplasms.GynecolOncol99(3):696–703
15. (IKNL), I.K.N. Endometriumcarcinom. Versie: 3.0, 24. Okt. 2011. Landelijke richtlijn. 2011
16. N.C.C.N. Clinical practice guidelines in oncology: uterine neoplasms. 2015
17. Mehnert A. Four-week prevalence of mental disorders in patients with cancer across major tumor entities. J Clin Oncol, 2014. 32(31):3540–3546
18. Herschbach, P.W. Screeningverfahren in der Psychoonkologie. 2nd ed. 2010, Berlin: Deutsche Krebsgesellschaft.
19. Cramp F and Byron-Daniel J. Exercise for the management of cancer-related fatigue in adults. Cochrane Database Syst Rev, 2012. 11
20. Nout R.A. Five-year quality of life of endometrial cancer patients treated in the randomised postperative Radiation Therapy in Endometrial Cancer (PORTEC-2) trial and comparison with norm data. Eur J Cancer, 2012. 48(11): p. 1638-48
21. Heubner M 02/2019 Nachsorge bei gynäkologischen Tumorerkrankungen – Fluch oder Segen? Frauenheilkunde aktuell Pro/Contra
22. Almstedt K Nachsorge und Lebensqualität nach Therapie eines Ovarialkarzinoms. Onkologe, 2019 25:145-150
23. Uleer C Nachsorge, Rezidivtherapie, psychoonkologische Versorgung und Palliativmedizin des Endometriumskarzinoms, Gynäkologe, 2018. 51:1037 – 1046
24. Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF) (2015) Palliativmedizin für Patienten mit einer nicht heilbaren Krebserkrankung, Langversion 1.0, 2015, AWMF-Registernummer: 128/001OL.
25. Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF) (2014) S3-Leitlinie Psychoonkologische Diagnostik, Beratung und Behandlung von erwachsenen Krebspatienten, Version 1.1, Januar 2014.
26. Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF) (2017) S3-Leitlinie Supportive Therapie bei onkologischen Patientinnen, Langversion 1.1 – April 2017, AWMF-Registernummer: 032/054OL.