Screeninguntersuchungen in der Allgemeinbevölkerung zur Früherkennung von Ovarial- oder Mammakarzinomen sind von umstrittener Nützlichkeit respektive Kosteneffizienz. Die Identifizierung von Risikogruppen dagegen ist von grosser Bedeutung, um sie einer frühzeitigen adäquaten intensivierten Vorsorge zuzuführen. Dies geschieht aktuell abhängig von persönlicher Anamnese und Familienanamnese mittels Hochdurchsatzsequenzierung hoch-penetranter Gene. Neben BRCA1/2, den Hauptgenen für den hereditären Brust- und Eierstockkrebs, können auch weitere mit Mamma- oder Ovarialkarzinom assoziierte Gene analysiert werden.
Krebs ist die häufigste Todesursache bei Frauen zwischen 25 und 84 Jahren. Laut dem Bundesamt für Statistik ist das Mammakarzinom die häufigste Krebskrankheit der Frau. Das Ovarialkarzinom kommt nach dem Kolonkarzinom, Tumoren der Lunge/Bronchien/Luftröhre, Hautmelanom, Endometriumkarzinom, Non-Hodgkin-Lymphom und Pankreaskarzinom an 8. Stelle.
Screeninguntersuchungen
Es lässt sich ein Anstieg von jährlichen Brustkrebs-Neuerkrankungen feststellen. Aktuell liegt die Zahl bei ca. 8800/Jahr (BFS 2017). Reduziert hingegen haben sich die Brustkrebs-Sterbefälle, vermutlich die Folge von Krebsfrüherkennung und verbesserten Therapien. Wie die Krebsfrüherkennung geschehen soll ist schweizweit uneinheitlich und es stellt sich die Frage nach der Nützlichkeit eines Mammographie-Screenings der Allgemeinbevölkerung ab dem Alter von 50 Jahren (1). Zu beachten gilt auch, dass 20% der Brustkrebsfälle vor dem 50. Lebensjahr auftreten und somit durch ein Mammographie-Screening, das erst bei über 50-jährigen Frauen einsetzt, verpasst werden. Zudem ist wie Studien bei Hochrisikopatienten zeigen, die Sensitivität der Mammographie (ca. 40%) im Vergleich zum MRI (ca. 85%) gering (2). Die Kombination aus beiden bildgebenden Verfahren zeigte hier eine Sensitivität von ca. 93%, wobei die Spezifität der Mammographie mit ca. 94% im Vergleich zur Spezifität des MRIs mit ca. 85% und MRI plus Mammographie mit ca. 80% angegeben wird. Hierbei ist der Nutzen der intensivierten Vorsorgeuntersuchungen oder auch prophylaktischer Chirurgie im Sinne einer höheren Überlebenswahrscheinlichkeit bei Hochrisikopatientinnen mit BRCA-1/2 -Mutationen klar belegt (3).
Für das Ovarialkarzinom gibt es bisher keine als treffsicher erwiesene Vorsorgeuntersuchung. Eine starke Risikoreduktion kann bei BRCA-1/2-Mutationsträgerinnen mittels prophylaktischer Operationen erzielt werden. Deshalb ist die Identifizierung von genetisch bedingten Risikopersonen für intensivierte Vorsorgemassnahmen oder prophylaktische Chirurgie von grosser Wichtigkeit.
Genetik der Tumorentstehung
Karzinome entstehen immer durch eine Anhäufung von Genmutationen. Dadurch kommt es schliesslich zu vermehrtem Wachstum, Invasion und Metastasenbildung. Im Rahmen der «two hit hypothese» benötigt es zur Tumorinitiation je eine Mutation in den auf beiden Chromosomen (Allelen) vorhandenen Tumorsuppressor-Genen. Während beim sporadischen (nicht vererbten Krebs) diese Veränderungen im Verlauf des Lebens entstehen, ist beim hereditären Krebs eine Mutation (Keimbahnmutation) schon seit Geburt vorhanden. Es braucht im Verlauf des Lebens (vereinfacht dargestellt) dann nur noch eine Mutation zur Wegbereitung der Tumorentstehung, weshalb dann Tumoren häufiger und früher zu beobachten sind. Somit besteht im Falle des Vorliegens einer Keimbahnmutation z.B. im BRCA-1/2-Gen ein stark erhöhtes Krebserkrankungsrisiko. Die genetische Testung auf eine Keimbahnmutation wird aktuell abhängig von persönlicher Anamnese und Familienanamnese empfohlen. Richtlinien hierzu wurden in der Schweizerischen Ärztezeitung publiziert (4) und sind unter folgendem Link auf der SAKK-Homepage zu «Genetic counseling» jederzeit einzusehen: https://www.sakk.ch/sites/default/files/2018-11/Swiss_guidelines_for_counseling_and_testing_for_genetic_predisposition_to_breast_and_ovarian_cancer.pdf.
BRCA1- und BRCA2-assoziiertes hereditäres Mamma- und Ovarialkarzinom
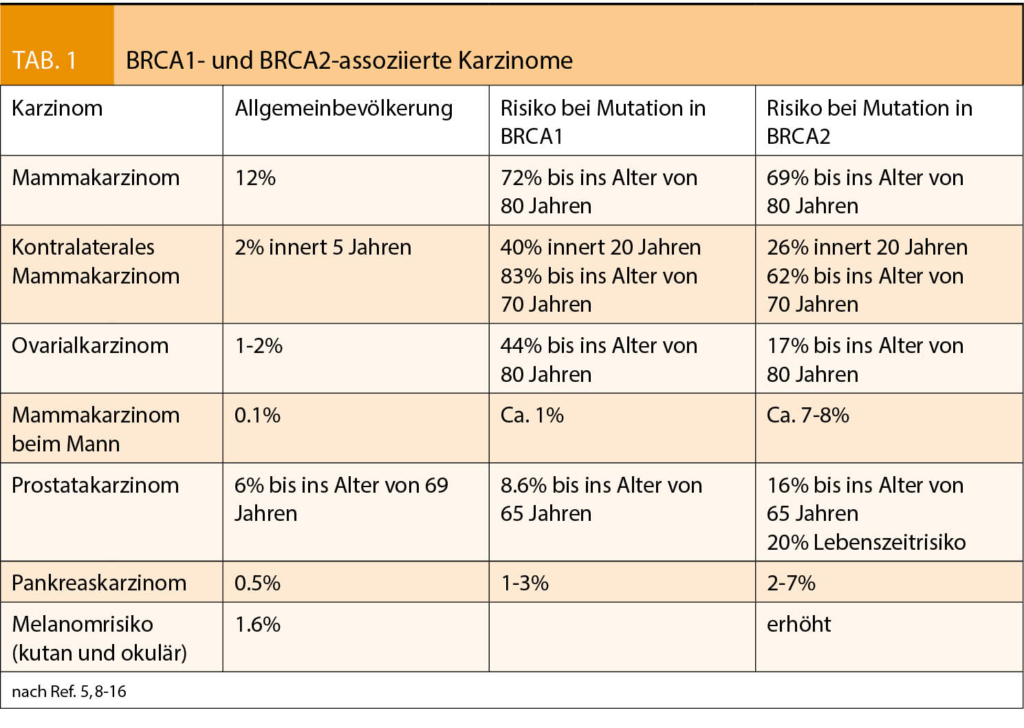
BRCA-1/2-Mutationen führen zu einem erhöhten Erkrankungsrisiko für Mammakarzinome bei Frauen und Männern, Ovarialkarzinomen (inklusive Tuben- und primären peritonealen Karzinomen), Prostatakarzinomen, Pankreaskarzinomen und Melanomen. Die Prävalenz von BRCA-1/2-Mutationen wird generell bei ca. 1:400 bis 1:500 angenommen (5, 6, 7). Eine Zusammenfassung der wichtigsten Karzinomerkrankungsrisiken bei BRCA-1/2-Mutationen findet sich in (Tab. 1). Zusätzlich wird auch ein erhöhtes Risiko für weitere Krebserkrankungen diskutiert.
Aufgrund oben genannter Erkrankungsrisiken werden bei Mutationsträgerinnen aktuell folgende Vorsorgeuntersuchungen empfohlen (ESMO/ NCCN guidelines (17, 18)):
- Monatliche Selbstuntersuchung der Brust ab dem Alter von 18 Jahren
- Halbjährliche klinische Brustuntersuchung ab dem Alter von 25 Jahren
- Jährliches MRI der Brust im Alter von 25-29 Jahren
- Jährliches MRI der Brust und zusätzlich Mammographie im Alter von 30-75 Jahren
- Option der prophylaktischen Mastektomie (mit Risikoreduktion um ca. 90-95%)
- Adnexektomie nach abgeschlossener Familienplanung typischerweise im Alter von 35-40 Jahren oder im Alter von 40-45 Jahren für BRCA2
- Mutationsträgerinnen (mit Risikoreduktion um ca. 95%)
- Allenfalls transvaginaler Ultraschall mit CA-125-Bestimmung auch bei unklarem Benefit falls keine Adnexektomie durchgeführt werden sollte
- optional Chemoprävention mit Tamoxifen für 5 Jahre
Bei männlichen Mutationsträgern werden folgende Vorsorgeuntersuchungen empfohlen:
- Brustselbstuntersuchung ab dem Alter von 35 Jahren mit allenfalls Basismammographie
- Jährliche klinische Untersuchung der Brust ab dem Alter von 30-35 Jahren
- Prostatakrebs-Screening ab dem Alter von 40-45 Jahren bei BRCA2-Mutationsträgern, allenfalls auch bei BRCA1-Mutationsträgern
Für beide Geschlechter sind ab dem Alter von 30 bis 35 Jahren auch jährliche Haut- und Augenhintergrundsuntersuchungen bezüglich des erhöhten Melanomrisikos bei BRCA2-Mutationsträgern empfohlen.
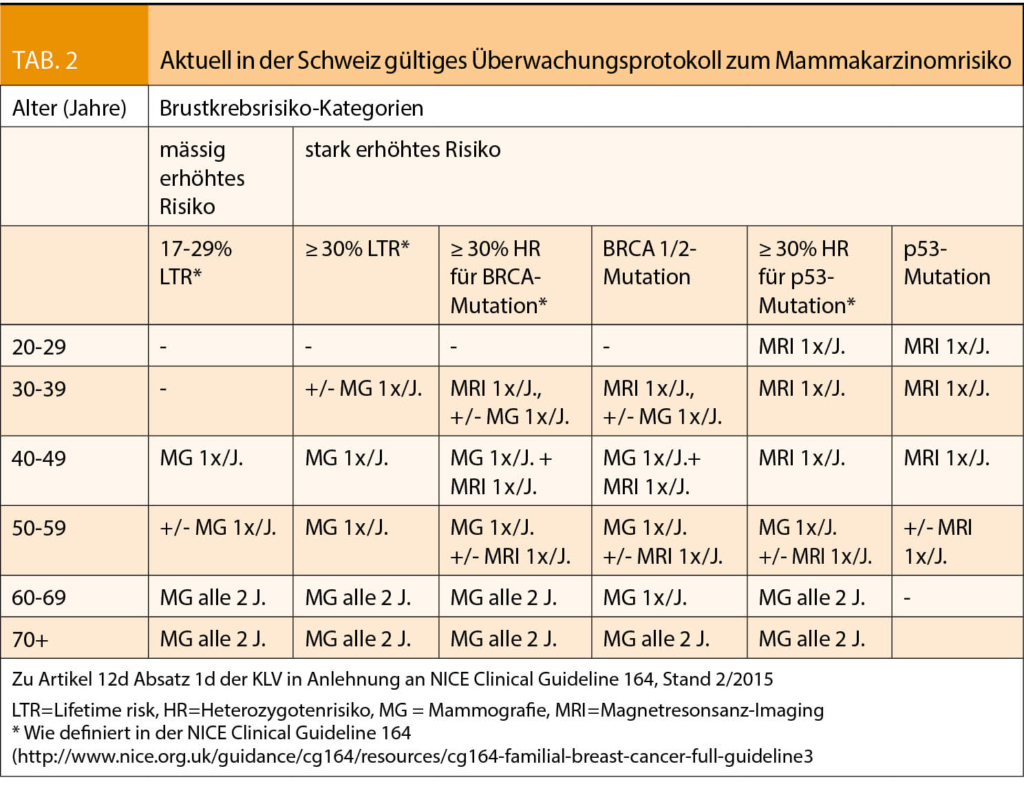
Im klinischen Alltag berücksichtigen wir in der Schweiz grösstenteils die oben genannten Richtlinien in der Betreuung unserer Patientinnen und Patienten. Ein Unterschied besteht aber im Einsatz der bildgebenden Verfahren in der Überwachung hinsichtlich Mammakarzinomrisikos, siehe (Tab. 2). Hier sind die in der jeweiligen Risiko- und Alterskategorie von den Krankenkassen aktuell obligat rückvergüteten Vorsorgeuntersuchungen zusammengefasst. Eine MRI-Untersuchung wird bei BRCA1/2-Mutationsträgerinnen und ihren Töchtern oder Schwestern ab dem Alter von 30 Jahren bis 50 Jahren, gegebenenfalls bis 60 Jahren vergütet. Bei Frauen mit einer TP53-Mutation, also einem SBLA-Syndrom (siehe auch Tab. 3) mit häufig sehr frühem Erkrankungsalter und ihren Töchtern oder Schwestern werden MRIs aber bereits ab dem Alter von 20 Jahren routinemässig rückerstattet. In einer besonderen Situation kann jeweils eine spezifische Kostengutsprache im Einzelfall angefragt werden. In der Regel fängt man mit der Bildgebung 5 bis 10 Jahre vor der Diagnosestellung bei der jüngsten Erkrankten an.
Aufgrund des oben beschriebe-nen Tumorentstehungsmechanismus, hängt das Risiko für die Krebserkrankung nicht nur von der genetischen Prädisposition ab, sondern auch Umwelt- und Lebensstilfaktoren können einen Einfluss haben. Es zeigt sich insbesondere eine Reduktion des Brustkrebserkrankungsrisikos bei Mutationsträgerinnen durch körperliche Aktivität und gesundes Körpergewicht, ähnlich wie in der Allgemeinbevölkerung. Einen Übersichtsartikel auf Deutsch über die Auswirkungen des Lebensstils bei BRCA-Mutationsträgerinnen wurde mit entsprechenden Literaturangaben im Leading Opinions Gynäkologie und Geburtshilfe 3/2017 publiziert (19).
Zu beachten gilt auch ein Risiko für autosomal-rezessive Erkrankungen bei Nachkommen, wenn der Partner ebenfalls Träger einer Mutation in demselben Gen sein sollte. Biallelische Mutationen im BRCA2-Gen führen zur Fanconi-Anämie und biallelische BRCA1-Mutationen können zu einer Fanconi-Anämie ähnlichen Erkrankung mit Mikrozephalie, Kleinwuchs, Entwicklungsrückstand und Krebsprädisposition führen (20).
Bei nachgewiesener Mutation kann sich zudem die Therapie bei einem Karzinom ändern (z. B. Chemotherapie mit Cisplatin oder Therapie mit PARP-Inhibitoren bei BRCA1- oder -2-Mutationen; Zurückhaltung mit Bestrahlung bei TP53 und biallelischen ATM-Mutationen).
Hochdurchsatzsequenzierung bei Verdacht auf hereditäres Ovarial- und Mammakarzinom
Neben den Genen BRCA1 und BRCA2 sind aktuell weitere hochpenetrante Gene bekannt, welche mit einem stark erhöhten Erkrankungsrisiko für Brust- oder Eierstockkrebs assoziiert werden. Da Mutationen in diesen Genen auch mit klaren klinischen Konsequenzen im Sinne von Vorsorgeuntersuchungen oder chirurgischen Massnahmen für damit assoziierte spezifische Krebserkrankungen verbunden sind, wird in der gängigen Praxis zunehmend eine Testung einer Gruppe von Genen durchgeführt, anstelle von lediglich einer BRCA1/2-Testung. Die genaue Anzahl der Gene, die in Frage kommen, richtet sich nach der individuellen persönlichen Anamnese und der Familienanamnese. Generell wird aktuell empfohlen eine Gruppe von Genen mit gut bekannten Erkrankungsrisiken und entsprechend vorgeschlagenen Vorsorgeuntersuchungen/ Massnahmen (nach ESMO/NCCN guidelines) im Falle einer detektierten Mutation zu testen (Empfehlung SAKK) und NICHT ein möglichst breites Panel von Genen mit wenig klinischer Relevanz. Unter folgendem Link finden Sie auf der SAKK-Homepage weitere Informationen: https://www.sakk.ch/sites/default/files/2018-11/CPTC_Network_statement_on_panels_combined.pdf
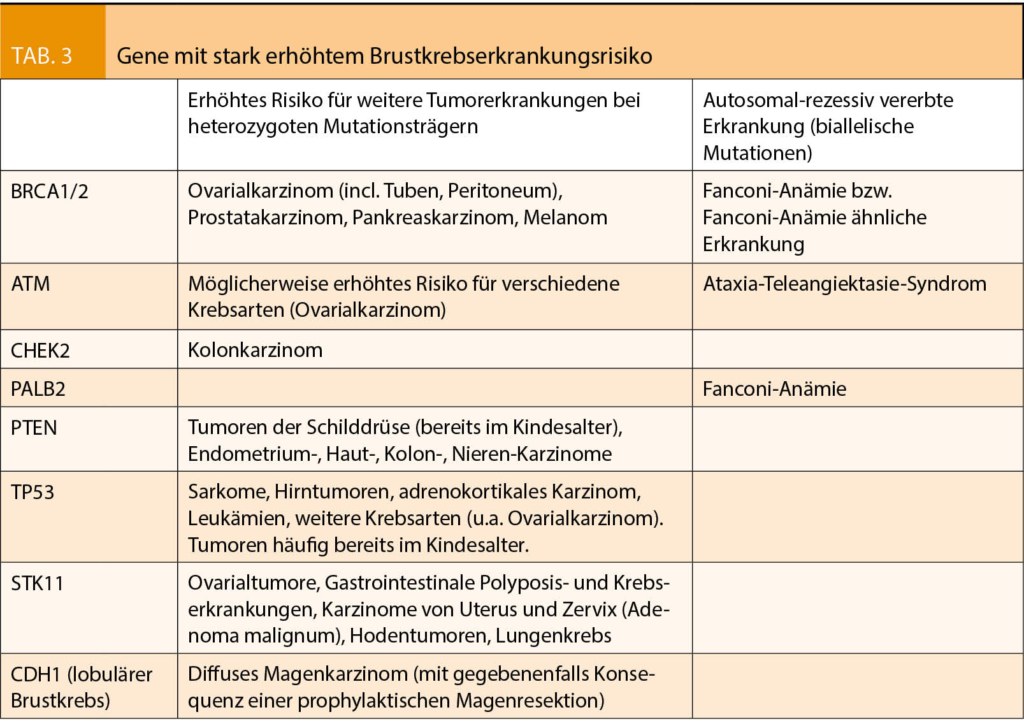
Bei hereditärem Brustkrebs sind dabei folgende Gene zu nennen: BRCA1/2, ATM, CHEK2, PALB2, PTEN, TP53, STK11, CDH1 (bei lobulärem Brustkrebs), beim hereditären Ovarialkarzinom sind es die Gene BRCA1/2, BRIP1, Lynch-Syndrom-Gene (MLH1, MSH2, MSH6), RAD51C und RAD51D. Laut aktueller Analysenliste kostet die Analyse von 1-10 Genen mittels Hochdurchsatzsequenzierung im Grundpreis 2900.- CHF, für 11-100 Gene 3300.- CHF. Zur Überprüfung einer detektierten Sequenzvariante oder Exon-Deletion- oder Duplikation können zusätzliche Analyseschritte mittels Sanger-Sequenzierung der entsprechenden Stelle bzw. mittels MLPA notwendig werden mit entsprechend höheren Kosten, so dass die Gesamtkosten einer Abklärung auf bis zu ca. CHF 4000.- zu stehen kommen. Je nach Anamnese bzw. Familienanamnese (4) sollte nach Artikel 12d KLV eine genetische Testung bei Patienten und Angehörigen ersten Grades von der Krankenkasse übernommen werden, wenn die Indikation dazu durch einen Facharzt medizinische Genetik oder ein Mitglied des «Network for Cancer Predisposition Testing and Counseling» der Schweizerischen Arbeitsgemeinschaft für Klinische Krebsforschung (SAKK) gestellt wird. Bei Unklarheiten hinsichtlich Indikation oder Erfüllung der WZW-Kriterien wird das Einholen einer Kostengutsprache empfohlen.
Eine genetische Beratung vor der genetischen Testung mit Besprechung der möglichen Konsequenzen eines pathologischen Befundes in allen im Panel vorgeschlagenen Genen und der Möglichkeit eines eventuellen unklaren Befundes ist von grosser Wichtigkeit. Bei BRCA1 und 2 ergeben sich in ca. 5% unklare Resultate, bei grösseren Genpanels bis zu 30%. Je nach Situation und Wunsch des Patienten kann es auch sinnvoll sein, nur die Gene BRCA1/2 zu testen oder auch stufenweise vorzugehen. Dabei gilt v.a. auch zu beachten, dass Mutationen in den oben aufgeführten Genen nicht nur zu einem erhöhten Mamma- und Ovarialkarzinomrisiko führen, sondern auch mit anderen Krebserkrankungen, je nach Mutation bereits im Kindesalter, assoziiert werden (Tab. 3). Das Wissen bezüglich spezifischer Erkrankungsrisiken je nach Mutation wird jedoch mit grosser Wahrscheinlichkeit zunehmen/bzw. sich ändern und vor der genetischen Beratung v.a. im Falle eines pathologischen Befundes muss die aktuelle Literatur jeweils konsultiert werden.
Wie oben erwähnt, sollte auch im vornherein darauf hingewiesen werden, dass ein unklarer Befund folgen kann. Je mehr Gene untersucht werden, umso höher ist die Wahrscheinlichkeit, dass eine seltene Genvariante unklarer Krankheitsrelevanz identifiziert wird. Nach aktuellem Wissensstand kann der Befund dann noch nicht klassifiziert werden, ob es sich um eine pathogene oder benigne Genvariante handelt, so dass eine «variant of un-known significance = VUS» befundet wird. Aufgrund einer unklaren Variante sollen keine Konsequenzen, wie z.B. prophylaktische Operationen oder die Testung von gesunden Angehörigen, gezogen werden. Auch muss dem Patienten mitgeteilt werden, dass im Falle eines unauffälligen Resultates eine genetische Prädisposition dennoch nicht ausgeschlossen werden kann.
Institut für Medizinische Genetik der Universität Zürich
Schlieren
azzarello-burri@medgen.uzh.ch
Universitätsspital Basel, Frauenklinik
Spitalstrasse 21, 4031 Basel
nicole.buerki@usb.ch
Institut für Medizinische Genetik der Universität Zürich
Schlieren
Die Autorinnen haben deklariert, keine Interessenskonflikte in Zusammenhang mit diesem Beitrag zu haben.
1. Biller-Andorno N, Jüni P. Abolishing Mammography Screening Programs? A View from the Swiss Medical Board. N Engl J Med 2014;370(21):1965-1967
2. Phi X et al. Magnetic Resonance Imaging Improves Breast Screening Sensitivity in BRCA Mutation Carriers Age ≥ 50 Years: Evidence From an Individual Patient Data Meta-Analysis. J Clin Oncol 2015 ;33(4) :349-356
3. Kurian A W et al. Survival Analysis of Cancer Risk Reduction Strategies for BRCA1/2 Mutation Carriers. J Clin Oncol 2010 ;28(2) :222-231
4. Chappuis P O et al. Genetic predisposition to breast and ovarian cancer. Schweiz Ärzteztg 2017 ;98(21-22) :682-684
5. Petrucelli N et al. BRCA1- and BRCA2-Associated Hereditary Breast and Ovarian Cancer. GeneReviews 2016
6. Anglian Breast Cancer Study Group. Prevalence and penetrance of BRCA1 and BRCA2 mutations in a population-based series of breast cancer cases. Br J Cancer 2000 ;83(10) :1301-1308
7. Whittemore A S et al. Prevalence of BRCA1 Mutation Carriers among U.S. Non-Hispanic Whites. Cancer Epidemiol Biomarkers Prev. 2004;13(12):2078–83
8. Kuchenbaecker K B et al. Risks of Breast, Ovarian, and Contralateral Breast Cancer for BRCA1 and BRCA2 Mutation Carriers. JAMA 2017 ; 317(23) :2402-2416
9. Mavaddat N et al. Cancer Risks for BRCA1 and BRCA2 Mutation Carriers: Results From Prospective Analysis of EMBRACE. J Natl Cancer Inst 2013 ;105(11) :812-822
10. Tai Y C et al. Breast Cancer Risk Among Male BRCA1 and BRCA2 Mutation Carriers. J Natl Cancer Inst 2007 ;99(3) :1811-1814
11. Evans D G R et al. Risk of breast cancer in male BRCA2 carriers. J Med Genet 2010 ;47 :710-711
12. Mersch J et al. Cancers Asscoiated with BRCA1 and BRCA2 Mutations other than Breast and Ovarian. Cancer 2015 ;121(2) :269-275
13. Moran A. et al. Risk of cancer other than breast or ovarian in individuals with BRCA1 and BRCA2 mutations. Familial Cancer 2012 ;11 :235-242
14. Van Asperen C J et al. Cancer risks in BRCA2 families: estimates for sites other than breast and ovary. J Med Genet 2005 ;42 :711-719
15. Thompson D et al. Cancer incidence in BRCA1 mutation carriers. J Natl Cancer Inst 2002 ;94(18) :1358-1365
16. Breast Cancer Linkage Consortium. Cancer risks in BRCA2 mutation carriers. J Natl Cancer Inst 1999 ;91(15) :1310-1316
17. Paluch-Shimon S et al. Prevention and screening in BRCA mutation carriers and other breast/ovarian hereditary cancer syndromes: ESMO Clinical Practice Guidelines for cancer prevention and screening. Annals of Oncology 2016 ;27(Supplement 5) :v103-v110
18. NCCN Guidelines Version 2.2019 BRCA-Related Breast and/or Ovarian Cancer Syndrome
19. Azzarello-Burri S M, Rauch A. Auswirkungen von Lebensstil und Genetik. Leading Opinions Gynäkologie und Geburtshilfe 2017; 3:28-30
20. Freire B L et al. Homozygous loss of function BRCA1 variant causing a Fanconi-anemia-like phenotype, a clinical report and review of previous patients. Eur J Med Genet 2018 ;61 :130-133