Zunehmende Evidenz belegt, dass sich mit einem Lungenkrebs-Screening-Programm mittels Niederdosis-Computertomographie (LDCT) die Mortalität in einer Risikopopulation signifikant senken lässt. Neuere Daten zeigen, dass eine strikte Selektion von Teilnehmenden in einem LDCT-Screening-Programm und Messung der Volumetrie von Rundherden die Häufigkeit falsch positiver Befunde reduziert. Eine multidisziplinäre Arbeitsgemeinschaft von Interessensgruppen und Experten für Lungenkarzinom-Screening, die «Schweizerische Lung Cancer Screening Implementation Group» (CH-LSIG), unterstützt die Etablierung eines Schweizerischen Lungenkrebs-Screening-Programms. Dieser Artikel widmet sich dem Lungenkarzinom-Screening, einem der Startprojekte des «Expertengremiums Krebsfrüherkennung», welches 2018 im Rahmen eines Pilotprojekts der Nationalen Strategie gegen Krebs eingesetzt wurde.
Mit 3 200 Todesfällen jährlich ist das Lungenkarzinom die häufigste krebsassoziierte Todessache in der Schweiz (1). Jedes Jahr werden 4 300 neue Fälle mit Lungenkarzinom diagnostiziert (4 363 in 2015, 4 252 in 2014, 4 293 in 2013). Der hauptsächliche Risikofaktor für das Lungenkarzinom ist Tabakrauchen, sodass die Inzidenz und Mortalität mit 20- bis 30-jähriger Latenz folgen. Diese Tatsache erklärt auch, warum in der Schweiz die Mortalität des Lungenkarzinoms bei Männern fällt, aber bei Frauen noch zunimmt.
Niederdosis-Computertomographie ermöglicht Lungenkrebs-Detektion im Frühstadium
Lungenkrebs hat eine detektierbare, aber häufig asymptomatische und mehrjährige präklinische Phase, sowie eine effektive chirurgische Behandlungsoption. Deshalb wurden verschiedene Methoden der Früherkennung in den letzten 20 Jahren untersucht. Niederdosis-Computertomographie (LDCT) ist ein sensitives bildgebendes Verfahren, welches die Detektion von Lungenkrebs in einem Frühstadium ermöglicht. Es gibt aktuell zunehmende Evidenz, dass eine adäquate diagnostische und therapeutische Strategie nicht nur die spezifische Mortalität von Lungenkrebs, sondern auch die Gesamtmortalität senkt. Im US National Lung Screening Trial (NLST) konnte die Mortalität von Lungenkrebs um 20% (relative Risikoreduktion) gesenkt werden, was eine «number needed-to-screen» von rund 320 entsprach (2). Die Ergebnisse der in Holland und Belgien durchgeführten NELSON-Studie wurden zum ersten Male im September 2018 an der Weltkonferenz für Lungenkrebs vorgestellt. Dabei wurde gezeigt, dass die Lungenkrebsmortalität sich um 26% reduzieren liess (3). In einer kleineren Subgruppe von Frauen verminderte LDCT-Screening die Todesrate sogar um 50%. Die NELSON-Studie ist wichtig, da sie Lungenrundherde mittels Volumetrie untersuchte, um suspekte Lungenrundherde zu beobachten und so falsch positive Befunde, verglichen mit dem NLST, deutlich vermindern konnte. Auch die kürzlich publizierten italienischen MILD- und deutschen LUSI-Studien konnten im 8- bis 10-Jahres-Verlauf einen andauernden Vorteil des LDCT-Screenings mit einer 36 bis 39%igen relativen Risikoreduktion für die Lungenkrebsmortalität und einer 20%igen relativen Risikoreduktion für die Gesamtmortalität in der MILD-Studie zeigen (4, 5).
Somit kumuliert sich die Evidenz, dass die Früherkennung von Lungenkrebs Potenzial hat, Leben zu retten. Eine kürzlich publizierte Mikro-Simulationsstudie konnte ausserdem zeigen, dass dies in der Schweiz mit grosser Wahrscheinlichkeit eine kosteneffektive Intervention ist (ca. 30 000 Schweizer Franken pro gerettetes Lebensjahr) (6). Bisher sind die USA, Grossbritannien und Polen die einzigen Länder, in denen das LDCT-Lungenkrebsscreening bereits eingeführt oder, nach Empfehlung verschiedener Fachgesellschaften, in Vorbereitung ist. In Europa warten eine Vielzahl Länder auf die Veröffentlichung der Ergebnisse der NELSON-Studie und Erneuerung der Gesundheitstechnologiebewertung, auf welchen die Einführung eines Lungenkrebs-Screening-Programms basiert sein wird. Die Verzögerung ist teilweise auch der Rate falsch positiver Untersuchungsresultate im NSLT mit potenziellen Nebenwirkungen invasiver diagnostischer Zusatzuntersuchungen oder Behandlungen geschuldet. Obwohl LDCT-Screening mit grosser Wahrscheinlichkeit kosteneffektiv sein wird (ein relativer Ausdruck), ist von substanziellen Mehrkosten (d.h. absoluten Kosten) auszugehen: Mit einer Teilnahmequote von 10% der für das Screening in Frage kommenden Personen wird der Mehraufwand mit ca. 16 Millionen Franken jährlich für die Schweiz beziffert.
Schweizer Dienstleister, unter anderem eine Stiftung (http://www.lungendiagnostik.ch/) mit assoziierten Privatspitälern, bieten bereits seit mehreren Jahren ein LDCT-Screening für asymptoma-tische Personen an.
In der Schweiz besteht gegenwärtig fürs Lungenkarzinomscreening ein Vakuum. Eine zukünftige Strategie wird für die nachhaltige Durchführbarkeit und Finanzierung eines hochqualitativen LDCT-Screening-Programms verschiedene Interessensgruppen berücksichtigen müssen, von potenziellen TeilnehmerInnen zu Leistungserbringern und verschiedenen Akteuren im öffentlichen Gesundheitswesen.
Aktuelle Daten und Evidenz
In der Schweiz wurde verschiedentlich versucht, die Auswirkung, Kosteneffizienz, Durchführbarkeit und Finanzierung von LDCT-Lungenkrebsscreening zu berechnen. Wie bereits erwähnt, konnte eine Modellierungsstudie zeigen, dass LDCT-Lungenkarzinomscreening potenziell die Mortalität in der Schweiz, einem Land mit hoher Raucherprävalenz mit akzeptablem Kosten-Risikoverhältnis reduzieren kann. Auch wenn die Durchführbarkeit bisher nicht systematisch untersucht wurde, zeigen erste Erfahrungen am Universitätsspital Zürich, dass die Integration eines Screening-Programms in die aktuelle klinische Routine mit substanziellen Personalressourcen und einer Anpassung der Prozesse sowie einer geeigneten Infrastruktur verbunden ist. So ist ein spezifisches Team in den Abteilungen für Radiologie, Pneumologie und Thoraxchirurgie notwendig, um den Anforderungen eines LDCT-Lungenkarzinom-Screening-Programms gerecht zu werden (Prof. T. Frauenfelder, mündliche Kommunikation). Diese Anpassungen betreffen im Übrigen auch nur diejenigen Menschen, welche sich tatsächlich einem Screening unterziehen möchten (vermutlich rund 10-20%). Für den ersten Schritt der Information über ein Screening-Programm und den Prozess der Entscheidungsfindung, ob man ein Screening-Zentrum aufsucht, gibt es derzeit noch keine Strukturen. In anderen Ländern (z.B. Polen) erfolgt dieser Schritt über Hausärzte, während man sich dafür in der Schweiz die Hausärzte, aber auch Gesundheitsorganisationen wie z.B. die Lungenliga, vorstellen könnte.
Die CH-LSIG, hat in einem Statement über LDCT-Lungenkrebsscreening die grundlegenden Anforderungen eines zukünftigen Früherkennungsprogramms festgehalten (7). In diesem Statement wird von 300 000 Frauen und Männern in der Schweiz ausgegangen, welche sich als Risiko-Zielgruppe potenziell für ein LDCT-Screening qualifizieren würden. Aufgrund der geographischen Verteilung von Dienstleistern und Zentren des Gesundheitswesens, welche ein Screening anbieten könnten, sowie der elektiven Natur der Untersuchung, kommt die Expertengruppe zum Schluss, dass ein landesweites Screening-Programm durchführbar wäre.
Daten zur Finanzierbarkeit eines LDCT-Lungenkrebs-Screening-Programms sind bisher unvollständig. Auch wenn die oben erwähnte Modellierungsstudie davon ausgeht, dass ein solches Früherkennungsprogramm mit grosser Wahrscheinlichkeit mit einem akzeptablen Kosten-Nutzen-Verhältnis unter 100 000 Schweizer Franken pro gerettetes Lebensjahr durchgeführt werden könnte, bestehen noch Unklarheiten über die absoluten Kosten und deren Verteilung zwischen potenziellen Kostenträgeren (Krankenversicherungen, TeilnehmerInnen im Screening-Programm, und Nicht-Profit-Organisation wie die Lungenliga).
Das Bundesamt für Gesundheit (BAG) hat die Evaluierung und Entscheidung zur Etablierung eines nationalen Lungenkrebs-Screening-Programms bis zur Publikation der NELSON-Studiendaten verschoben.
Auch stehen bisher ungenügend Daten zur Verfügung über die Bereitschaft potenzieller TeilnehmerInnen im Screening-Programm, einen Teil der Kosten zu tragen oder bezüglich der Möglichkeit, dass Dienstleister die Kosten für notwendige Personalressourcen und Anpassung der Infrastruktur übernehmen würden.
Die anlässlich der Lungenkarzinom-Weltkonferenz im September 2018 präsentierten Ergebnisse der NELSON-Studie zeigten eine 26%ige relative Risikoreduktion bei Männern, was in medizi-nischen Fachgesellschaften international eine breite Unterstützung für den Aufbau nationaler Screeningprogramme ausgelöst hat (3). Dies wurde bereits im 2017 erschienen «European position statement on lung cancer screening» propagiert (8). Gegenwärtig wird in Polen ein Screening-Programm initiiert und in Grossbritannien erweitert das öffentliche Gesundheitswesen NHS das vorhandene Pilotprogramm. Auch etabliert die europäische Gesellschaft für thorakale Bildgebung (European Society for Thoracic Imaging, ESTI) einen Zertifizierungsprozess für Lungenkarzinomscreening bei Radiologen. Dieser wird von der Europäischen Gesellschaft für Radiologie unterstützt und basiert auf Webinaren sowie Kursen zur Diagnostik von Rundherden und dem Einsatz von Diagnostik-Software (computeraided diagnosis, CAD).
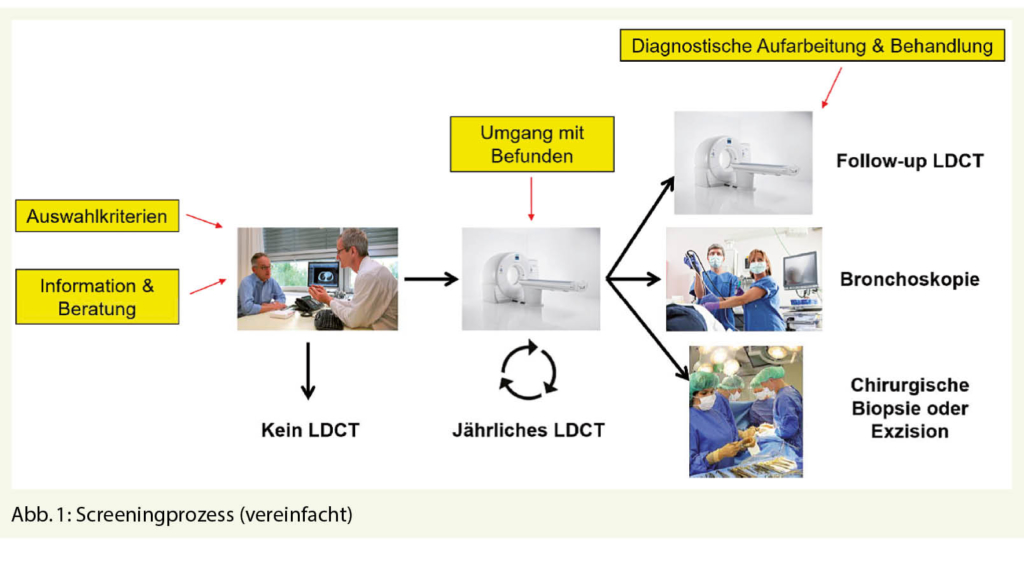
Trotzdem bleiben einige grundlegende Fragen bisher unbeantwortet, welche anhand des Screening-Prozesses illustriert werden können (Abb. 1). Ein wichtiger Aspekt ist die Tatsache, dass Lungenkrebs-Screening deutlich komplexer als die Durchführung einer einzelnen Screeninguntersuchung ist. Der Prozess beginnt mit einer Information der TeilnehmerInnen aus der Risikopopulation (z.B. 60- bis 80-jährig und mindestens 30 packyears Tabakrauchen oder zusätzliche/andere Kriterien). Ziel ist es, dass TeilnehmerInnen im Screeningprogramm eine informierte Entscheidung treffen können, ein LDCT durchzuführen. Nach dem ersten LDCT findet eine Konsultation statt, um die Untersuchungsergebnisse zu besprechen, Risikofaktoren zu thematisieren und zu entscheiden, welche Folgeuntersuchungen stattfinden sollen. Diese könnten bei einer suspekten Läsion entweder diagnostische Verfahren beinhalten oder weitere Nachkontrollen zur Folge haben. Der Screening-Prozess kann auch zu einer Behandlung führen, welche auch ein spezifisches Monitoring beinhaltet.
Es gibt zunehmend wissenschaftliche Evidenz für jeden Schritt des Screening-Prozesses. Sowohl die Studien NSLT, MILD, LUSI und NELSON, als auch die Modellierungsstudien von Tomonaga et al. werden zukünftig eine detaillierte Evaluierung des Prozesses über Nutzen, Nebenwirkungen und Kosten ermöglichen.
Relevanz des Lungenkarzinomscreenings im Schweizer Kontext
Lungenkrebs hat die höchste karzinomassoziierte Mortalität in der Schweiz und in Europa, hauptsächlich wegen der späten Diagnose im fortgeschrittenen Stadium, welches keinen kurativen Therapieansatz mehr zulässt. Mehrere Studien für Lungenkrebs-Screening mit LDCT zeigen eine klare Evidenz für eine signifikante Reduktion der Lungenkrebsmortalität.
Gegenwärtig werden in den USA Lungenkrebs-Screeningprogramme etabliert und mehrere europäische Länder folgen diesem Beispiel. In der Schweiz findet aktuell eine politische Debatte über die Kosten im Gesundheitswesen statt, mit Kritik an etablierten Präventionsmassnahmen wie das Screeningprogramm beim Mammakarzinom. Deshalb wird eine zukünftige Lungenenkrebsprävention eine evidenzbasierte Etablierung eines Screeningprogramms benötigen, unter aktivem Einbezug involvierter Interessensgruppen.
Die CH-LSIG unterstützt deshalb ein national koordiniertes Programm zur Erfassung und wissenschaftlichen Auswertung sämtlicher Daten und Outcomes. Ein «opportunistisches» Screening ausserhalb eines Programmes wird von der CH-LSIG nicht empfohlen. Wünschen Patienten trotzdem eine LDCT Untersuchung, sollten sie vorher umfassend über Risiko und Nutzen aufgeklärt werden.
Ein zukünftiges Schweizer Programm sollte über einen «bottom-
up»-Ansatz der verschiedenen Interessensgruppen etabliert und durch eine Implementierungsanalyse wissenschaftlich begleitet werden, mit dem primären Ziel, die Lungenkrebs-Mortalität zu senken und falsch positive Befunde zu reduzieren.
Eine solche breite und integrative Strategie bezweckt, alle Interessensgruppen während des Implementierungsprozesses zu integrieren, was sowohl national als auch international ein innovativer Ansatz ist. Die Schweiz kann daher eine wichtige Rolle in der Einführung eines LDCT Lungenkarzinom Screeningprogramms spielen, welches auf der besterhältlichen Evidenz basiert und die Stärken des Schweizer Gesundheitssystems nutzt.
Offene Fragen zur Durchführbarkeit
- Welche Organisationen interagieren mit potenziellen TeilnehmerInnen aus der Risikopopulation für das Screening?
- Welche Kriterien definieren die Risikopopulation, um eine minimale «number needed to screen» und «number harmed» zu gewährleisten?
- Welche Aspekte behindern und welche vereinfachen die nachhaltige Etablierung eines LDCT-Screening-Programms für Dienstleister im Gesundheitswesen?
- Welche Anbieter im Gesundheitswesen etablieren interdisziplinäre Teams und stellen die notwendige Infrastruktur zur Verfügung, um ein LDCT-Screening-Programm anzubieten?
- Wie wird Rauchentwöhnung im LDCT-Screening-Programm integriert, um die maximale Anzahl RaucherInnen zu erreichen?
- Welches Screening-Regime sollte die Schweiz einsetzen, welches sind die Details vom LDCT-Screening-Programm?
- Wie und durch wen werden Rundherde detektiert, analysiert und befundet, welcher Algorithmus wird zum Management implementiert?
- Welches sind die Optionen für die Datenerfassung, ein Register und ein begleitendes Qualitätsprogramm in der Schweiz?
Offene Fragen zur Finanzierung und Nachhaltigkeit
- Wie werden Information, Konsultationen und Spirometrie vor dem LDCT finanziert? Sind TeilnehmerInnen bereit, einen Teil der Kosten selber zu tragen?
- Könnte eine zusätzliche Tabaksteuer einen Teil des LDCT-Screening-Programms finanzieren?
- Wie hoch müsste die Kostenübernahme der obligatorischen Krankenkasse sein, um eine nachhaltige Etablierung eines LDCT-Screening-Programms zu gewährleisten?
- Wie finanzieren Dienstleister im Gesundheitswesen Personalressourcen, zusätzliche technische Ausrüstung, Ausbildung und Infrastruktur unabhängig von der Rückerstattung durch Krankenkassen?
- Wie werden Datenerfassung, Register und Qualitätsprogramme finanziert?
- Wie wird mit Zufallsbefunden umgegangen (z.B. kardiovaskuläre Erkrankungen), um hohe und unnötige Kosten für das Gesundheitssystem zu vermeiden?
Prof. Dr. med. Paola Gasche-Soccal, Service de Pneumologie, Hôpitaux Universitaires de Genève, Genève
Dr. med. Catherine Beigelmann-Aubry, Service de Radiodiagnostic et Radiologie Interventionnelle, Centre Hospitalier Universitaire Vaudois, Lausanne
Prof. Dr. med. Thomas Frauenfelder, Institut für diagnostische und interventionelle Radiologie, Universitätsspital Zürich, Zürich
Prof. Dr. med. Oliver Gautschi, Medizinische Onkologie, Luzerner Kantonsspital, Luzern
Prof. Dr. med. Isabelle Schmitt-Opitz, Klinik für Thoraxchirurgie, Universitätsspital Zürich, Zürich
Dr. med. Yuki Tomonaga, Institut für Epidemiologie, Biostatistik und Prävention, Universität Zürich, Zürich
Prof. Dr. med. Stefan Neuner-Jehle, Kollegium für Hausarztmedizin, Zürich
Prof. Dr. med. Oliver Senn, Institut für Hausarztmedizin, Universität Zürich, Zürich
Dr. med. Alexander Turk, Klinik für Innere Medizin, See-Spital, Horgen und Kilchberg
Prof. Dr. med. Milo Puhan, Institut für Epidemiologie, Biostatistik und Prävention (EBPI), Universität Zürich, Zürich
Centre Hospitalier Universitaire Vaudois
Lausanne
christophe.von-garnier@chuv.ch
1 Specific causes of death. https://www.bfs.admin.ch/bfs/en/home/statistics/health/state-health/mortality-causes-death/specific.html (accessed April 24, 2019).
2 Aberle DR, Adams AM, Berg CD, Black WC, et al. Reduced lungcancer mortality with lowdose computed tomographic screening. N Engl J Med. 2011 Aug 4;365(5):395-409.
3 De Koning H, Van Der Aalst C, Ten Haaf K, Oudkerk M. PL02.05 Effects of Volume CT Lung Cancer Screening: Mortality Results of the NELSON Randomised-Controlled Population Based Trial. J Thorac Oncol 2018; 13: S185.
4 Pastorino U, Silva M, Sestini S, et al. Prolonged Lung Cancer Screening Reduced 10-year Mortality in the MILD Trial. Ann Oncol 2019; published online April 1. DOI:10.1093/annonc/mdz117.
5 Becker N, Motsch E, Trotter A, Heussel CP, et al. Lung cancer mortality reduction by LDCT screening-Results from the randomized German LUSI trial. Int J Cancer. 2019 Jun 4. doi: 10.1002/ijc.32486.
6 Tomonaga Y, ten Haaf K, Frauenfelder T, et al. Costeffectiveness of low-dose CT screening for lung cancer in a European country with high prevalence of smoking—A modelling study. Lung Cancer 2018. DOI:10.1016/j.lungcan.2018.05.008.
7 Frauenfelder T, Puhan MA, Lazor R, et al. Early detection of lung cancer: A statement from an expert panel of the swiss university hospitals on lung cancer screening. Respiration 2014; 87: 254–64.
8 Oudkerk M, Devaraj A, Vliegenthart R, et al. European position statement on lung cancer screening. Lancet Oncol. 2017. DOI:10.1016/S1470-2045(17)30861-6.