Obwohl es erst drei Jahre her ist, dass die vorangegangenen ESC/EAS-Leitlinien zur Behandlung von Dyslipidämien veröffentlicht wurden, hat sich eine ganze Reihe neuer Erkenntnisse angesammelt, die eine Neuauflage dieser Leitlinien rechtfertigen. Dazu gehören neue Daten aus Beobachtungsstudien, randomisierten kontrollierten Studien und Mendelschen Randomisierungsstudien. Sie zeigen alle eindeutig einen kausalen Effekt von LDL-C (Low Density Lipoprotein Cholesterin) bei der Entwicklung von atherosklerotischer kardiovaskulärer Krankheit (ASCVD).
Konsistente Belege aus mehreren grossen randomisierten kontrollierten Studien bestätigen, dass tiefere LDL-C Werte mit niedrigerem Risiko für kardiovaskuläre Erkrankungen einhergehen. Die Intensivierung der lipidsenkenden Therapie durch Zugabe von Ezetimibe oder eines PCSK9-Hemmers hat zu tieferen LDL-C-Konzentrationen als den bisher empfohlenen geführt, was zu niedrigeren Raten von Myokardinfarkt und Schlaganfall als eine weniger intensive Therapie führte. Dementsprechend wurden die Behandlungsziele in den ESC/EAS Leitlinien gesenkt (1).
Empfehlung für die Schätzung des kardiovaskulären Risikos
Die Risikoschätzung umfasst 3 Stufen:
- Klinische Evaluation: Es wird empfohlen, dass Personen mit hohem und sehr hohem Risiko auf der Basis dokumentierter kardiovaskulärer Krankheit, Diabetes mellitus, moderater bis schwerer Nierenerkrankung, sehr hohen Werten einzelner Risikofaktoren, FH oder einem hohen SCORE-Risiko identifiziert werden. Diese Patienten gelten als prioritär für die Beratung und Behandlung aller Risikofaktoren. Diese Empfehlung erhielt eine Klasse I/C-Empfehlung.
- 10-Jahresrisiko nach SCORE-Berechnung: Die Schätzung des Gesamtrisikos mit Hilfe eines Risikoschätzungssystems wie SCORE wird für asymptomatische Erwachsene ab 40 Jahren ohne Anzeichen von kardidovaskulärer Krankheit, Diabetes mellitus, chronischer Nierenerkrankung, familiärer Hypercholesterinämie oder LDL-C > 4.9 mmol/l empfohlen. Dies ist ebenfalls eine I/C-Empfehlung.
- Bewertung von Risikomodifikatoren: Bei ausgewählten Personen mit niedrigem bis moderatem Risiko können andere Faktoren, einschliesslich erhöhtes Apo B, Lipoprotein (a), (Lp(a)) oder C-reaktives Protein (CRP), Familienanamnese für verfrühte ASCVD oder die Präsenz von atherosklerotischen Plaques im Imaging die Risikostratifikation verbessern und die Behandlungsentscheidung beeinflussen. Ebenfalls eine I/C-Empfehlung.
Risikokategorien: klinische Beurteilung
Die Risikokategorien umfassen insgesamt 4 Kategorien, von niedrigem bis sehr hohem kardiovaskulärem Risiko.
Sehr hohes kardiovaskuläres Risiko
Dokumentierte ASCVD entweder klinisch oder eindeutig durch Bildgebung. Dokumentierte ASCVD schliesst früheres ACS (MI oder instabile Angina), stabile Angina, koronare Revaskularisierung (PCI, CABG und andere arterielle Revaskularisierungsprozeduren), Schlaganfall und TIA und periphere arterielle Verschlusskrankheit mit ein. Durch Bildgebung eindeutig dokumentierte ASCVD schliesst diese Befunde mit ein, von denen man weiss, dass sie für klinische Ereignisse prädiktiv sind, wie besipielsweise signifikante Plaques in der Koronarangiographie oder im CT-Scan (Mehrgefässherzkrankheit mit 2 wichtigen epikardialen Arterien, die > 50% Stenosen aufweisen) oder im Karotisultraschall.
Diabetes mellitus mit Zielorganschaden, ≥ 3 Hauptrisikofaktoren oder frühes Auftreten von T1DM mit langer Dauer (> 20 Jahre).
Schwere chronische Nierenkrankheit (eGFR < 30 ml/min/1.73 m2).
Familiäre Hypercholesterinämie mit ASCVD oder mit einem andern Hauptrisikofaktor. Ein kalkulierter SCORE von ≥ 10% für das 10-Jahresrisiko für ein tödliches kardiovaskuläres Ereignis.
Hohes kardiovaskuläres Risiko
Personen mit stark erhöhten einzelnen Risikofaktoren, insbesondere Gesamtcholesterin > 8mmol/l, LDL-C > 4.9 mmol/l oder Blutdruck > 180/110 mmHg. Patienten mit familiärer Hypercholesterinämie ohne weitere Risikofaktoren. Patienten mit Diabetes mellitus ohne Zielorganschaden, mit Diabetesdauer ≥10 Jahre oder einem weiteren, zusätzlichen Risikofaktor. Berechneter Risikoscore ≥5% und <10% für das 10-Jahresrisiko für ein tödliches kardiovaskuläres Ereignis.
Moderates Risiko
Junge Patienten (T1DM < 35 Jahre, T2DM < 50 Jahre mit Diabetesdauer unter 10 Jahren) ohne weitere Risikofaktoren.
Berechneter Risikoscore ≥ 1% und < 5% für das 10-Jahresrisiko für ein tödliches kardiovaskuläres Ereignis.
Niedriges Risiko
Keines der oben genannten Merkmale.
Berechneter Risikoscore < 1% für das 10-Jahresrisiko für ein tödliches kardiovaskuläres Ereignis.
Der Referent wies auf die kardiovaskulären Risiko-Score-Charts für europäische Populationen mit hohem und solche mit niedrigem kardiovaskulärem Risiko hin. Die Schweiz gehört zu den Niedrigrisiko-Populationen.
Es ist festzuhalten, dass die Charts bei der Risikoschätzung helfen können, dass sie aber im Lichte der Erfahrungen des Klinikers und der Patienten-Prätest-Wahrscheinlichkeit für kardiovaskuläre Krankheit interpretiert werden sollen. Bei Frauen sind die Risikoabschätzungen tiefer als bei Männern, das Risiko ist aber nur verschoben. Das Risiko einer 60-jährigen Frau ist ähnlich wie dasjenige eines 50-jährigen Mannes.
Risikoalter
Es muss ferner darauf verwiesen werden, dass das Risiko bei jungen Personen unerwartet hoch sein kann, auch wenn die absoluten Werte niedrig sind. Die Chart mit dem relativen Risiko und das geschätzte Risikoalter können in diesen Fällen hilfreich sein. Als Beispiel sei ein 40-jähriger männlicher Raucher mit verschiedenen weiteren Risikofaktoren erwähnt, dessen Gesamtrisiko gleich hoch ist (3-4%) wie dasjenige eines 65-jährigen Mannes mit idealen Risikowerten. Das Risikoalter dieses 40-Jährigen ist deshalb 65 Jahre.
Behandlungszielwerte für LDL-Cholesterin
In der Sekundärprävention empfehlen die neuen ESC/EAS-Guidelines eine ≥ 50%ige LDL-C-Reduktion gegenüber dem Ausgangswert und ein absolutes LDL-C-Behandlungsziel von < 1,4 mmol/L (< 55 mg/dL) für Patienten mit sehr hohem Risiko (I/A).
In der Primärprävention wird bei Patienten mit sehr hohem Risiko, aber ohne FH eine LDL-C-Senkung um ≥ 50% und ein LDL-C-Zielwert von < 1.4 mmol/l empfohlen (I/C). In der Primärprävention bei Patienten mit FH bei sehr hohem Risiko wird eine ≥ 50% LDL-C-Senkung und ein Zielwert <1.4mmol/l empfohlen.
Für Patienten mit ASCVD, die ein zweites vaskuläres Ereignis innerhalb von 2 Jahren erleiden, kann ein LDL-C Zielwert von 1.0mmol/l in Betracht gezogen werden (IIb/B).
Für Patienten mit hohem Risiko wird eine LDL-C-Senkung um ≥ 50% und ein LDL-C-Zielwert von 1.8 mmol/l empfohlen (I/A).
Für Patienten mit moderatem Risiko sollte ein LDL-C-Zielwert von < 2.6 mmol/l in Betracht gezogen werden (IIa/A).
Bei Personen mit niedrigem Risiko kann ein LDL-C-Zielwert < 3.0 mmol/l in Betracht gezogen werden (IIb//A).
Ein hochintensives Statin (plus Ezetimibe) sollte bis zur höchsten verträglichen Dosis verschrieben werden, um die festgelegten Ziele zu erreichen. Die Zugabe eines PCSK9-Hemmers wird bei Patienten mit sehr hohem Risiko empfohlen, die die Behandlungsziele bei einer maximal verträglichen Dosis von Statin und Ezetimbe nicht erreichen (I/A).
Wirksamkeit von LDL-C senkenden Behandlungen
In einer Meta-Analyse von 27 RCTs (Statin- vs. Kontroll-Schema oder intensiveres vs. ein weniger intensives Statin-Schema), reduzierte jede 1mmol/l-LDL-C Reduktion/Statin vs. mehr Statin schwere vaskuläre Ereignisse (MI, CAD, Tod, Schlaganfall oder koronare Revaskularisation) um ca. 22%, koronare Ereignisse um 23%, CAD-Tod um 20%, Schlaganfall um 17% und Gesamtmortalität um 10% über 5 Jahre. Die absolute Risikominderung erfolgte im Verhältnis zum absoluten Risiko. Der relative Nutzen war im ersten Jahr im Vergleich zu den Folgejahren halb so gross (2).
Die Zugabe von Ezetimibe ergab in der IMPROVE-IT-Studie (3) eine zusätzliche Senkung um 22%, was mit einer absoluten Risikosenkung von 2% (p = 0.016) einherging. Die Zugabe des PCSK9-Inhibitors Evolocumab ergab in der Fourier Studie eine zusätzliche LDL-C-Senkung um mehr als 65% und eine relative Reduktion des primären Endpunkts um 15% (4). Ähnliche Daten wurden in der ODYSSEY OUTCOMES Studie (5) mit Alirocumab erreicht.
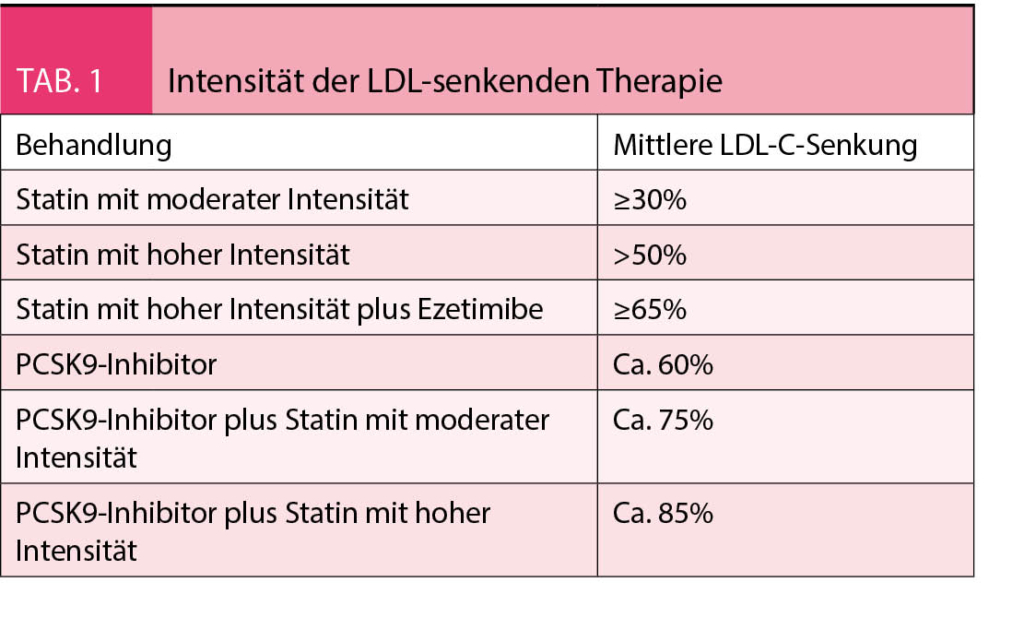
Die zu erwartenden LDL-C-Senkungen mit verschiedenen Lipidsenkern sind in der Tabelle 1 wiedergegeben.
Statinintoleranz
Ein überarbeiteter Abschnitt der ESC/EAS-Leitlinien 2019 befasst sich mit der «Intoleranz» von Statin. Über sogenannte «Statin-assoziierte Muskelsymptome» wurden in Beobachtungsstudien häufig berichtet, vielleicht aufgrund eines Nocebo-Effekts. Placebo-kontrollierte randomisierte Studien zeigen jedoch deutlich, dass echte Statinintoleranz selten ist. In der Praxis stellt man fest, dass die Änderung des Statins oder die Reduzierung der Dosis und das Hinzufügen von Ezetimbe Ansätze sind, die es den meisten Patienten ermöglichen, Statine in irgendeiner Form zu erhalten.
Diagnostische Aspekte
Empfehlungen für Lipidanalysen
Gesamtcholesterin wird für die Abschätzung des kardiovaskulären Gesamtrisikos mit Hilfe des SCORE-Systems benötigt (I/C).
HDL-Cholesterin wird empfohlen zur Risikoverfeinerung mit dem online SCORE-System (I/C).
Die Bestimmung von LDL-Cholesterin ist als primäre Lipidanalyse für Screening, Diagnose und Management empfohlen (I/C).
Die Bestimmung der Triglyceride ist als Teil der Routine-Lipid-Analyse empfohlen (I/C).
Non-HDL-C ist für die Risikoabschätzung empfohlen, insbesondere bei Personen mit hohen Triglyceriden, Diabetes, Übergewicht oder sehr tiefen LDL-C Werten (I/C).
Die Bestimmung von Apo B ist für die Risikoabschätzung empfohlen, insbesondere bei Personen mit hohen Triglyceriden, Diabetes, Übergewicht oder dem metabolischen Syndrom oder sehr tiefen LDL-C Werten. Diese kann, falls verfügbar, alternativ zu LDL-C als primäre Bestimmung, als primäre Messung für Screening, Diagnose und Management verwendet werden und kann gegenüber non HDL-C bevorzugt werden bei Personen mit hohen Triglyceriden, Diabetes, Übergewicht oder sehr tiefen LDL-C Werten (I/C).
Die Bestimmung von Lp(a) sollte mindestens einmal im Leben einer jeden Person in Betracht gezogen werden, um die Personen mit vererbten, sehr hohen Werten > 180 mg/dl (> 430 nmol/l) zu finden, die ein äquivalentes lebenslanges Risiko aufweisen wie Patienten mit heterozygoter familiärer Hypercholesterinämie (IIa/C).
Die Notwendigkeit, das gesamte kardiovaskuläre Risiko, einschliesslich aller kardiovaskulärer Risikofaktoren, nicht nur LDL-C, zu schätzen, wird auch in den ESC/EAS-Leitlinien 2019 bekräftigt.
Nicht invasive Bildgebung
Weitere empfohlene Methoden zur Risikobewertung und möglichen Neueinstufung sind die nicht-invasive kardiovaskuläre Bildgebung sowie die arterielle Ultraschalluntersuchung zur Beurteilung der Plaquebelastung (IIa/B) und die Computertomographie, die zur Beurteilung des Kalziumspiegels der Koronararterien als Risikomodifikator bei Personen mit geringem oder mittlerem Risiko in Betracht gezogen werden kann (IIa/B).
Weitere Lipide als Risikofaktoren
Triglyceride
Bezüglich weiterer Lipide sind die Auswirkungen der mehrfach ungesättigten Omega-3-Fettsäuren zur Senkung erhöhter Triglyceridwerte von Interesse, wobei festzuhalten ist, dass die Beweise nicht eindeutig sind. Basierend auf den Ergebnissen der jüngsten REDUCE-IT-Studie sollte Ikosapent Ethyl (2 x 2 g/day) in Kombination mit einem Statin bei Hochrisikopatienten (mit Triglyceridwerten von 1,5 bis 5,6 mmol/L trotz Statintherapie) in Betracht gezogen werden.
Lipoprotein (a)
Die neuen ESC/EAS-Leitlinien sehen vor, dass die Messung von Lipoprotein (a) nach Möglichkeit mindestens einmal im Leben einer Person in Betracht gezogen werden sollte, um Personen mit sehr hohen Vererbungswerten (> 180 mg/dL[> 430 nmol/L]) und einem sehr hohen ASCVD-Risiko zu identifizieren.
Die Lipoprotein (a)-Messung sollte insbesondere bei ausgewählten Patienten mit einer familiären Vorgeschichte von vorzeitiger ASCVD und für die Reklassifizierung bei Personen, die an der Grenze zwischen mittlerem und hohem Risiko stehen, in Betracht gezogen werden (IIa/C).
Weitere Konzepte
Der Einsatz von Statin bei älteren Patienten, die Inflammation und die Kosteneffizienz lipidmodifizierender Massnahmen sind nur einige der weiteren überarbeiteten oder neuen Konzepte, die in den ESC/EAS-Leitlinien 2019 behandelt werden.
«Die neuen Richtlinien konzentrieren sich nicht nur auf pharmakologische Ansätze zur Modifikation von Lipiden. Es wird ein lebenslanges Konzept für das ASCVD-Risiko empfohlen. Zusätzlich zu den Patienten mit hohem und sehr hohem ASCVD-Risiko sollte jeder ermutigt werden, einen gesunden Lebensstil anzunehmen oder aufrechtzuerhalten, um sein Plasma-Lipidprofil zu verbessern», so der Kommentar von Prof. Dr. med. Christian Müller, Basel, anlässlich der Präsentation der Lipid-Guidelines am ESC-Kongress 2019.
riesen@medinfo-verlag.ch
Der Autor hat keine Interessenskonflikte in Zusammenhang mit diesem Artikel.
1. Mach F et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J. 2019 Aug 31. pii: ehz455. doi: 10.1093/eurheartj/ehz455. [Epub ahead of print]
2. Fulcher J et al. Cholesterol Treatment Trialists‘ (CTT) Collaboration Efficacy and safety of LDL-lowering therapy among men and women: meta-analysis of individual data from 174,000 participants in 27 randomised trials. Lancet. 2015 Apr 11;385(9976):1397-1405
3. Cannon CP et al. Ezetimibe Added to Statin Therapy after Acute Coronary Syndromes. N Engl J Med 2015; 372:2387-2397
4. Sabatine MS et al. Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease. N Engl J Med. 2017;376:1713-1722
5. Schwarz GG et al. Alirocumab and Cardiovascular Outcomes after Acute Coronary Syndrome. N Engl J Med. 2018;379:2097-2107