Es hat noch nie so viele, so alte und so gesunde Menschen gegeben wie aktuell bei uns. Dem entsprechend werden Sterben und Tod im Alltag ausgeblendet. «What do you think about dying?» «I am against it» so Woody Allen. Dennoch: Bei guter Gesundheit befragt, möchten die meisten Menschen zu Hause sterben. Tatsächlich sterben aber 4 von 5 Personen in Spitälern oder Pflegeheimen. Mit einer Palliativstation am Kantonsspital, dem palliativen Brückendienst zur Unterstützung der Sterbenden zu Hause und der palliativen Grundversorgung ambulant und in Pflegheimen ist der Kanton St. Gallen für die Sterbephase gut gerüstet. Ein Hospiz für medizinisch und/oder psychosozial sehr komplexe Sterbende, die weder zu Hause, noch im Akutspital, noch im Pflegeheim betreut werden können, hat bisher gefehlt. Nach langjähriger Vorbereitung wurde das Hospiz St. Gallen im Februar 2018 eröffnet und hat sich seither bewährt.
Die Medizin hat in den letzten 50 Jahren enorm grosse Fortschritte gemacht. Es ist heute zum Beispiel möglich, über eine periphere Arterie die Aortenklappe zu ersetzen ohne den Brustkorb zu eröffnen, bisher nur palliativ behandelbare Krebskrankheiten können geheilt, versagende Organe können mit voller Funktion ersetzt werden und bei Bedarf ist praktisch jedes angeschlagene Gelenk ersetzbar. Diese als faktisch unbegrenzt wahr genommenen Möglichkeiten führen dazu, trotz medizinischer und ökonomischer Grenzen den Tod als nicht existent oder zumindest immer weit weg, hinaus schiebbar, zu betrachten. Ewiges Leben und ewige Jugend werden angestrebt. Aus diesem Grund werden oft in aussichtslosen Situationen in Kollusion von Arzt und Patient kurative Massnahmen ergriffen, die nicht mehr Sinn machen. «Defining the Point of no return», also den Zeitpunkt des Übergangs von kurativer zu palliativer Betreuung zu bestimmen ist immer wieder schwierig (1). Zum Zeitpunkt des Hospizeintritts müsste der Wunsch nach ewigem Leben eigentlich im Hintergrund sein, die Frage taucht aber trotz allem hie und da wieder auf. Auch wenn jemand am Sterben ist, muss er weiterleben, bis er stirbt.
Die ungeahnten medizinischen Möglichkeiten haben nicht nur Fantasien von unbegrenztem Leben und Gesundheit hervorgerufen. Es ist tatsächlich auch so, dass der Zeitpunkt des Todes durch das Einsetzen oder Weglassen von therapeutischen Massnahmen z.T. substantiell verschoben werden kann. Das Horaz zugeschriebene römische Sprichwort «Mors certa, hora incerta», also dass der Tod uns allen sicher ist, der Zeitpunkt aber unbestimmt, hatte wegen der geringen medizinischen Möglichkeiten vor 50 Jahren durchaus seine Gültigkeit: Der Tod und Sterben wurden als gegeben erachtet und damals öffentlich wenig diskutiert. Auch in der direkten Beziehung zum Patienten war der Tod kein Thema. Heutzutage ist der Tod trotz aller Unsterblichkeitsbemühungen immer noch für alle Menschen sicher, aber die Todesstunde kann mitbestimmt werden, z.B. durch Verzicht auf medizinische Massnahmen oder selbstbestimmt (2). Obwohl die meisten Menschen, wenn bei guter Gesundheit befragt, am liebsten zuhause sterben möchten, versterben in der Schweiz 4 von 5 Personen in Institutionen. Möglicherweise hat das unter anderem auch mit dem Wunsch zu tun die Todesstunde möglichst lange hinauszuzögern.
Die Hospizbewegung
Der Begriff Hospiz stammt vom lateinischen «hospitium» für Gasthaus, Herberge und Gastfreundschaft. In der römischen Antike stand hospitium für zeitweiliges Obdach und Bewirtung von Fremden. Unter den Bezeichnungen Hospice, Hôtel Dieu, Hospital entstanden im Mittelalter die in christlicher Tradition von Klöstern errichteten Hospize, vor allem entlang der grossen Pilgerwege zur kostenlosen Beherbergung und Pflege der Gläubigen, sowie zur Betreuung von Armen, Waisen, mittellosen Gebärenden, Leprakranken und Sterbenden. Letztere machten nur einen kleinen Teil
der Gäste aus. Im Gegensatz zu heute war der Tod im Mittelalter allgegenwärtig (Kindsbettfieber, Seuchen, Kriege), was eine spezielle Einrichtung für das Sterben absurd erscheinen lässt.
«To a patient, who makes inquires which, if faithfully answered might prove fatal to him, it would be a gross and and unfeeling wrong to tell the truth.» (Thomas Percival, Medical Ethics 1803)
Bis in die 70er Jahre des letzten Jahrhunderts wurden Patienten und ihre Angehörige nicht über ihre unheilbaren Krankheiten aufgeklärt, Sterben und Tod wurden ausgeblendet, Sterbende nur marginal betreut oder ganz allein gelassen. Die Glarner Ärztin Elisabeth Kübler-Ross hat in den USA als erste das Tabu der Verschwiegenheit durchbrochen und sich ans Bett von Sterbenden gesetzt, ihnen zugehört, ihre Anliegen aufgenommen und sie in den Tod begleitet (On Death and Dying, 1969) (3). Diese Pionierleistung hat die Entwicklung der heutigen Form der Institution Hospiz erst ermöglicht.
Dame Cicely Saunders, Krankenschwester, Sozialarbeiterin und Ärztin hat 1967 das St Christopher Hospice in London eröffnet. Es ist das erste moderne Hospiz mit der Zielsetzung Schwerstkranken ein Sterben in Würde zu ermöglichen. Die Grundprinzipien der Palliative Care, nämlich Zuwendung durch ein interprofessionelles Team und Symptomlinderung wurden von Cicely Saunders wesentlich mitentwickelt und etabliert. Wenig vertraut mit diesen Entwicklungen habe ich damals als junger Assistenzarzt mit Staunen von der «Brompton mixture» für die Schmerzbehandlung erfahren. Sie enthält Morphin oder Heroin, Cocain, Cannabis, Gin und Chloroform und ist heute obsolet, war aber der erste Schritt zu einer ernsthaften, differenzierten und effizienten Schmerzbehandlung (4).
Die weitere Entwicklung, Einrichtung und Verbreitung von Hospizen sind in verschiedenen Ländern ganz unterschiedlich (5). Im Gegensatz zu Deutschland mit einer langjährigen, vorwiegend christlichen Tradition, gibt es in der Schweiz nur wenige Hospize. 16 unterschiedlich konzipierte und funktionierende Institutionen sind im Dachverband Hospize Schweiz zusammengeschlossen.
Der lange Weg zum Hospiz St. Gallen
Ausgangslage: Palliative Care, die Behandlung, Betreuung und Begleitung von unheilbar kranken und sterbenden Menschen haben im Kanton St. Gallen einen hohen Stellenwert und eine lange Tradition. 1991, vor mehr als 20 Jahren, wurde am Kantonsspital St. Gallen auf Initiative von Prof. Hansjörg Senn eine der ersten Palliativstationen in der Schweiz aufgebaut und eröffnet. Von jeher besteht aber bei vielen Menschen der Wunsch zu Hause zu sterben. Konsequenterweise wurde als weiterer wichtiger Schritt vor 10 Jahren der palliative Brückendienst mit Hilfe der Krebsliga Ostschweiz entwickelt. Um eine Betreuung von Sterbenden zu Hause zu ermöglichen, stehen, wenn nötig, der Spitex und den betreuenden Hausärzten rund um die Uhr in Palliative Care speziell ausgebildete Pflegende und Ärzte zur Verfügung. Zusätzlich können die Freiwilligen des Hospiz-Dienstes St. Gallen eingesetzt werden. Auch in Spitälern und geriatrischen Pflegeinstitutionen hat Ausbildung und Praxis von Palliative Care an Wichtigkeit gewonnen. Grundsätzlich ist die palliative Grundversorgung im Kanton gewährleistet.
Problemstellung: Während der Arbeit im Brückendienst in den letzten 10 Jahren haben die Pflegenden jedoch immer wieder eine entscheidende Versorgungslücke festgestellt. Bei Sterbenden, vor allem auch jüngeren Menschen mit kleinen Kindern, mit komplexen pflegerischen und medizinischen Problemen oder schwieriger psychosozialer Situation, kommt es vor, dass Angehörige und Betreuende zu Hause trotz all den genannten Hilfestellungen überfordert sind. Es stellt sich akut die Frage «Wo kann der Patient betreut werden, wenn es zu Hause nicht mehr geht?». Das Akutspital kann den Patienten für längere Zeit nicht aufnehmen und ist von seiner Struktur her auch nicht der richtige Ort. Bei grossem Betreuungsaufwand über 24 Stunden sind die Pflegeinstitutionen nach eigenen Angaben oft nicht geeignet und überfordert. Zudem möchten jüngere Menschen ihre letzte Zeit, wenn möglich nicht im Heim verbringen. Das Problem wurde offensichtlich: Für diese speziellen Situationen ist ein spezielles Angebot nötig. Fehlt dieses Angebot kommt es in der ohnehin schwierigen Situation zu belastenden Irrwegen mit Dekompensation von Betroffenen und Betreuenden und unsinniger Einweisung in die Notfallstation als einzig mögliche und teure Sofortmassnahme.
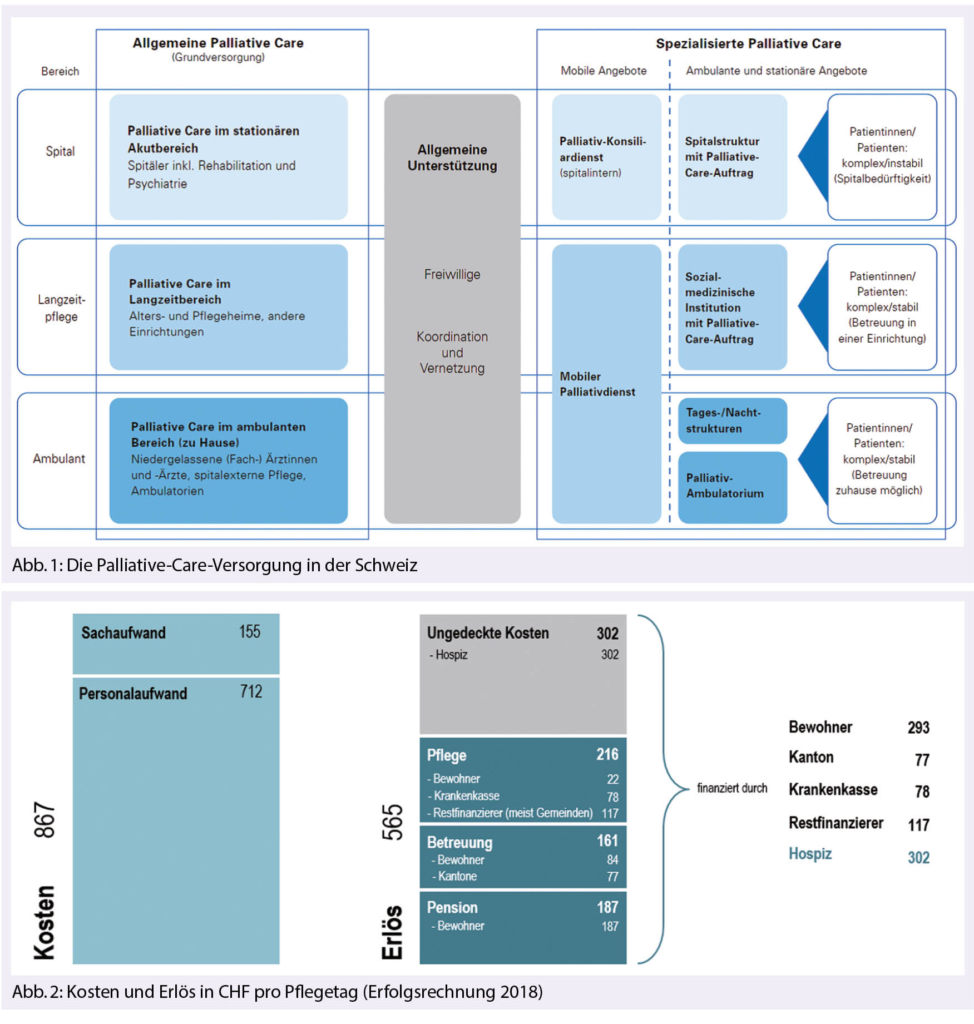
Problemlösung: Es braucht eine Langzeitinstitution mit der Qualität und den Möglichkeiten des Akutbetriebs, es braucht ein Hospiz mit spezialisierter Palliative Care (zum Unterschied von allgemeiner und spezialisierter Palliative Care siehe Abb. 1), und das war damals in St. Gallen nicht vorhanden. Das nächstgelegene Hospiz war das Lighthouse in Zürich, das wegen fehlender Nähe zum Familiennetz nicht in Frage kam. Um diesem Missstand beizukommen, haben in den letzten zehn Jahren drei Pflegefachleute der St. Galler Palliative Care unter Beizug eines Ökonomen neben ihrer Arbeit unbezahlt ein ausgereiftes Projekt zur Realisierung eines Hospizes erarbeitet. Der Bedarf in St. Gallen und angrenzenden Gebieten wurde sorgfältig abgeschätzt und liegt bei 10 bis 12 Betten mit Aufenthaltsdauer von ca. 3 Wochen und etwa 60 Bewohnenden pro Jahr. Im Hospiz soll die Atmosphäre so sein wie zu Hause und gleichzeitig eine intensive pflegerische, ärztliche, und nach Bedarf spirituelle, psychologische und soziale Betreuung mit Einbezug der Angehörigen über 24 Stunden möglich sein (Tab. 1) (6). Mit der Gründung des Vereins «Freunde stationäres Hospiz St. Gallen» wurde eine Basis für Öffentlichkeitsarbeit und das Fundraising geschaffen und schliesslich in langjähriger Fronarbeit ermöglicht, dass das Hospiz St. Gallen im Februar 2018 eröffnet werden konnte (Tab. 2).
Pflegen im Hospiz, eine herausfordernde Aufgabe
«Wie kann man nur in einem Sterbehospiz arbeiten? Nur sterben, sterben, Tag und Nacht, schrecklich!», so die Bemerkung eines Bekannten beim Besuch des Hospizes. In medizinisch aussichtslosen Situationen hören wir Ärzte oft sagen: «Jetzt können wir nichts mehr für Sie tun!». Wer im Hospiz arbeitet wird gewahr, dass wir sehr viel tun können, um den Bewohnenden das Leben bis zum Schluss zu erleichtern und ihnen mit den Angehörigen auf dem Weg zum Ende beizustehen. Aber wir müssen uns auf die Sterbenden einlassen können. Die Grundlage für die Betreuung ist die Beziehung. Beziehung mit Menschen in Grenzsituationen ist heikel. Im Hospiz ist die Grenzsituation des Sterbens Alltag. Fragen der Kommunikation, von Nähe und Distanz, von Betroffenheit, Mitgefühl und Abgrenzung stehen bewusst oder unbewusst ständig im Raum. Diese emotionale Spannung zu handhaben ist tatsächlich eine Herausforderung, auch wenn durch die Alltäglichkeit der Grenzsituation eine gewisse Gewöhnung und dadurch Entspannung entsteht. Zuwendung und «da sein» ist der wichtigste Pfeiler für die Betreuung Sterbender. Der zweite zentrale Aspekt ist die Symptomkontrolle. Eine effektive und effiziente Milderung der Symptome kann oft den Zugang du den Bewohnenden erst ermöglichen. Die Palliative Wissenschaft hat uns sehr gute Methoden und Richtlinien zur Beherrschung von Symptomen wie Schmerz, Atemnot, Angst, Asthenie, Übelkeit, Erbrechen und anderen erarbeitet. Auch wenn die Richtlinien sehr hilfreich sind, gibt es doch bei jedem Sterbenden individuelle Aspekte. Diese zu erkennen und entsprechend zu berücksichtigen ist eine anspruchsvolle Aufgabe der Pflege und kann für Sterbende und Betreuende sehr befriedigend sein. Das Erreichen von kleinen Zielen charakterisiert die Hospizarbeit und wirkt Angst und Frustration entgegen. Auch wenn das für Aussenstehendende schwer nachvollziehbar ist, kann eine gelungene Sterbebegleitung durchaus als eine gut gelöste schwierige Aufgabe erlebt werden und mit grosser Befriedigung einhergehen.
Um im Hospiz pflegen zu können sind eine klare Führung und regelmässige Supervisionen im Team unverzichtbar. Als Voraussetzung ist zudem Ausbildung in (spezialisierter) Palliative Care sowohl für Pflegende als auch für Freiwillige eine Notwendigkeit.
Das erste Jahr
Im Alltag im Hospiz stehen im Gegensatz zu manchen kurativen medizinischen Institutionen tatsächlich Sterbende und ihre Angehörigen im Mittelpunkt. Die Pflegenden verbringen die meiste Zeit mit den Bewohnenden. Der administrative Aufwand ist gering. Das macht die Arbeit im Hospiz attraktiv. Die Rekrutierung von Pflegenden und Freiwilligen gestaltete sich entsprechend einfach und im ersten Jahr ist das Team unter Führung der Pflegedienstleitung stabil und tragfähig geworden.
Die zu Beginn schlechte Auslastung der 7 Betten um 40% hat sich mit optimierten Abläufen und besserer Vernetzung mit den Zuweisern bei 70% stabilisiert. Von insgesamt 66, vorwiegend krebskranken Bewohnenden mit Durchschnittsalter 69, waren 57 Sterbefälle, die sich durchschnittlich während 19 Tage im Hospiz aufhielten. Die spontanen Rückmeldungen von Angehörigen und Bewohnenden waren zu einem grossen Teil ausgezeichnet.
Finanzierung und Fundraising
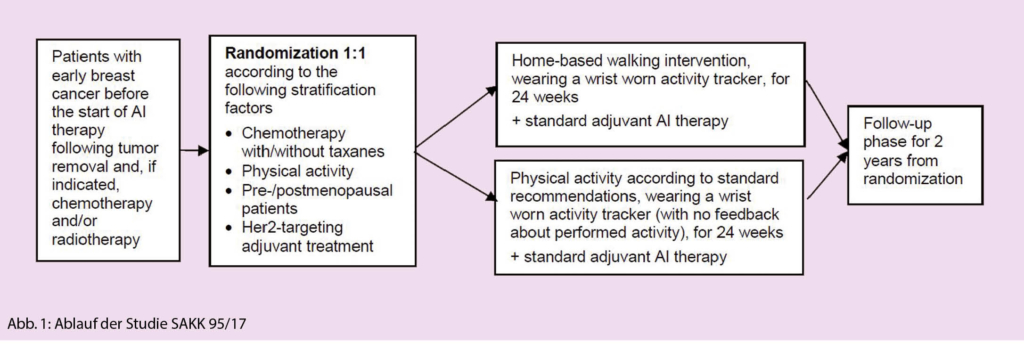
Die Finanzierung gestaltet sich schwierig. Auch nachdem der Kantonsrat im Nachtrag zum Gesundheitsgesetz vom 20. November 2018 Palliative Care inklusiv Hospize zur öffentlichen Aufgabe erklärt hat, sind die Beiträge von Gemeinden, Kantonen und Krankenkassen bei weitem nicht kostendeckend. Wie aus Abb. 2 ersichtlich kostet ein Pflegetag rund 850 Franken, mit dem Hauptanteil von 80% für das (Pflege)personal. Das muss so sein, denn im Gegensatz zum Pflegeheim braucht es im Hospiz über 24 Stunden intensive Pflege. Das Pflegeheim ist mit rund 400 Franken wesentlich günstiger. Im Vergleich zur Spitalabteilung mit 1 500 bis 2 000 Franken und einer Intensivstation mit 3 500 bis 5 000 Franken pro Tag ist das Hospiz dennoch relativ kostengünstig. Auf der Einnahmenseite berappen Bewohner, Krankenkassen, Restfinanzierer und Kanton rund 550 Franken, die restlichen rund 300 Franken muss das Hospiz durch Spenden beschaffen. Dieser Spendenbedarf macht je nach Auslastung rund eine halbe Million Franken pro Jahr.
Das Fundraising ist neben dem Führen des Betriebes das anstrengendste Hauptproblem. Im Jahr 2013 haben wir den Verein Hospiz St. Gallen gegründet, dessen Mitglieder uns stetig materiell und mental unterstützen und wir halten sie mit einem Newsletter auf dem Laufenden. Vor 10 Jahren hatten das breite Publikum und zum Teil auch Professionelle im Gesundheitsbereich keine Vorstellung von Sinn und Zweck eines Hospizes. Durch unsere wiederholten Aktionen und Vorträge in verschiedensten Bevölkerungsgruppierungen und Vereinen hat sich das verändert. Das Hospiz ist in St. Gallen und in der Ostschweiz ein Begriff. Den Hauptanteil für unsere Betriebsvorbereitung (Projektierung, Investitionen usw.) haben wir von Stiftungen erhalten. Stiftungen unterstützen gerne etwas im Aufbau, machen Anschubfinanzierungen. Seit 1 ½ Jahren sind wir ein laufender Betrieb und brauchen Mittel zur Finanzierung der ungedeckten Kosten. Das ist kaum attraktiv für eine Stiftung. Kurzfristig ist dank aufwändigen Fundraising Bemühungen die Finanzierung gesichert. Auf der anderen Seite ist das Führen eines Hospizes eine öffentliche Aufgabe und klarer Bestandteil der Palliativen Versorgung des Kantons. Zudem verhindert es häufig, belastende und teure Irrwege von Sterbenden und spart Kosten ein. Damit das Hospiz überleben kann, wünschen wir uns für die Zukunft eine substantielle Beteiligung der öffentlichen Hand.
Obere Felsenstrasse 15
9000 St. Gallen
christoph.huerny@hospizstgallen.ch
Der Autor hat in Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
1. Hürny C. Palliative care in high-tech medicine: defining the point of no return. Support Care Cancer 1994; 2: 3-4.
2. Zimmermann M, Felder St, Streckeisen U, Tag B. Das Lebensende in der Schweiz. Individuelle und gesellschaftliche Perspektiven. Basel:Schwabe-Verlag,2019
3. Kübler-Ross E, Interviews mit Sterbenden.6.Auflage.Stuttgart-Berlin; Kreuzverlag Gmbh,1969
4. Student JC. Das Hospizbuch. 4. Auflage, Freiburg: Lambertus Verlag,1999
5. Heller A. Die Geschichte der Hospizbewegung in Deutschland. Ludwigsburg: Der Hospiz Verlag, 2012
6. Student JC. Sterben, Tod und Trauer-Handbuch für Begleitende, 3. Auflage, Freiburg: Herder, 2008