Am 7. und 8. November 2024 fand der traditionelle Kongress für praktische Gynäkologie und Geburtshilfe zum 27. Mal in der Lintharena in Näfels statt. Den Organisatoren gelang es, ein interessantes Programm mit hervorragenden Referentinnen und Referenten zusammenzustellen. Der folgende Bericht bezieht sich auf einige ausgewählte Referate.
Management von Borderline-Ovarial-Tumoren

«Zehn bis zwanzig Prozent aller epithelialen Ovarialtumoren sind Borderline-Tumoren», so Frau Prof. Viola Heinzelmann-Schwarz, Co-Leiterin der Frauenklinik, Universitätsspital Basel. 95% sind muzinös oder serös (Histotyp), 40-50% MBOT (muzinöse Boderline-Tumoren), 53% SBOT (seröse Borderline-Tumoren). Sehr selten sind endometrioide und klarzellige Borderline-Tumoren. Ein Drittel aller Patientinnen sind jünger als 40-jährig, 82% sind diagnostiziert als FIGO I (Tumor auf das Ausgangsorgan begrenzt).
Borderline-Tumoren (BOT) werden als eigenständige Gruppe klassifiziert. BOT zeigen keine Stroma-Invasion oder infiltrativ destruktives Wachstum. Karzinome dagegen zeigen Stromainvasion (destruktiv/infiltrativ oder nicht destruktiv/expansiv).
Seit 2014 gibt es eine veränderte Einteilung der Borderline-Tumoren. Früher: Nicht invasives Implantat, epithelial und nicht invasives Implantat, desmoplastisch. Heute: invasives Implantat, low-grade seröses Karzinom (LGSC), aber falls nicht-invasiv, zytologisch wie invasiv (LGSC).
Der Begriff «nicht-invasive Implantate», wird verwendet, um Gruppen von Tumorzellen aus einem serösen Borderline-Tumor zu beschreiben, die sich an einem Organ im Bauch oder Becken festgesetzt haben. Zu den Organen, die häufig von nicht-invasiven Implantaten betroffen sind, gehören das Omentum und das Peritoneum. Im Gegensatz zu «invasiven» Implantaten befinden sich «nicht-invasive» Implantate nur auf der Aussenfläche eines Organs. Nicht-invasive Implantate sind wichtig, da sie das pathologische Tumorstadium erhöhen und mit einem erhöhten Risiko für ein erneutes Tumorwachstum im Bauch oder Becken verbunden sind.
Borderline-Tumor Diagnostik: Bei den meisten Frauen wird die Diagnose eines serösen Borderline-Tumors erst gestellt, wenn der gesamte Tumor operativ entfernt und zur Untersuchung an einen Pathologen geschickt wurde. Die Referentin zeigte Daten, die mit der 3D-«Silhouette»-Beurteilung erhoben wurden.
Bei den serösen BOT ist das Staging sehr wichtig, betonte die Referentin. Die muzinösen BOT sind zwar extrem voluminös. Sie sind aber sonst unproblematisch.
Vulväre intraepitheliale Neoplasien (VIN) sind meist plattenepithelial und HPV-assoziiert. Man unterscheidet die HPV-assoziierte uVIN und die seltenere HPV-unabhängige dVIN. Risikofaktoren sind HPV-Infektion, Immunsuppression, Nikotinabusus und Lichen sclerosus.
Borderline-Tumor-Therapie (BOT) erfordert ein präzises Staging. Ein vollständiges Staging umfasst Omentektomie, Peritonealbiopsie, Zytologie, ggf. Appendektomie (bei M-BOT) und bilaterale Adnektomie (ausser bei fertilitätserhaltender OP oder Patientinnen <55 Jahre). PFS: Staging komplett vs. inkomplett HR 1,77 (95% KI 1,15–2,71).
Prognostische Faktoren waren FIGO-Stadium, peritoneale Implantate (invasiv, HR 42,3) (nicht invasiv, HR 7,7), chirurgisches Stadium (komplett vs. inkomplett), Resttumor, Fertilitätserhalt, Rezidiv. Risikofaktoren für invasives Rezidiv: Hochrisikogruppe BOT: invasive peritoneale Implantate. Resterkrankung nach Operation.
Umstrittene Faktoren sind mikropapilläre Läsionen, Stroma-Mikroinvasion, Zystektomie bei MBOT und intraepitheliale CA bei muzinösen Läsionen.
Borderline-Tumoren – Zusammenfassung Therapie
BOT hat insgesamt gute Prognose. Sie treten häufig beidseitig auf, deshalb Fertilitätsreserve vor Operation berücksichtigen. Rezidivrate liegt bei 7,8%, maligne Transformation in 2,3% (=30% aller Rezidive) der Fälle, MBOT hat hervorragende Prognose.
Prognostische Faktoren sind: FIGO-Stadium, Therapie, Staging – Qualität!, Tumorrest. Eine Fertilitätserhaltung kann nach sorgfältigem Staging bzw. nach Resektion aller Implantate erwogen werden sowie nach der Aufklärung über ein erhöhtes Rezidivrisiko.
Risikoläsionen für das Vulvakarzinom

Das Vulvakarzinom ist insgesamt selten aber mit steigender Inzidenz stellte PD Dr. Patrick Imesch, Zürich, fest. Es nimmt insbesondere bei Frauen unter 60 Jahren zu. Im Frühstadium ist es gut therapierbar. Die frühe Diagnose und das Erkennen der Vorstufen sind deshalb von zentraler Bedeutung. Die Diagnosezeiten sind relativ lang, zwischen 186 und 328 Tagen. Dies ist häufig auf eine Fehldiagnose einer vulvovaginalen Entzündung zurückzuführen.
Evolution der Terminologie und Nomenklatur
Zwei Pathways der vulvären Plattenepithelneoplasie spiegeln sich in den ISSVD-Klassifikationen (1986, 2004) wider: VIN, usual type (HPV-abhängig) und VIN, differenzierter Typ (HPV-unabhängig). Die LAST-Klassifikation (2013) vereinheitlichte die Nomenklatur für HPV-assoziierte Läsionen des unteren Anogenitaltrakts mit einer zweistufigen Einteilung: LSIL (low-grade squamous intraepithelial lesion) und HSIL (high-grade squamous intraepithelial lesion). Eine Einschränkung der LAST-Klassifikation ist, dass die dVIN trotz ihres malignen Potenzials nicht erwähnt wird, während vulväre LSIL einbezogen werden, was das Risiko von Überdiagnosen und Überbehandlungen erhöht.
Klinik
Es gibt kein pathognomonisches Merkmal der vulvären SIL. Die klinischen Aspekte variieren stark in Anzahl, Grösse, Farbe und Oberfläche. Etwa 60 % der Patientinnen berichten über Juckreiz, Schmerzen oder Blutungen. Diagnostik: Essigsäuretest kann HPV-assoziiertes SIL identifizieren: VHSIL zeigt scharf abgegrenztes, erhabenes acetoweisses Epithel, während dVIN meist nicht reagiert. VHSIL tritt häufiger bei jüngeren Frauen (Ø 47,8 Jahre) und multifokal im Introitus auf. dVIN betrifft meist ältere Frauen (Ø 67 Jahre), ist unifokal, schlecht abgrenzbar und erscheint pink oder gräulich-weiss. Eine Unterscheidung von Lichen sclerosus kann schwierig sein – therapieresistente Dermatosen erfordern eine genauere Abklärung. HPV-Zusammenhang: Obwohl 80 % der Vulvakarzinome HPV-negativ sind, sind die meisten vulvären Vorläuferläsionen HPV-assoziiert. HPV-unabhängige VIN machen <10 % der high-grade VIN aus, haben aber eine 10-Jahres-Krebsinzidenz von 50 % (vs. 10 % bei VHSIL).
Vulväres Paget-Syndrom
Vulväres Paget-Syndrom (VPD) wird als in situ-Adenokarzinom der vulvären Haut mit oder ohne zugrunde liegendem invasivem Adenokarzinom betrachtet. Es ist meist auf das Epithel beschränkt, in 10% der Fälle aber invasiv. Eine sekundäre Beteiligung der vulvären Haut durch Rektum-, Blasen- und Zervixkarzinom wird als «sekundäres Paget-Syndrom» bezeichnet. Das unspezifische Erscheinungsbild wird deshalb auch häufig missinterpretiert. Die Latenzzeiten von Symptombeginn bis Diagnosestellung liegen bei 20 Monaten. Meist zwischen 50. und 80. Lebensjahr. VPD sind insgesamt selten und machen weniger als 2% aller Vulvamalignome aus. Therapie der Wahl ist die wide local excision, 1-2cm im gesunden Gewebe. Die Rezidivrate ist hoch und liegt bei bis zu 60% nach Resektion. Eine Radiotherapie kann als mögliche adjuvante Behandlungsoptionen bei Invasion, LK-Metastasen oder positiven Wundrändern in Betracht gezogen werden.
Differentialdiagnosen
– Lichen simplex chronicus
– Lichen sclerosus
– Lichen planus
– Psoriasis
– Kontaktdermatitis
Sind entzündliche Dermatosen präneoplastisch?
Speziell Lichen sclerosus (LS) wurde als potentieller Präkursor beschrieben. Eine eindeutige Prävalenz ist ausstehend. Ein Vulvakarzinom wird bei 3.5-7% der Patientinnen mit LS gesehen. LS ist mit dVIN assoziiert (dVIN pathway). Das Risiko einer Neoplasie beträgt pro Jahr ca. 1%, weshalb ein langes Follow up empfohlen werden sollte. Die 20-Jahre Inzidenz für Vulvakarzinom liegt bei 6.7% vor allem bei Patientinnen mit zusätzlich Vin und bei über 70-jährigen.
Management
Derzeit gibt es keinen allgemein gültigen Standard. Es gibt verschiedene Guidelines, allerdings teils ohne Evidenzangaben. Bei dVIN sollte meist ein Exzisionsverfahren angewandt werden. Bei VHSIL können sowohl Exzisionsverfahren als auch ablative Verfahren angewandt werden. Letztere können zur Erhaltung von Anatomie und Funktion in Betracht gezogen werden und müssen zum Ausschluss von Malignität durch mehrere repräsentative Biopsien ergänzt werden. Bei VHSIL kann eine medizinische Behandlung (z.B. Imiquimod) in Betracht gezogen werden. Das Risiko eines mit Lichen sclerosus-assoziierten Karzinoms (über einen dVIN-Weg) wird durch die Behandlung mit hochwirksamen topischen Kortikosteroiden verringert und sollte bei diesen Patientinnen empfohlen werden.
Zusammenfassung
Die meisten vulvären Neoplasien sind HPV-abhängig, doch HPV-unabhängige (dVIN, DEVIL, VAAD) haben ein höheres Karzinomrisiko und eine schlechtere Prognose. Entzündliche Erkrankungen sind häufiger mit dVIN, DEVIL, VAAD assoziiert.
Therapie: dVIN sollten chirurgisch saniert werden. Die Behandlung von Lichen sclerosus und Lichen planus ist wichtig. Vor nicht-exzidierenden Verfahren (Laser, Imiquimod) sind multiple Biopsien ratsam. Imiquimod wird bei multifokaler VHSIL zur Anatomieerhaltung empfohlen. Nach R1-Resektion ohne Restläsion ist keine direkte Re-Resektion nötig. Die HPV-Impfung kann postoperativ diskutiert werden. Regelmässige Kontrollen nach VHSIL sind empfohlen.
Kontrazeption in der Jugendgynäkologie

Die Adoleszenz ist eine Phase wichtiger körperlicher und psychischer Entwicklungen, die etwa zwischen dem 10. und 20. Lebensjahr stattfindet, stellte Frau Dr. med. Nina Manz, Stadtspital Triemli, Zürich, fest.
Sie umfasst die Pubertät und den Übergang zur Geschlechtsreife und ist von Experimentieren in Bereichen wie Alkohol, Drogen und Sexualität geprägt. Jugendliche entwickeln im Verlauf unterschiedliche Einstellungen zur Sexualität: In der frühen Adoleszenz steht Egozentrismus im Vordergrund, später kommen erste romantische Beziehungen hinzu und in der späten Adoleszenz zeigen sich mehr Verantwortung und emotionale Reife.
Verhütungsverhalten von Jugendlichen
Laut einer Schweizer Umfrage (2021) verhüteten 5.4% der Jugendlichen beim ersten Geschlechtsverkehr nicht. Die Verhütungsraten sind höher, wenn Aufklärung und Beratung zugänglich sind; und sie sind geringer bei niedrigem Bildungsstand oder hohem Nikotinabusus. Bei einer repräsentativen Umfrage in Deutschland verwendeten 70% der Jugendlichen die „Pille“, 48% Kondome und 2% ein IUD (Intrauterinpessar).
Verhütungsmethoden:
• Kondome: Einzige Methode zum Schutz vor sexuell übertragbaren Krankheiten. Sie haben einen relativ schlechten Pearl-Index aufgrund von Anwendungsfehlern und sind bei Latexallergie problematisch.
• Kombinierte Ovulationshemmer (Pille): Häufig verwendet, auch wenn die Einhaltung nicht immer optimal ist. Nebenwirkungen können Übelkeit, Brustspannen und Kopfschmerzen umfassen. Sie bieten Vorteile wie eine Regulierung des Zyklus und Schutz vor bestimmten Krebsarten.
• Rein gestagenhaltige Methoden: Geeignet für Frauen, die keine Östrogene vertragen. Diese Methoden sind auch vorteilhaft bei unregelmässigen Perioden und haben weniger Auswirkungen auf das Gewicht und die Knochendichte.
• IUDs: Eine sehr effektive, langwirksame Methode mit einem Pearl-Index von unter 1, die keine Compliance-Probleme aufweist. Sie können auch von Jugendlichen und Nulliparae gut genutzt werden, wobei ein Screening auf sexuell übertragbare Infektionen empfohlen wird.
• Notfallkontrazeption: Zu den Optionen gehören Levonorgestrel (Norlevo) bis 72 Stunden nach ungeschütztem Geschlechtsverkehr, Ulipristalacetat (EllaOne®) bis 120 Stunden sowie Kupfer-IUDs bis 120 Stunden nach dem Geschlechtsverkehr.
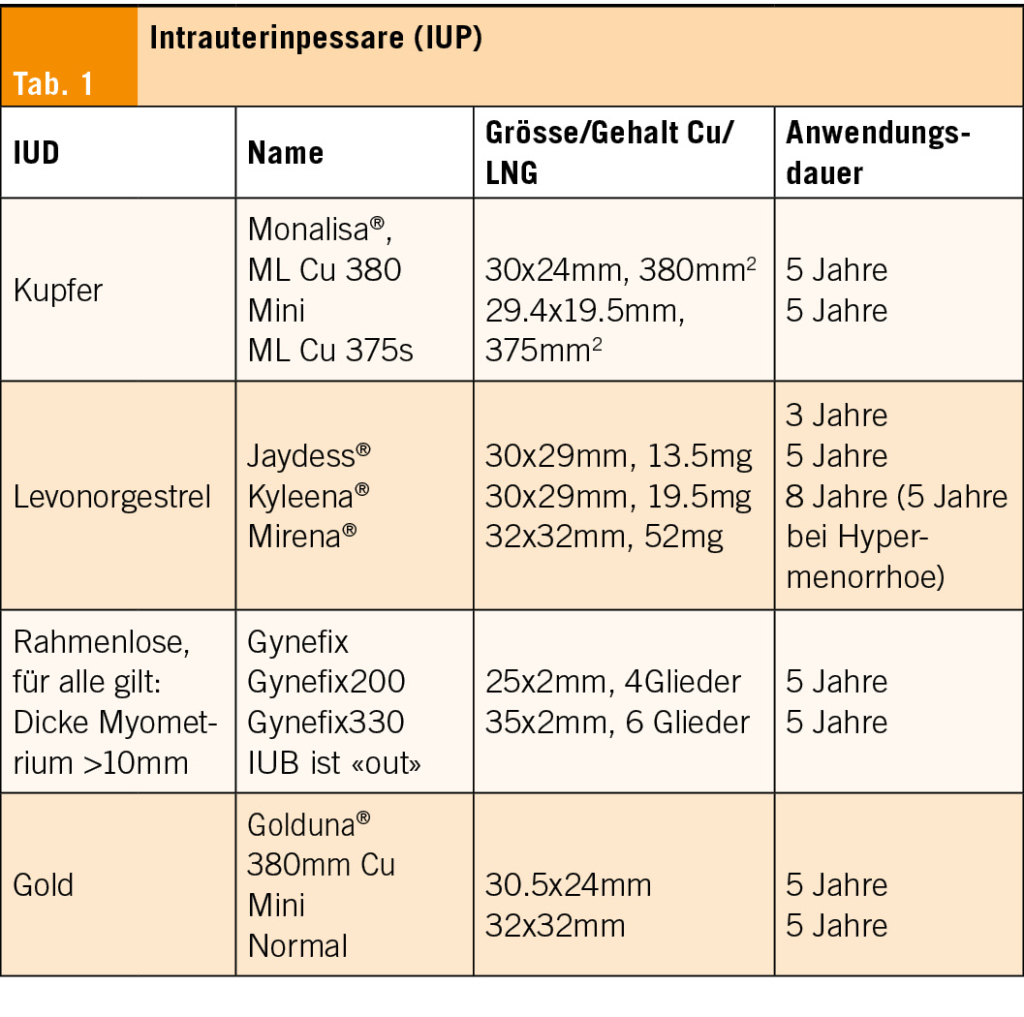
Formen der Kontrazeption: IUDs
IUDs gehören zu den long acting reversible contraception (LARC). Sie sind 100% reversibel, haben keine Compliance-Probleme und einen optimalen Pearl-Index (<1). Sie sind kostengünstig (bei Langzeitanwendung). Sie sind sicher auch für Adoleszentinnen und Nulliparae (Tab. 1). Für alle IUDs gilt: Einlage erst nach Geschlechtsverkehr, Cavumlänge mit transvaginalem Ultraschall und Hysterometer bestimmen.
Beratung und Aufklärung
Die Beratung sollte individuell und umfassend sein, um die richtige Methode zu finden. Dabei ist es wichtig, Vorurteile, Ängste und äussere Einflüsse wie Medien und Peers zu berücksichtigen. Für Jugendliche ist es entscheidend, dass sie Informationen über alle verfügbaren Methoden erhalten und wissen, welche für sie am besten geeignet ist.
Take Home Message
Die Adoleszenz ist eine sensible Lebensphase
• Aspekte wie Risikoverhalten, Adhärenz und Compliance bei medikamentöser Therapie und Bedarf nach hoher Sicherheit müssen bei der Beratung zur Antikonzeption berücksichtigt werden
• Adoleszentinnen brauchen und wünschen eine übergreifende und komplette Aufklärung über die verfügbaren Antikonzeptiva inklusive IUD/IUS
• Es steht eine grosse Platte von sicheren Kontrazeptiva (s. WHO-Kriterien) zur Auswahl mit wenigen Einschränkungen und komplette Aufklärung über die verfügbaren Antikonzeptiva inklusive IUD/IUS
• Es steht eine grosse Platte von sicheren Kontrazeptiva (s. WHO-Kriterien) zur Auswahl mit wenigen Einschränkungen
Nystatin – eine Jahrhundertsubstanz
Am Satellitensymposium von Gynial AG, Rotkreuz, sprach Prof. Dr. Hans-Jürgen Tietz, Berlin, zum Thema Nystatin: «Der natürliche Feind des Scheidenpilzes». Der Referent betonte, dass Pilze keine Immunität hervorrufen und Infektionen deshalb wiederholt auftreten können. Er wies insbesondere auf die Resistenzen hin, die mit den gängigen Antimykotika einhergehen. Prof. Tietz unterstrich seinen engagierten und humorvollen Beitrag mit eindrucksvollen Bildern von Pilzinfektionen.
Prof. Tietz beschreibt Nystatin in seinem Buch mit dem Titel «75 Jahre Nystatin – eine Jahrhundertsubstanz» wie folgt:
Nystatin wurde 1948 als erstes Antimykotikum isoliert aus Streptomyces noursei von Elizabeth Lee Hazen und Rachel Fuller Brown am New York State Department of Health. Die beiden Forscherinnen untersuchten Actinomyceten aus Bodenproben. Der Streptomyces-Stamm, aus dem sie Nystatin isolierten, stammte aus dem Gartenboden von Freunden mit dem Namen Nourse und wurde entsprechend Streptomycin noursei genannt. Hazen und Brown benannten Nystatin 1954 nach dem New York State Department Institute, in dem sie arbeiteten.
Nystatin ist das erste entdeckte Antimykotikum und eine der bis heute weltweit am häufigsten eingesetzten Substanzen, schrieb Prof. Hans-Jürgen Tietz in seinem Buch «75 Jahre Nystatin». Auch in Zeiten zunehmender Resistenzen bei Spezies wie Candida (C.) albicans und C. glabrata gegenüber Azolen wie Fluconazol, Clotrimazol und Miconazol zeigt es eine ungemindert breite und fungizide Wirksamkeit gegenüber allen relevanten Candida-Spezies. Resistenzen sind bis heute nicht bekannt.
Damit bleibt Nystatin auch nach 70 Jahren von herausragender Bedeutung in der Therapie von Mykosen. Angesichts der wachsenden Resistenzproblematik ist es unverzichtbarer denn je. Es ist hochwirksam bei Azol-Resistenz, so der Autor.
Prof. Dr. Dr. h.c. Walter F. Riesen
riesen@medinfo-verlag.ch