De nombreux médecins se demanderont pourquoi il y a déjà de nouvelles recommandations? La réponse est simple: depuis les dernières recommandations de 2020, il y a eu beaucoup d’études de points finaux cardiovasculaires qui doivent être classées. En outre, certains nouveaux médicaments, qui ont été ou seront introduits en 2023, n’ont pas encore été pris en compte. En outre, il existe certes les directives européennes et américaines sur le diabète, mais elles sont à notre avis trop compliquées pour les internistes généralistes et les médecins de famille. L’objectif du groupe de travail suisse était d’élaborer des recommandations simples, étape par étape, qui puissent être bien mises en œuvre par tous les médecins (1).
Many physicians will ask themselves, why are there already new recommendations? The answer is simple: since the last recommendations of 2020, there have been many cardiovascular endpoint studies that need to be classified. In addition, there are some new drugs that have been or will be introduced in 2023 that have not yet been considered. In addition, there are the European and American guidelines on diabetes, but in our opinion they are too complicated for the general internist and GP. The goal of the Swiss working group was to develop simple step-by-step recommendations that can be easily implemented by all physicians (1).
Key words: Diabète, diabète sucré de type 2, Endocrinologie
Recommandations thérapeutiques en Suisse
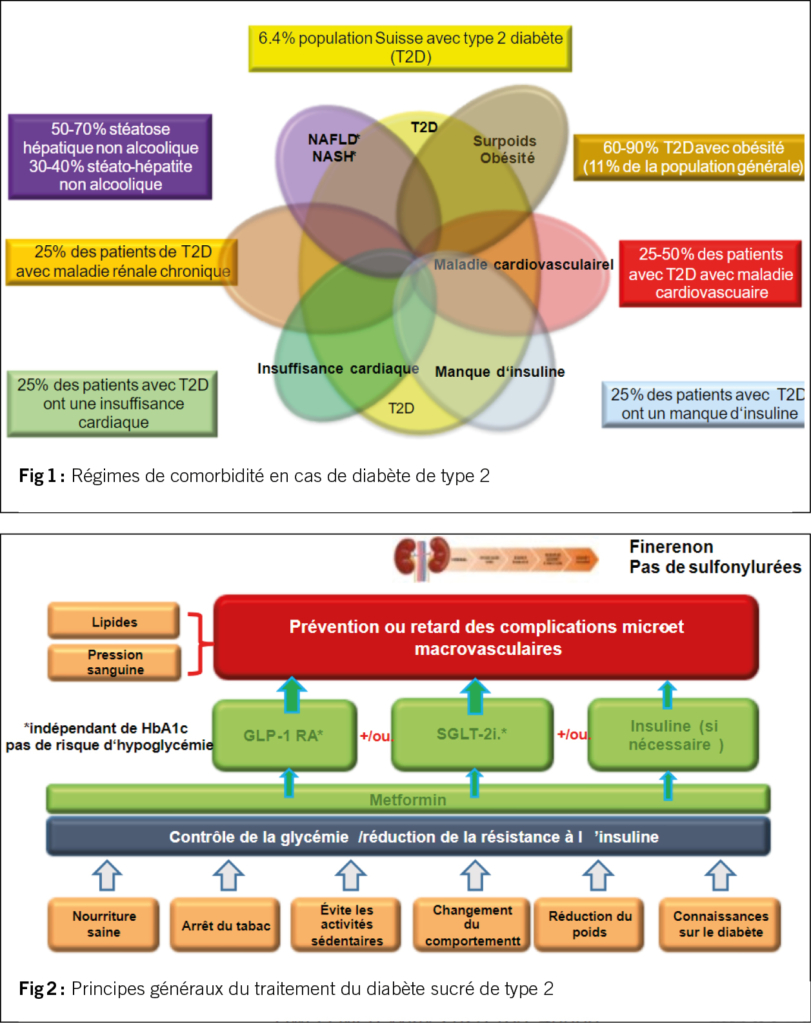
La figure 1 résume les comorbidités les plus fréquentes dans le diabète sucré de type 2 en Suisse, ainsi que leur prévalence. Toutes les comorbidités ont fait l’objet de progrès importants et de nouvelles connaissances au cours des dernières années. La seule comorbidité, très fréquente chez les diabétiques, pour laquelle il n’existe pas encore de recommandations thérapeutiques universelles et qui nécessite encore un important travail de recherche est la stéatose hépatique non alcoolique (NAFLD), également appelée aujourd’hui stéatose hépatique métabolique associée (MAFLD), car cette forme est très souvent associée à un syndrome métabolique, à l’obésité et au diabète (50-70%). Le terme non alcoolique a été remplacé par celui d’alcoolique, car une consommation légère à modérée d’alcool est tout de même assez fréquente dans ce groupe de population. Ce que l’on sait déjà, c’est que le GLP-1 RA et le GLP-1/GIP RA peuvent réduire la stéatose hépatique et la progression vers la fibrose et que les inhibiteurs du SGLT-2 ont également un effet positif, la perte de poids étant probablement le facteur le plus important.
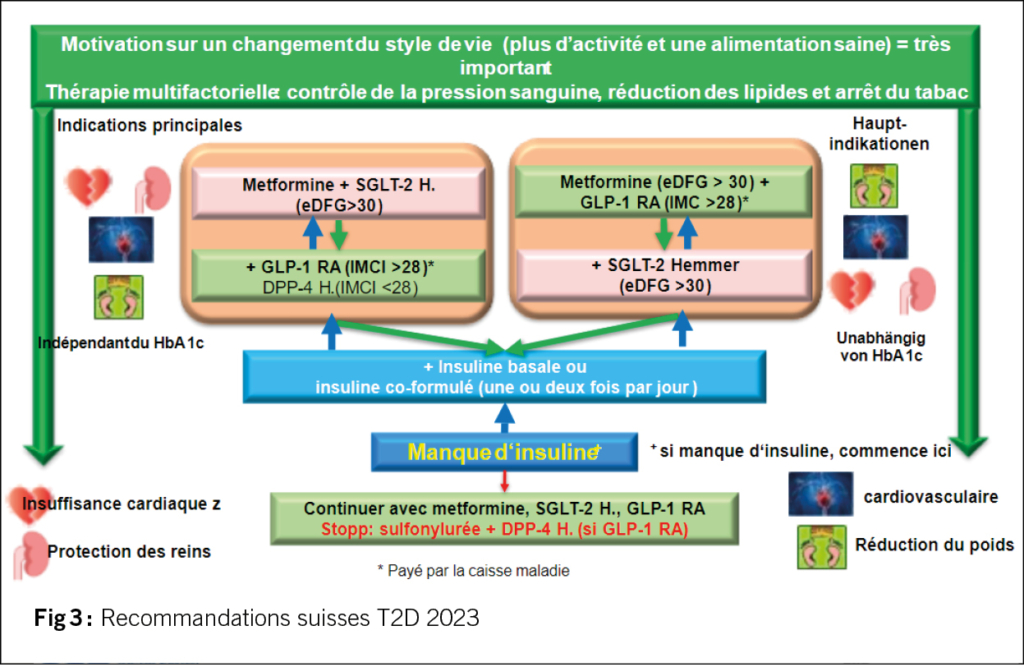
La figure 2 résume les principes généraux du traitement, mais il convient de noter que les lipides et la pression artérielle doivent également être pris en compte et que l’utilisation du GLP-1 RA et des inhibiteurs du SGLT-2 doit être indépendante de l’HbA1c.
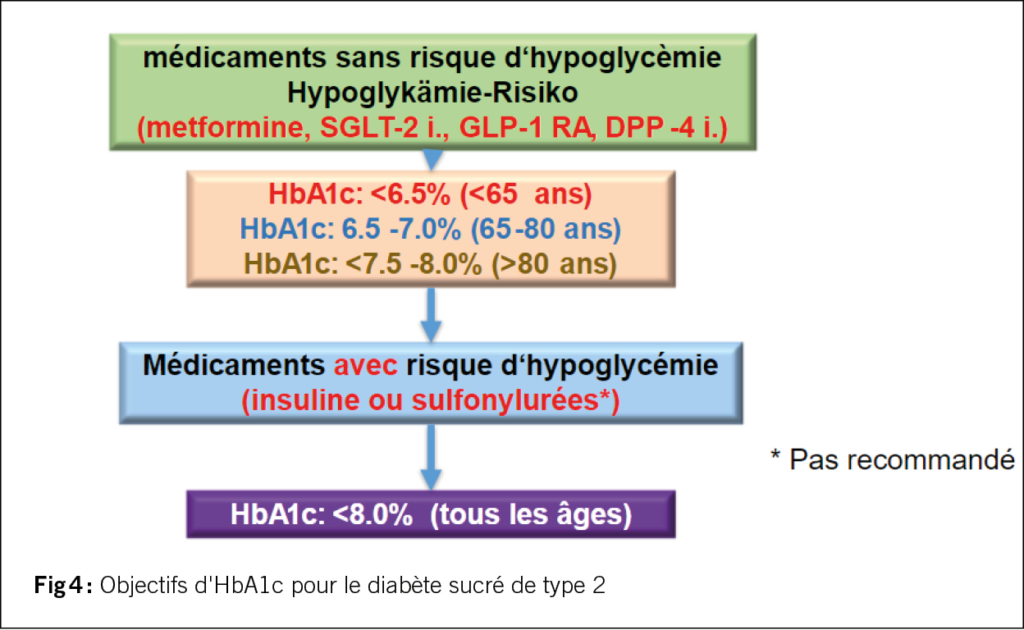
La figure 3 présente un guide étape par étape sur la manière dont le diabète de type 2 doit être traité. La première étape définit l’indication principale pour l’utilisation des antidiabétiques modernes. Si l’accent est mis sur le traitement de la maladie rénale chronique ou de toutes les formes d’insuffisance cardiaque, il convient d’envisager un traitement combiné initial par la metformine et les inhibiteurs du SGLT-2. Si l’indication principale est la perte de poids et la protection cardiovasculaire (notamment la prévention de l’apoplexie), l’association metformine et GLP-1 RA doit être favorisée. Les GLP-1 RA fonctionnent également en cas d’IMC <28, l’Office fédéral de la santé publique a introduit cette restriction afin de réduire la fréquence de prescription. La question se pose parfois de savoir pourquoi la metformine est toujours utilisée? La metformine est le seul médicament qui inhibe nettement la gluconéogenèse hépatique et elle a été utilisée comme traitement de première ligne dans toutes les études cardiovasculaires en point final. De plus, une grande méta-analyse portant sur plus de 40 études et plus d’un million de patients atteints de diabète sucré et d’une maladie coronarienne a montré une réduction significative des décès d’origine cardiovasculaire et de la mortalité totale de 19, respectivement 33%, et les événements cardiovasculaires ont également été réduits de manière significative de 17% (Han Y, et al, Cardiovas Diabetol 2019;18:96).
La deuxième étape consiste à combiner les inhibiteurs du SGLT-2 avec le GLP-1 RA, indépendamment de l’HbA1c. Cette triple combinaison représente le traitement idéal du diabète sucré de type 2 en réunissant tous les avantages des deux groupes de substances: réduction de la réduction de la MACE en 3 points, de l’apoplexie non fatale, de la mort cardiovasculaire, de l’insuffisance cardiaque, de la néphroprotection et de la réduction de la mortalité globale. Un nouveau médicament qui sera mis sur le marché suisse à l’automne 2023 est le tirzépatide (Mounjaro®), un double GLP-1/GIP RA, autorisé pour le diabète de type 2 et utilisé à une dose de 5-15 mg. Les effets sur l’HbA1c et le poids sont comparables à ceux du semaglutide (1,0 ou 2,4 mg (Wegovy® autorisé pour l’obésité). Il n’existe cependant qu’une comparaison directe avec 1 mg de sémaglutide vs. 5-15 mg de tirzépatide, le tirzépatide étant supérieur en termes de réduction du poids et de l’HbA1c.
Les inhibiteurs de la DPP-4 ne sont en fait utilisés que si l’IMC est <28 ou si les GLP-1 RA ne peuvent pas être utilisés en raison d’effets secondaires gastro-intestinaux.
Le principal problème avec la triple combinaison est le remboursement des coûts par les caisses d’assurance maladie. Si l’on commence par le médicament le plus cher, le GLP-1 RA, la caisse maladie rembourse pratiquement toujours l’inhibiteur du SGLT-2, qui est aussi cher qu’un inhibiteur du DPP-4. Si l’on commence par l’association d’un inhibiteur du SGLT-2 et de la metformine, l’utilisation du GLP-1 RA nécessite actuellement la plupart du temps une garantie de prise en charge des coûts. On peut contourner cette difficulté en posant l’indication de l’inhibiteur du SGLT-2 soit pour la maladie rénale chronique, soit pour toute forme d’insuffisance cardiaque. L’insuffisance cardiaque avec fraction d’éjection préservée (>40%) est la forme prédominante du diabète de type 2 (3/4 des cas) et les inhibiteurs du SGLT-2 sont le seul traitement efficace pour l’HFpEF. L’indication du GLP-1 RA serait donc le traitement du diabète. Des efforts sont en cours de la part de toutes les entreprises pharmaceutiques impliquées pour que l’OFSP élimine ces limitations, car la triple combinaison représente l’option thérapeutique préférée au niveau national et international.
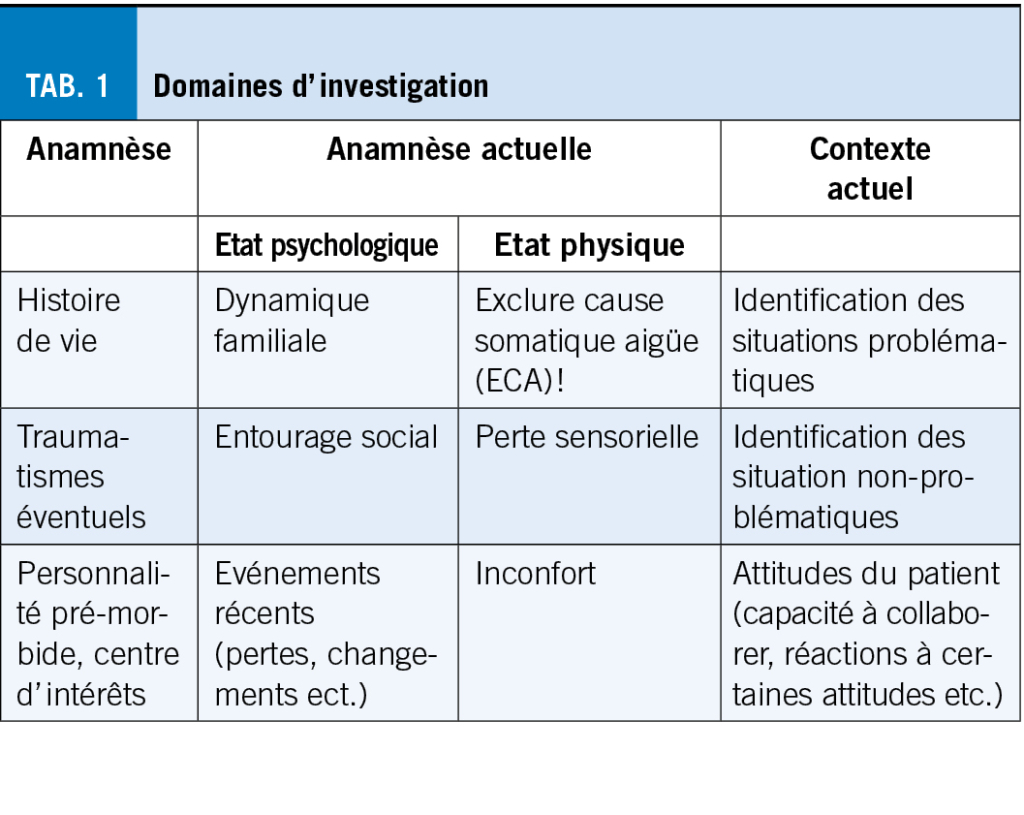
L’étape 3 suit, si l’HbA1c ne se situe pas dans la zone cible malgré la tri-thérapie, on utilise alors l’insuline (le manque d’insuline concerne 25% de tous les patients atteints de diabète sucré de type 2). La forme la plus simple est l’administration une fois par jour d’une insuline basale à action ultra-longue comme la glargine 300 ou l’insuline dégludec (Toujeo® ou Tresiba®). On commence généralement avec 10 U par jour ou 0,2 U/kg et on augmente de 2 unités une fois par semaine. L’alternative serait, surtout si la glycémie augmente fortement après un ou deux repas principaux, d’administrer une insuline co-formulée comme Ryzodeg®, qui se compose de 30% de NovoRapid® à courte durée d’action et de 70% de Tresiba®. Cette insuline peut être administrée une ou deux fois par jour au moment des repas contenant le plus de glucides ou au moment du repas où la glycémie postprandiale augmente le plus. Une comparaison directe avec un système de bolus de base dans le diabète de type 2 a montré qu’il était possible d’obtenir la même HbA1c, mais avec moins d’hypoglycémies avec l’insuline Ryzodeg® administrée deux fois par jour.
L’ objectif HbA1c dans le diabète sucré de type 2
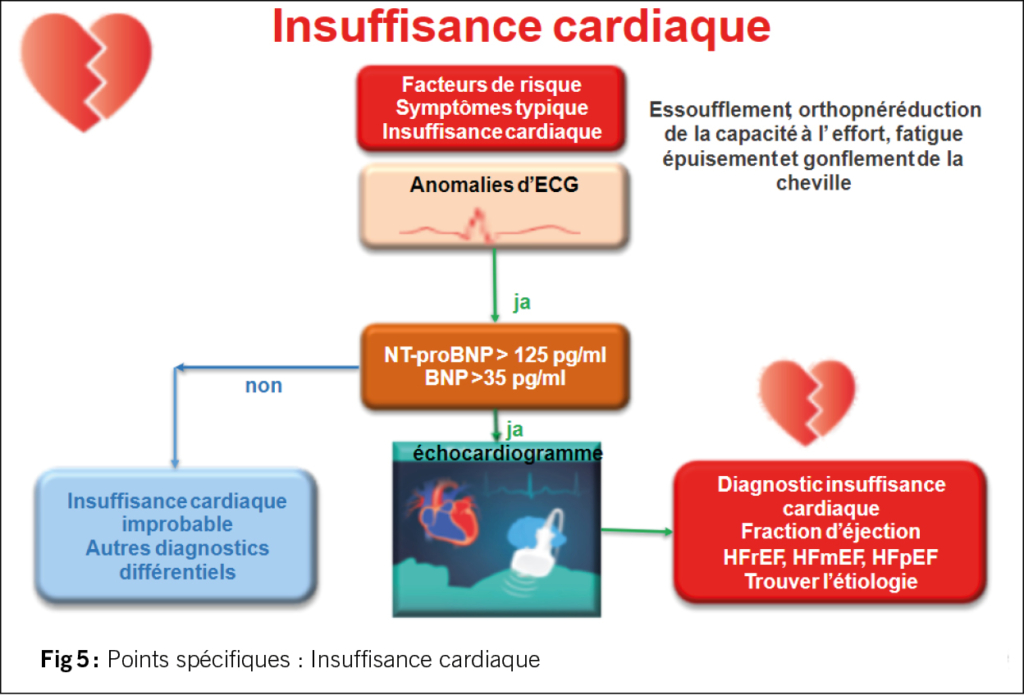
Comme il n’y a pas de risque d’hypoglycémie avec une double ou triple combinaison (metformine, inhibiteur du SGLT-2, GLP-1 RA ou inhibiteur de la DPP-4), l’objectif est HbA1c <6,5% ou aussi proche de la normale que possible pour toutes les personnes de moins de 65 ans. Si l’âge est >65 ou 80 ans, on peut être un peu plus indulgent. La figure 4 illustre ces recommandations. Ce n’est qu’en cas de traitement à l’insuline ou aux sulfonylurées, ces dernières n’étant plus recommandées, que l’on ne souhaite pas atteindre une HbA1c trop basse, en raison du risque d’hypoglycémie. L’HbA1c devrait cependant toujours être < 8,0% pour tous les groupes d’âge, même en cas de traitement à l’insuline.
Situations particulières: Maladie rénale chronique, insuffisance cardiaque et patients âgés et fragiles
Environ 25% des patients suisses atteints de diabète de type 2 souffrent d’une maladie rénale chronique. Malheureusement, beaucoup ne sont pas diagnostiqués, car la détermination de l’albuminurie est effectuée chez moins de 30% des patients. Dans le cas de la maladie rénale chronique, les inhibiteurs du SGLT-2 sont le groupe de médicaments préféré, suivis par les GLP-1 RA, qui peuvent être administrés jusqu’à un eDFG de 15 ml/min. Un nouveau médicament, disponible sur le marché depuis le 1er juin 2023, est un nouvel antagoniste des récepteurs minéralocorticoïdes non stéroïdiens, la finérone (Kerendia®). Ce nouveau médicament est indiqué en cas d’IRC avec un eDFG de 25-59 ml et une microalbuminurie et un eDFG de 25-75 ml/min et une macroalbuminurie et peut être utilisé en association avec des inhibiteurs du SGLT-2.
Pour le dépistage précoce de l’insuffisance cardiaque, il est recommandé d’interroger tous les patients sur les symptômes typiques (dyspnée, orthopnée, réduction de la capacité d’effort, fatigue, œdème des chevilles). Si un ou plusieurs symptômes sont présents et/ou si l’ECG présente des anomalies, le NT-proBNP ou le BNP doivent être déterminés. Si les valeurs sont élevées, les patients doivent être adressés à un cardiologue pour une échocardiographie. Cet examen permet de diagnostiquer l’insuffisance cardiaque et de la classer en HFrEF, HFmEF ou HFpEF en fonction de la fraction d’éjection systolique. La figure 5 illustre le déroulement de cet examen. Outre le traitement établi pour l’HFrEF (inhibiteurs de l’ECA/sartans, diurétiques, bêtabloquants, antagonistes de l’aldostérone), les inhibiteurs du SGLT-2 sont recommandés pour la fraction d’éjection préservée et réduite. Les inhibiteurs du SGLT-2 sont le seul groupe de médicaments présentant une réduction significative des hospitalisations pour insuffisance cardiaque à fraction d’éjection préservée (HFpEF).
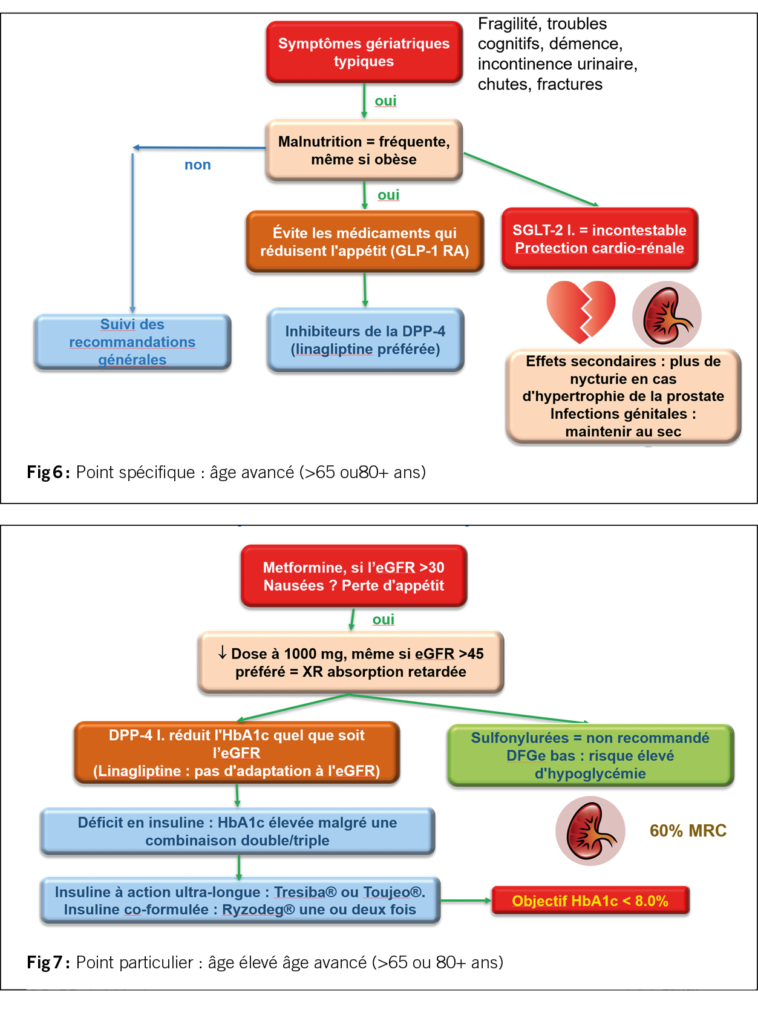
Les patients >65 ans souffrent souvent de maladies gériatriques typiques et présentent souvent une malnutrition, même s’ils sont obèses (figures 6 et 7). Chez ces patients, on souhaite éviter l’effet coupe-faim du GLP-1 RA et on préfère les inhibiteurs de la DPP-4. La linagliptine (Trajenta®) est privilégiée, car la dose ne doit pas être adaptée au eDFG. L’effet rénocardioprotecteur des inhibiteurs du SGLT-2 est également incontesté dans ce groupe.
Copyright Aerzteverlag medinfo AG
Cet article est une traduction de « der informierte arzt » 08_2023
UniversitätsSpital Zürich
Rämistrasse 100
8091 Zurich
Roger.Lehmann@usz.ch
RL: Participation à des Advisory Boards et honoraires de conferencier de Novo Nordisk, Sanofi, MSD, Boehringer Ingelheim, Servier et Astra Zeneca.
(1) Giacomo Gastaldi, Barbara Lucchini , Sebastien Thalmann, Stephanie Alder,
Markus Laimer, Michael Brändle, Peter Wiesli. Roger Lehmann; Working group of the SGED/SSED, Swiss recommendations of the Society for Endocrinology and Diabetes (SGED/SSED) for the treatment of type 2 diabetes mellitus (2023), Swiss Med Wkly 2023;153;40060 doi.org/10.57187/smw.2023.40060