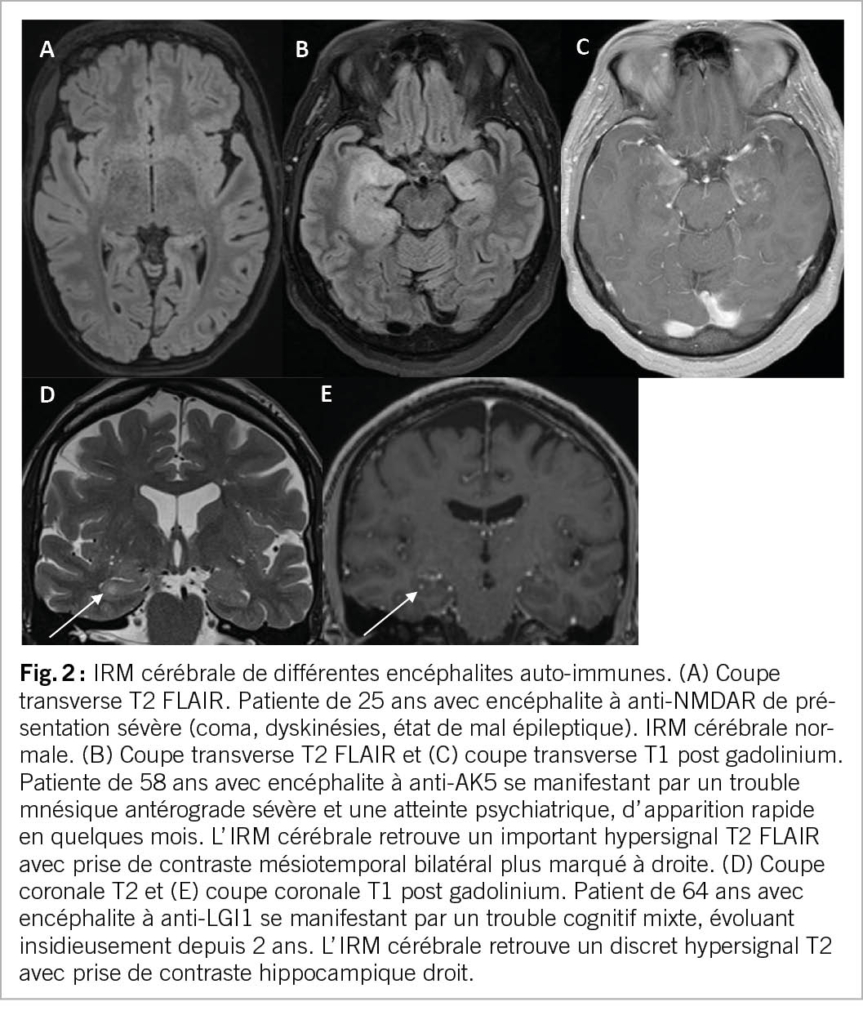
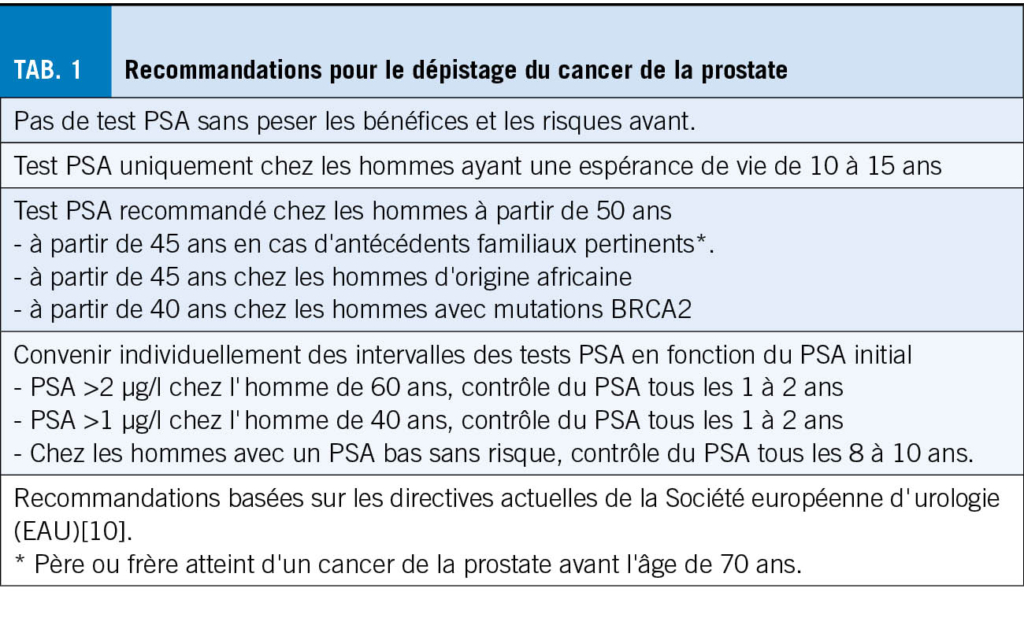
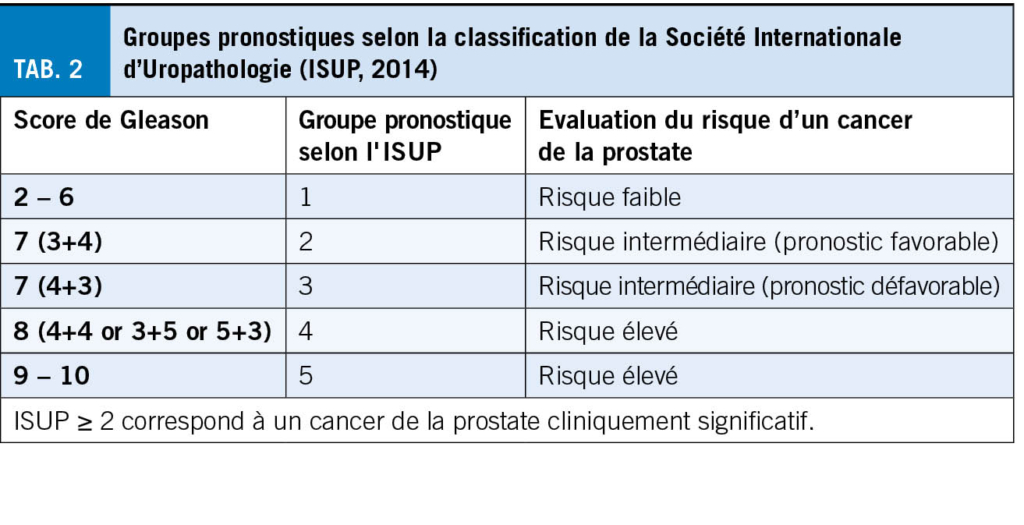
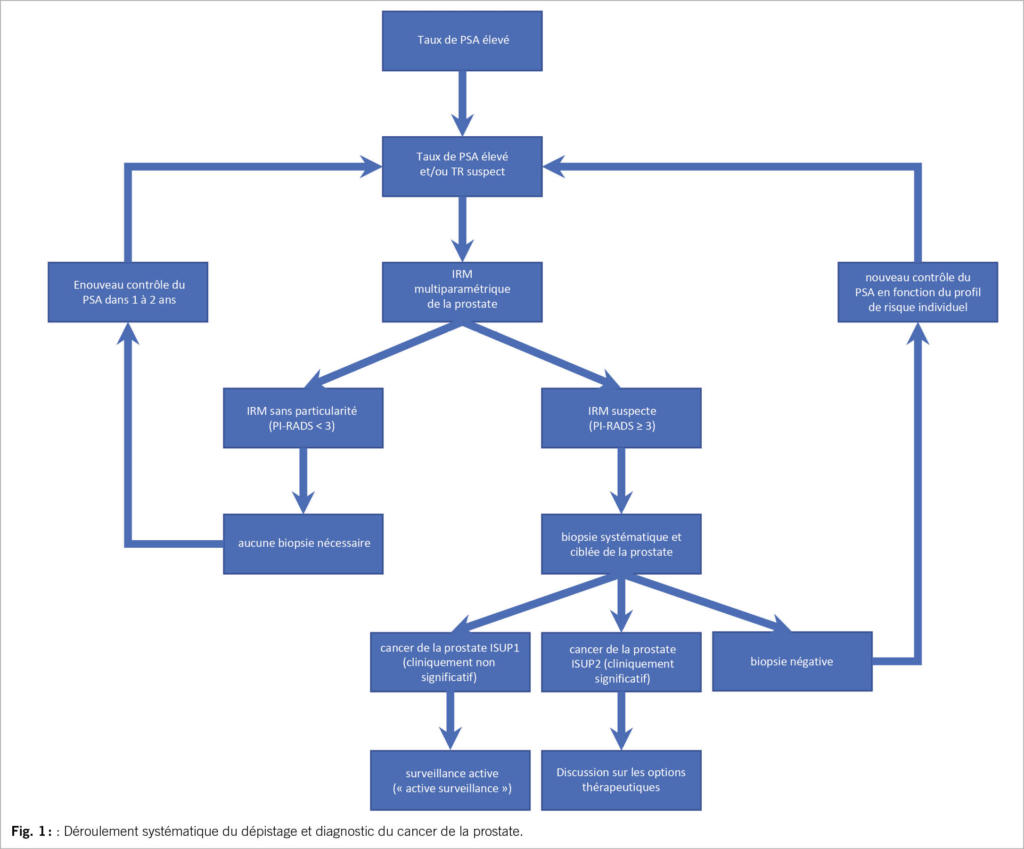
Aussi bien l’ incidence que la prévalence de l’ épilepsie augmentent après 65ans. Au vu du vieillissement de la population, la prise en charge de l’ épilepsie chez la personne âgée devient un enjeu de santé publique. La prise en charge de ces patients implique de tenir en compte l’ étiologie, les comorbidités, les risques inhérents à une récidive de crise ou au traitement anticonvulsivant, ainsi que les changements pharmacodynamiques et pharmacocinétiques survenant dans l’ âge avancé.
Both the incidence and prevalence of epilepsy increase after the age of 65. In view of the ageing population, the management of epilepsy in the elderly is becoming a public health issue. The management of these patients implies taking into account the etiology, comorbidities, the risks inherent in a seizure recurrence or anticonvulsant treatment, as well as the pharmacodynamic and pharmacokinetic changes that occur in old age.
Key Words: epilepsy, elderly,public health, anticonvulsant treatment
L’ épilepsie est la troisième maladie neurologique la plus fréquente >65ans, après l’ AVC et les démences, tous deux majorant le risque d’ épilepsie (1). Cette tendance va s’ accentuer au vu du vieillissement de la population, avec estimation d’ une augmentation de 60 % des personnes de > 65ans dans les prochain 15ans (2). La prise en charge de l’ épilepsie chez la personne âgée implique des considérations particulières au vu des différentes étiologies, comorbidités, risque accru d’ effets secondaires du traitement, comédications, et changements pharmacodynamiques et pharmacocinétiques. De plus, la personne âgée est particulièrement vulnérable en cas de survenue de crise épileptique : risque de lésion traumatique, perte de confiance et diminution de l’ autonomie. Malgré tout cela, l’ épilepsie est souvent diagnostiquée avec retard chez la personne âgée, et ces patients ont moins facilement accès à des centres spécialisés (3).
Epidémiologie
Quand nous parlons de crises épileptiques chez la personne âgée, il convient de bien définir trois scénarios:
1) Crises épileptiques provoquées (ou symptomatique aigues), survenant dans la phase précoce d’ une lésion cérébrale ou suite à des troubles toxico-métaboliques. L’ incidence augmente linéairement dès la troisième décade, avec risque estimé à 3.6 % à 80ans (4). Suite à une première crise il convient d’ effectuer un bilan biologique large, une imagerie cérébrale et une anamnèse détaillée à la recherche d’ un facteur favorisant. Ce type de crise ne permet pas de retenir automatiquement un diagnostic d’ épilepsie. En effet, l’ épilepsie est définie par la survenue de ≥2 crises non provoquées espacées de 24h ou une crise unique avec risque de récidive à 10ans estimé ≥60 % (par le biais des examens complémentaires, tels qu’ EEG, imagerie) (5).
2) Epilepsie ayant débuté dans le jeune âge et se poursuivant dans l’ âge avancé.
3) Epilepsie survenant de novo à l’ âge avancé (>60ans).
L’ incidence de l’ épilepsie est accentuée dans le très jeune âge et l’ âge avancé (augmentation graduelle dès 40-50ans), et est estimée à 90-150/100’000 à 65ans. Ce pattern bimodal a été répétitivement démontré aussi bien dans des pays développés que en voie de développement (3, 6). Au vu du vieillissement de la population et de l’ amélioration des soins avec survie plus longue des patients souffrant d’ épilepsie dans le jeune âge, la prévalence de l’ épilepsie suit une même courbe bimodal (5.4 % chez la personne âgée et jusqu’ à 7.5 % chez les patients en EMS (7, 8)). L’ incidence de l’ état de mal épileptique (EME), soit une crise prolongées de plus de 5 à 10 minutes, est estimée à 86/100’ 00 chez la personne âgée, soit 5x plus élevé que chez les plus jeunes (9). De plus la mortalité associée à l’ EME augmente avec l’ âge pour atteindre 38 % > 60ans (9, 10) et représente un des facteurs pronostiques principaux (11). Ces données confortent le fait que l’ épilepsie chez la personne âgée ne doit pas être considérée comme une maladie bénigne.
Etiologies et facteur de risque
Les maladies cérébrovasculaires sont responsable de plus d’ un tiers des épilepsie chez la personne âgée (12) avec une incidence d’ épilepsie, suite à un AVC, de 6.4-15 % (13). Les maladies neurodégénératives et les étiologies indéterminées représentent environ un quart des cas (6). Les étiologies tumorales sont responsables d’ environ 10 % (14). Plusieurs études reportent une association entre les facteurs de risque cérébro-vasculaire et la survenue d’ épilepsie (15-18). Dans la cohorte ARIC (Atherosclerosis Risk in Communities) incluant plus de 10’000 patients suivi durant une décennie, la survenue d’ épilepsie était est associée à l’ HTA, le diabète et les AVC (18). Cette observation ouvre la possibilité d’ une approche holistique permettant peut-être de réduire l’ épileptogenèse en traitant les facteurs de risque cérébo-vasculaire.
Challenge diagnostic
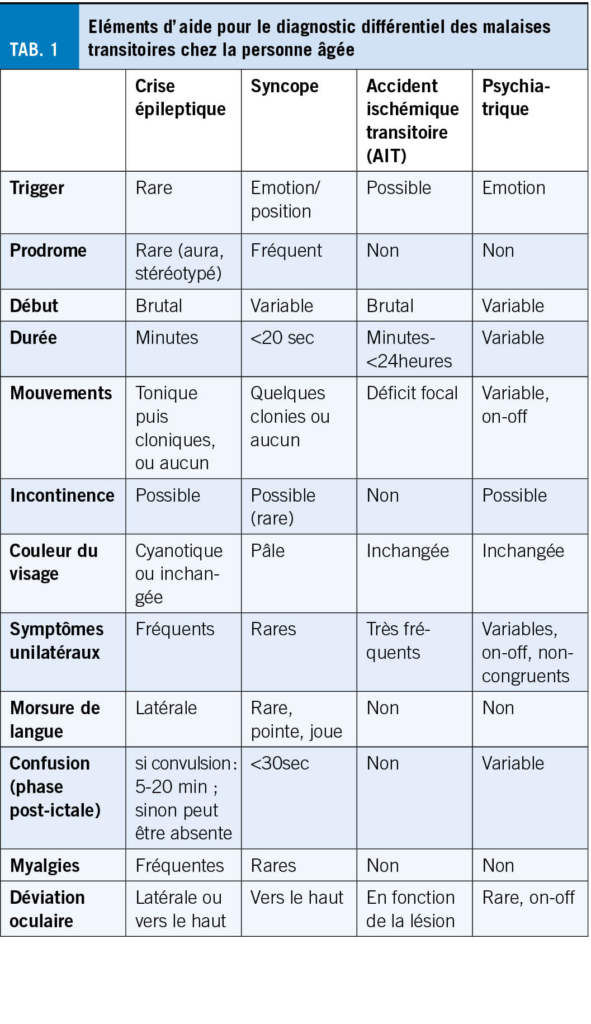
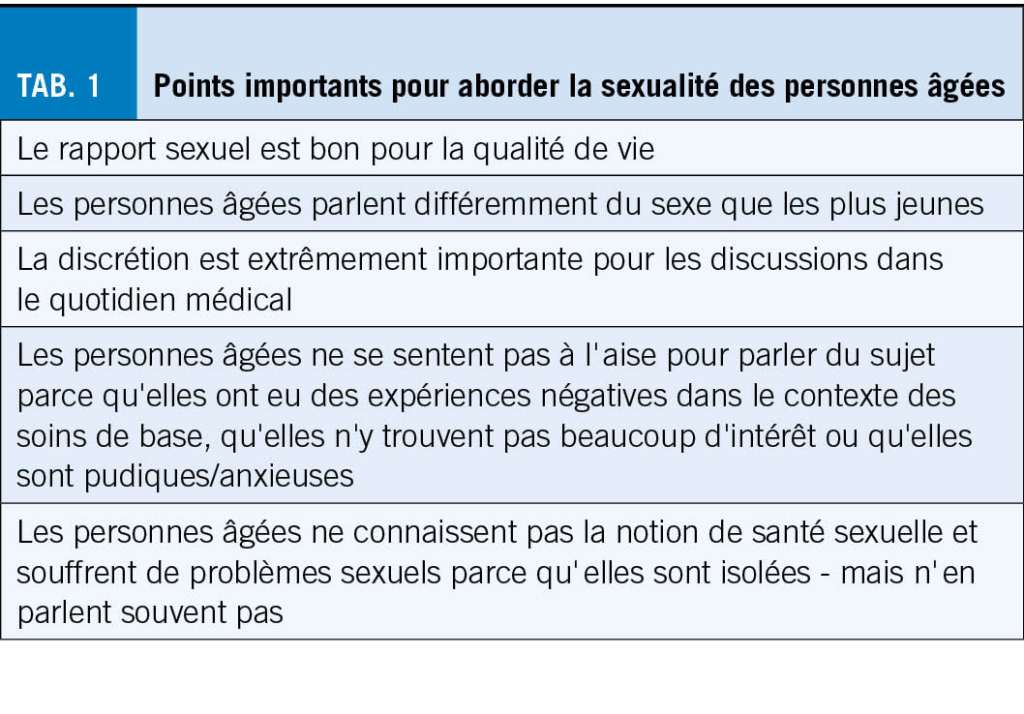
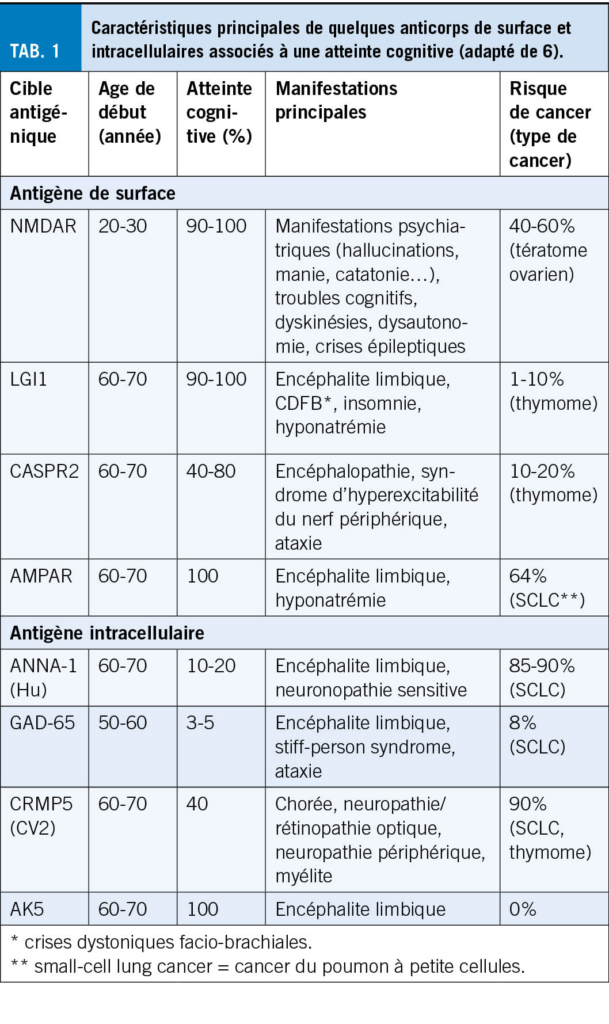
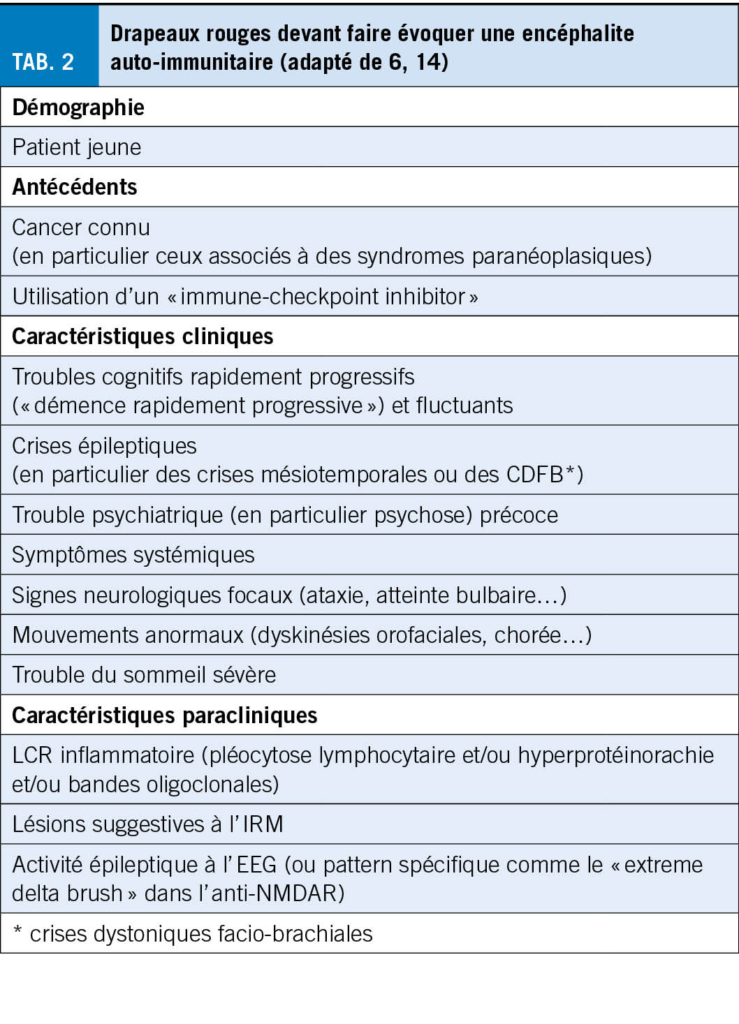
Les crises épileptiques chez la personne âgée sont majoritairement focales et peuvent passer inaperçues de par leur sémiologie moins « motrice » que chez le jeune. Elles peuvent se manifester uniquement par des épisodes paroxystiques d’ arrêt d’ activité, perte de contact, chute ou confusion (3). Une épilepsie n’ aurait pas été considérée initialement chez 26 % de patients âgés avec diagnostic final d’ épilepsie (19). Jusqu’ à 70 % des crises, lors d’une maladie d’Alzheimer, se présenteraient purement avec des troubles de l’ état de conscience (20). De plus, le diagnostic différentiel est très large, incluant fluctuations dans le cadre d’ une maladie neurodégénérative, syncopes, AIT ou troubles toxico-métaboliques. L’ anamnèse auprès du patient et des proches est essentielle. Il convient de chercher activement le caractère stéréotypé des épisodes, les circonstances de survenue et d’ éventuels signes associés tel que des automatismes (Tab. 1). Les patients âgés tendent à avoir une confusion post-critique ou des phénomènes de Todd prolongés (plusieurs heures, voir jours), pouvant mener au diagnostic erroné de démence ou d’ AVC (21). Le diagnostic d’ épisode fonctionnel (PNES ; Psychogenic Non epileptic Seizures) est souvent peu considéré chez la personne âgée. Toutefois dans une cohorte de 94 patients de >60ans sous monitoring EEG à but de caractérisation d’ épisode, 27 ont présenté des épisodes non-épileptiques, principalement des PNES (22). Il s’ agit souvent de sujets avec une lourde comorbidité somatique (23). L’ EEG peut évidemment aider au diagnostic. Il convient toutefois de souligner qu’ un enregistrement interictal ne présente ni une spécificité ni une sensibilité parfaite. L’ EEG détecte des anomalies irritatives interictales chez environs un tiers des patients âgés souffrant d’ épilepsie. Inversement des anomalies irritatives interictales sont rapportées, principalement dans le sommeil, chez 2 à 6 % des patients souffrant de maladie neurodégénérative, sans nécessairement d’ épisode clinique compatibles avec des crises (20). L’ anamnèse et le jugement clinique doivent donc primer. En de cas forte suspicion clinique, un traitement d’ épreuve, voire un enregistrement EEG prolongé incluant du sommeil peuvent être discutés au cas par cas.
Traitement
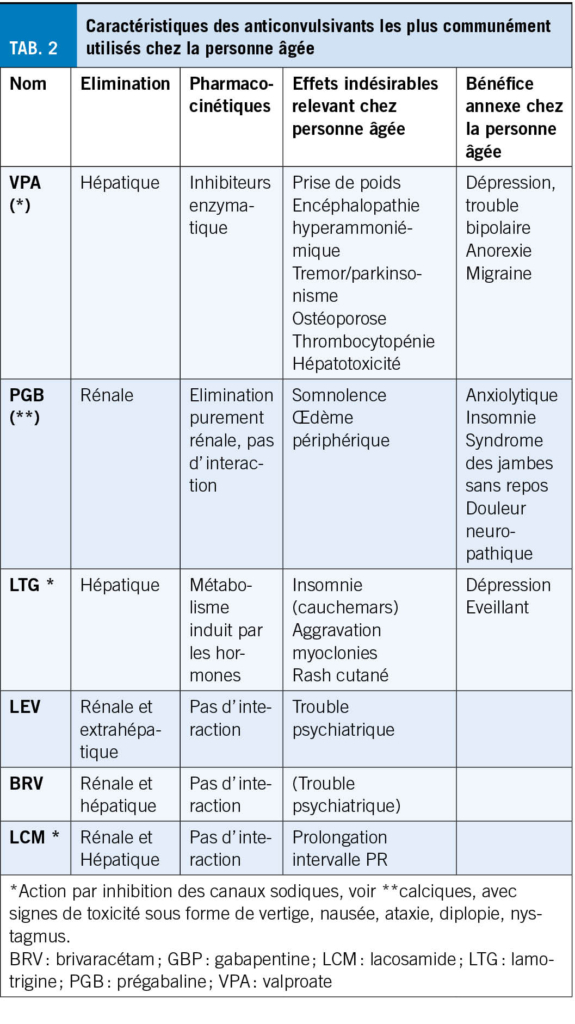
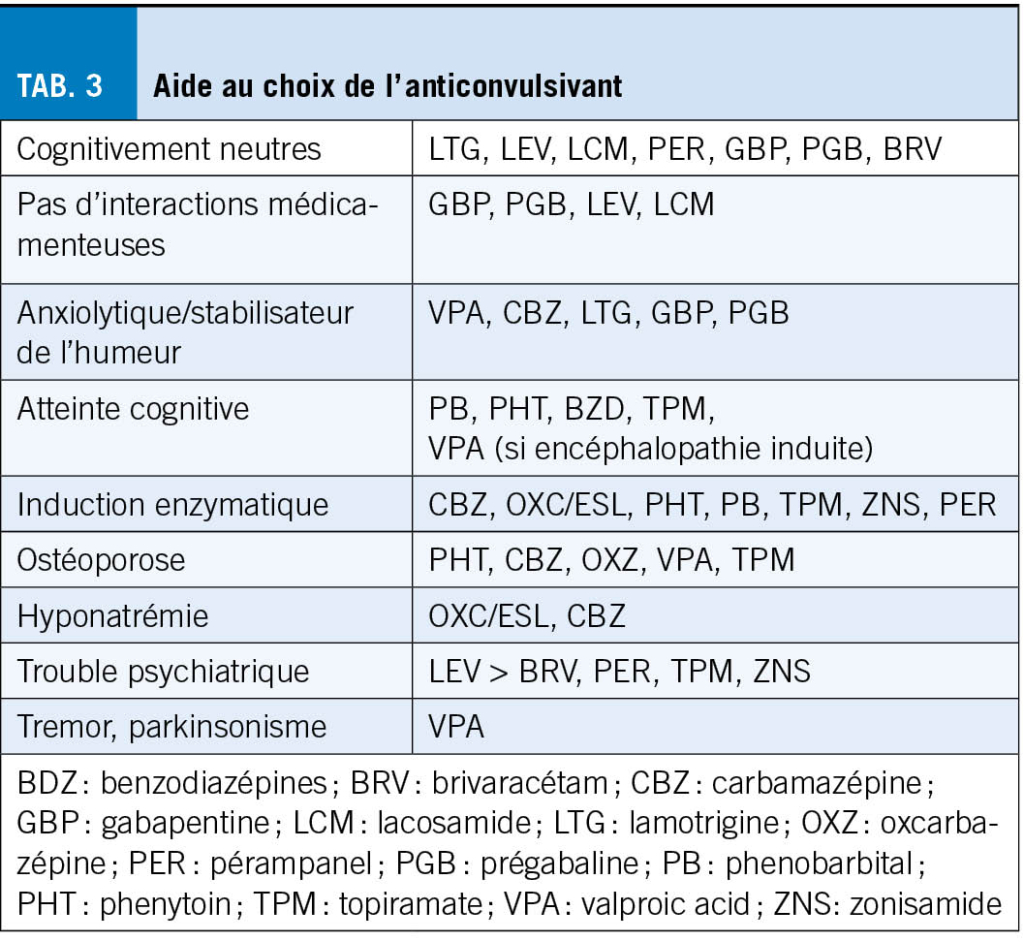
Bien que la majorité des personnes âgées soient libres de crises après un an sous monothérapie (6), l’ introduction d’ un traitement est potentiellement complexe, et implique de tenir en compte les changements pharmacodynamiques et pharmacocinétiques liés à l’ âge, les comédications, et les comorbidités spécifiques à chaque patient. Le choix de la médication doit être fait au cas par cas avec balance de la tolérance et de l’ efficacité. Une consultation spécialisée, au moins dans la phase initiale, est donc recommandée. La lamotrigine et le lévétiracétam (24, 25) sont les anticonvulsivants les plus utilisés, et présentent, avec la gabapentine/prégabaline, les molécules de premier choix chez la personne âgée. Le lévétiracétam pouvant engendrer des troubles du comportement, il convient d’ en informer le patient et ses proches et de les chercher activement. La lamotrigine présente un effet éveillant et stabilisateur de l’ humeur, pouvant être bénéfique. Ce traitement peut toutefois majorer les myoclonies et son schéma d’ introduction lentement progressif au vu des risques de réaction cutanées sévères, peut être difficile à suivre en cas d’ atteinte cognitive. De manière générale, les inducteurs enzymatiques sont à éviter si possible au vu de leur effet sur le métabolisme osseux et leurs interactions médicamenteuses. Les tables 2 et 3 résument les caractéristiques des anticonvulsivants les plus communs. Lors de l’ introduction d’ un traitement, il convient d’ effectuer un schéma de titration lent et de viser une dose plus faible que chez le jeune.
Relation bidirectionnelle entre épilepsie et démence
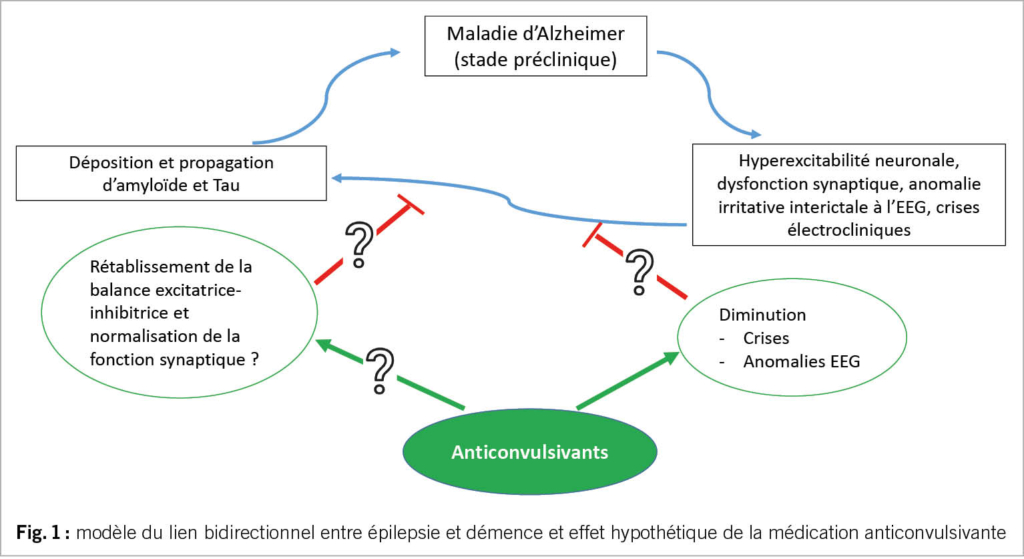
Après une première crise non provoquée, chez un patient souffrant d’ une démence d’ Alzheimer, le risque de récidive est estimé à 70 % (26), remplissant les critères diagnostic pour une épilepsie. Un risque majoré de crises épileptiques en cas de démence est connu de longue date (27). Au vu d’ études animales décrivant que l’ accumulation de β-amyloïde favoriserait la survenue de crises électriques et qu’ en retour, les crises contribueraient à la dysfonction hippocampique et donc au trouble mnésique (28), l’ intérêt pour cette relation bidirectionnelle s’ est accru récemment. Dans la cohorte Framingham on rapporte un risque de démence doublé chez les patients souffrant d’ épilepsie, et de manière similaire un risque d’ épilepsie accru en cas de démence (29). De même, dans la cohorte ARIC, on observe 3x plus de risque de démence chez les patients avec épilepsie tardive (30) et 3x plus de risque de survenue d’ épilepsie chez les patients déments (18). La physiopathologie sous-jacente reste non élucidée. Des patients avec épilepsie ayant débuté dans l’ enfance présentaient, après plus de 50ans, plus de troubles cognitif et un PET-amyloïde plus altéré que des contrôles (31). Une étude récente n’ a par ailleurs pas retrouvée d’ association entre les anticonvulsivants et des troubles cognitifs (32), mais plutôt entre la fréquence des crises et le déclin cognitif. Inversement plus de 50 % des patients avec une épilepsie tardive présentent un MCI au moment du diagnostic (33, 34). Plusieurs études anatomopathologiques chez des patients, sans démence, ayant bénéficié d’ une lobectomie temporale pour traitement de l’ épilepsie, décrivent plus d’ accumulation de β-amyloïde ou de Tau-hyperphosphorylée chez les patients souffrant d’ épilepsie que chez des contrôles (20, 35, 36). Finalement des anomalies irritatives intercritiques à l’ EEG sont associés à un mauvais pronostic cognitif dans la maladie d’ Alzheimer (29, 37). Il n’ est pas encore compris si cela est dû à des crises infra-cliniques entravant la cognition, si ces anomalies EEG sont délétères en elles-mêmes, ou si elles témoignent d’ une pathologie sousjacente plus sévère. Ceci a amené à étudier les possibilités d’ un traitement anticonvulsivant prophylactique (Fig 1). Des études animales ont montré que le lévétiracétam, en réduisant l’excitotoxicité liée au glutamate et en supprimant l’ hyperactivité neuronale hippocampique, pouvait amener à une restauration de la fonction synaptique et une diminution des dépôts de β-amyloïde. Une étude récente a randomisé des patients souffrant de maladie d’ Alzheimer entre placebo et lévétiracetam à très basse dose : chez le petit sous-groupe présentant une activité irritative à l’ EEG (9 patients !) certaines fonctions cognitives s’ amélioraient après le lévétiracetam (38).
Conclusion
L’ épilepsie est une maladie fréquente chez la personne âgée, et peut avoir d’ innombrables conséquences aussi bien physiques que sociales ou psychiatriques. Au vu de la relation bidirectionnelle entre l’ épilepsie et la démence, un screening rigoureux à la recherche de phénomènes cliniques évocateurs de crises épileptiques chez les patients souffrant de démence, ou de plaintes cognitives chez ceux souffrant d’ épilepsie devrait être effectué. Le diagnostic et la mise en route d’ un traitement requiert le recours à un/e spécialiste.
Copyright Aerzteverlag medinfo AG
CHUV, NLG, BH07
Centre Hospitalier Universitaire Vaudois (CHUV) et université de Lausanne, Suisse ; Département des neurosciences cliniques, Service de neurologie, Unité d’épileptologie
Rue du Bugnon 46
1011 Lausanne
Isabelle.beuchat@chuv.ch
CHUV, NLG, BH07
Centre Hospitalier Universitaire Vaudois (CHUV) et université de Lausanne, Suisse ; Département des neurosciences cliniques, Service de neurologie, Unité d’épileptologie
Rue du Bugnon 46
1011 Lausanne
Andrea.rossetti@chuv.ch
Les auteurs n’ ont pas déclaré de conflits d’ intérêt en rapport avec cet article.
1. WHO. Epilepsy: a public health imperative. 2019 [online]. Available at: www.who.int/mental_health/neurology/epilepsy/report_2019/en/.
2. Available at: https://www.census.gov/content/dam/Census/%20library/publications/2016/demo/p95-16-1.pdf.
3. Stephen LJ, Brodie MJ. Epilepsy in elderly people. The Lancet 2000;355:1441-1446.
4. Annegers JF, Hauser WA, Lee JR, Rocca WA. Incidence of acute symptomatic seizures in Rochester, Minnesota, 1935-1984. Epilepsia 1995;36:327-333.
5. Fisher RS, Acevedo C, Arzimanoglou A, et al. ILAE official report: a practical clinical definition of epilepsy. Epilepsia 2014;55:475-482.
6. Sen A, Jette N, Husain M, Sander JW. Epilepsy in older people. The Lancet 2020;395:735-748.
7. Beghi E, Giussani G, Nichols E, et al. Global, regional, and national burden of epilepsy, 1990–2016: a systematic analysis for the Global Burden of Disease Study 2016. The Lancet Neurology 2019;18:357-375.
8. Birnbaum AK, Leppik IE, Svensden K, Eberly LE. Prevalence of epilepsy/seizures as a comorbidity of neurologic disorders in nursing homes. Neurology 2017;88:750-757.
9. DeLorenzo RJ, Hauser WA, Towne AR, et al. A prospective, population-based epidemiologic study of status epilepticus in Richmond, Virginia. Neurology 1996;46:1029-1035.
10. Sveinsson O, Andersson T, Carlsson S, Tomson T. The incidence of SUDEP: A nationwide population-based cohort study. Neurology 2017;89:170-177.
11. Sutter R, Kaplan PW, Ruegg S. Outcome predictors for status epilepticus–what really counts. Nat Rev Neurol 2013;9:525-534.
12. Liu S, Yu W, Lu Y. The causes of new-onset epilepsy and seizures in the elderly. Neuropsychiatr Dis Treat 2016;12:1425-1434.
13. Galovic M, Ferreira-Atuesta C, Abraira L, et al. Seizures and Epilepsy After Stroke: Epidemiology, Biomarkers and Management. Drugs Aging 2021;38:285-299.
14. Hernandez-Ronquillo L, Adams S, Ballendine S, Tellez-Zenteno JF. Epilepsy in an elderly population: Classification, etiology and drug resistance. Epilepsy Res 2018;140:90-94.
15. Leppik IE. Epilepsy in the elderly: scope of the problem. Int Rev Neurobiol 2007;81:1-14.
16. Ramsay RE, Pryor F. Epilepsy in the elderly. Neurology 2000;55:S9-14; discussion S54-18.
17. Choi H, Pack A, Elkind MS, Longstreth WT, Jr., Ton TG, Onchiri F. Predictors of incident epilepsy in older adults: The Cardiovascular Health Study. Neurology 2017;88:870-877.
18. Johnson EL, Krauss GL, Lee AK, et al. Association Between Midlife Risk Factors and Late-Onset Epilepsy: Results From the Atherosclerosis Risk in Communities Study. JAMA Neurol 2018;75:1375-1382.
19. Rowan AJ, Ramsay RE, Collins JF, et al. New onset geriatric epilepsy: a randomized study of gabapentin, lamotrigine, and carbamazepine. Neurology 2005;64:1868-1873.
20. Vossel KA, Tartaglia MC, Nygaard HB, Zeman AZ, Miller BL. Epileptic activity in Alzheimer’s disease: causes and clinical relevance. Lancet Neurol 2017;16:311-322.
21. Sheth RD, Drazkowski JF, Sirven JI, Gidal BE, Hermann BP. Protracted ictal confusion in elderly patients. Arch Neurol 2006;63:529-532.
22. McBride AE, Shih TT, Hirsch LJ. Video-EEG monitoring in the elderly: a review of 94 patients. Epilepsia 2002;43:165-169.
23. Duncan R, Oto M, Martin E, Pelosi A. Late onset psychogenic nonepileptic attacks. Neurology 2006;66:1644-1647.
24. Lattanzi S, Trinka E, Del Giovane C, Nardone R, Silvestrini M, Brigo F. Antiepileptic drug monotherapy for epilepsy in the elderly: A systematic review and network meta-analysis. Epilepsia 2019;60:2245-2254.
25. Lezaic N, Gore G, Josephson CB, Wiebe S, Jette N, Keezer MR. The medical treatment of epilepsy in the elderly: A systematic review and meta-analysis. Epilepsia 2019;60:1325-1340.
26. Voglein J, Ricard I, Noachtar S, et al. Seizures in Alzheimer’s disease are highly recurrent and associated with a poor disease course. J Neurol 2020;267:2941-2948.
27. Hesdorffer DC, Hauser WA, Annegers JF, Kokmen E, Rocca WA. Dementia and adult-onset unprovoked seizures. Neurology 1996;46:727-730.
28. Palop JJ, Chin J, Roberson ED, et al. Aberrant excitatory neuronal activity and compensatory remodeling of inhibitory hippocampal circuits in mouse models of Alzheimer’s disease. Neuron 2007;55:697-711.
29. Stefanidou M, Beiser AS, Himali JJ, et al. Bi-directional association between epilepsy and dementia: The Framingham Heart Study. Neurology 2020;95:e3241-e3247.
30. Johnson EL, Krauss GL, Kucharska-Newton A, et al. Dementia in late-onset epilepsy: The Atherosclerosis Risk in Communities study. Neurology 2020;95:e3248-e3256.
31. Joutsa J, Rinne JO, Hermann B, et al. Association Between Childhood-Onset Epilepsy and Amyloid Burden 5 Decades Later. JAMA Neurol 2017;74:583-590.
32. Foster E, Malpas CB, Ye K, et al. Antiepileptic drugs are not independently associated with cognitive dysfunction. Neurology 2020;94:e1051-e1061.
33. Witt JA, Werhahn KJ, Kramer G, Ruckes C, Trinka E, Helmstaedter C. Cognitive-behavioral screening in elderly patients with new-onset epilepsy before treatment. Acta Neurol Scand 2014;130:172-177.
34. Nardi Cesarini E, Babiloni C, Salvadori N, et al. Late-Onset Epilepsy With Unknown Etiology: A Pilot Study on Neuropsychological Profile, Cerebrospinal Fluid Biomarkers, and Quantitative EEG Characteristics. Front Neurol 2020;11:199.
35. Thom M, Liu JY, Thompson P, et al. Neurofibrillary tangle pathology and Braak staging in chronic epilepsy in relation to traumatic brain injury and hippocampal sclerosis: a post-mortem study. Brain 2011;134:2969-2981.
36. Tai XY, Koepp M, Duncan JS, et al. Hyperphosphorylated tau in patients with refractory epilepsy correlates with cognitive decline: a study of temporal lobe resections. Brain 2016;139:2441-2455.
37. Voglein J, Noachtar S, McDade E, et al. Seizures as an early symptom of autosomal dominant Alzheimer’s disease. Neurobiol Aging 2019;76:18-23.
38. Vossel K, Ranasinghe KG, Beagle AJ, et al. Effect of Levetiracetam on Cognition in Patients With Alzheimer Disease With and Without Epileptiform Activity:
A Randomized Clinical Trial. JAMA Neurol 2021;78:1345-1354.