Chez l’ âgé, particulièrement vulnérable aux effets indésirables médicamenteux et aux conséquences néfastes d’ une polymédication, les variations génétiques mais également l’ environnement, les comorbidités et les comédications influencent fortement la réponse aux médicaments. Le Geneva Cocktail permet d’ évaluer l’ activité des principales enzymes impliquées dans le métabolisme des médicaments et aide à choisir le bon traitement à la bonne posologie en termes d’ efficacité et de tolérance.
In the elderly, who are particularly vulnerable to adverse drug reactions and to the harmful consequences of polymedication, genetic variations but also the environment, comorbidities and co-medications strongly influence the response to drugs. The Geneva Cocktail allows to evaluate the activity of the main enzymes involved in drug metabolism and helps to choose the right treatment at the right dosage in terms of efficacy and tolerance.
Key Words: phénotypage, gériatrie, Geneva Cocktail, cytochromes P450, glycoprotéine P
Le défi de la prescription gériatrique
Prescrire ni trop, ni trop peu, aux personnes âgées de plus de 65 ans, est une tâche difficile. En réaction à l’ « épidémie » de polymédication qui touche cette population depuis plusieurs décennies, de nombreux auteurs ont élaboré des outils de déprescription pour épauler le personnel médico-soignant dans la rationalisation des traitements gériatriques (1). Il est notamment recommandé de limiter le nombre de prescriptions médicamenteuses au strict nécessaire et d’ éviter certaines molécules particulièrement à risque chez le patient âgé (2-4). Cela vise à modérer les risques d’ effets indésirables et d’ interactions médicamenteuses, qui accompagnent immanquablement une multiplication de la médication (5, 6). Cependant, il n’ est pas toujours évident pour le médecin prescripteur de savoir quel traitement choisir parmi les différentes options disponibles ni d’ identifier le médicament qui est responsable d’ un effet indésirable observé ou la cause de l’ absence de réponse thérapeutique. Les effets indésirables non reconnus conduisent en effet trop souvent à une aggravation de la polymédication par un mécanisme appelé « cascade de prescription ». Ce phénomène décrit la prescription successive de médicaments destinés à traiter des effets indésirables non identifiés au lieu d’ arrêter les traitements responsables (7).
Rôle des cytochromes P450, de la glycoprotéine P et pharmacogénomique
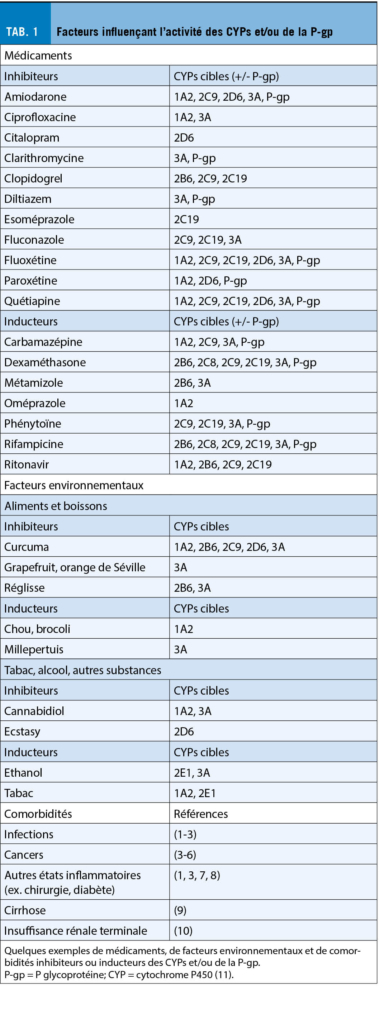
Parmi les facteurs qui influencent la réponse et la tolérance aux médicaments, les mutations génétiques qui touchent les enzymes du métabolisme appelées cytochromes P450 (CYPs), ou de certains transporteurs, tels que la glycoprotéine P (P-gp), jouent un rôle important. Les CYPs sont responsables de transformer les médicaments afin d’ en faciliter l’ élimination (8, 9). La P-gp, qui est exprimée au niveau des organes d’ absorption et d’ excrétion (foie, rein, intestin) et des barrières protégeant les organes clefs (cerveau, yeux, placenta), limite l’ absorption et facilite l’ élimination de nombreuses substances (10). Génétiquement, l’ activité de ces enzymes (ou transporteur) peut être augmentée ou diminuée de manière importante, et influencer la survenue d’ effets indésirables ou la réponse thérapeutique (11). L’ environnement, les autres médicaments, les comorbidités agissent également sur l’ activité de ces enzymes et des transporteurs (cf. Tab. 1). Sous l’ influence de ces facteurs, il arrive que l’ activité enzymatique, ou du transporteur, ne coïncide plus avec celle prédite par la génétique. Ce phénomène est appelé phénoconversion (12-14).
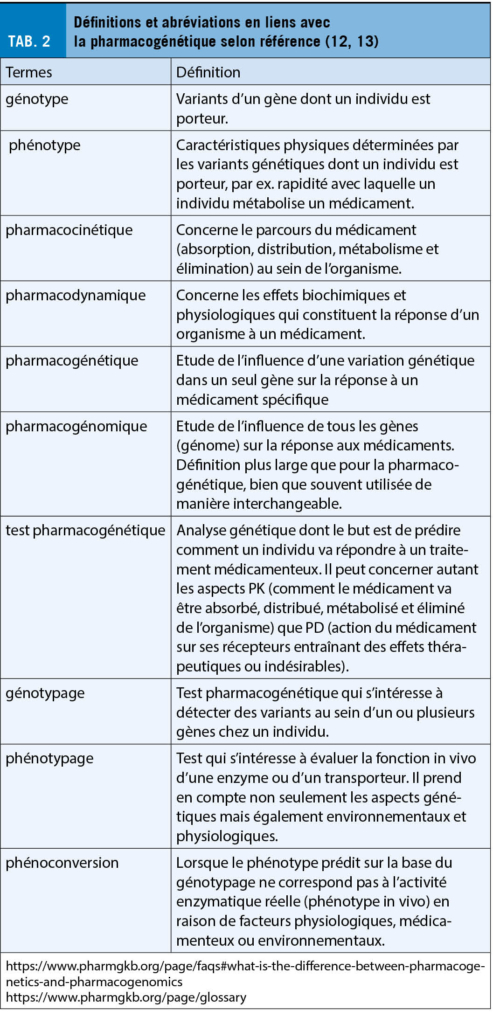
En cas de phénoconversion, les examens pharmacogénétiques appelés génotypage (cf. Tab. 2), qui consistent en la recherche de polymorphismes génétiques sur la base d’ un prélèvement sanguin ou salivaire, ne permettent plus de prédire l’ activité enzymatique réelle (le phénotype). Seule une mesure in vivo de l’ activité enzymatique ou du transport au moyen d’ une procédure nommée « phénotypage » permet de prendre en compte tous les facteurs, qu’ ils soient génétiques, physiologiques, environnementaux ou médicamenteux, qui influencent leur fonction à un moment précis (14, 15).
La technique du phénotypage
Le test de phénotypage consiste à administrer le plus souvent par voie orale, un médicament qui est métabolisé de manière spécifique ou prédominante par l’ enzyme dont on veut déterminer l’ activité. Ensuite, les métabolites produits sont analysés dans des biofluides (généralement le sang ou les urines) (16). Le ratio entre la substance administrée et un de ces produits du métabolisme permet de mesurer à quelle vitesse l’ enzyme fonctionne.
Le résultat traduit un phénotype (l’ activité enzymatique mesurée), qui peut être normal (activité enzymatique attendue), intermédiaire (activité enzymatique réduite), lent (activité enzymatique fortement réduite voire absente), ou ultrarapide (activité enzymatique augmentée). En présence d’ une activité enzymatique augmentée, les concentrations plasmatiques de la substance active seront diminuées, et au contraire augmentées en cas d’ activité enzymatique réduite. L’ inverse est vrai pour les pro-médicaments qui doivent être bioactivés en métabolite actif (14, 17).
En cas de concentrations plasmatiques élevées, le risque d’ effets indésirables dose-dépendants est accru alors que des concentrations plasmatiques basses peuvent être synonyme de réponse thérapeutique insuffisante (18). Le phénotype mesuré par l’ examen et la réponse clinique du patient permettent ainsi d’ adapter le traitement en modifiant les posologies ou en changeant de molécules.
Le Geneva Cocktail en pratique
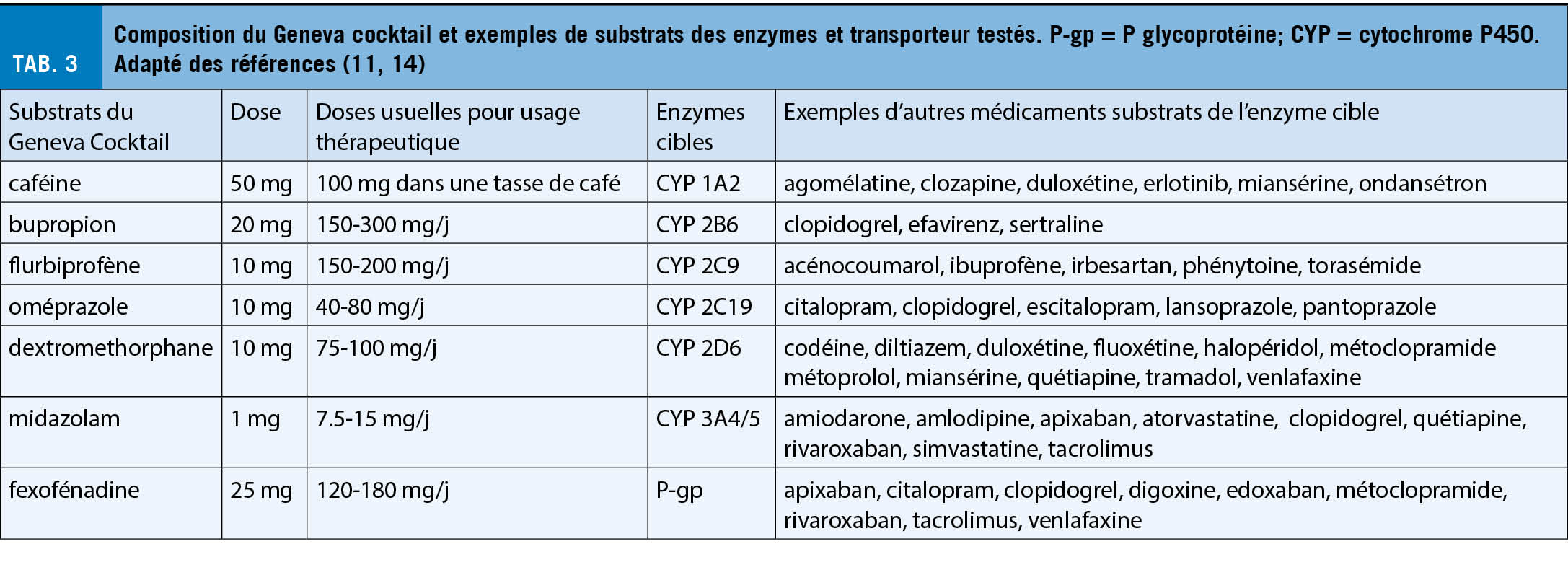
Le Geneva Cocktail est une méthode de phénotypage minimalement invasive qui contient plusieurs substances et est destinée à mesurer simultanément l’ activité de six CYPs (CYP1A2, 2B6, 2C9, 2C19, 2D6 et 3A) et de la P-gp. Les substances contenues dans le Geneva Cocktail sont de deux à dix fois moins dosées que pour leur usage clinique chez l’ adulte (cf. Tab. 3) et conduisent à des concentrations plasmatiques qui ne provoquent généralement ni effet pharmacologique ni toxicité dose-dépendante (19, 20).
L’ examen, qui fait partie des investigations cliniques proposées par le Service de pharmacologie et de toxicologie cliniques des Hôpitaux Universitaires de Genève (HUG), de routine depuis près de 10 ans, est très bien toléré, également par des sujets très âgés (>90 ans) (21). Seuls des effets indésirables légers à modérés ont été rapportés dans de rares cas (rash cutané, vertiges transitoires et nausées) (19). Pour effectuer le phénotypage, le Geneva Cocktail doit être administré à jeun (> de 2 heures après un repas), puis des prélèvements sanguins capillaires ou veineux sont effectués deux, trois et six heures après la prise (21). La consommation de boissons ou aliments contenant de la caféine doit être évitée la veille de l’ examen. Les autres facteurs environnementaux (tabagisme ou prise médicamenteuse) ne devraient pas être interrompus pour permettre de mesurer l’ activité enzymatique dans la « vraie » vie.
Ce sont les médecins pharmacologues et toxicologues cliniques qui posent l’ indication au phénotypage et au génotypage, interprètent les résultats et proposent une adaptation des traitements médicamenteux. Les examens de génotypage sont pris en charge par l’ assurance maladie sous certaines conditions (22). Comme avant toute investigation, il est nécessaire d’ obtenir le consentement éclairé du patient ou de son représentant thérapeutique sous forme orale avant d’ effectuer un phénotypage, et sous forme écrite pour le génotypage, dans la mesure où il s’ agit d’ une analyse génétique.
Qu’ apporte le phénotypage en gériatrie ?
Les tests pharmacogénomiques sont peu demandés en gériatrie malgré l’ intérêt qu’ ils représentent pour cette population (23-26), qui est davantage exposée à des médicaments générant des interactions médicament-gène (aussi appelés médicaments actionnables)(14, 25, 27, 28). Leur interprétation peut être rendue ardue par les facteurs de complexités qui caractérisent le sujet âgé (polymédication, interactions médicamenteuses, altération des réserves physiologiques et des fonctions d’ organes), qui vont modifier le phénotype prédit.
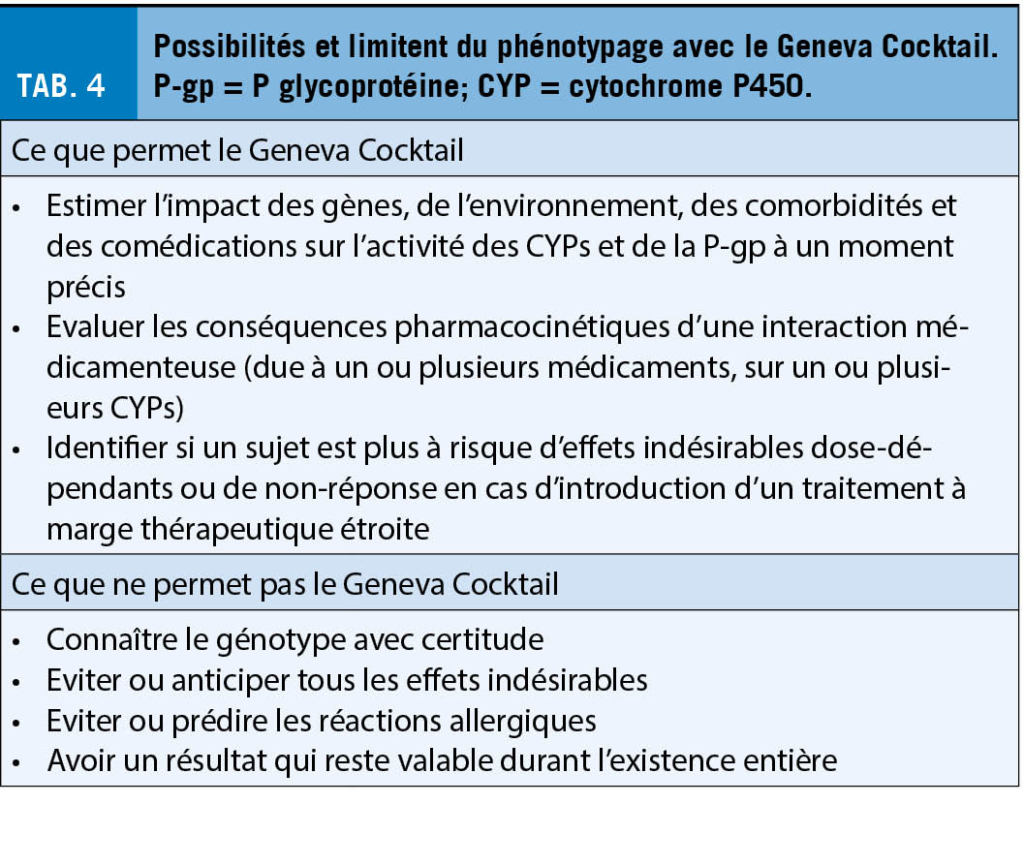
Ainsi, le phénotypage des CYPs et de la P-gp est un outil peu invasif qui a toute sa place auprès des sujets âgés puisqu’ il apporte une information complémentaire au génotypage, pour lequel des recommandations thérapeutiques basées sur le génotype existent (29). Il permet d’ appuyer le clinicien dans ses décisions thérapeutiques en cas de réponse insuffisante à un traitement, de concentrations plasmatiques de médicament trop basses ou trop élevées, ou de survenue d’ un effet indésirable inattendu aux posologies recommandées. Il peut également orienter le choix du traitement avant l’ introduction d’ un nouveau médicament à marge thérapeutique étroite ou dans un contexte d’ interactions médicamenteuses complexes (14, 30) (cf. Tab. 4).
Ainsi, si les principes généraux de bonne prescription en gériatrie restent valables (introduction des traitements à dose minimale et titration lente, réévaluation régulière des traitements et déprescription, tout symptôme chez le patient âgé est jusqu’ à preuve du contraire un effet indésirable médicamenteux), le phénotypage et le génotypage des CYPs et de la P-gp constituent des outils supplémentaires afin d’ améliorer le diagnostic différentiel face à un tableau clinique particulier de résistance thérapeutique ou d’ hypersensibilité aux médicaments, d’ optimiser l’ efficacité des traitements et de réduire l’ incidence des effets indésirables chez l’ âgé et ainsi de diminuer les coûts pour le système de santé.
Copyright Aerzteverlag medinfo AG
Médecin cheffe de clinique
Service de pharmacologie et toxicologie cliniques
Département de médecine aiguë
HUG, rue Gabrielle Perret-Gentil 4
1211 Genève 14
Myriam.elbiali@hcuge.ch
Médecin chef du Service de pharmacologie et toxicologie cliniques
Centre multidisciplinaire d’évaluation et de traitement de la douleur
Département de médecine aiguë
HUG, rue Gabrielle Perret-Gentil 4
1211 Genève 14
Jules.Desmeules@hcuge.ch
médecin adjointe agrégée responsable du Centre d’ information
thérapeutique de l’ unité de pharmacogénomique et thérapies
personnalisées, Service de pharmacologie et toxicologie cliniques,
Département de médecine aiguë, HUG
Caroline.samer@hcuge.ch
Aucun des auteurs ne présente de conflits d’ intérêt.
1. Desnoyer A, Guignard B, Lang PO, Desmeules J, Vogt-Ferrier N, Bonnabry P. [Potentially inappropriate medications in geriatrics: Which tools to detect them?]. Presse Med. 2016;45(11):957-70.
2. Lavan AH, Gallagher PF, O’Mahony D. Methods to reduce prescribing errors in elderly patients with multimorbidity. Clin Interv Aging. 2016;11:857-66.
3. O’Mahony D, O’Sullivan D, Byrne S, O’Connor MN, Ryan C, Gallagher P. STOPP/START criteria for potentially inappropriate prescribing in older people: version 2. Age Ageing. 2015;44(2):213-8.
4. Mangin D, Bahat G, Golomb BA, Mallery LH, Moorhouse P, Onder G, et al. International Group for Reducing Inappropriate Medication Use & Polypharmacy (IGRIMUP): Position Statement and 10 Recommendations for Action. Drugs & aging. 2018;35(7):575-87.
5. Wenger NK, Doherty CL, Gurwitz JH, Hirsch GA, Holmes HM, Maurer MS, et al. Optimization of Drug Prescription and Medication Management in Older Adults with Cardiovascular Disease. Drugs & aging. 2017;34(11):803-10.
6. Hohl CM, Dankoff J, Colacone A, Afilalo M. Polypharmacy, adverse drug-related events, and potential adverse drug interactions in elderly patients presenting to an emergency department. Ann Emerg Med. 2001;38(6):666-71.
7. Sternberg SA, Guy-Alfandary S, Rochon PA. Cascade médicamenteuse chez la personne âgée. CMAJ. 2021;193(16):E589.
8. Samer CF, Lorenzini KI, Rollason V, Daali Y, Desmeules JA. Applications of CYP450 testing in the clinical setting. Molecular diagnosis & therapy. 2013;17(3):165-84.
9. Manikandan P, Nagini S. Cytochrome P450 Structure, Function and Clinical Significance: A Review. Current drug targets. 2018;19(1):38-54.
10. Hodges LM, Markova SM, Chinn LW, Gow JM, Kroetz DL, Klein TE, et al. Very important pharmacogene summary: ABCB1 (MDR1, P-glycoprotein). Pharmacogenetics and genomics. 2011;21(3):152-61.
11. Zanger UM, Schwab M. Cytochrome P450 enzymes in drug metabolism: regulation of gene expression, enzyme activities, and impact of genetic variation. Pharmacology & therapeutics. 2013;138(1):103-41.
12. Shah RR, Smith RL. Addressing phenoconversion: the Achilles’ heel of personalized medicine. British journal of clinical pharmacology. 2015;79(2):222-40.
13. Storelli F, Samer C, Reny JL, Desmeules J, Daali Y. Complex Drug-Drug-Gene-Disease Interactions Involving Cytochromes P450: Systematic Review of Published Case Reports and Clinical Perspectives. Clinical pharmacokinetics. 2018;57(10):1267-93.
14. Hahn M, Roll SC. The Influence of Pharmacogenetics on the Clinical Relevance of Pharmacokinetic Drug-Drug Interactions: Drug-Gene, Drug-Gene-Gene and Drug-Drug-Gene Interactions. Pharmaceuticals (Basel). 2021;14(5).
15. Klomp SD, Manson ML, Guchelaar HJ, Swen JJ. Phenoconversion of Cytochrome P450 Metabolism: A Systematic Review. J Clin Med. 2020;9(9).
16. Magliocco G, Daali Y. Modern approaches for the phenotyping of cytochrome P450 enzymes in children. Expert review of clinical pharmacology. 2020;13(7):671-4.
17. Caudle KE, Dunnenberger HM, Freimuth RR, Peterson JF, Burlison JD, Whirl-Carrillo M, et al. Standardizing terms for clinical pharmacogenetic test results: consensus terms from the Clinical Pharmacogenetics Implementation Consortium (CPIC). Genetics in medicine : official journal of the American College of Medical Genetics. 2017;19(2):215-23.
18. Allorge D, Loriot MA. [Pharmacogenetics or the promise of a personalized medicine: variability in drug metabolism and transport]. Annales de biologie clinique. 2004;62(5):499-511.
19. Rollason V, Mouterde M, Daali Y, Cizkova M, Priehodova E, Kulichova I, et al. Safety of the Geneva Cocktail, a Cytochrome P450 and P-Glycoprotein Phenotyping Cocktail, in Healthy Volunteers from Three Different Geographic Origins. Drug safety. 2020;43(11):1181-9.
20. Bosilkovska M, Samer CF, Deglon J, Rebsamen M, Staub C, Dayer P, et al. Geneva cocktail for cytochrome p450 and P-glycoprotein activity assessment using dried blood spots. Clinical pharmacology and therapeutics. 2014;96(3):349-59.
21. Ing Lorenzini K, Desmeules J, Rollason V, Bertin S, Besson M, Daali Y, et al. CYP450 Genotype—Phenotype Concordance Using the Geneva Micrococktail in a Clinical Setting. Frontiers in Pharmacology. 2021;12(2257).
22. Baumann P, Amstutz U, Buhlmann RP, Meier-Abt P, Meyer UA, Samer C, et al. Pharmacogenomique et therapie personnalisee. Revue medicale suisse. 2017;13(573):1544-5.
23. Jablonski MR, Lorenz R, Li J, Dechairo BM. Economic Outcomes Following Combinatorial Pharmacogenomic Testing for Elderly Psychiatric Patients. Journal of geriatric psychiatry and neurology. 2020;33(6):324-32.
24. Bright DR, Calinski DM, Kisor DF. Pharmacogenetic considerations in the elderly patient. The Consultant pharmacist : the journal of the American Society of Consultant Pharmacists. 2015;30(4):228-39.
25. Westergaard N, Sogaard Nielsen R, Jorgensen S, Vermehren C. Drug Use in Denmark for Drugs Having Pharmacogenomics (PGx) Based Dosing Guidelines from CPIC or DPWG for CYP2D6 and CYP2C19 Drug-Gene Pairs: Perspectives for Introducing PGx Test to Polypharmacy Patients. Journal of personalized medicine. 2020;10(1).
26. Bozina N, Vrkic Kirhmajer M, Simicevic L, Ganoci L, Mirosevic Skvrce N, Klarica Domjanovic I, et al. Use of pharmacogenomics in elderly patients treated for cardiovascular diseases. Croatian medical journal. 2020;61(2):147-58.
27. Liu D, Olson KL, Manzi SF, Mandl KD. Patients dispensed medications with actionable pharmacogenomic biomarkers: rates and characteristics. Genetics in medicine : official journal of the American College of Medical Genetics. 2021;23(4):782-6.
28. Lunenburg C, Hauser AS, Ishtiak-Ahmed K, Gasse C. Primary Care Prescription Drug Use and Related Actionable Drug-Gene Interactions in the Danish Population. Clin Transl Sci. 2020;13(4):798-806.
29. Jaccard E, Redin, C., Girardin, F., Waeber, G., Fellay, J., Vollenweider, P. . Pharmacogénomique et aide à la prescription médicamenteuse. Rev Med Suisse 2020. 2020;6(716):2259 – 63.
30. Ing Lorenzini K, Desmeules J, Rollason V, Bertin S, Besson M, Daali Y, et al. CYP450 Genotype-Phenotype Concordance Using the Geneva Micrococktail in a Clinical Setting. Front Pharmacol. 2021;12(2257):730637.
Références Tableaux :
1. Lenoir C, Rollason V, Desmeules JA, Samer CF. Influence of Inflammation on Cytochromes P450 Activity in Adults: A Systematic Review of the Literature. Front Pharmacol. 2021;12:733935.
2. Lenoir C, Terrier J, Gloor Y, Curtin F, Rollason V, Desmeules JA, et al. Impact of SARS-CoV-2 infection (COVID-19) on cytochromes P450 activity assessed by the Geneva cocktail. Clinical pharmacology and therapeutics. 2021.
3. Klomp SD, Manson ML, Guchelaar HJ, Swen JJ. Phenoconversion of Cytochrome P450 Metabolism: A Systematic Review. J Clin Med. 2020;9(9).
4. Rivory LP, Slaviero KA, Clarke SJ. Hepatic cytochrome P450 3A drug metabolism is reduced in cancer patients who have an acute-phase response. Br J Cancer. 2002;87(3):277-80.
5. Geist M, Bardenheuer H, Burhenne J, Mikus G. Alteration of drug-metabolizing enzyme activity in palliative care patients: Microdosed assessment of cytochrome P450 3A. Palliat Med. 2019;33(7):850-5.
6. Geist MJP, Siller N, Egerer G, Bardenheuer H, Burhenne J, Mikus G. Decreased Cytochrome P450 3A activity in palliative patients with haematological diseases: Potential impact on supportive drug therapies. Basic & clinical pharmacology & toxicology. 2019;125(2):117-22.
7. Lenoir C, Daali Y, Rollason V, Curtin F, Gloor Y, Bosilkovska M, et al. Impact of Acute Inflammation on Cytochromes P450 Activity Assessed by the Geneva Cocktail. Clinical pharmacology and therapeutics. 2021;109(6):1668-76.
8. Darakjian L, Deodhar M, Turgeon J, Michaud V. Chronic Inflammatory Status Observed in Patients with Type 2 Diabetes Induces Modulation of Cytochrome P450 Expression and Activity. Int J Mol Sci. 2021;22(9).
9. Dietrich CG, Gotze O, Geier A. Molecular changes in hepatic metabolism and transport in cirrhosis and their functional importance. World J Gastroenterol. 2016;22(1):72-88.
10. Déri MT, Kiss Á F, Tóth K, Paulik J, Sárváry E, Kóbori L, et al. End-stage renal disease reduces the expression of drug-metabolizing cytochrome P450s. Pharmacol Rep. 2020;72(6):1695-705.
11. Samer CF, Lorenzini KI, Rollason V, Daali Y, Desmeules JA. Applications of CYP450 testing in the clinical setting. Molecular diagnosis & therapy. 2013;17(3):165-84.
12. Roden DM, McLeod HL, Relling MV, Williams MS, Mensah GA, Peterson JF, et al. Pharmacogenomics. Lancet. 2019;394(10197):521-32.
13. Jaccard E, Redin, C., Girardin, F., Waeber, G., Fellay, J., Vollenweider, P. . Pharmacogénomique et aide à la prescription médicamenteuse. Rev Med Suisse 2020. 2020;6(716):2259 – 63.
14. Rollason V, Mouterde M, Daali Y, Cizkova M, Priehodova E, Kulichova I, et al. Safety of the Geneva Cocktail, a Cytochrome P450 and P-Glycoprotein Phenotyping Cocktail, in Healthy Volunteers from Three Different Geographic Origins. Drug safety. 2020;43(11):1181-9.