L’ eczéma (péri-) anal est un motif de consultation assez fréquent dans le cabinet du médecin généraliste. En raison d’ un sentiment de honte et de tabou, le premier contact avec un médecin n’ a souvent lieu que tardivement, lorsque le patient souffre déjà beaucoup. Il n’ est pas facile de poser un diagnostic, car les symptômes décrits et la présentation clinique sont généralement très hétérogènes. Ce bref aperçu se concentre sur la clarification et le traitement approprié en fonction de l’ étiologie de l’ eczéma anal.
Présentation de cas :
Un patient de 77 ans a été vu par les collègues du service de gastro-
entérologie avec des lésions cutanées périanales qui démangeaient beaucoup depuis plusieurs mois. Dans l’ anamnèse le patient décrit un nettoyage très minutieux de ses parties intimes et, en plus du papier de toilette, des lingettes sont utilisés pour le nettoyage quotidien. En outre, il existe une dermatite atopique avec sensibilisation de type I au pollen.
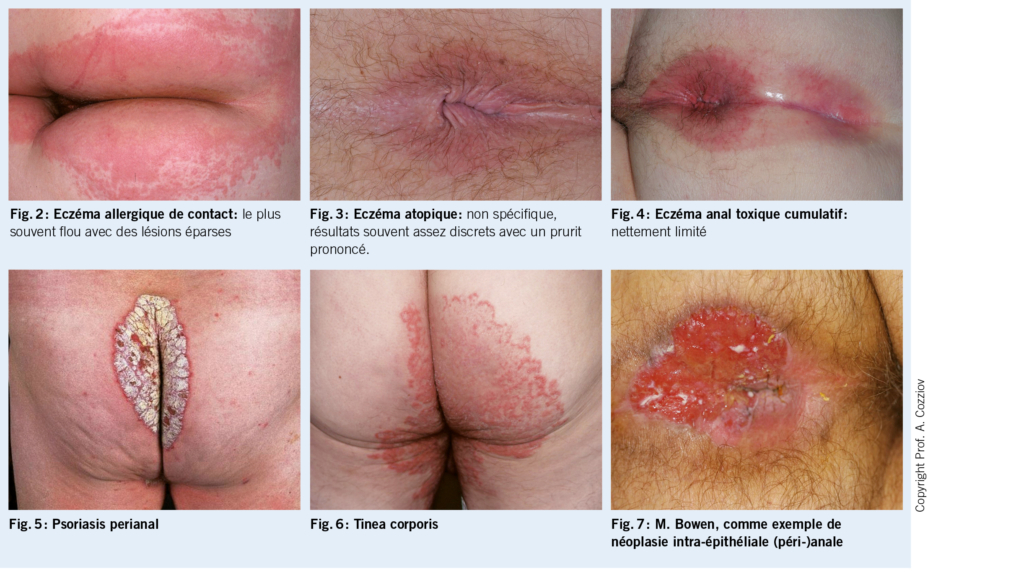
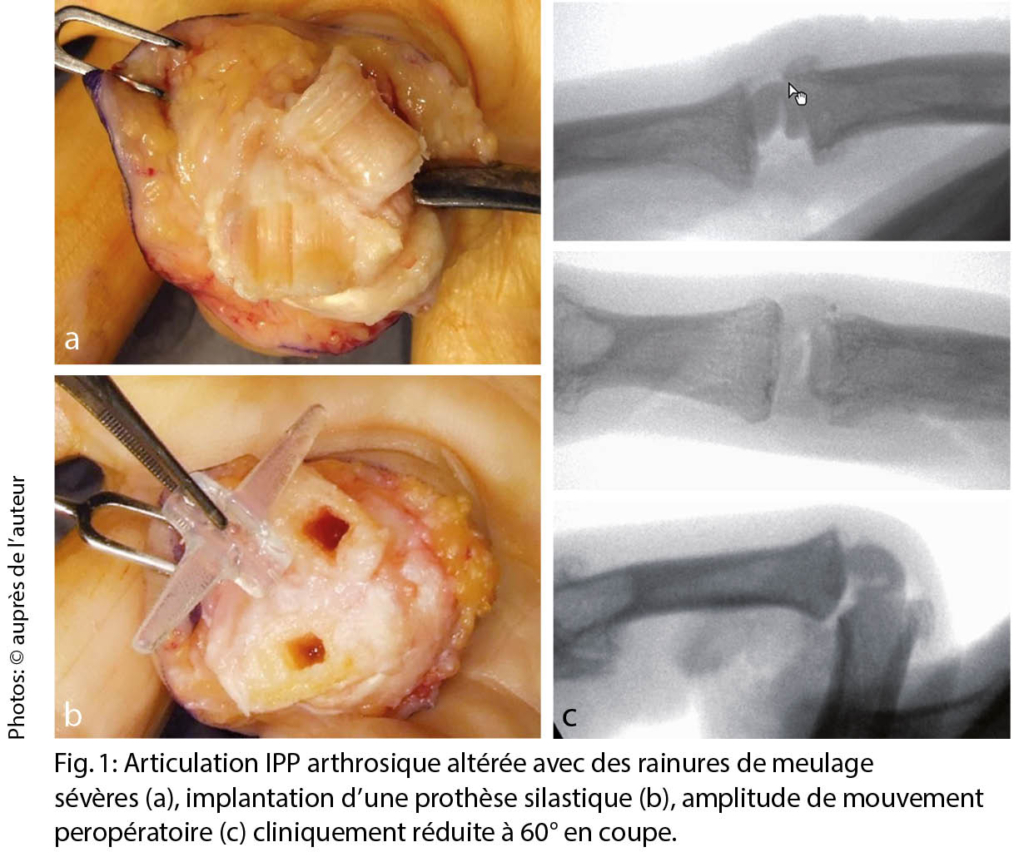
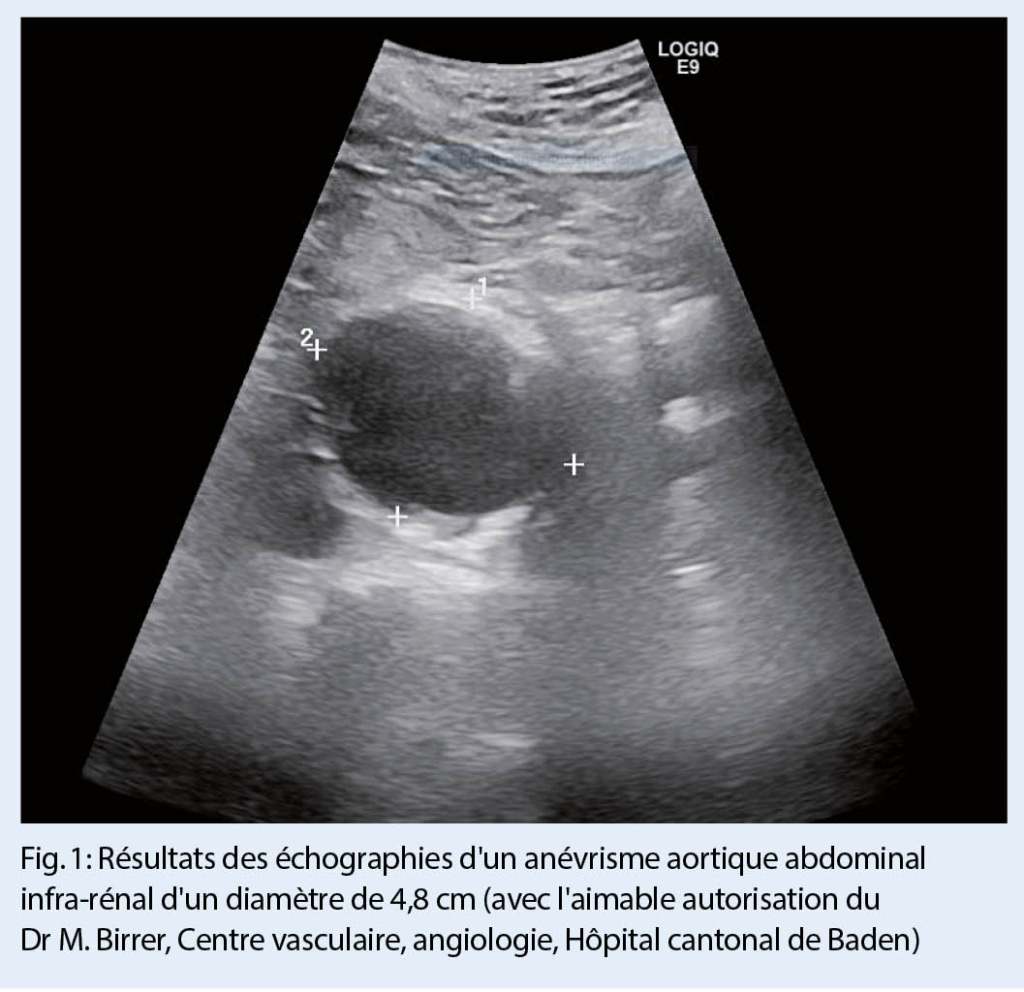
Cliniquement, on observe un érythème périanal avec des lésions éparses, avec des bords indistincts (fig. 2). Des hemorroïdes ou d’ autres affections proctologiques ont déjà été exclues par les collègues de la gastro-entérologie. Comme une sensibilisation de contact semblait possible sur la base de l’ anamnèse, un examen épicutané a été effectué.
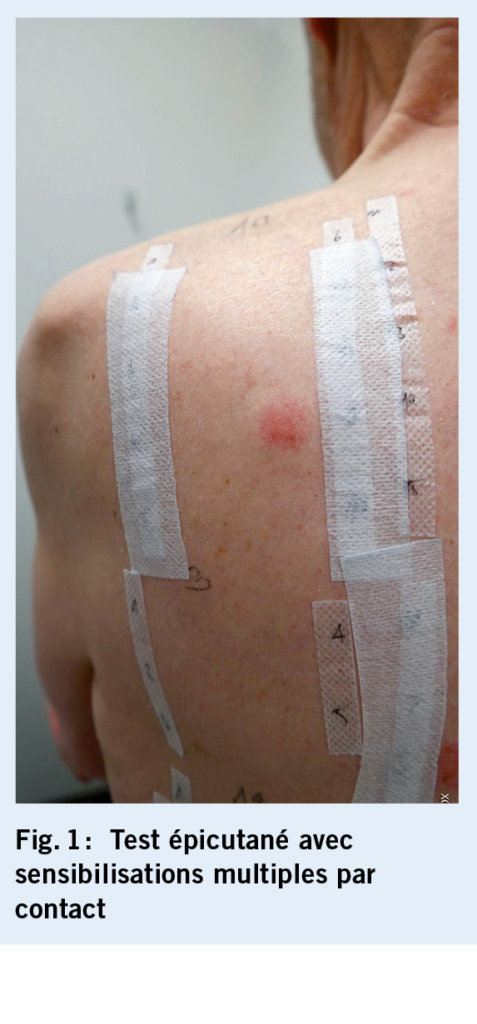
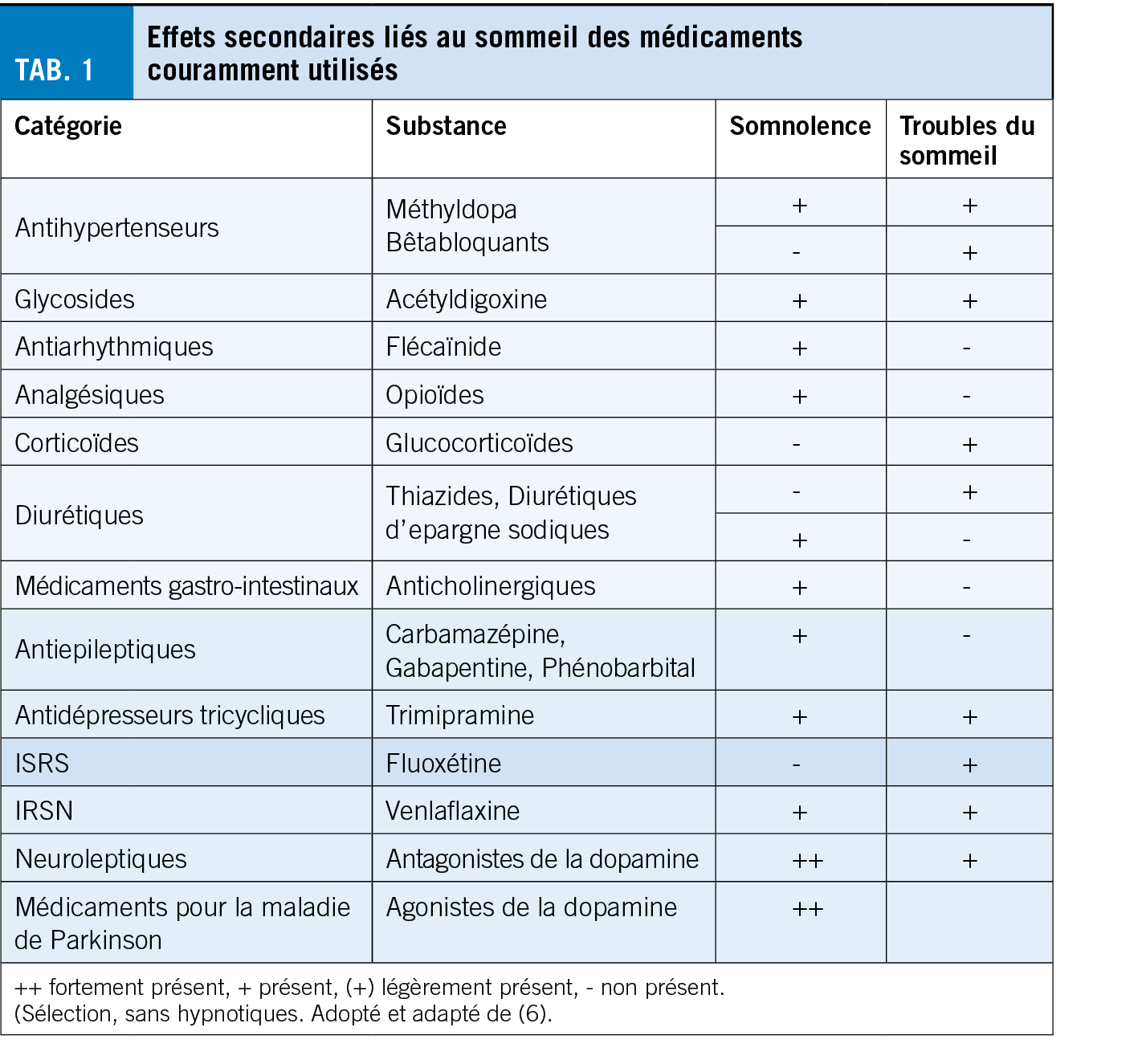
Cet examen a révélé une sensibilisation de contact à divers composants de produits topiques dans la zone périanale, en particulier à la méthylisothiazolinone (lingettes humides) et le mélange de parfums/colophane (ingrédient de nombreuses crèmes) (fig. 1). Le diagnostic d’ eczéma anal allergique de contact a donc été posé et on a conseillé au patient d’ arrêter tous les produits de soins de la peau et de passer à la vaseline simple pour les soins de la peau. Avec ces mesures, ainsi qu’ une application à court terme d’ un stéroïde topique de classe II, une guérison complète est survenue en quelques semaines.
Sur la base de l’ étiologie on distingue 3 formes d’ eczéma anal.
L’ eczéma anal allergique de contact est causé par des ingrédients (soins de la peau ou parfums) de crèmes à application topique, d’ agents proctologiques ou de lingettes humides. Selon le moment de son apparition, l’ eczéma anal peut avoir une évolution aiguë ou chronique, cliniquement, la limite est floue (fig. 2). Il est important de recueillir des informations détaillées, d’ identifier l’ allergène et de faire un test épicutané pour identifier l’ allergène. Les allergènes de contact sont nombreux. Outre les divers parfums, les anesthésiques locaux tels que la lidocaïne et la benzocaïne, le thiomersal (également le thimérosal), la méthylisothiazolinone (conservateurs dans certaines crèmes et médicaments), le baume du Pérou (Myroxylon pereirae), l’ extrait de camomille et le menthol ont été décrits comme provoquant des allergies (1, 3).
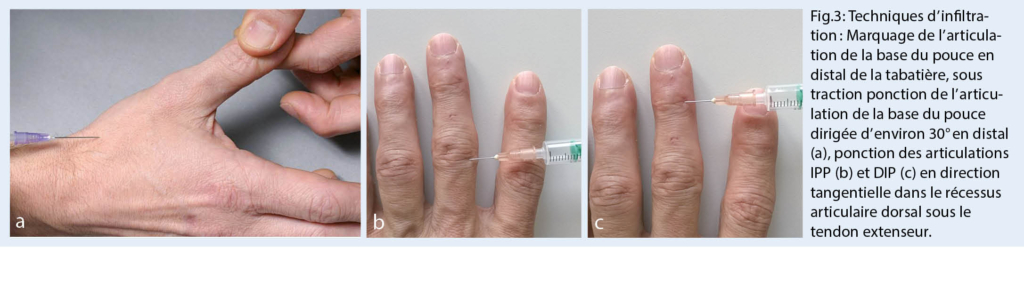
L’ eczéma anal atopique se rencontre souvent chez les patients ayant une prédisposition atopique. En plus des sites de prédilection typiques de l’ eczéma atopique, comme le visage, les coudes et les jambes, l’ arrière des genoux, la zone anogénitale est également fréquemment touchée (fig. 3).
Dans l’ eczéma anal atopique, le patient se plaint généralement d’ un prurit sévère. D’ autre part, l’ inspection ne révèle souvent que des troubles discrets cutanés discrets. En cas d’ évolution chronique et de prurit important, il n’est pas rare de trouver un eczéma lichénifié (1, 2).
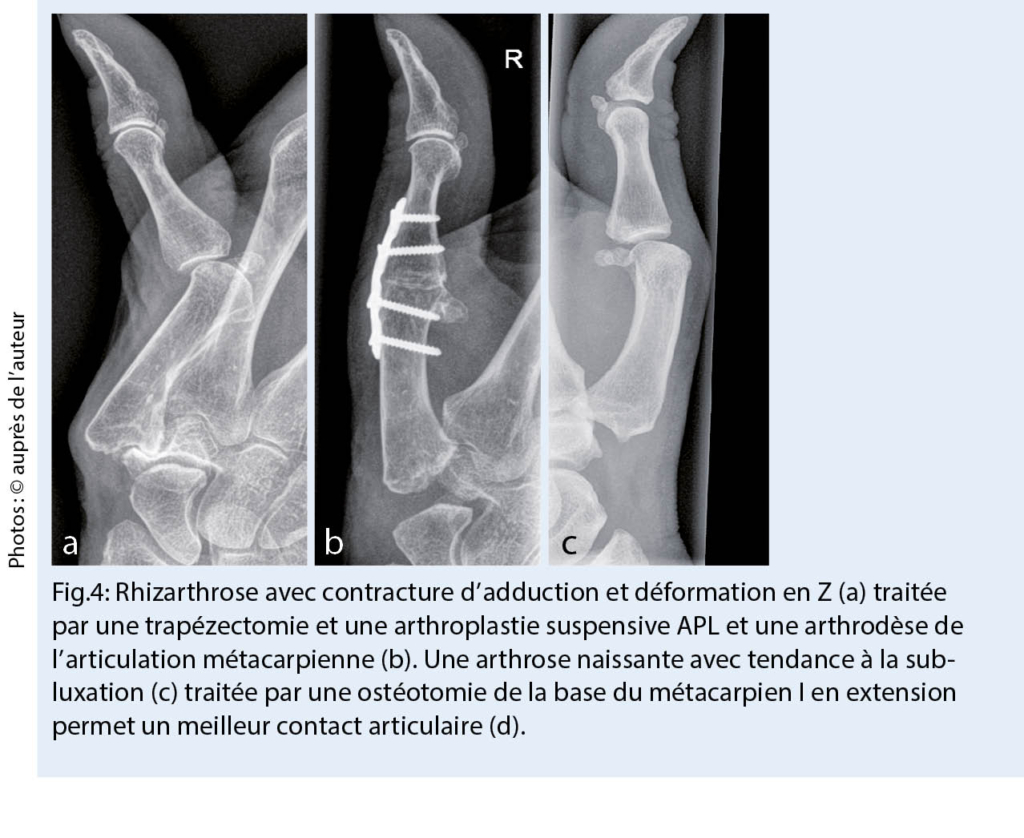
L’ eczéma anal toxique cumulatif se produit généralement à la suite de divers facteurs, qui provoquent une irritation à long terme de la peau périanale. Il y a souvent une incontinence fécale ou un problème anatomique, des changements tels que des hémorroïdes ou marisques, qui interfèrent avec l’ hygiène anale et conduisent ainsi à une macération généralement bien délimitée de la peau périanale (fig. 4). D’ autres causes peuvent être une transpiration augmentée (p.ex., en cas d’ obésité) ou un manque de l’ hygiène intime ou l’ excès d’ hygiène avec des détergents agressifs ou du papier toilette rugueux.
Comme diagnostic différentiel une infection par Candida ou par des streptocoques, dans le sens d’ une dermatite périanale streptogène doit aussi être envisagée (1, 2).
Le diagnostic
Afin d’ éviter les rechutes et la chronification de l’ eczéma anal, la recherche de la cause déclenchante doit se faire au moyen d’ une méthode aussi standardisée que possible.
Une anamnèse détaillée est essentielle afin d’ identifier la cause de l’ eczéma anal. En plus de la date de l’ apparition et l’ évolution de l’ eczéma il faut rechercher les symptômes principaux tels que des démangeaisons, des brûlures, des suintements et des douleurs. L’ anamnèse doit examiner la possibilité d’ une éventuelle diathèse atopique et le type d’ hygiène anale (excessive/insuffisante). En outre, l’ anamnèse doit chercher des troubles proctologiques (hémorroïdes, fistules anales, etc.), et adresser le comportement sexuel (rapports anaux, lubrifiants, utilisation de préservatifs), les maladies sexuellement transmissibles dans les antécédents personnels et pour les personnes âgées de plus de 50 ans, une coloscopie antérieure. L’ examen standard comprend l’ inspection et le toucher rectal, qui sont faciles à réaliser dans le cabinet du médecin généraliste. L’ inspection doit idéalement porter sur l’ ensemble du tégument. Ainsi, dans le cas du psoriasis, par exemple en plus des points de prédilection typiques sur les côtés extenseurs des extrémités (coude, genou) ou sur l’ os du sacrum, des modifications cutanées typiques sont également fréquemment observées dans la région anogénitale (fig. 5). Un frottis, par exemple pour détecter une dermatite streptococcique périanale, peut contribuer à clarifier la situation. Le prélèvement d’ un échantillon dans le cas de tinea corporis (fig. 6) ou de candidose doit être effectuée en cas de doute.
En cas de suspicion d’ eczéma anal allergique de contact, un test épicutané doit être réalisé dans le cadre du bilan de base. Il devrait comprendre la série standard, la série des fragrances et inclure les préparations ainsi que les produits de soins de la peau du patient. La proctoscopie et la rectoscopie sont réservées aux médecins expérimentés. En cas de doute, il convient d’ orienter le patient vers une consultation proctologique. Ceci s’ applique en particulier lors d’ anomalies à la palpation dans le canal anal, s’ il s’ agit d’ un patient VIH, si l’ on suspecte une néoplasie intraépithéliale anale (NIA) et lors de résultats qui ne répondent pas au traitement dans un délai adéquat. Les biopsies doivent également être réalisées par un dermatologue ou un proctologue (fig. 7).
La thérapie
Les mesures décrites ci-dessous sont également valables pour toutes les variantes de l’ eczéma. Hygiène anale appropriée : un nettoyage excessif de la zone intime, ainsi qu’ une hygiène anale insuffisante peuvent souvent favoriser l’ eczéma anal et doivent être corrigés. Le nettoyage quotidien à l’ eau claire, sans savon est recommandé. La peau doit ensuite être séchée à l’ aide d’ une serviette ou d’ un sèche-cheveux à air froid. Les vêtements serrés doivent, si possible, être évités. Les sous-vêtements permettant d’ évacuer la transpiration, en coton par exemple, sont à privilégier.
Éviter les substances toxiques cumulées et les allergènes de contact : L’ évitement de ces substances est la condition préalable du traitement d’ un eczéma anal allergique de contact. L’ utilisation de lingettes humides, de nettoyants et de déodorants parfumés doit être arrêtée.
Le traitement des maladies proctologiques : Les plus courantes sont les hémorroïdes qui provoquent des démangeaisons, des douleurs, des saignements ou une sensation de défécation incomplète. La présence d’ une fistule anale ou d’ un sinus pilonidal peut également entraîner un suintement et ainsi une macération cutanée, qui peut à son tour entraîner un eczéma périanal (1). Une perturbation de la continence pour de diverses raisons peut provoquer un changement de l’ environnement humide et favoriser ainsi le développement de l’ eczéma périanal.
Le traitement topique
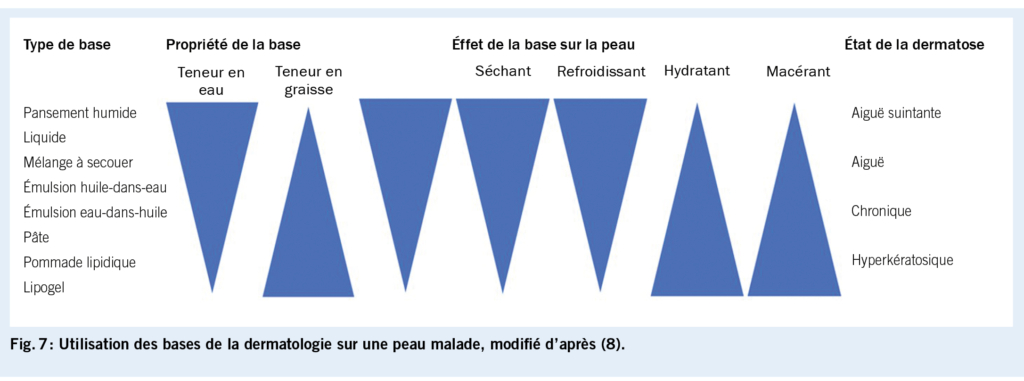
Le traitement topique dépend de l’ étiologie sous-jacente et de la morphologie de la dermatose (fig. 8). En cas de lésions cutanées aiguës suintantes ou de transpiration abondante dans la région anale, des astringents peuvent être appliqués sous la forme de bains de siège (Tannosynt liquide, 1-2x/jour). Les tanins contenus dans le thé noir ont également un effet asséchant et peuvent être appliquées sous forme de compresses humides. En outre, les préparations à base de zinc, anti-inflammatoires et le plus souvent sans allergènes, favorisent la cicatrisation des plaies. Les topiques avec différents contenus en eau et en graisses sont disponibles (pâte pour plaies d’ oxyplastine, pâte ZinCream Medinova), qui peuvent être appliqués plusieurs fois par jour. Si l’ on soupçonne un eczéma de contact, il faut appliquer, si possible, notamment avant les tests épicutanés, uniquement des topiques sans allergènes, tels que la formulation de base d’ huile dans de l’ eau Unguentum emulsificans aquosum (formulation magistrale Ung. Emulsificans, p.ex. 30 ad Aqua 100) ou de la vaseline blanche. Comme thérapie anti-inflammatoire pour tous les eczémas (péri-)anaux, mais surtout l’ eczéma atopique, les stéroïdes de classe II sont utilisés à court terme. L’ application 1x/jour ne doit pas dépasser une période de 2 à 3 semaines (diminution progressive) (hydrocortisone, p.ex. Locoid émulsion fluide ou crème 0.1%) (4).
Il existe un certain nombre de produits combinés sur le marché, principalement pour le traitement des hémorroïdes, qui associent des stéroïdes et des anesthésiques locaux ou des antiseptiques (Scheriproct, Synalar, Faktu ong avec disp). D’ une part, ces préparations sont efficaces en ce qui concerne les effets analgésiques et antiprurigineux, mais d’ autre part elles ne doivent pas être utilisées en présence d’ infections bactériennes ou de mycoses concomitantes. En outre, il existe un risque d’ allergie de contact, et la durée de l’ application ne doit pas dépasser 2 semaines (5).
Les inhibiteurs de la calcineurine tels que le Tacrolimus (Protopic®) et le Pimecrolimus (Elidel®) sont utilisés dans l’ eczéma persistant (péri-) anal pour économiser les stéroïdes. Non seulement dans l’ eczéma atopique ou de nombreuses autres dermatoses inflammatoires, les deux agents présentent un effet anti-inflammatoire élevé sans les effets secondaires typiques des stéroïdes ou une absorption systémique importante. En outre, les inhibiteurs topiques de la calcineurine n’ entrainent pas assez souvent une amélioration rapide du prurit, qui est un symptôme majeur de l’ eczéma anal. Cependant, sauf dans le cas de la genèse atopique, il s’ agit d’ une utilisation Off-label (6, 7).
Article traduit de « der informierte arzt » 03-2021
Copyright Aerzteverlag medinfo AG
Julia Kandinger
Hausarztpraxis Grossfeld
Grossfeldstrasse 1
7310 Bad Ragaz
julia.kandinger@hin.ch
Kantonsspital St. Gallen
Rorschacher Strasse 95
Haus 20
9007 St. Gallen
antonio.cozzio@kssg.ch
Les auteurs n’ ont déclaré aucun conflit d’ intérêts en rapport avec cet article.
1. Dietrich A, Ruzicka T, Hermans C. Differenzialdiagnose des Analekzems. Hautarzt 2015, 66:400-407
2. Wienert V. Das Analekzem – eine interdisziplinäre, diagnostische Herausforderung. Wien Klin Wochenschr 2006, 118:69-71
3. Kränke et al. Etiologic and causative factors in perianal dermatitis: result of a prospective study in 126 patients. Wien Klin Wochenschr 2006, 118:90-94
4. Schauber J. Topische Therapie des perianalen Ekzems. Hautarzt 2010, 61:33-38
5. Havlickova B, Weyandt G.H. Therapeutic management of anal eczema: an evidence-based review. Int J Clin Pract 2014, 68:1388-1399
6. Schauber J, Weisenseel P, Ruzicka T. Topical treatment of perianal eczema with tacrolimus 0.1%. BJD 2009, 161:1384-1386
7. Kreuter A, Hochdorfer B, Altmeyer P. Pimecrolimus 1% cream for perianal atopic dermatitis. BJD 2005, 152:176-198
8. Niedner R, Ziegenmeyer J. Dermatika, Therapeutischer Einsatz, Pharmakologie und Pharmazie, Wissenschaftliche Verlagsgesellschaft Stuttgart;1992 (Fig. 4)