D’ici 2040, la proportion des seniors de 65 ans et plus devrait augmenter de 49%, passant de 1 641 204 à 2 445 764 personnes. La progression atteignant 83% chez les personnes de 80 ans et plus. Il s’en suivra une augmentation des maladies chroniques invalidantes et de la dépendance, ce qui aura un impact sur presque tous les aspects de la société, notamment sur les dépenses liées à notre système de santé. Vu l’importance des habitudes alimentaires, la mise sur pied d’une « stratégie suisse de nutrition 2017-2024 » devrait permettre d’atténuer les pressions exercées sur l’inflation des coûts de la santé. Cet article vise à mettre en évidence des recommandations d’un mieux manger visant à accroître l’espérance de vie en bonne santé des seniors non vulnérables vivant à domicile et à alléger ainsi le fardeau des maladies non transmissibles (MNT).
La première Enquête Nationale sur l’Alimentation, menuCH, a montré que la population suisse âgée de 18 à 75 ans possédait de très bonnes connaissances sur les recommandations nutritionnelles, mais que par contre leur adoption restait faible (1). En bref, les écarts par rapport à une alimentation équilibrée se traduisaient par une consommation trop élevée de sucreries et de viande, avec un manque de fruits et de légumes..
Le récent rapport d’experts de la Commission fédérale de l’ Alimentation (COFA) « Nutrition vieillissement » (2) mentionne qu’en moyenne, les personnes âgées :
- boivent suffisamment d’eau (près de 1,5 litre par jour),
- consomment tous les jours entre 2 et 3 portions de fruits et entre 1,5 et 3 portions de légumes (selon les études),
- respectent probablement les recommandations en matière d’apports énergétiques,
- respectent approximativement les recommandations en matière d’ apports protéiques destinées aux personnes âgées en bonne santé,
- ont une prévalence élevée de carences en vitamine D,
- présentent avec l’âge des carences en vitamines B12 et B9 (acide folique).
En vieillissant, en plus des MNT, les déséquilibres alimentaires vont engendrer un risque accru des principales affections suivantes :
- la dénutrition (consommation ou absorption insuffisante ou déséquilibrée d’énergie, de protéines ou d’autres nutriments),
- la sarcopénie,
- la vulnérabilité (frailty),
- les démences,
- les affections gingivo-dentaires,
- ainsi qu’une réduction des défenses immunitaires et leurs conséquences.
Les bienfaits d’une alimentation saine chez les seniors
Une alimentation saine correspond à une alimentation équilibrée alliant l’apport de tous les nutriments nécessaires au bon fonctionnement des différents systèmes de l’organisme tout en veillant à respecter leurs besoins spécifiques, ses capacités métaboliques et d’ épuration selon l’âge et le sexe.
Au-delà d’ être un besoin fondamental de l’ être humain, une alimentation saine procure un sentiment de bien-être physique et psychique, ainsi qu’une amélioration de la qualité de vie. Elle freine l’ avancée du vieillissement en préservant les capacités fonctionnelles. Elle permet également de réduire le risque de survenue des MNT et des autres maladies mentionnées ci-dessus.
Quels sont les besoins nutritionnels spécifiques des seniors ?
Bien que les preuves scientifiques soient insuffisamment étayées car elles proviennent en majorité d’ études d’observation de qualité variable, les experts de la COFA reconnaissent qu’ en général, les besoins des personnes âgées non vulnérables ont des apports nutritionnels recommandés identiques à ceux des adultes d’ âge moyen tels qu’explicités dans la pyramide alimentaire suisse disponible sur le site web de la Société suisse de nutrition (www.sge-ssn.ch). Toutefois ces experts y apportent les nuances suivantes :
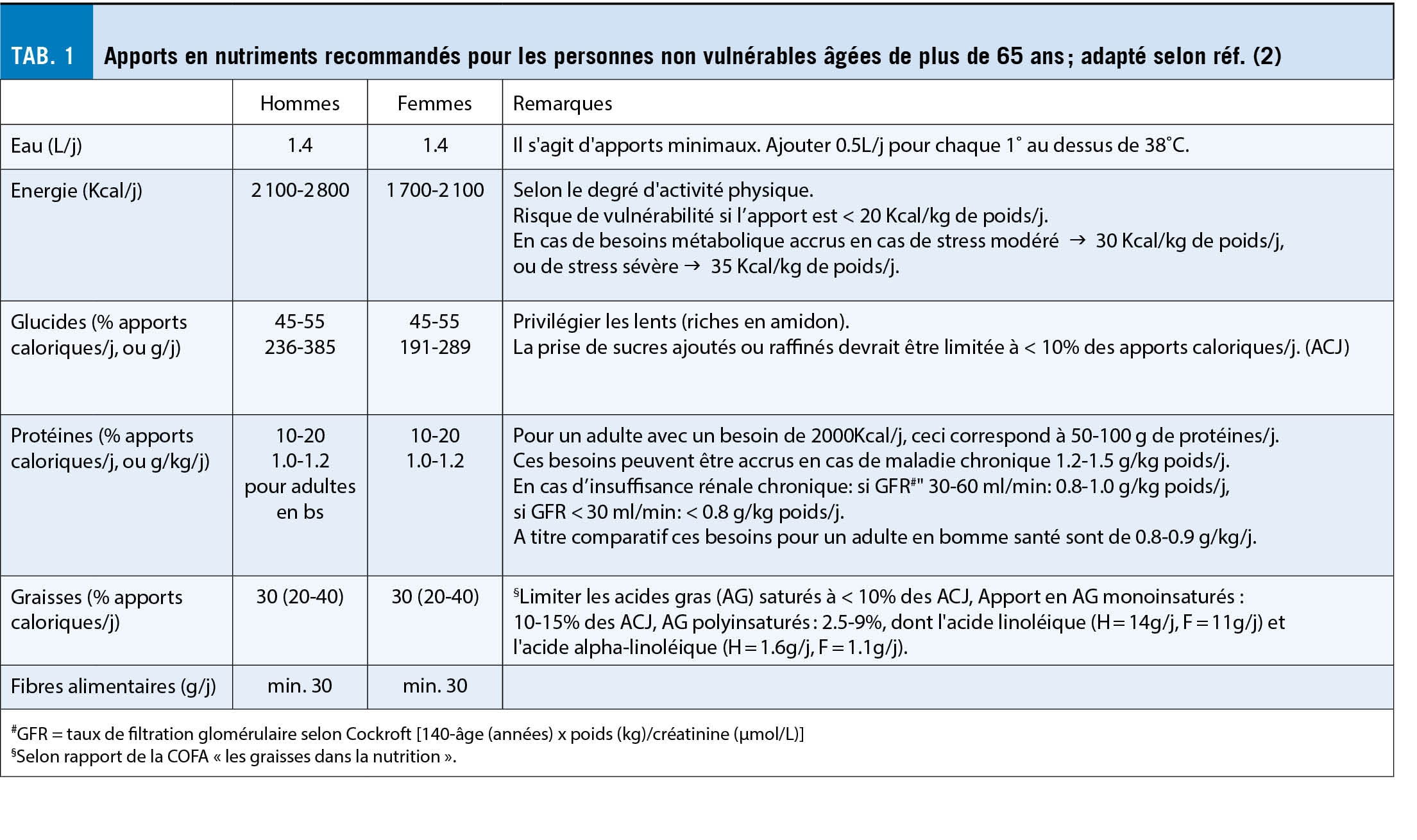
- généralement les besoins énergétiques diminuent légèrement avec l’ âge, de l’ ordre de 100 à 200 Kcal/j chez les hommes et de 100 à 300 Kcal/j chez les femmes,
- l’ apport protéique doit être légèrement augmenté de 0.8-0.9 à 1.0-1.2 g/kg de poids corporel,
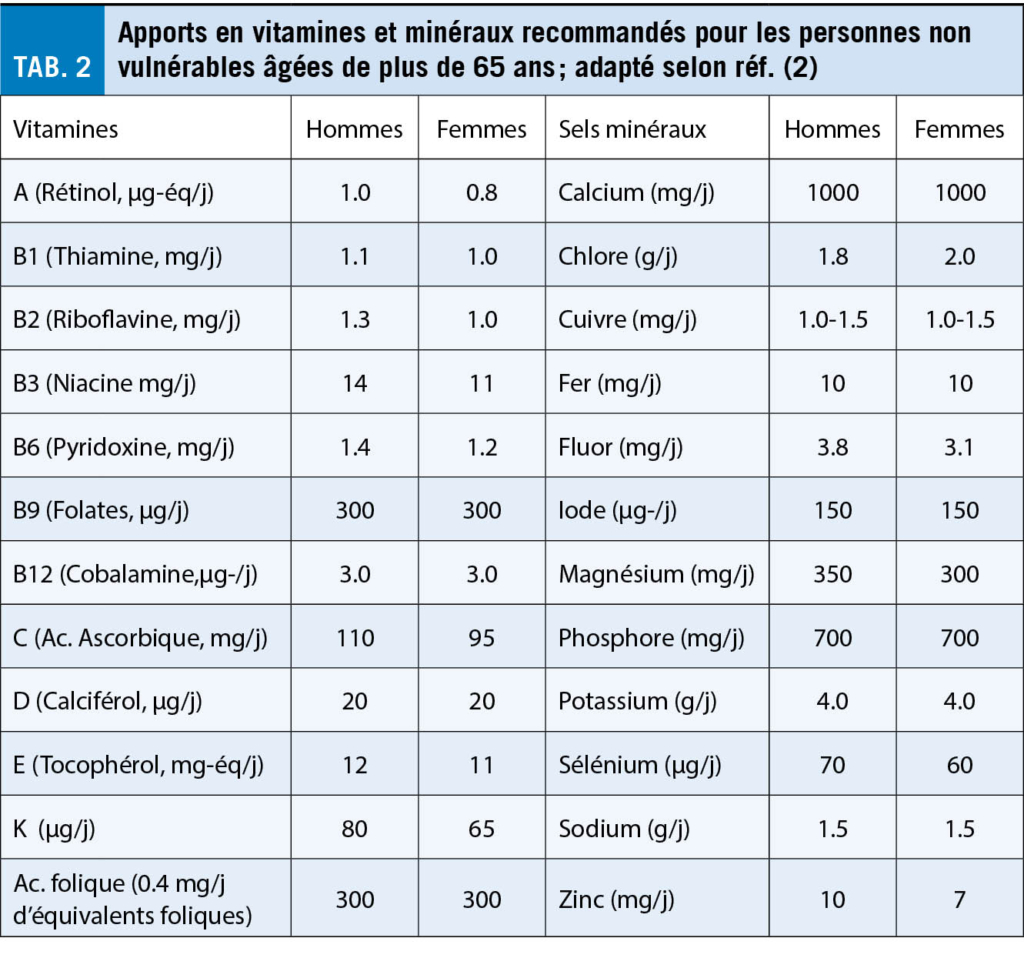
- une supplémentation en vitamine D (20 µg/j) est recommandée en raison de la perte progressive de la capacité de synthèse cutanée de cette vitamine avec l’ âge,
- un dépistage d’ une possible carence en vitamine B12 est recommandé chez les personnes à risque en raison d’ une affection intestinale ou d’ une pharmacothérapie entravant la résorption intestinale, et c’ est également le cas lors de symptômes laissant suspecter un déficit de cette vitamine,
- une déficience en acide folique (vitamine B9) peut être fréquente chez les personnes âgées, en particulier chez celles qui sont devenues vulnérables ou dépendantes, le plus souvent en raison d’ une prise insuffisante d’ aliments riches en acide folique. L’ éthylisme chronique ou certains médicaments (p.ex. l’ hydantoïne, le méthotrexate, les diurétiques de l’ anse), accroissent ce risque. Dépistage et traitement de la carence en folates sont recommandés en cas de manifestations cliniques.
Les tableaux 1 et 2 résument les apports recommandés en nutriments, vitamines et minéraux, chez les personnes âgées non vulnérables. Il s’ agit-là d’ indicateurs qui, en complément avec la pyramide alimentaire, devraient faciliter la composition des repas visant à l’ équilibre alimentaire sur plusieurs jours.
En somme, manger de façon variée, régulière, adaptée aux besoins énergétiques et protéiques suffit généralement à couvrir les besoins nutritionnels si l’ on y ajoute la supplémentation en vitamine D.
Le régime de type méditerranéen et ses avantages
A l’ heure actuelle, il apparaît qu’ une alimentation équilibrée ne devrait plus être basée sur des régimes comportant la restriction de tel ou tel nutriment ou aliment (p.ex. graisses, cholestérol, viande et produits carnés) ou au contraire la supplémentation en tel ou tel nutriment (p.ex. graisses oméga-3, compléments alimentaires), mais sur un « pattern alimentaire », c’ est-à-dire à un régime ou une diète qui représentent un ensemble approprié de divers types d’aliments, d’ ingrédients et de boissons. Parmi les nombreux régimes existants, le régime méditerranéen de tradition millénaire est celui qui a été le plus étudié. Comme le montrent les revues systématiques et les méta-analyses successives, son efficacité à réduire significativement la morbidité et mortalité dues aux MNT, y compris la vulnérabilité et les démences, a pu être démontrée tant sur la base d’ études observationnelles de cohortes que d’ études randomisées interventionnelles dans de nombreux pays autres que la Grèce et l’ Italie (3-5).
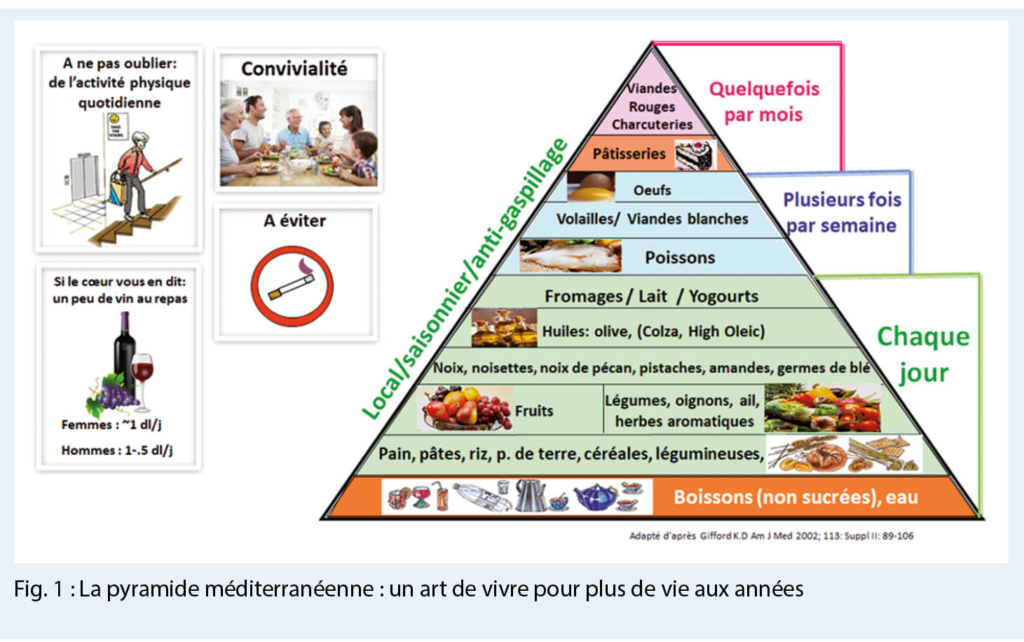
A titre d’ exemple, l’ adhérence à une diète de type méditerranéenne pour 2339 personnes âgées de 70 à 90 ans suivies pendant 10 ans a été associée à une réduction significative de la mortalité totale (-23%), coronarienne (-39%), cardiovasculaire (-29%) et d’autres causes (-39%), la baisse de la mortalité par cancers étant non significative (-10%) (6). Certes ces études comportent des limitations méthodologiques liées notamment à la saisie des habitudes alimentaires. Mais, la cohérence des résultats plaide en faveur d’ une telle diète qui peut être également applicable en Suisse à l’ aide de la pyramide méditerranéenne (fig. 1) et du tableau de son score d’ adhérence à cette diète (tab. 3).
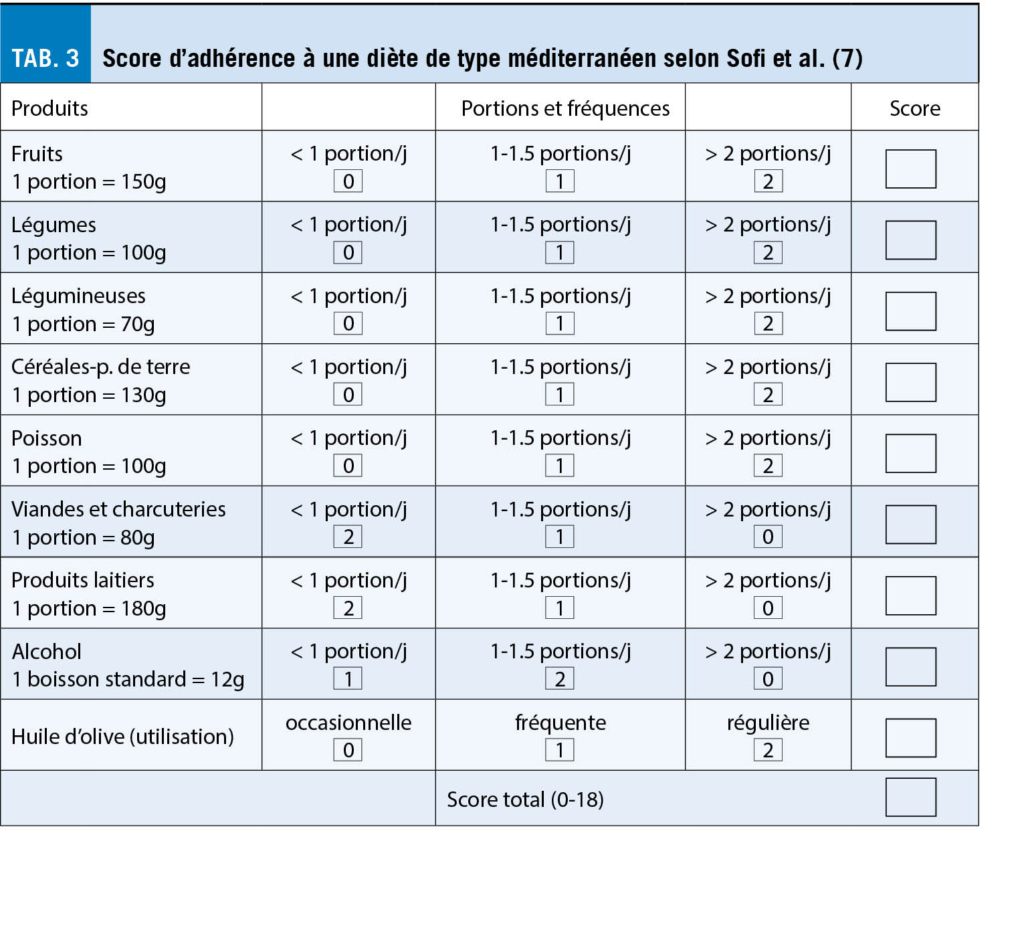
En bref, la pyramide méditerranéenne qui mentionne les fréquences de consommation des items alimentaires complète la pyramide suisse. S’ il existe de nombreux index ou scores d’ alimentation saine, celui présenté ici par F. Sofi et al. (tab. 3) a l’ avantage d’ être simple d’ utilisation et d’ avoir été établi sur un ensemble de 18 études prospectives réalisées en Europe, aux USA et en Australie. A noter que chaque incrément de 2 pts de ce score, oscillant en 0 et 18, est corrélé à une réduction de 9% de la mortalité totale, de 10% de la morbidité/mortalité cardiovasculaire et de 5% de la mortalité par cancer.
Copyright Aerzteverlag medinfo AG
Président de la Fondation Suisse Nutrition Santé
5, chemin des Fleurs
1007 Lausanne
roger.darioli@unisante.ch
Directeur de la Fondation Institut suisse
des vitamines, Biopôle
Route de la Corniche 1
1066 Epalinges
serge.rezzi@swissvitmin.ch
RD déclare que son activité de Président de l’ Institut suisse des vitamines est strictement bénévole. SR déclare n’ avoir aucun conflit d’ intérêts en rapport avec cet article.
1. Chatelan A, Beer-Borst S , Alex Randriamiharisoa A, et al. Major Differences in Diet across Three Linguistic
Regions of Switzerland: Results from the First National Nutrition Survey menuCH. Nutrients. 2017; 9:
1163. doi: 10.3390/nu9111163.
2. https://www.blv.admin.ch/dam/blv/fr/dokumente/das-blv/organisation/kommissionen/eek/ernaehrung-im-alter/ernaehrung-im-alter-bericht.pdf.download.pdf/ernaehrung-im-alter-bericht.pdf
3. Soltani S, Jayedi A, Shab-Bidar, et al. Adherence to the Mediterranean Diet in Relation to All-Cause Mortality: A Systematic Review and Dose-Response Meta-Analysis of Prospective Cohort Studies. Adv Nutr 2019 ; 10: 1029-39.
4. Becerra-Tomás N, Mejía S, Viguiliouk E, et al. Mediterranean diet, cardiovascular disease and mortality in diabetes: A systematic review and meta-analysis of prospective cohort studies and randomized clinical trials. Crit Rev Food & Nutr. 2020; 60: 1207-27.
5. Kojima D, Avgerinou D, PhD, Steve Iliffe S, et al.Adherence to Mediterranean Diet Reduces Incident Frailty Risk: System-atic Review and Meta-Analysis
6. Knoops KT, et al. Mediterranean diet, lifestyle factors, and 10-year mortality in elderly European men and women: the HALE project. JAMA 2004; 292:1433-39.
7. Sofi F et al. Mediterranean diet and health status: an updated meta-analysis and a proposal for a literature-based adherence score. Health Pub Nutr. 2014 Dec;17(12):2769-82. doi: 10.1017/S1368980013003169