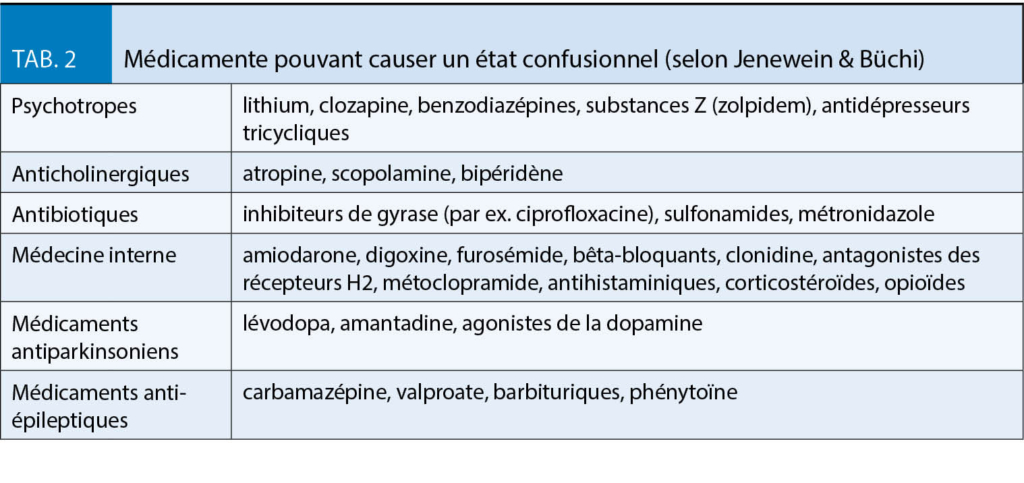
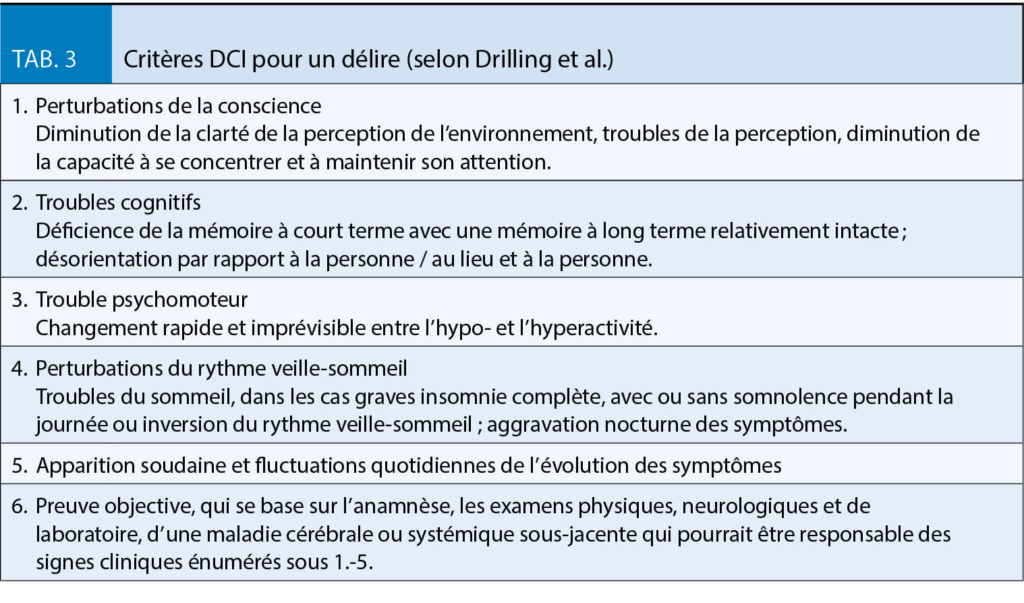
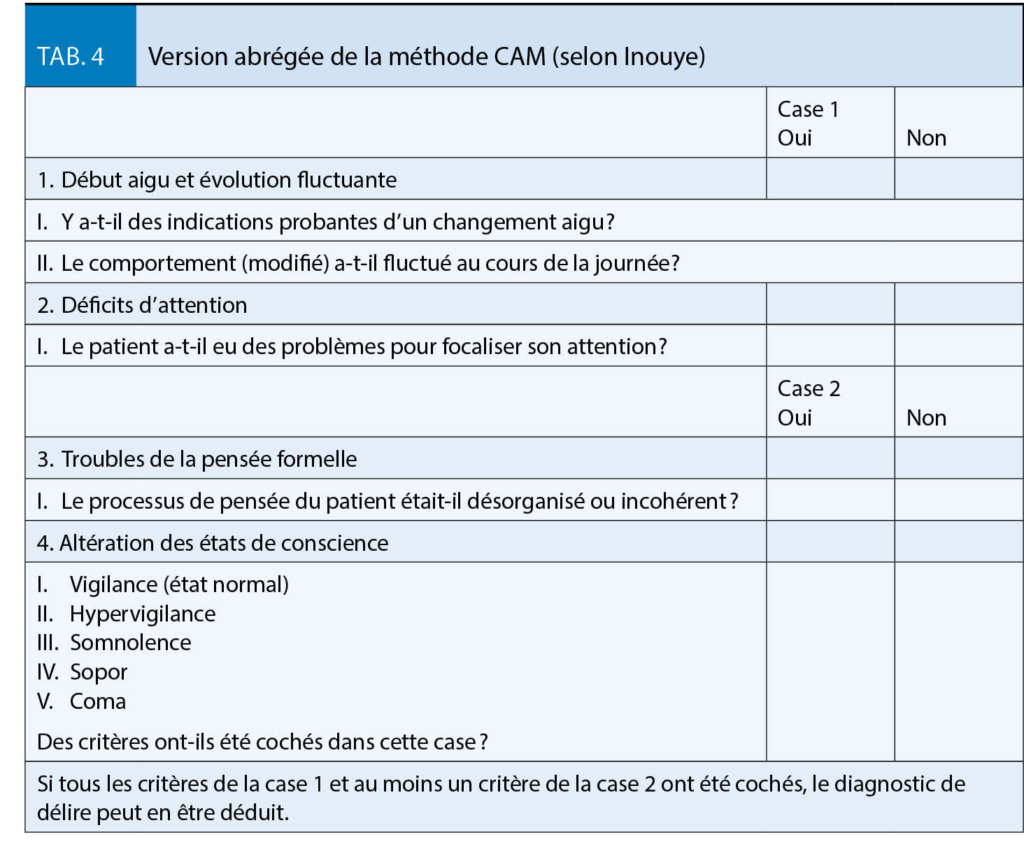
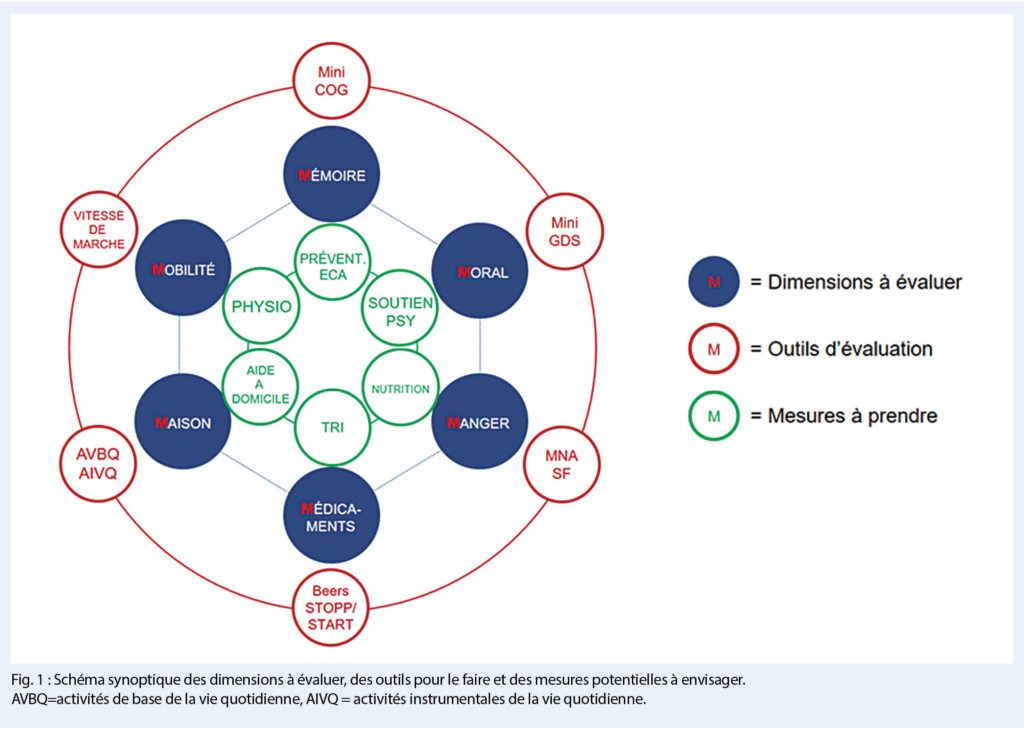
Les mécanismes physiopathologiques sous-jacents dans la bronchopneumopathie chronique obstructive, qui entraînent des symptômes de gravité variable et sont déclenchés par des agents nocifs inhalés, principalement par la consommation de nicotine, sont l’ œdème de la muqueuse bronchique, le spasme des muscles bronchiques et l’ hypersécrétion avec formation/sécrétion accrue de mucus. Les stratégies de traitement répondent donc à un ou plusieurs de ces problèmes. Dans le diagnostic de la BPCO, la détection précoce et le diagnostic différentiel par rapport aux autres maladies pulmonaires telles que l’ asthme, la bronchectasie, etc. posent un défi particulier.
Chez un patient qui souffre de dyspnée persistante et progressive ou de toux chronique, d’ infections respiratoires récurrentes et présente certains critères anamnestiques, tels que l’ exposition à des agents nocifs inhalés, mais aussi des antécédents familiaux ou un faible poids à la naissance, voire une naissance prématurée, il faut penser à la BPCO.
Évaluation spirométrique
Pour confirmer le diagnostic, un examen spirométrique est toujours essentiel et indispensable. En pratique générale, la spirométrie est très bien adaptée pour détecter l’ obstruction non réversible et l’ étendue de la restriction du flux respiratoire.
La spirométrie est également importante pour l’ évaluation de la gravité et du pronostic de la BPCO, alors que la prise en charge de la BPCO par les médicaments dépend de la classification en groupes A à D, en fonction des symptômes cliniques – en particulier la dyspnée – et de la fréquence d’ exacerbation (4).
Au moins une fois au cours d’ une BPCO une présentation à un médecin spécialiste en pneumologie devrait avoir lieu, surtout si les patients ne répondent pas au traitement standard ou s’ ils sont encore symptomatiques, avec des exacerbations fréquentes, ou doivent être hospitalisés pour cause d’ exacerbation.
Surtout si la restriction spirométrique n’ explique pas suffisamment l’ étendue de la dyspnée, un cardiologue doit également être consulté, car les comorbidités cardiaques sont relativement fréquentes dans la BPCO.
Individualisation de la thérapie
L’ individualisation est devenue de plus en plus courante dans le traitement de la BPCO. Ici, il s’ agit principalement de décider quel patient bénéficie ou non de tel ou tel médicament. Le facteur décisif est toujours l’ image clinique globale du patient concerné avec les circonstances anamnestiques et symptomatiques correspondantes, y compris les comorbidités au sens d’ une image en mosaïque, de sorte qu’ un concept de thérapie individuel puisse être créé pour chaque patient. Un concept de traitement basé sur la méthode « one size fits all » n’ est pas à sa place dans le traitement de la BPCO. Même s’ il n’ existe pas de thérapie curative médicamenteuse pour la BPCO, il n’ y a aucune raison de pratiquer le nihilisme thérapeutique.
Les objectifs thérapeutiques, outre la lutte contre l’ inflammation de la BPCO, sont le soulagement des symptômes, l’ augmentation de la résilience, l’ évitement des exacerbations et donc l’ amélioration de la qualité de vie globale des patients atteints de BPCO.
Les pierres angulaires du traitement de la BPCO sont les bronchodilatateurs, représentés par le groupe des bêtamimétiques (à longue durée d’ action) (LABA) et des parasympatholytiques (à longue durée d’ action) (LAMA). Les bêtamimétiques à courte durée d’ action jouent un rôle secondaire dans le traitement à long terme de la BPCO, sauf lorsque les symptômes sont très légers.
Les principes actifs LABA et LAMA réduisent l’hyperinflation, en particulier pendant l’ effort physique. Par rapport aux LABA, les LAMA sont plus efficaces pour prévenir les exacerbations.
Fondamentalement, le fait de commencer par une association fixe LABA/LAMA est avantageux pour les patients présentant des symptômes prononcés, car les deux groupes de substances actives augmentent ensemble leur mécanisme d’ action et sont plus efficaces pour soulager les symptômes.
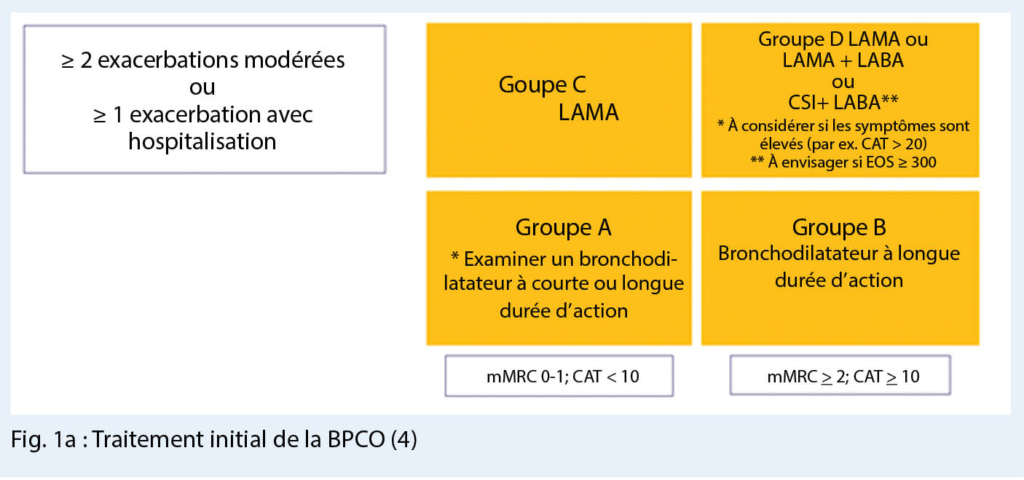
Niveaux de sévérité GOLD 1 à 4 et symptômes / exacerbations GOLD groupe A à D
Toujours dans la recommandation GOLD actualisée pour le diagnostic et le traitement de la BPCO, la classification en niveaux de gravité respectifs GOLD 1 à 4 est basée sur la limitation du flux respiratoire dans la fonction pulmonaire de GOLD 1 (VEMS ≥ 80 % du volume cible) à GOLD 4 (VEMS < 30 % du volume cible).
La classification supplémentaire est basée sur le tableau à quatre champs déjà connu, la graduation étant ici basée sur l’ anamnèse d’ exacerbation d’ une part et les symptômes de la maladie d’ autre part et s’ effectue comme auparavant dans les groupes A, B, C et D. Les groupes à haut risque C et D comprennent les patients ayant subi deuxexacerbations ou plus au cours de l’ année précédente ou au moins une hospitalisation liée à une exacerbation. Ces deux groupes C et D se distinguent ensuite par la gravité des symptômes. Cette dernière peut être déterminée plus facilement avec l’ échelle mMRC (modified Medical Research Council) qui interroge le symptôme important qu’ est la dyspnée.
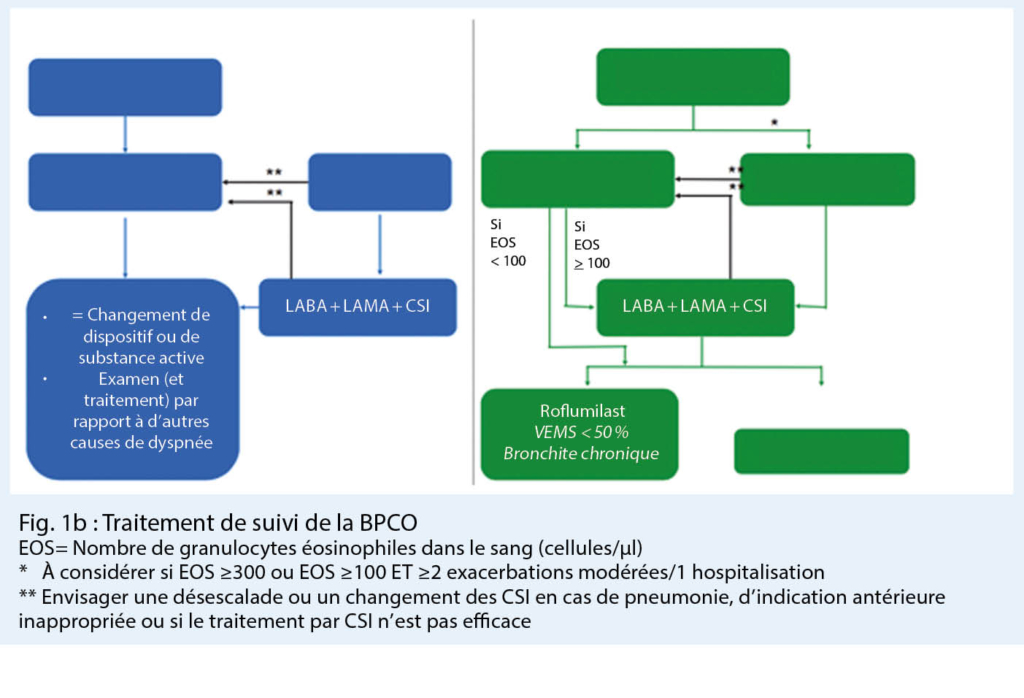
La classification en ces 4 groupes de thérapie détermine la thérapie recommandée, une distinction étant désormais faite entre les patients naifs de la thérapie (fig. 1a), c’ est-à-dire ceux qui doivent commencer une thérapie contre la BPCO et les patients prétraités (fig. 1b), et pour cette procédure thérapeutique des algorithmes ont été développés.
Les bronchodilatateurs jouent le rôle principal dans le traitement de la BPCO ; les préparations à longue durée d’ action doivent être utilisées au plus tard à partir du groupe B.
Nombre d’ éosinophiles et CSI
L’ une des questions les plus importantes dans le traitement de la BPCO est de savoir quel patient bénéficie de la thérapie par corticostéroides inhalées (CSI). Dans le traitement initial d’ un patient atteint de BPCO, l’ ajout d’ un CSI n’ est justifié que dans les cas gravement malades avec exacerbations fréquentes, ainsi que lors d’ une composante asthmatiquee supplémentaire pertinente.
Le problème est qu’ en pratique, les patients atteints de BPCO sont toujours traités par un CSI – même sans exacerbations fréquentes et sans symptômes graves. Certaines études ont montré qu’ il est possible et raisonnable d’ interrompre le CSI chez une partie des patients qui ne répondent à aucun critère pour cette thérapie mais qui sont traités avec celle-ci. Ceci également dans le contexte d’ un risque accru de pneumonie dans la BPCO avec CSI, en particulier chez les personnes moins symptomatiques et avec peu d’exacerbations, de sorte qu’ il faut toujours mettre l’ accent sur la nécessité de peser le risque d’ un traitement par CSI par rapport à son bénéfice potentiel.
En outre, la ligne directrice GOLD actuelle tient compte du fait qu’ en plus de la fréquence d’ exacerbation, le taux d’ éosinophiles dans le sang est un marqueur approprié de la réponse à une dose de CSI dans le traitement de la BPCO.
Des études ont montré que les patients présentant un taux d’ éosinophiles de 300/μl de sang ou plus bénéficient d’ un traitement supplémentaire de CSI pour réduire le taux d’ exacerbation. En revanche, cet effet est très faible chez les patients atteints de BPCO avec des valeurs inférieures à 100 éosinophiles/μl, de sorte que GOLD recommande maintenant que l’ escalade ou la désescalade du traitement de la BPCO soit également basée sur le nombre d’ éosinophiles (fig. 2).
Le nombre d’ éosinophiles est donc un biomarqueur important dans le traitement de la BPCO et il est utile d’effectuer une formule sanguine complète pour guider les décisions thérapeutiques, en particulier chez les patients BPCO prétraités.
Dans un premier temps, l’ association LABA/CSI ne doit être envisagée que chez les patients présentant une forte charge de symptômes et un risque élevé d’ exacerbation, c’ est-à-dire le groupe GOLD D, si le nombre d’ éosinophiles dépasse 300 / μl de sang. En outre, cette association peut constituer une première option thérapeutique chez les patients atteints de BPCO ayant des antécédents d’ asthme et/ou d’ allergies.
Le facteur décisif dans la pharmacothérapie de la BPCO chez les patients prétraités, ou dans le suivi, est de savoir quel problème domine chez le patient avec BPCO, soit la dyspnée, soit les exacerbations du symptôme cardinal (fig. 1 b).
Si la dyspnée est au premier plan, le traitement bronchodilatateur doit passer d’ une monothérapie (LABA ou LAMA) à une bithérapie (LABA / LAMA) ou de LABA / CSI à une trithérapie (LABA / LAMA / CSI), ou encore à une combinaison de bronchodilatateurs (LABA / LAMA).
Le cas échéant, un changement de dispositif et/ou de substance active doit également être envisagé.
Dans le cas d’ exacerbations fréquentes, l’ ajout d’ un CSI à un LAMA, LABA ou LAMA / LABA déjà établi a pour but d’ éviter de nouvelles exacerbations, surtout si, comme nous l’ avons déjà mentionné, le nombre d’ éosinophiles est de ≥ 300 cellules / µl de sang.
Pour moins de 100 cellules éosinophiles / µl de sang, des alternatives telles que l’ anti-inflammatoire oral et l’ inhibiteur de PDE4 roflumilast ou encore l’ azithromycine doivent être envisagées.
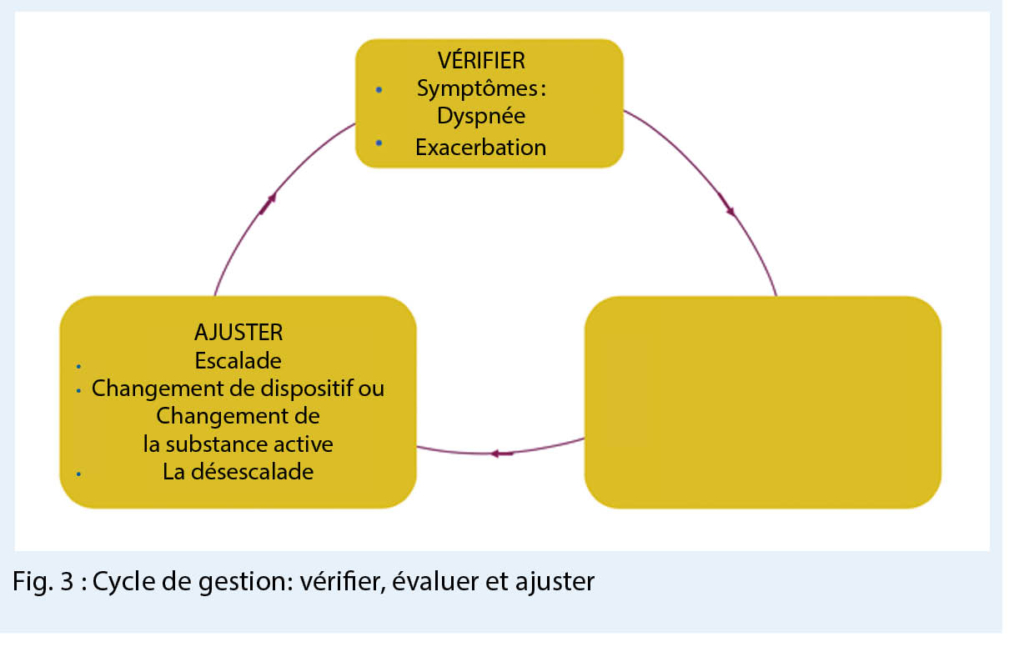
Cycle de gestion : examiner, évaluer et ajuster
Dans la gestion de la BPCO, il est essentiel de contrôler régulièrement le succès de la thérapie, comme dans le cas de l’ asthme, et d’ ajuster le traitement si nécessaire, par exemple si le patient continue d’ être symptomatique, s’il fait des exacerbations fréquentes, si la technique d’ inhalation à contrôler à chaque contact avec le patient ne s’ adapte pas de manière optimale et si le dispositif d’ inhalation doit être changé éventuellement ou s’ il existe de (nouvelles) maladies concomitantes aggravantes.
Afin de garantir que les patients ne soient pas laissés à eux-mêmes après la thérapie initiale, il est recommandé de suivre un cycle de gestion comprenant des tests, des évaluations et des ajustements et de prendre les mesures appropriées si la thérapie ne se déroule pas encore de manière optimale ou si les objectifs thérapeutiques souhaités n’ ont pas encore été atteints (fig. 3).
La formation à une technique d’ inhalation correcte est essentielle dans le cadre de l’ éducation des patients, un médicament par inhalation ne peut être efficace que s’ il arrive là où il est censé d’ aller. Sans une formation approfondie et individuelle de l’ inhalation, le succès du traitement n’ est généralement pas atteint. Afin de garantir une utilisation correcte de l’ inhalateur, il est judicieux de vérifier la technique d’ inhalation à chaque consultation si possible. Il est préférable que le patient montre comment il utilise l’ inhalateur, et toute erreur peut alors être corrigée.
La reconnaissance et l’ autogestion des exacerbations peuvent être enseignées à l’ aide d’ un plan d’ action contre la BPCO. En plus de la formation classique des patients, un accompagnement et des conseils adaptés aux besoins individuels peuvent contribuer à améliorer la prise en charge de la maladie.
En raison de la dyspnée à l’ effort, les patients atteints de BPCO évitent très souvent l’ effort physique et se déconditionnent donc encore plus. Afin de contrer cette spirale descendante, des mesures de réhabilitation avec un entraînement physique régulier sont au moins aussi importantes que la thérapie par médicaments inhalés. Cela améliore l’ endurance, la dyspnée et le risque d’ exacerbation, et surtout la qualité de vie.
En principe, cette dernière peut être améliorée et maintenue le plus longtemps possible, notamment en arrêtant de fumer, en suivant une thérapie médicamenteuse avec la meilleure technique d’ inhalation possible et en pratiquant une activité physique régulière avec un entraînement au moins deux fois par semaine.
Cet article est une traduction de « der informierte arzt » 09_2020
Copyright bei Aerzteverlag medinfo AG
LungenZentrum Hirslanden
Witellikerstrasse 40
8032 Zürich
a.piecyk@lungenzentrum.ch
L’ auteur a déclaré n’ avoir aucun conflit d’ intérêts en rapport avec cet article.
Graf J, Jörres RA, Lucke T, Nowak D, Vogelmeier C, Ficker JH : Traitement médical de la BPCO – une analyse de la prescription conforme aux directives dans une large cohorte nationale (COSYCONET). Dtsch Arztebl Int 2018 ; 115 : 599-605. DOI : 10.3238/arztebl.2018.0599
Vogelmeier C, et al : Deutsche Gesellschaft für Pneumologie und Beatmungsmedizin e.V. et Deutsche Atemwegsliga e.V., avec la participation de la Société autrichienne de pneumologie (eds.) : Leitlinie zur Diagnostik und Therapie von Patienten mit chronisch obstruktiver Bronchitis und Lungenemphysem (COPD). Pneumologie 2018 ; 72 : 253-308
Initiative mondiale pour les maladies pulmonaires obstructives chroniques : Stratégie mondiale pour le diagnostic, la gestion et la prévention des maladies pulmonaires obstructives chroniques (Rapport 2020).
https://goldcopd.org/wp-content/uploads/2019/11/GOLD-2020-REPORT-ver1.0wms.pdf
Agusti A, et al : Les corticostéroïdes inhalés dans la BPCO : Ami ou ennemi ? Eur Respir J 2018 ; 52 (6). pii : 1801219 CrossRef