En Suisse, environ 1600 personnes souffrent de surdité soudaine chaque année. Les deux sexes sont également touchés, le type de perte auditive le plus fréquent se produisant entre 50 et 60 ans. Alors qu’ une perte auditive légère a une forte tendance à la guérison spontanée, une perte auditive aiguë sévère peut conduire à une surdité unilatérale malgré une stéroïdothérapie empirique. La deuxième raison la plus fréquente de surdité unilatérale soudaine est une fracture transversale du rocher. Quelle qu’ en soit la cause, cette perte soudaine d’ un organe sensoriel est un événement traumatisant pour le patient concerné et a, dans de nombreux cas, des conséquences dramatiques sur son audition. Cet article traite des dernières découvertes sur les conséquences de la surdité unilatérale et des options de traitement actuelles.
Les patients atteints de surdité aiguë peuvent être triés cliniquement de manière concluante dans le cabinet d’ urgence du médecin de famille au moyen d’ une anamnèse ciblée, d’ une otoscopie et de tests au diapason. Le diagnostic définitif d’ une surdité soudaine et l’ étendue de la perte auditive sont enregistrés au moyen de l’ audiométrie tonale. Le traitement d’ une surdité soudaine n’ est pas une urgence, mais un cas urgent. L’ étiologie de la perte auditive aiguë n’ étant toujours pas claire, aucune thérapie causale ne peut être effectuée. Dans la plupart des centres, une thérapie empirique avec des corticostéroïdes topiques ou systémiques est utilisée en fonction de la gravité de la perte auditive. Ce traitement doit être commencé dans les 48 heures suivant l’ apparition de la perte auditive aiguë. Le degré de perte auditive est un facteur de pronostic pour le rétablissement d’ une surdité soudaine. Si la perte auditive aiguë entraîne une perte auditive ou une surdité grave (fig. 1), le pronostic est défavorable et la guérison ne peut être attendue que dans des cas individuels.
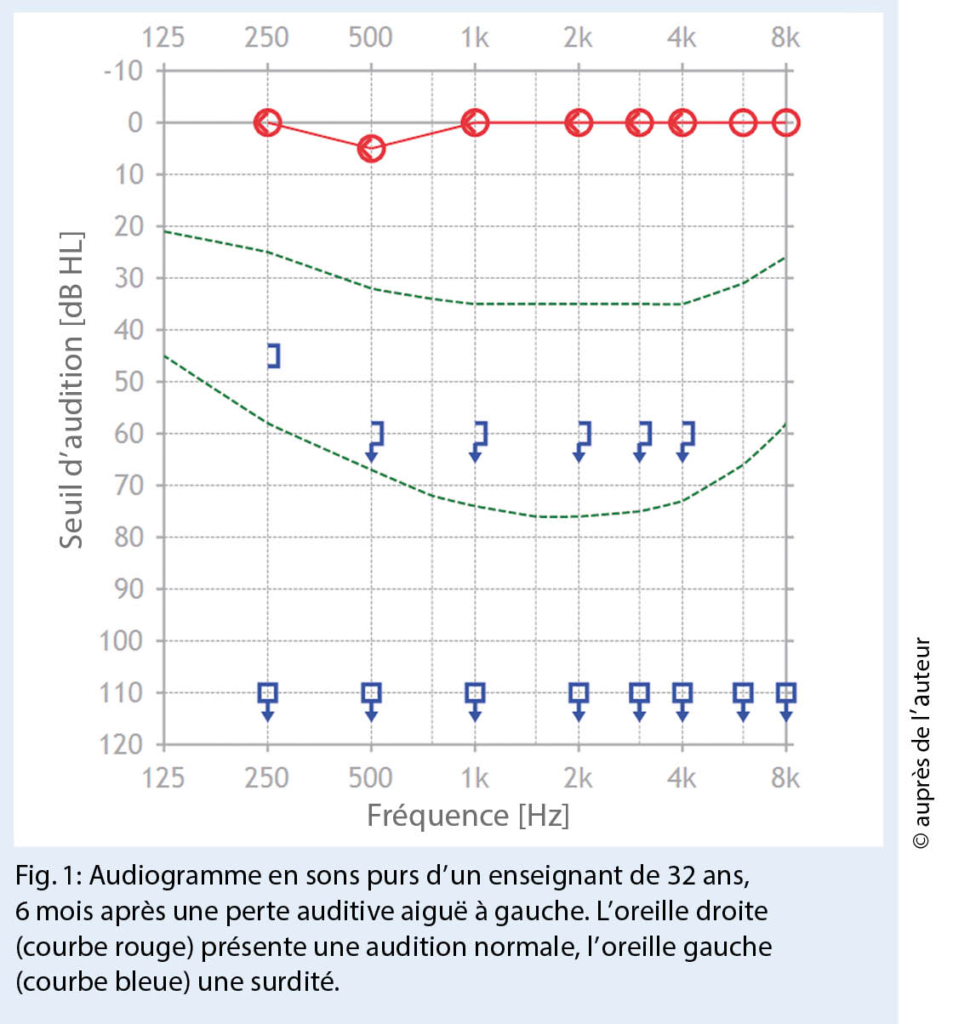
Outre la perte auditive aiguë de haut grade, la fracture transversale du rocher est la deuxième raison la plus fréquente de surdité à l’ âge adulte. Dans les fractures du rocher, une fracture transversale peut déjà être distinguée cliniquement d’ une fracture longitudinale par des tests au diapason. Dans le cas d’ une fracture longitudinale du rocher, il en résulte une surdité de transmission et, selon Weber, le diapason est latéralisé dans l’ oreille atteinte. En revanche, les fractures transversales du rocher entraînent une surdité, de sorte que le diapason est latéralisé dans l’ oreille opposée entendante. La fracture transversale du rocher passe par l’ oreille interne, c’ est-à-dire par la cochlée et le labyrinthe (fig. 2).
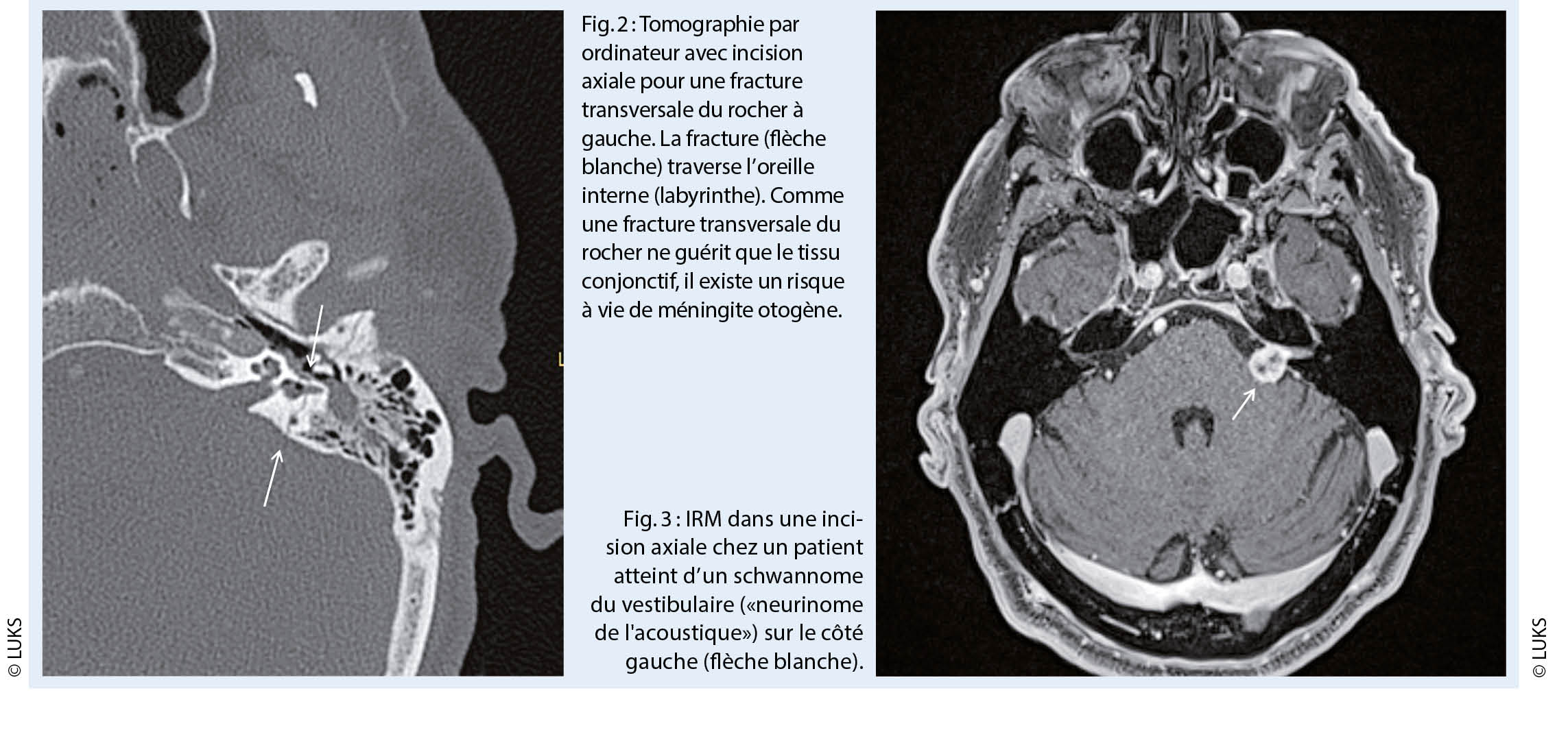
Une perte fonctionnelle cochléo-vestibulaire avec surdité et perte vestibulaire se produit. En plus de la surdité, le patient présente un nystagmus spontané à l’ oreille opposée indemne en raison de l’ insuffisance vestibulaire, c’ est-à-dire un nystagmus de défaillance.
Alors que le vertige s’ atténue progressivement grâce à la compensation centrale de l’ insuffisance vestibulaire, la surdité de l’ oreille interne affectée persiste. En outre, il existe un risque de méningite otogène à vie, car une fracture dans la zone de la capsule otique ne peut guérir qu’ avec du tissu conjonctif.
Une fracture du rocher est confirmée par une tomodensitométrie. La cause d’ une fracture transversale du rocher étant évidente, aucune autre précision n’ est nécessaire. En revanche, en cas de surdité consécutive à une surdité soudaine, une pathologie intra- ou rétrocochléaire telle qu’ un schwannome vestibulaire (« neurinome de l’ acoustique ») doit être exclue (fig. 3).
Les conséquences de la surdité unilatérale et ses effets sur l’ oreille normale controlatérale
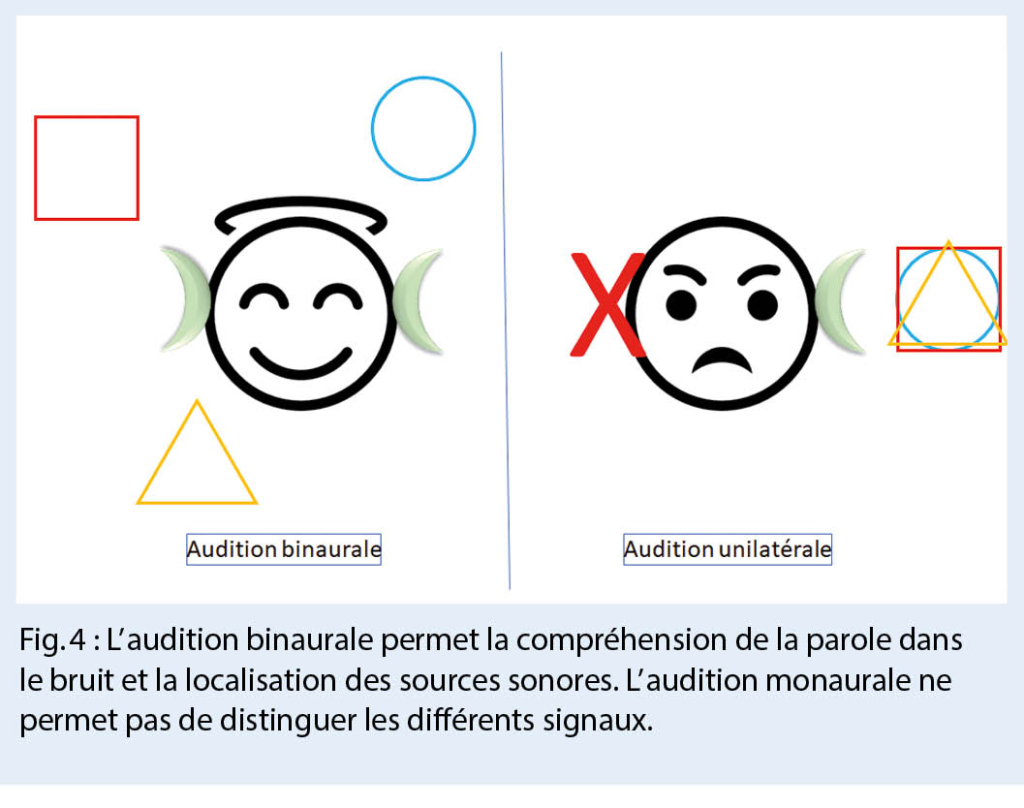
Les patients atteints de surdité unilatérale et ayant une audition normale dans l’ oreille opposée ne ressentent que peu ou pas de troubles lors d’ un dialogue dans un environnement calme et d’ un contact visuel avec les expressions du visage. Cependant, dès que les conditions habituelles d’ audition sont remplies dans la pratique quotidienne, l’ unilatéralisme devient perceptible. Une audition monaurale et asymétrique entraîne des limitations importantes, notamment en ce qui concerne la compréhension de la parole dans le bruit et la localisation des sources sonores. L’ audition devient pénible (fig. 4). Le défi est d’ autant plus grand que la situation actuelle de pandémie est caractérisée par le port de masques faciaux.
La surdité unilatérale affecte également l’ oreille à audition normale par des changements dans l’ activation neurale et les interactions binaurales dans la voie auditive centrale. Ces changements essentiels ont été démontrés dans le cadre d’ expériences sur les animaux ainsi que sur les humains. Un exemple en est le fait que les patients atteints de surdité unilatérale sont nettement plus sensibles aux traumatismes acoustiques dans l’ oreille normale. En outre, la perte auditive sympathique a déjà été décrite il y a une centaine d’ années, ce qui, par analogie avec l’ ophtalmopathie sympathique, est une perte auditive à médiation immunologique controlatérale à une cochlée endommagée. Une étude récente menée auprès de plus de 400 patients a permis d’ étudier l’ influence de la surdité unilatérale sur la capacité auditive de la meilleure oreille. Il a pu être démontré pour la première fois que les patients atteints de surdité unilatérale ont une audition significativement plus mauvaise dans la cochlée préservée qu’ un groupe témoin comparable d’ audition normale. La raison de cette situation est encore inconnue. On soupçonne la combinaison de différents facteurs tels que la prédisposition génétique, des raisons anatomiques et immunologiques, des perturbations de la microcirculation de l’ oreille interne, mais aussi l’ augmentation de l’ effort auditif en audition monaurale. Il est donc désormais évident que la surdité unilatérale signifie non seulement la perte de la moitié d’ un organe sensoriel bilatéral avec toutes ses déficiences, mais aussi que l’ audition normale de l’ oreille opposée est affectée dans son évolution ultérieure.
Réhabilitation pour surdité unilatérale
Grâce à ces nouvelles découvertes, la rééducation auditive en cas de surdité unilatérale présente des aspects à la fois thérapeutiques et prophylactiques. Les différentes étapes doivent être discutées individuellement avec le patient. Parfois, il y a des patients qui, au moins dans la période initiale, ne ressentent aucune limitation due à une audition monaurale. Aucune autre mesure thérapeutique n’ est nécessaire dans ce cas. Cependant, la majorité des patients se sentent considérablement diminués par la perte d’ un organe sensoriel, surtout s’ ils sont encore dans la vie active. Jusqu’ à il y a quelques années, la thérapie standard consistait à équiper le patient d’ un système auditif appelé CROS. L’ acronyme CROS signifie « Contralateral Routing of Signals ». Cela implique la transmission du son avec un microphone sur l’ oreille sourde à une aide auditive sur l’ oreille entendante. Techniquement, cela est possible avec les aides auditives conventionnelles, qui utilisent la transmission radio. Le patient doit porter deux appareils auditifs. L’ « émetteur » avec microphone est situé sur l’ oreille sourde et le « récepteur » avec le haut-parleur sur l’ oreille entendante. D’ autre part, il s’ agit d’ une indication classique pour les appareils auditifs à ancrage osseux (« BAHA – Bone Anchored Hearing Aid »). Ici, une prothèse auditive à ancrage osseux est portée sur l’ oreille sourde. Les signaux sont transmis à l’ oreille controlatérale par l’ os ou par le liquide céphalo-rachidien. Bien que les systèmes auditifs «CROS» apportent une certaine amélioration de la situation auditive de nombreux patients et imitent une pseudostéréophonie, ils ne peuvent naturellement pas garantir une véritable audition binaurale. L’ audition reste monaurale avec un appareillage CROS. En outre, l’ oreille opposée normale n’ est pas protégée contre une perte auditive prématurée par un système CROS.
Grâce au traitement de la surdité unilatérale par un implant cochléaire, la rééducation auditive avec une véritable audition binaurale est à nouveau possible pour la première fois. Cela fait maintenant plus de trois années que ce type de soins pour surdité unilatérale est mis en œuvre en Suisse, car il est désormais également financé par les caisses d’ assurance maladie et l’ AI. Auparavant, le financement des implants cochléaires était réservé à la surdité bilatérale.
Lorsqu’ un patient atteint de surdité unilatérale est équipé d’ un implant cochléaire, il continue à entendre physiologiquement dans une oreille, tandis que dans l’ autre oreille, le nerf auditif est stimulé directement par quelques électrodes (entre 12 et 22 électrodes, selon la marque). Néanmoins, grâce à la plasticité de notre cerveau, il est possible d’ intégrer ces deux signaux différents l’ un à l’ autre dans les centres auditifs avec une rapidité surprenante et de les percevoir comme une audition binaurale.
Selon les dernières études, l’ adaptation d’ un implant cochléaire à l’ oreille sourde semble avoir un caractère prophylactique en plus de la réhabilitation de l’ audition. Alors que la surdité unilatérale entraîne une perte auditive prématurée dans l’ oreille controlatérale à audition normale si elle n’ est pas traitée, les receveurs d’ implants cochléaires présentent une capacité auditive constante dans l’ oreille controlatérale à audition normale, comparable aux seuils auditifs de la population à audition normale.
Dans le cas d’ une fracture transversale du r ocher, il faut tenir compte, en plus du traitement de la surdité de l’ oreille, du risque accru de méningite otogène tout au long de la vie. Chez les patients qui ne décident pas de recevoir un implant cochléaire, la vaccination antipneumococcique est recommandée à titre de précaution pour réduire le risque de méningite otogène. Chez les patients ayant reçu un implant cochléaire, une exstirpation dite sous-totale est pratiquée simultanément à l’ implantation. Il s’ agit de la fermeture chirurgicale du conduit auditif externe et de la trompe d’ Eustache pour créer un joint étanche entre l’ oreille moyenne et le monde extérieur, éliminant ainsi de façon permanente le risque de méningite otogène en cas de fracture transversale du rocher.
Afin de clore le cercle de la réhabilitation auditive dans les cas de surdité unilatérale, il convient, par souci d’ exhaustivité, de mentionner les soins aux nouveaux-nés atteints de surdité congénitale unilatérale. Là aussi, l’ objectif aujourd’ hui est de détecter ce phénomène à un stade précoce grâce à un dépistage auditif du nouveau-né dans les deux oreilles et, si nécessaire, d’ entreprendre la pose d’ un implant cochléaire.
Cet article est une traduction de « der informierte arzt » 10_2020
Copyright Aerzteverlag medinfo AG
Klinik für Hals-Nasen-Ohren- und Gesichtschirurgie (HNO)
Luzerner Kantonsspital
Spitalstrasse
6004 Luzern
christoph.schlegel@luks.ch
L’ auteur n’ a pas déclaré de conflits d’ intérêts en rapport avec cet article.
peuvent être obtenues auprès de l’ auteur