Situation de départ
Un employé de commerce de 49 ans a reçu un diagnostic de diabète sucré de type 2 par hasard lors d’ un examen de routine en 2015. On lui a alors prescrit 2 x 1 g de metformine par jour à un taux d’ HbA1c de 6,6% et, par la suite, du Janumet 50/1000 mg 2 x par jour. Sous ce régime, l’ HbA1c est restée pratiquement inchangée. Il y a environ 5 mois, du Jardiance 10 mg/jour lui a été administré en plus de Janumet. Il a bien toléré les deux préparations, mais l’ HbA1c est resté stable à environ 6,5 %.
Le patient est athlétique, et joue au football régulièrement. Il est dérangé par le fait d’ avoir perdu environ 6 kg depuis qu’ il a été diagnostiqué diabétique en 2015, bien qu’ il se soit entraîné à peu près au même niveau et ait un peu réduit sa consommation de glucides. Il se sent toujours fatigué et épuisé. Il boit peu d’ alcool (au maximum un verre standard par semaine) et n’ a jamais eu de douleurs abdominales dans le passé.
Anamnèse personnelle
Diabète sucré de type 2 sans atteinte secondaire des organes depuis 2015. Goutte.
Anamnèse familiale
Père atteint de diabète sucré de type 2, diagnostiqué à l’ âge de 35 ans, actuellement sous insulinothérapie, a toujours été mince.
Médicaments actuels
Allopurinol 300 mg p.o. 1-0-0 prise irrégulière
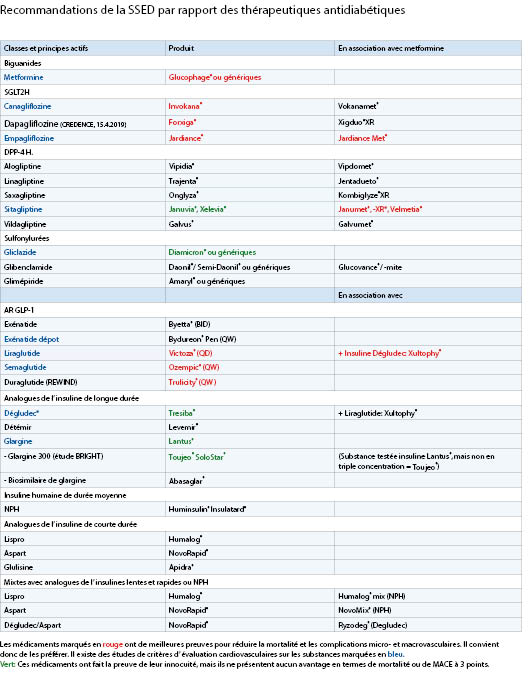
Janumet 50/1000 mg p.o. 1-0-1
Jardiance 10 mg p.o. 1-0-0
État clinique
Taille 183 cm, 69 kg, IMC 20,6 kg/m2, PA 118/75, pouls 56/min, réflexes rotulien et achilléen symétriques, monofilament 10/10 des deux côtés, sens de vibration 7/8 des deux côtés, tour de taille 84 cm.
Résultats de laboratoire
HbA1c 6,3 %
eGFR selon CKD-EPI 72 ml/min
LDL 2,6 mmol/L HDL 1,5 mmol/L
triglycérides 1,13 mmol/L
Y a-t-il des doutes quant au diagnostic du diabète de type 2 Autres considérations thérapeutiques et diagnostiques ?
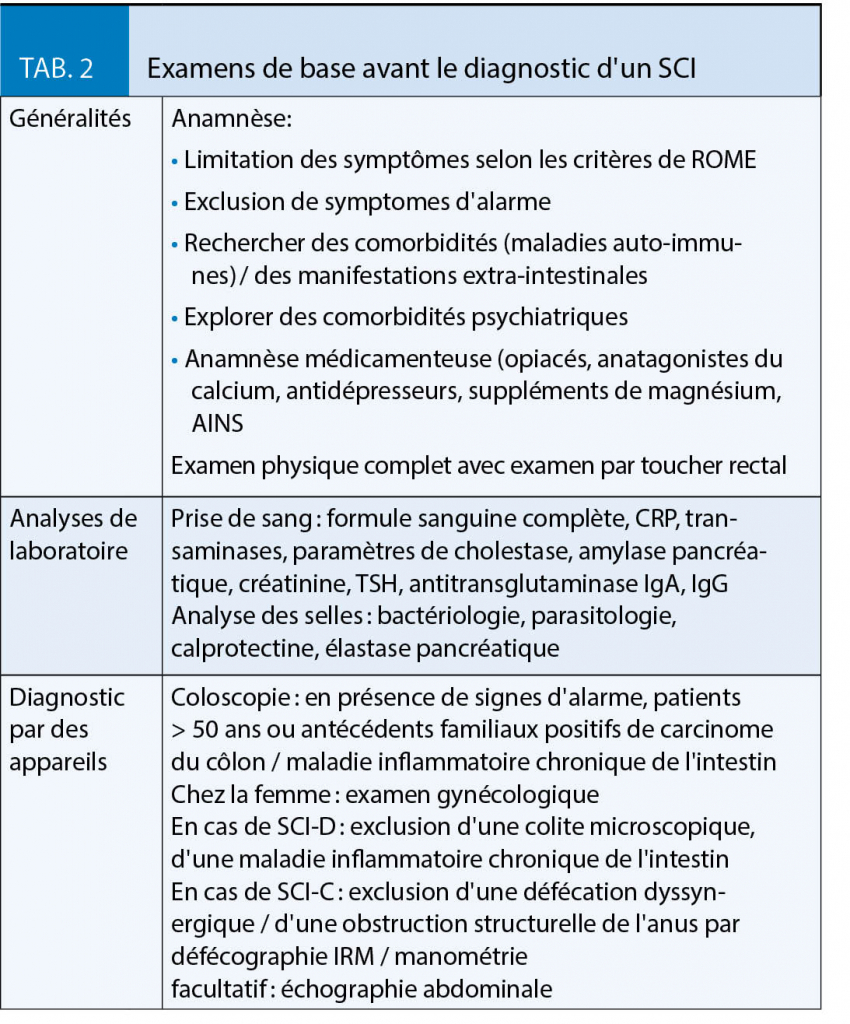
l Il n’ y a pas de syndrome métabolique avec un IMC de 20,6 kg/m2 et un tour de taille de < 94 cm.
l La perte de poids non désirée sous traitement par antidiabétiques oraux avec la metformine, la sitagliptine et l’ empagliflozine avec un taux d’ HbA1c inchangé n’ est pas typique pour un diabète sucré classique de type 2. Avec une perte de poids de 6 kg, nous pourrions nous attendre à une réduction de l’ HbA1c d’ au moins 1-2 %.
l Le taux de cholestérol HDL élevé et les triglycérides dans la norme plaident contre le diabète sucré de type 2. Typiquement, le diabète sucré de type 2 présente wun cholestérol HDL bas (< 0,9 mmol/L) et des triglycérides élevés (> 1,7 mmol/L) dans le statut lipidique à jeun. Le cholestérol LDL n’ est pas aussi pertinent pour la différenciation.
l Anamnèse familiale : père mince, atteint de diabète sucré de type 2 depuis son jeune âge, ce qui soulève des doutes sur le type de diabète de son père.
l L’ indication d’ un bloqueur SGLT-2 est-elle bonne pour le patient ? Si la sécrétion d’ insuline est potentiellement faible, l’ inhibiteur SGLT-2 peut entraîner une augmentation du glucagon, de la cétogenèse et de l’ acidocétose euglycémique.
En résumé
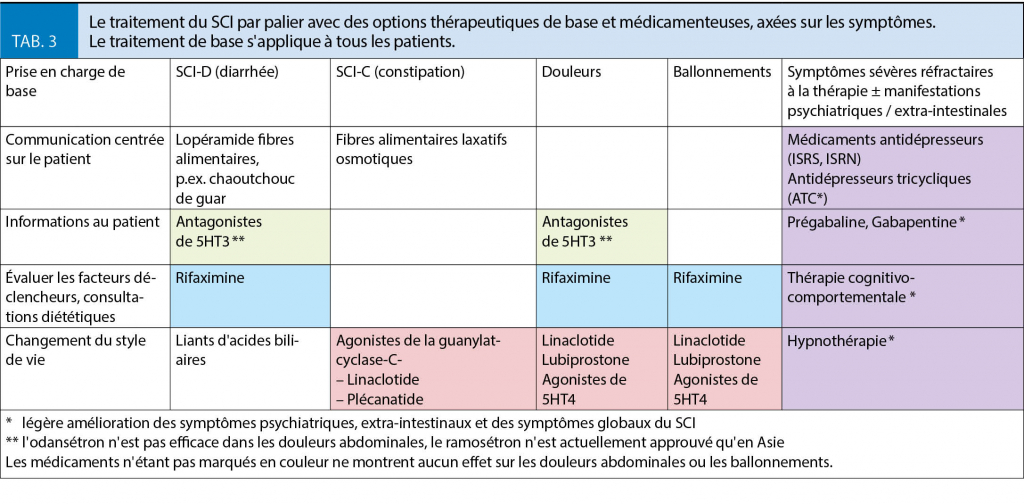
Le diagnostic de diabète sucré de type 1 est probable si l’ on se base sur l’ anamnèse. Les anticorps spécifiques du diabète (anti-GAD, -IA2, -ZnT8, -cellules des îlots pancréatiques) étaient négatifs. Ceux-ci sont positifs chez 10 à 15 % de tous les patients atteints de diabète sucré de type 1. Il n’ existe aucune preuve anamnestique d’ un diabète sucré spécifique (la saturation normale en ferritine / transferrine exclut l’ hémochromatose ; l’ absence de douleurs abdominales et les selles normales (pas de stéatorrhée) plaident contre une pancréatite chronique).
L’ arrêt des antidiabétiques oraux établis ainsi que l’ administration d’ insuline de base tout d’ abord, et ensuite l’ insuline en bolus, a permis à notre patient de reprendre son poids corporel athlétique comme avant le diagnostic du diabète sucré. De plus, la fatigue a disparu.
UniversitätsSpital Zürich
Rämistrasse 100
8091 Zurich
Roger.Lehmann@usz.ch
USZ Zürich
matthias.ernst@usz.ch
RL: Participation d‘Advisory Boards et honoraires de conférencier
avec Novo
Nordisk, Sanofi, MSD, Boehringer Ingelheim, Servier et Astra Zeneca.
ME: Frais de voyage et de congrès d’Eli Lilly et Ipsen.