La disponibilité des agonistes des récepteurs du GLP-1 est actuellement limitée au niveau mondial et ne couvre pas les besoins. Comme ce groupe de médicaments joue un rôle particulier dans le traitement de l’ obésité, la question se pose actuellement de savoir quels patients devraient avoir accès en priorité à ces médicaments. Les études actuelles, SELECT et STEP-HFpEF, portant sur l’ utilisation du semaglutide chez des patients présentant des antécédents cardiovasculaires ou une insuffisance cardiaque avec fraction d’ éjection préservée, peuvent fournir des indications sur une priorité médicalement justifiée. D’ autre part, la souffrance individuelle et le désir de traitement chez les personnes souffrant d’ obésité ne correspondent pas toujours aux aspects médicaux de l’ indication de traitement. Cela rend souvent la priorisation difficile pour les médecins traitants dans le quotidien clinique.
The availability of GLP-1 receptor agonists is currently limited worldwide and does not meet demand. As this group of drugs plays a special role in the treatment of obesity, the question currently arises as to which patients should be given priority access to these drugs. The current studies, SELECT and STEP-HFpEF, on the use of semaglutide in patients with pre-existing cardiovascular disease or heart failure with preserved ejection fraction may provide indications of medically justified prioritization. On the other hand, the individual level of suffering and desire for treatment in people with obesity does not always correlate with the medical aspects of the treatment indication. This often makes prioritization difficult for the treating physicians in everyday clinical practice.
Key Words: GLP-1 receptor agonists, obesity, limited availability
Nous disposons depuis quelques années de l’agoniste du GLP-1 liraglutide sous la marque Saxenda pour le traitement de l’obésité et de la surcharge pondérale en cas de comorbidités associées. En avril 2020, le médicament a été inscrit sur la liste des spécialités (LS) de l’ Office fédéral de la santé publique (OFSP) et a été largement utilisé par la suite. Comme nous l’ avons montré dans une étude récemment publiée à l’ échelle nationale, le traitement a été très efficace, mais l’ utilisation et le succès ont été restreints par les limitations de la LS (1).
Nouveau Wegovy® au lieu de Saxenda®
À l’ avenir, Saxenda® ne sera plus utilisé en Suisse pour le traitement de l’ obésité chez l’ adulte, car la société de production Novo Nordisk a actuellement mis sur le marché un nouveau médicament de la même classe de substances actives appelé Wegovy® (principe actif : sémaglutide) avec la même indication thérapeutique, qui est désormais prioritaire en raison des capacités de production limitées. Cette décision semble compréhensible pour différentes raisons et justifiée sur le plan médical. Tout d’ abord, le sémaglutide est, en ce qui concerne la réduction de poids souhaitée nettement plus efficace que le liraglutide (2).
Deuxièmement, on dispose pour la première fois de données cardiovasculaires pour le traitement de l’ obésité et de surpoids avec complications métaboliques chez des personnes sans diabète de type 2 (3, 4). Troisièmement, le sémaglutide, contrairement au liraglutide n’ est pas administré quotidiennement, mais seulement une fois par semaine par voie sous-cutanée, ce qui permet de réduire nettement la consommation de stylos injecteurs, réduisant ainsi l’impact environnemental et permettant l’utilisation plus judicieuse de stylos dont la production est limitée.
Indication et abus du semaglutide
L’ utilisation du semaglutide dans la pratique n’ est pas nouvelle, puisque la substance est disponible sous le nom commercial Ozempic® pour la forme injectable sous-cutanée et Rybelsus® pour la voie orale depuis quelques années déjà pour le traitement du diabète de type 2. Tel que rapporté dans les médias ces derniers mois, ces médicaments ont également été utilisés dans le cadre d’ applications “off label” chez des patients souffrant de surpoids et d’ obésité sans diabète de type 2. Compte tenu des données scientifiques disponibles et du fait que le sémaglutide est déjà utilisé depuis longtemps pour le traitement du surpoids et l’ obésité, cette utilisation off label peut être considérée comme justifiée dans certains cas. Cependant, il semble qu’ il y ait eu un abus à plus grande échelle, car les indications médicales ont été insuffisamment prises en compte et que la médication a été administrée à des personnes sans surpoids ou obésité, dans le seul but d’ optimiser subjectivement la forme corporelle. Cette évolution a des conséquences négatives dramatiques pour les patients atteints de diabète de type 2, car il est parfois impossible de se procurer du semaglutide en raison de l’ indisponibilité du produit. Il est important de souligner que tant les personnes atteintes de diabète de type 2, mais aussi les personnes souffrant d’ obésité ou de surpoids avec des maladies secondaires associées sans diabète de type 2 ont une claire indication à traitement médicamenteux spécifique, étant donné que toutes les maladies mentionnées s’ accompagnent d’ une forte augmentation de la mortalité. La disponibilité restreinte des médicaments ne doit en aucun cas conduire à ce que des groupes de patients individuels soient mis en opposition les uns contre les autres, Afin de garantir un approvisionnement suffisant pour toutes les groupes de patients à l’ avenir, il est essentiel de prescrire strictement les médicaments disponibles dans les indications données.
Quels médicaments pour le diabète de type 2, quels médicaments pour l’ obésité?
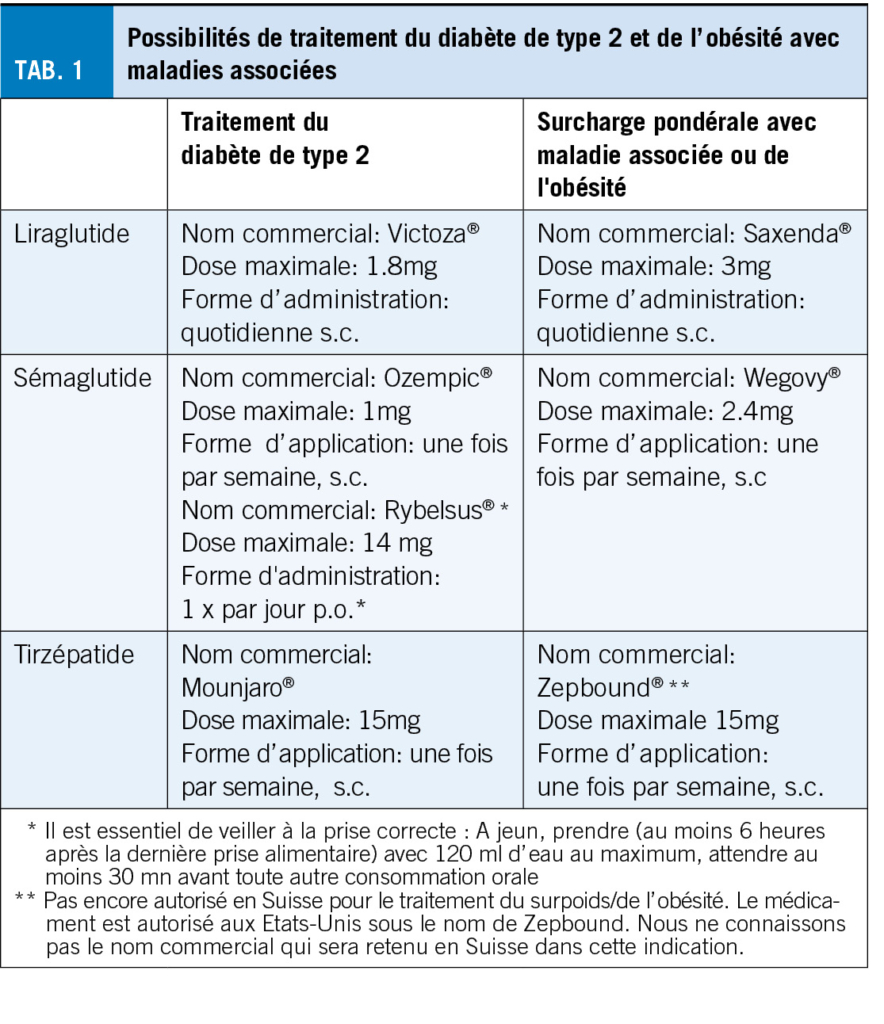
L’ obésité est une maladie chronique qui s’ accompagne de nombreuses séquelles et d’ une forte diminution de l’ espérance et de la qualité de vie.
Les personnes souffrant d’ obésité ont donc droit à un traitement adéquat, basé sur des preuves, comme les personnes atteintes de diabète de type 2. Ainsi, il nous semble actuellement difficilement supportable, d’ un point de vue médical et éthique, de devoir nous concentrer formellement sur le traitement du diabète de type 2 ou de l’ obésité chez certaines personnes, pour des raisons réglementaires de prise en charge des coûts, alors que les deux maladies concernent souvent la même personne. Nous souhaitons néanmoins donner ici un aperçu des substances actives autorisées, à quel dosage et sous quel nom, pour le traitement du diabète de type 2 et pour le traitement de l’ obésité ou du surpoids avec troubles associés. Le tirzépatide (“Mounjaro”), un bi-agoniste qui stimule non seulement le récepteur GLP-1, mais aussi le récepteur GIP, jouera probablement un rôle important dans le traitement de toutes les maladies mentionnées dans un avenir proche, c’ est pourquoi nous l’ avons également listé dans le tableau 1. Pour plus de détails sur l’ autorisation et le remboursement, nous vous renvoyons aux publications correspondantes de Swissmedic (5) et à la liste des spécialités (6) de l’ OFSP.
Le semaglutide – toujours en pénurie et contingenté
Selon les informations fournies par le fabricant Novo Nordik, le sémaglutide sous forme d’ injection sous-cutanée ne sera toujours disponible qu’ en quantité limitée. Durant les prochains mois, les investissements massifs réalisés actuellement dans l’ extension de nouvelles capacités de production devraient certes permettre de remédier à cette situation à l’ avenir, mais cela prendra encore plusieurs années avant qu’ un approvisionnement conforme aux besoins soit assuré. Cela signifie que nous continuerons à disposer de médicaments en quantité limitée et que nous devrons établir des priorités. Concrètement, au cours des prochaines années, nous devrons décider quotidiennement quels patients seront traités en priorité avec les médicaments disponibles et quels patients devront attendre malgré le souhait de traitement et l’ indication médicale existante. Il s’ agit là d’ un défi particulier, que nous n’ avons que peu, voire pas du tout, connu en Suisse jusqu’ à présent.
Le défi de la priorisation
L’ obésité est une maladie chronique. Les interruptions du traitement médicamenteux entraînent une reprise du poids corporel (2), ce qui représente une charge émotionnelle importante pour les personnes concernées, mais a également des conséquences somatiques négatives considérables. Pour nous, la priorité absolue est donc de pouvoir poursuivre les traitements existants. C’ est pourquoi nous proposons donc aux patient traités par Saxenda jusqu’à présent ainsi qu’à ceux traités par sémaglutide en utilisation «off label» mais pour des raisons médicales justifées, de changer pour le traitement de Wegovy. Il ne faut pas oublier de mentionner que la poursuite du traitement dépend malheureusement aussi des ressources financières des personnes concernées en raison de la prise en charge des coûts limitée dans le temps jusqu’ à présent, car les traitements correspondants doivent être financés par les personnes elles-mêmes sur le long terme. Contrairement à d’ autres maladies telles que le diabète de type 2 mellitus, l’ hypertension artérielle ou le cancer, les personnes atteintes de cette maladie doivent financer elles-mêmes leur traitement. Le surpoids et l’ obésité sont également des maladies neurobiologiques non imputables à des facteurs polygéniques (7), il s’ agit d’ une situation inacceptable qui doit être corrigée d’ urgence.
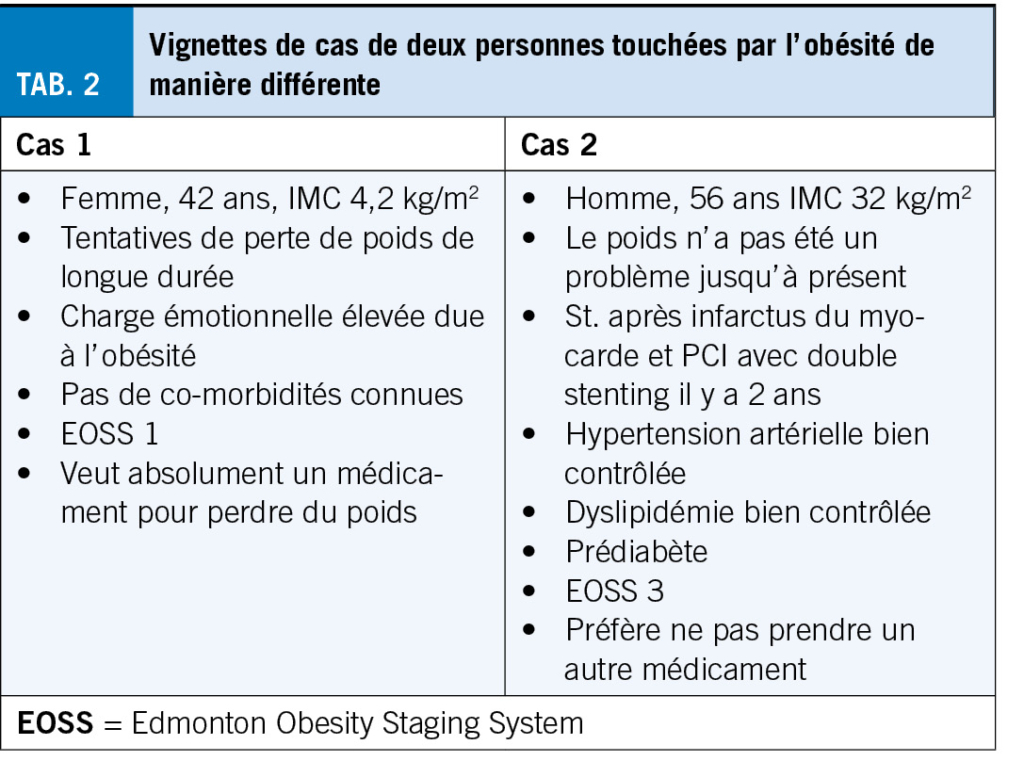
Nous pensons que la disponibilité future du sémaglutide devrait s’ améliorer progressivement, de sorte que de plus en plus de nouveaux patients pourront en bénéficier. Aujourd’ hui déjà, les centres qualifiés connaissent de longs délais d’ attente pour les personnes souhaitant être traitées sur la base d’ une indication médicale claire. La question des priorités se pose avec acuité, au plus tard en face de ces longs d’elais d’attente. Pour illustrer ce dilemme de manière tangible dans le quotidien clinique, nous décrivons deux patients rencontrés dans la pratique quotidienne (encadré 1). Qui traiteriez-vous en premier? La patiente qui souffre énormément et qui souhaite absolument un traitement? Ou plutôt le patient qui ne souhaite pas vraiment de traitement et qu’il faudrait probablement encourager à débuter un traitement?
Études cardiovasculaires
Pour prendre de bonnes décisions cliniques, il est important, même si ce n’ est pas toujours suffisant, de connaître les données scientifiques disponibles. L’ étude SELECT récemment publiée (3) est particulièrement pertinente dans le contexte de la priorisation de l’ utilisation du sémaglutide. Cette étude a porté sur des personnes ayant un IMC d’ au moins 27 kg/m2 et souffrant d’ une maladie cardiovasculaire (infarctus du myocarde survenu, accident vasculaire cérébral ou maladie artérielle périphérique). Au total, 17604 personnes ont été randomisées 1:1 pour recevoir soit un placebo, soit 2,4 mg de sémaglutide, 1 fois par semaine, s.c. Le critère d’ évaluation primaire combiné était le décès d’ origine cardiovasculaire, l’ infarctus du myocarde non fatal ou l’ accident vasculaire cérébral non fatal (MACE à 3 pts). L’ étude s’ est terminée après une durée moyenne de traitement de près de 40 mois, après la survenue d’ un nombre prédéfini (1’ 225) d’ événements du critère d’ évaluation primaire. Le résultat a montré que le traitement par le sémagutide a permis de réduire de 20% la survenue du critère d’ évaluation primaire par rapport au traitement par placebo (placebo vs. sémaglutide : 8,0% vs 6,55, hazard ratio 0,80 ; 95% intervalle de confidence 0. 72- 0.90; P<0.001). La réduction absolue du risque était donc de 1.5%, ce qui signifie qu’ environ 67 personnes présentant les caractéristiques cliniques correspondantes devraient être traitées par le sémaglutide pendant 40 mois pour éviter l’ un des critères d’ évaluation primaires.
Une autre étude semble également pertinente dans le cadre de la priorisation. Il s’ agit de l’ étude STEP-HFpEF, qui a inclus des personnes présentant un IMC d’ au moins 30kg/m2 et une insuffisance cardiaque avec fraction d’ éjection préservée (FE >45%, NYHA II-IV) (4). 529 personnes ont été randomisées 1:1 pour recevoir soit 2,4mg de sémaglutide par semaine, soit un placebo, et ont été traitées pendant 52 mois. Outre les effets sur le poids corporel, l’ amélioration de la symptomatologie et des fonctions physiques ont été définies comme critère d’ évaluation primaire. Les résultats ont montré qu’ après 20 semaines de traitement par le sémaglutide, l’ amélioration des symptômes de l’ insuffisance cardiaque était déjà nettement plus importante que sous placebo et que la différence entre les groupes de traitement augmentait avec la durée du traitement. Lors d’ un test de marche de 6 minutes, la distance de marche s’ est allongée de 21,5 mètres sous sémaglutide, alors qu’ elle ne s’ est améliorée que de 1,2 mètre sous placebo (différence de 20,3 mètres ; intervalle de confiance à 95% : 8,6 -32,1 ; p<0,001).
Qui devrait maintenant être traité en priorité?
Revenons à nos deux cas: il n’ est pas facile de décider qui doit être traité en priorité par le sémaglutide. La plupart d’ entre nous seront probablement enclins à traiter en premier la patiente (cas 1) qui souffre beaucoup et qui a une forte envie de traitement. Cependant, cette patiente a une indication claire pour une chirurgie bariatrique, pour laquelle elle a été jugée apte en raison de son obésité marquée et de ses longues années de tentative de perte de poids (8, 9). Dans ce contexte, il convient de rappeler une fois de plus les effets impressionnants de la chirurgie bariatrique sur la prolongation de la vie (10). Basé sur les dates publiées, il est clair que le patient (cas 2) doit être traité prioritairement par le sémaglutide.
Du point de vue de l’ économie de la santé, cela pourrait avoir du sens, si l’ on considère que chez le patient 2 il y a une chance de prévenir un autre accident cardiovasculaire grave dans les années à venir, et donc d’ économiser les coûts du traitement correspondants. Dans une telle considération médicale, plutôt théorique, on perd toutefois de vue la perspective des patients, qui devrait également être prise en compte dans la prise des décisions. En fin de compte, il n’ y aura pas de réponse de principe à la question de la priorisation. Il n’ y a pas de bonne ou de mauvaise réponse, car chaque cas doit être examiné individuellement. Les directives réglementaires, qui sont actuellement en cours d’ élaboration par les sociétés savantes suisses concernées peuvent aider les différents décideurs dans cette situation et offrir un soutien pratique et un certain soulagement en ce qui concerne la responsabilité de la prise de décision.
À quoi ressemblera l’ avenir?
On peut s’ attendre à ce que les pénuries et les retards de livraison soient surmontés. En outre, il y aura toute une série de nouvelles préparations avec des effets similaires, ce qui élargira le choix et la disponibilité des médicaments pour le traitement pharmacologique de l’ obésité, et améliorera encore la situation. En plus du médicament déjà mentionné, le tirazépatide, des substances basées également sur un effet GLP-1 et parfois d’ autres effets supplémentaires, sont actuellement en cours dans des programmes d’ études de phase 2 et de phase 3 (11, 12). Même si les résultats de ces études doivent être attendues, on peut déjà affirmer le grand espoir de voir s’ élargir la palette des options thérapeutiques pour le traitement pharmacologique de l’ obésité à l’ avenir. Il convient de mentionner que de nouvelles substances à base de peptides, aussi des “petites molécules” qui peuvent être prises par voie orale sont à l’ étude et pourraient ainsi être utilisées à moindre coût (13). Si l’ on considère le grand nombre de personnes qui pourraient bénéficier d’ un tel traitement, cela souligne l’ importance de l’ aspect des coûts, car il s’ agit en fin de compte de la possibilité de financer un traitement de longue durée pour une grande partie de la population. À cet égard, la charge socio-économique élevée que représentent pour la société les nombreuses maladies consécutives à l’ obésité extrêmement coûteuses, qui peuvent être évitées grâce aux nouveaux médicaments doivent être prises en compte. La dépendance d’ un traitement médicamenteux efficace de l’ obésité des possibilités financières aux ressources individuelles des personnes concernées est inacceptable, tant du point de vue médical que d’ un point de vue social, car elle ne correspond pas à notre exigence d’ une société socialement équitable. Même s’ il faut attendre les résultats de ces études, on peut déjà espérer que la palette des options thérapeutiques pour le traitement de l’ obésité s’ élargira.
Conclusion
La disponibilité limitée de médicaments contre l’ obésité en général et le sémaglutide en particulier pose actuellement de nouveaux défis importants qui nécessitent une priorisation inhabituelle. Même si le manque de disponibilité sera résolu dans quelques années, les ressources financières limitées du système de santé laissent craindre que dans le futur, des priorités soient fixées pour certains traitements. Dans ce contexte, les expériences dans le domaine de l’ obésité que nous sommes en train d’ acquérir seront aussi précieuses pour les processus décisionnels médicaux futures d’ économie de la santé.
Plus d’informations sur ce sujet : https://www.smob.ch/fr/
Cet article est une traduction de «der informierte arzt – die informierte ärztin» 02_2024
Copyright Aerzteverlag medinfo AG
Centre du métabolisme de Saint-Gall
friendlyDocs AG
Lerchentalstrasse 21
9016 St. Gallen
stoffwechselzentrum@friendlydocs.ch
Cabinet d’ endocrinologie, de diabète et d’obésité
Baslerstrasse 30
4600 Olten
endokrinologie-olten@hin.ch
Clinique d’endocrinologie, de diabétologie et
de métabolisme Hôpital universitaire de Bâle
Petersgraben 4
4031 Bâle
Département de biomédecine, Université de Bâle
Bernd Schultes : Les honoraires de conférence et de conseil de Novo Nordisk et Eli Lilly, ainsi qu’ un soutien financier à la recherche par Novo Nordisk. Gottfried Rudofsky :
honoraires de conférenciers et honoraires de conseil de Novo Nordisk et Eli Lilly. Katharina Timper: honoraires de conférence et honoraires de conseil de Novo Nordisk, Eli Lilly, et Boehringer-Ingelheim, ainsi qu’ un soutien financier à la recherche de la part de Novartis et Novo Nordisc.
1. Schultes B, Timper K, Cavadini G, Rüh J, Gerber PA. Weight loss and treatment patterns in a real-world population of adults receiving liraglutide 3.0 mg for weight management in routine clinical practice in Switzerland (ADDRESS study). Diabe¬tes Obes Metab. 2023 Dec 13;
2. Schultes B, Ernst B, Rudofsky G. Medikamentöse Adipositastherapie – endlich Licht, jedoch auch Schatten. der informierte Arzt. 2023;(03):10–5.
3. Lincoff AM, Brown-Frandsen K, Colhoun HM, Deanfield J, Emerson SS, Esbjerg S, et al. Semaglutide and Cardiovascular Outcomes in Obesity without Diabetes. N Engl J Med. 2023 Dec 14;389(24):2221–32.
4. Kosiborod MN, Abildstrøm SZ, Borlaug BA, Butler J, Rasmussen S, Davies M, et al. Semaglutide in Patients with Heart Failure with Preserved Ejection Fraction and Obesity. N Engl J Med. 2023 Sep 21;389(12):1069–84.
5. Swissmedic 2019 © Copyright. Swissmedic [Internet]. [cited 2023 Dec 19]. Available from: https://www.swissmedic.ch/swissmedic/de/home.html
6. Spezialitätenliste (SL) – Übersicht [Internet]. [cited 2023 Dec 19]. Available from: https://www.xn--spezialittenliste-yqb.ch/
7. Schultes B, Ernst B, Hallschmid M, Bueter M, Meyhöfer SM. The “Behavioral Balance Model”: A new perspective on the aetiology and therapy of obesity. Dia¬betes Obes Metab. 2023 Dec;25(12):3444–52.
8. Aeby G, Schultes B, Bueter M. Chirurgische Behandlung der Adipositas – Teil 1: Richtlinien der Swiss Society for the Study of morbid obesity and metabolic disor¬ders (SMOB). der informierte Arzt. 2023;(05):41–4.
9. Aeby G, Schultes B, Ernst B, Bueter M. Chirurgische Behandlung der Adipositas – Teil 3: Kompikationen und Ergebnisse der bariatrisch-metabolischen Chirurgie. der informierte Arzt. 2023;(11):28–31.
10. Syn NL, Cummings DE, Wang LZ, Lin DJ, Zhao JJ, Loh M, et al. Association of metabolic-bariatric surgery with long-term survival in adults with and without dia¬betes: a one-stage meta-analysis of matched cohort and prospective controlled studies with 174 772 participants. Lancet. 2021 May 15;397(10287):1830–41.
11. Frias JP, Deenadayalan S, Erichsen L, Knop FK, Lingvay I, Macura S, et al. Efficacy and safety of co-administered once-weekly cagrilintide 2·4 mg with once-weekly semaglutide 2·4 mg in type 2 diabetes: a multicentre, randomised, double-blind, active-controlled, phase 2 trial. Lancet. 2023 Aug 26;402(10403):720–30.
12. Jastreboff AM, Kaplan LM, Frías JP, Wu Q, Du Y, Gurbuz S, et al. Triple-Hormone- Receptor Agonist Retatrutide for Obesity – A Phase 2 Trial. N Engl J Med. 2023 Aug 10;389(6):514–26.
13. Wharton S, Blevins T, Connery L, Rosenstock J, Raha S, Liu R, et al. Daily Oral GLP-1 Receptor Agonist Orforglipron for Adults with Obesity. N Engl J Med. 2023 Sep 7;389(10):877–88.