medinfo am Sächsilüüte 2022
Verlegerin Eleonore Droux nutze die besondere Gelegenheit, sich bei den Herausgebern und Autoren aus den Zünften Zürichs oder als ihre Gäste zu bedanken:






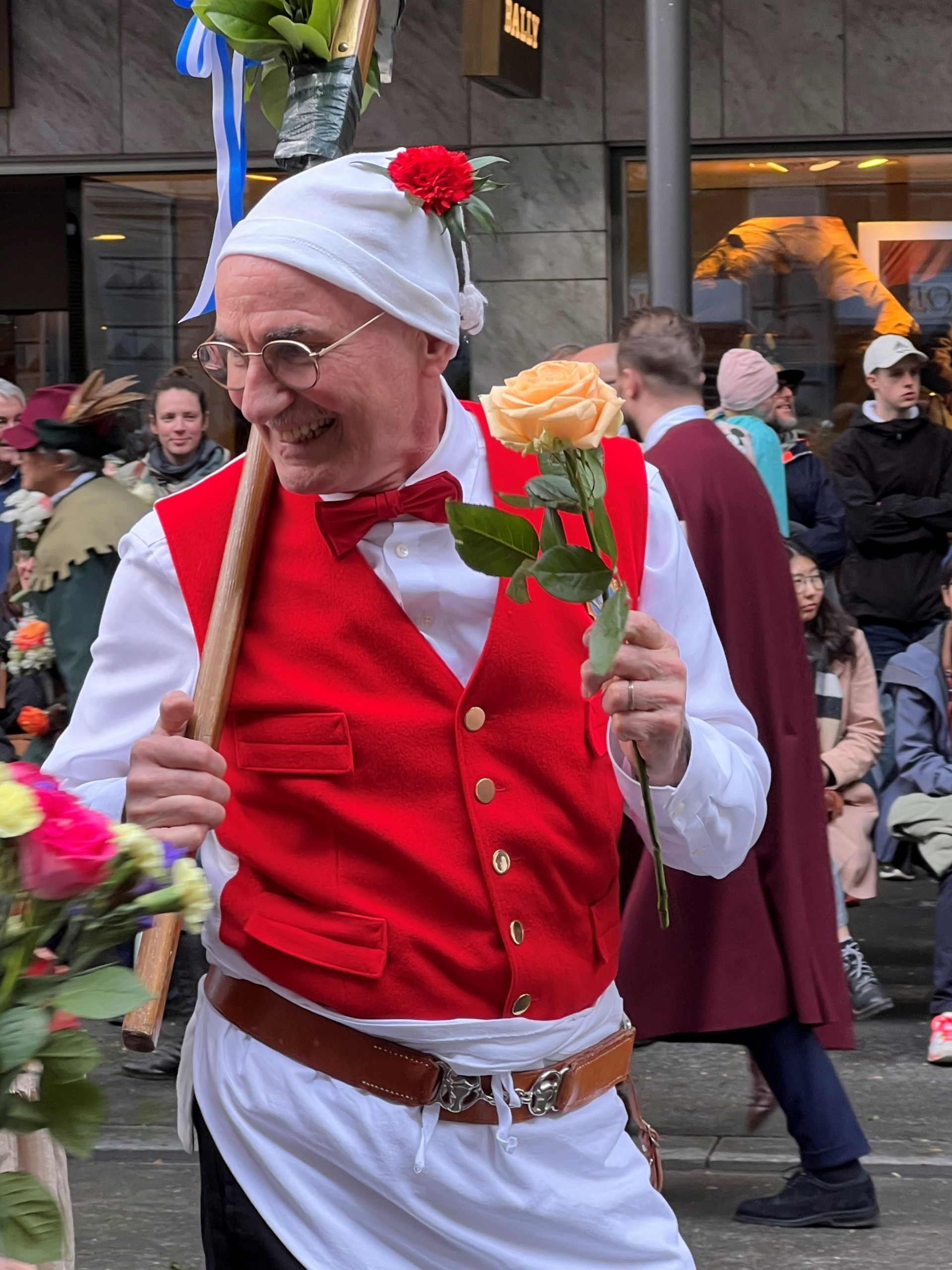





Georgia O‘Keeffe
Von O’KEEFFEs frühesten Abstraktionen bis hin zu ihren ikonischen Darstellungen – von Blumen und Landschaften aus dem Südwesten der USA. Die grosse Retrospektive zu Georgia O‘Keeffe zeigt eine der bedeutendsten Malerinnen und ein herausragende Persönlichkeit der modernen amerikanischen Kunst.

«Man nimmt sich selten Zeit, eine Blume wirklichzu sehen. Ich habe sie gross genug gemalt, damit andere sehen, was ich sehe» – dies eine Aussage von Georgia O’Keeffe, die ihre Bilder mal nahezu abstrakt, einmal naturnah umsetzte.
Die Fondation Beyeler widmet die Frühjahrsausstellung der amerikanischen Malerin Georgia O’Keeffe (1887-1986) einer Ikone der modernen Amerikanischen Kunst.
Im Zentrum von O’KEEFFE’s Schaffen steht die Auseinandersetzung mit der Natur und den Landschaften des ländlichen Amerika. Mit 85 Werke aus verschiedenen Schaffensphasen, erwartet Sie eine wunderschöne Ausstellung mit einem umfassenden Überblick über sechs Jahrzehnte umspannenden Karriere und das facettenreiche OEuvre der Künstlerin.
Bericht und Fotos Eleonore E. Droux

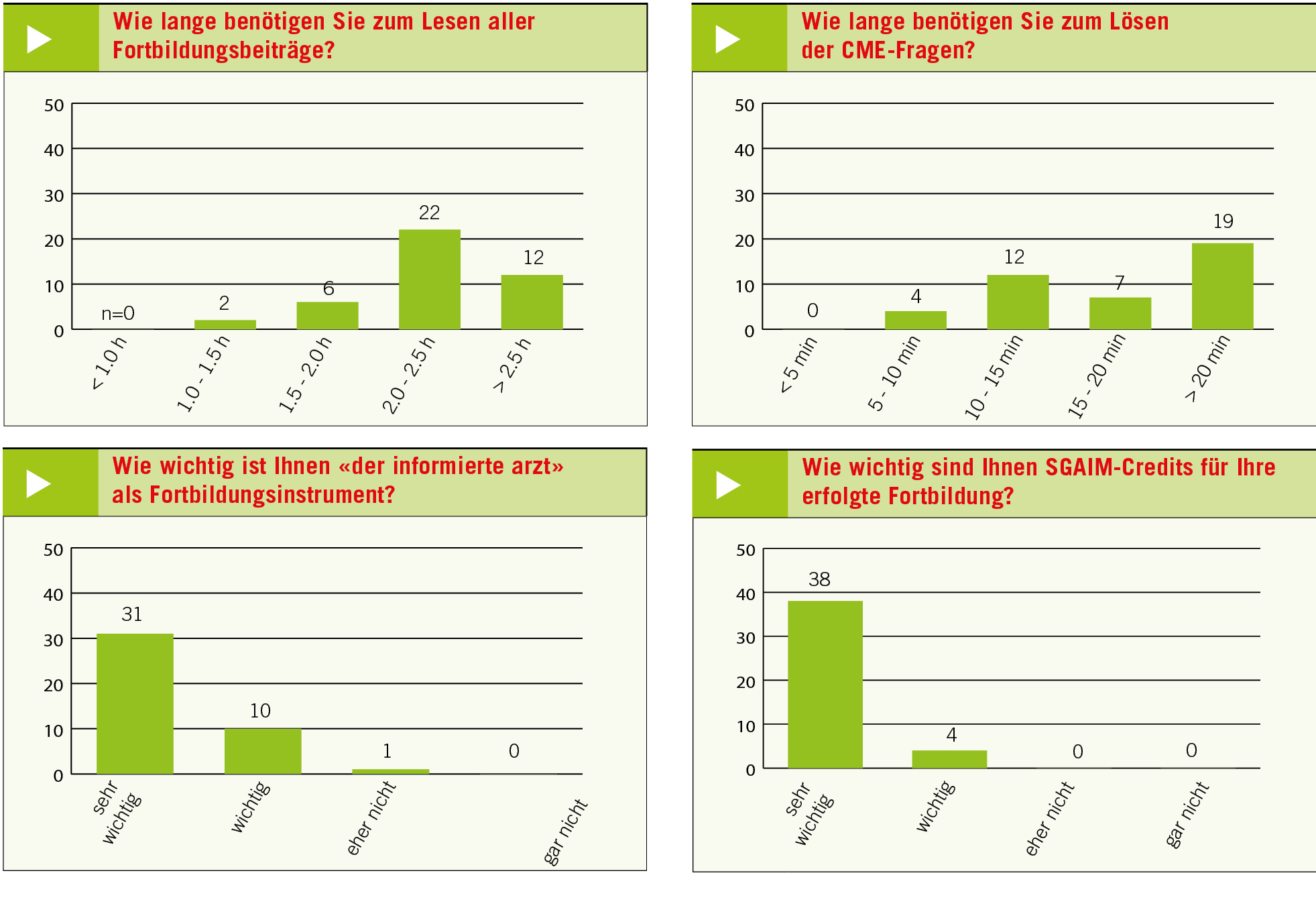
Klares Ergebnis der LeserInnen in unserer Umfrage
Das heisst erneut, die wenigen Testleser der Kommission benötigen für alle Fortbildungstexte inkl. dem Ausfüllen der CME-Fragen für eine Erfolgsquote von mind. 60% weniger als 1 Stunde … Erforderlich für die derzeit 2 Credits sind 90 Minuten. Die grafische Darstellung der Ergebnisse von unserer entsprechenden Umfrage in den vergangenen beiden Ausgaben zeigen hingegen auf einen Blick: Die 42 TeilnehmerInnen (oder anders gesagt deutlich mehr Test-LeserInnen) benötigen überwiegend mehr als 2 Stunden für Lesen der Artikel und Lösen der CME-Fragen, um sich mit «der informierte arzt» qualitätsgesichert fortzubilden – was unseren hierfür notwendigen enormen Aufwand bestätigt und die entsprechende Creditanzahl ergeben sollte. Wir können uns nur wundern!
Doch eigentlich überlegen wir, Aufwand und Kosten für nur einen unverhältnismässigen Credit einzustellen. Wir können nicht nachvollziehen, warum eine solche anhand der richtig beantworteten CME-Fragen messbare Fortbildung nicht ausreichend honoriert wird. Und warum unsere 669 angemeldeten CME-Leser wie auch die Chefredaktorin und unser Hausärzte-Board als allesamt SGAIM-Mitglieder zumindest enttäuscht wenn nicht frustriert werden: Unsere LeserInnen für ihre Teilnahme an der Fortbildung, unser Editorial-Board für seinen Einsatz für die praxisrelevante Themenauswahl und ihre aktuelle, professionelle Umsetzung in «der informierte arzt».
Insbesondere mit Blick darauf, wie sehr auch die Umfrage-TeilnehmerInnen unsere Zeitschrift als Fortbildungsinstrument schätzen und über 90% von ihnen die SGAIM-Credits hiefür wichtig sind, bedauern wir den aktuell erhaltenen Beschluss für 2022 sehr und hoffen, dass die Geringschätzung von «der informierte arzt» resp. der engagierten Fortbildung unserer LeserInnen nochmals überdacht wird.
Eleonore E. Droux
Verlegerin und Geschäftsinhaberin

Prof. Dr. Dr. h.c. Walter F. Riesen
Wissenschaftlicher Leiter
droux@medinfo-verlag.ch
riesen@medinfo-verlag.ch
Die Blockade der «Bilateralen» wirft erste lange Schatten auf unsere Spitzen-Forschung
Die Strategie, mit einem Eklat eine Blockade erfolgreich zu lösen, ist fürs Erste nicht aufgegangen. Was sich noch deutlicher abzeichnet ist die Illusion, dass hier zwei gleich starke Partner sich gegenübersitzen. Laut unseren stramm rechtsbürgerlichen Politikern müsse die EU gar froh sein, mit einem Partner wie der Schweiz verhandeln zu dürfen: so einmalig und erfolgreich, wie wir Rütli-Nachgeborenen schliesslich seien!?
Die Realität ist anders: Die Schweiz liegt nun mal seit je im Herzen Europas, ein unverzichtbar grosser Teil unserer Arbeitsleistung wird von EU-Bürgern täglich erbracht und unsere Produkte werden vor allem in Europa verkauft und zu einem guten Teil auch produziert. Der freie Waren- und Personenverkehrt ist Teil unserer «nationalen DNA» geworden, die jüngere Bevölkerung kennt es gar nicht anders. Wie nur konnte die Schweiz sich so überschätzen?
Die Folgen dieser unnötig irritierten Situation spüren inzwischen die Maschinen-Industrie in der Produkteanerkennung und insbesondere unsere Spitzenforschung in der ganzen Breite:
1. Der Zugang zum weltweit grössten milliardenschweren Forschungsprogramm «Horizon Europe» bleibt letzteren nun grösstenteils verwehrt.
2. Millionenschwere zugesprochene Grants für Forschende in der Schweiz dürfen nur ausbezahlt werden, wenn diese Arbeit an vom ERC (European Research Council) anerkannten Institutionen erbracht wird. Der EU-Forschungsrat behandelt die Schweiz neu nur noch als «nicht-assoziierten Drittstaat». Die Forschenden haben nun 2 Monate Zeit, sich zu entscheiden!
3. Dass die Eidgenossenschaft diese Gelder nun kompensieren will, ist leider kein gleichwertiger Ersatz für die ehrenvollen international kompetitiv erworbenen Grants. Der Wegfall dieser international anerkannten Netzwerk-Forschung und einer internationalen weit besser abgestützten Karriere sind ein monetär nicht kompensierbarer Attraktivitätsverlust. Dazu lastet auf dem Ganzen die Unsicherheit, wie es mit den Bilateralen weitergeht. Der SNF selber sagt klar, dass er keine Alternative zu «Horizon Europe» bieten kann.
4. Nun werden besonders erfolgreichen Forschenden in unserem Land bereits sehr attraktive Angebote gemacht, die Schweiz zu verlassen und in EU-Institutionen ihre Arbeit fortzusetzen. Wer annimmt, hat wieder Zugang zu den gewonnen Grants, den europäischen Forschungsnetzwerken und wieder die Zukunfts-Perspektive, die aktuell in der Schweiz fehlt.
5. Durch den Weggang der besten Forschenden wird auch der Innovations-Werkplatz Schweiz für international führende Firmen in der Biomedizinischen Entwicklung in Diagnostik und Therapie, der Robotik, der Informatik und KI, der Physik und Chemie und vielen weiteren Bereichen an Attraktivität verlieren.
Ob sich dies noch aufhalten lässt? Was sich abzeichnen müsste, ist ein klarer politischer Wille der Schweiz, rasch zu handeln und einen glaubwürdig praktikablen bilateralen Weg aufzuzeichnen. Helfen Sie mit in ihrem Umfeld, dass dieses noch wenig beachtete Thema stärker in der Öffentlichkeit wahrgenommen und diskutiert wird! Es hat viele Milliarden Geld und Jahrzehnte gebraucht, die kleine Alpen-Schweiz an der Front der weltweiten Forschungsspitze zu positionieren. Dieser Platz kann schneller verspielt werden als wir uns vorstellen können. Viele Länder sind heute auf einem ähnlichen Niveau wie die Schweiz, aber weniger belastet durch politische Unentschlossenheit und lähmende Tabus. Europa ist nun einmal unser gesetzter Platz auf diesem Planeten, Teil unserer Geschichte, Kultur, Identität und damit unserer Zukunft. Auf keinem anderen Kontinent gibt es vergleichbare Freiheiten und Chancen.
So wollen wir hoffen, dass die Schweiz zurückfindet zu einem realistischen Pragmatismus, zu einem diplomatischen erfolgreichen Verhandeln und zum Mut, den neuen globalen Herausforderungen Rechnung zu tragen.

Prof. em. Dr. med. Thomas Cerny
thomas.cerny@kssg.ch
Rosengartenstrasse 1d
9000 St. Gallen
thomas.cerny@kssg.ch
Aktuelle Diskussion: Covid-19 Triage Intensivmedizinplätze
Die Oncosuisse hat dazu der SAMW, wie bereits vor einem Jahr, einen Brief geschrieben und die Triagekriterien zur erneuten Diskussion empfohlen im Hinblick auf die a priori ungünstige Triage-Situation vieler Krebspatienten. Und dies hat folgende Gründe:
1. Die Prognoseabschätzung für Krebspatienten für nicht onkologisch erfahrenen Medizinalpersonen ist besonders schwierig, da sie einerseits durch die bedrohliche Grundkrankheit bereits eingefärbt ist und die meisten Patienten in der zweiten Lebenshälfte stehen. Andererseits ist der prognoserelevante Fortschritt in der Onkologie-Hämatologie so rasant, dass dies von vielen Kolleginnen noch nicht perzipiert wird.
2. Kurativ intendierte Therapien von Krebspatienten können auch intensivmedizinische Behandlungen einschliessen, die weder planbar noch elektiv, aber für den Behandlungserfolg ausschlaggebend sind. Derzeit gibt es viele Patienten, die bereits mit solchen Therapien behandelt werden, die keinen Unterbruch erlauben und daher auch eine mögliche IPS-Behandlung einschliessen.
3. Das Immunsystem vieler Krebspatienten ist krankheits- und/oder therapiebedingt nicht in der Lage, auch durch korrekte mehrfache Impfung eine genügende Schutzwirkung aufzubauen. Damit sind diese Patienten ohne ausreichenden Schutz und doppelt gefährdet für schwere Infektionen, einerseits bereits durch die Krankheit und Therapie, andererseits neu auch durch die Pandemie. Sie sind somit besonders auf die «Impf»-Solidarität durch die Allgemeinheit angewiesen.
4. Während normalerweise Patienten einige Tage auf der IPS gepflegt werden müssen, sind ungeimpfte und eher jüngere Covid-19 Patienten, welche beatmungspflichtig und ECMO-pflichtig werden, häufig 6 – 8 Wochen auf einen Platz auf der IPS angewiesen, der zudem besonders gut ausgebildetes Personal verlangt. Ein solcher Patient belegt somit einen IPS-Platz, der für mehrere andere Patienten genutzt werden könnte bei besonders hoher Beanspruchung des Personals.
5. Die Versehrtheit der Gesellschaft mit weltweit über 5 Millionen Todesfällen von Covid-19 Erkrankten und viel weiterem Leid ist gegenüber der geringen Versehrtheit durch ein generelles Impfprogramm mit einer hochwirksamen und sicheren Impfung abzuwägen. Die Unversehrtheit des Körpers und Lebens sehr vieler Menschen wird der Unversehrheit einer kleineren Minderheit von Impfverweigerern hintenangestellt. Hier wird das Gebot der Verhältnissmässigkeit missachtet. Es ist dabei klar, dass wir unter Impfverweigerern nur Personen verstehen, welche ohne nachvollziehbare medizinische Gründe eine Impfung ablehnen.
Bei Auftreten einer krassen Mangelsituation an IPS-Plätzen sollte die selbstgewählte Ablehnung der seit einem Jahr allen Bürgern angebotenen freiwilligen und kostenfreien Mehrfachimpfung mit dem damit auch freiwillig eingegangenen Risiko einer lebensbedrohlichen Covid-Infektion ein legitimer neuer Diskussionspunkt für die geltenden Triagekriterien sein. Ein apriori Ausschluss, dass der freiwillig selbstgewählte Impfstatus zu keinem Zeitpunkt ein Kriterium sein darf, erachtet die Oncosuisse aus den erwähnten Gründen als problematisch und in einer aussergewöhnlichen Notlage wie der aktuell akzellerierten Pandemiesituation als nicht abschliessend. Die normativen Wertegrundlagen einer freien Gesellschaft wie Freiheit, Gerechtigkeit, Verantwortung, Wahrheit, Solidarität und der Schutz des Lebens geben mit diese a priori Position der SAMW der Freiheit mehr Gewicht als der Verantwortung Einzelner und dem Schutz des Lebens vieler.

Prof. em. Dr. med. Thomas Cerny
thomas.cerny@kssg.ch
Rosengartenstrasse 1d
9000 St. Gallen
thomas.cerny@kssg.ch