Das Risiko von thromboembolischen Ereignissen wie unter anderem ischämischen Schlaganfällen ist bei Krebspatienten bekanntermassen signifikant erhöht. Eine paraneoplastische Gerinnungsstörung wird bei onkologischen Patienten häufig als primäre Ursache für Schlaganfälle, tiefe Venenthrombosen und Lungenembolien angesehen. Neben dieser paraneoplastischen Thrombusbildung trägt auch das Vorhandensein klassischer kardiovaskulärer Risikofaktoren, die Krebs- und Schlaganfallpatienten gemeinsam haben, erheblich zum Auftreten von Schlaganfällen bei Krebspatienten bei. Bestimmte Chemo-, Hormon- und Immuntherapien sowie Strahlentherapien im Bereich des Halses und des Gehirns erhöhen ebenso das Schlaganfallrisiko bei Krebspatienten. Es ist daher wichtig, die entsprechenden Krebspatienten mit einem erhöhten Schlaganfallrisiko zu erkennen und entsprechend zu sensibilisieren.
The risk of thromboembolic events is known to be increased in cancer patients. This also applies to cerebrovascular events such as strokes. Paraneoplastic coagulopathy is often regarded as the main cause of strokes and other thromboembolic events (venous thrombosis and pulmonary embolism) in cancer patients. In addition to paraneoplastic coagulopathy, the presence of classic cardiovascular risk factors, which cancer and stroke patients have in common, also contributes significantly to the occurrence of strokes in cancer patients. Certain chemo-, hormone- and immunotherapies and radiotherapy to the neck and brain also increase the risk of stroke in cancer patients. It is therefore crucial to be able to identify and provide care for cancer patients at increased risk of stroke.
Key words: Cancer-associated stroke, Hypercoagulability, Paraneoplastic coagulopathy, Secondary prevention, Anticoagulation therapy
Fallbericht
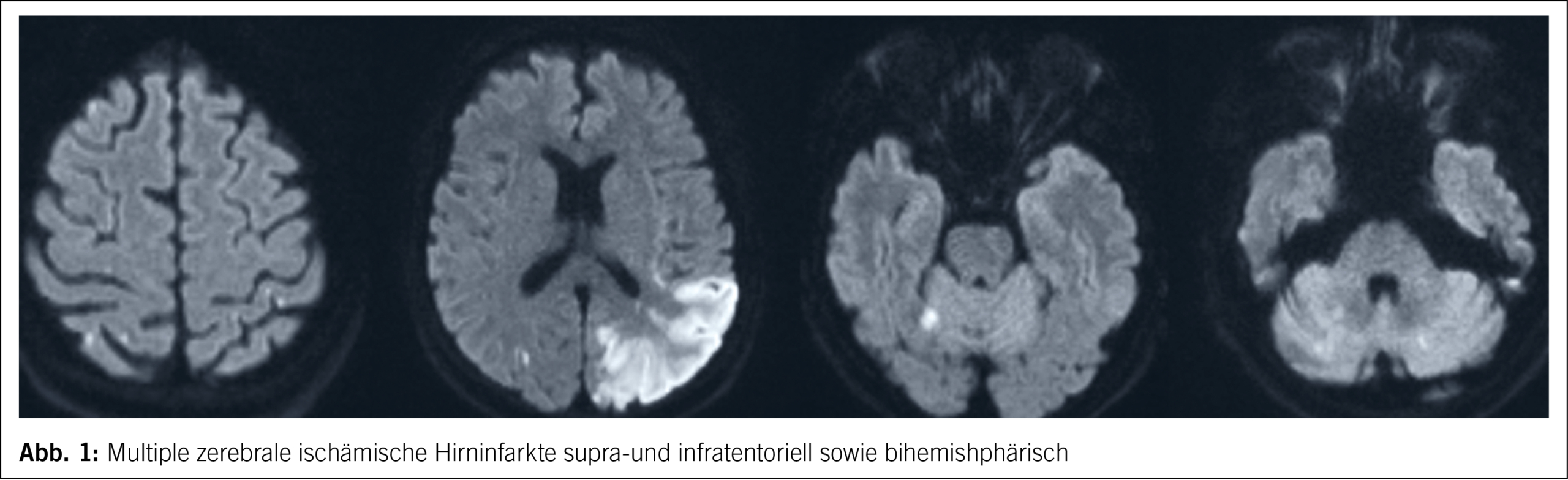
Eine 68-jährige Patientin wurde mit Verdacht auf einen Schlaganfall mit einer schweren Aphasie, einer leichtgradigen motorischen Hemiparese rechts und einer deutlichen Vernachlässigung (Neglekt) der linken Körperseite in ein Zentrumsspital eingeliefert. Einige Monate zuvor war bei der Patientin ein metastasierendes Bronchialkarzinom diagnostiziert worden. Bildgebende Untersuchungen zeigten das Vorliegen multipler zerebraler Infarkte in verschiedenen zerebralen Versorgungsgebieten, was auf eine proximal-embolische Genese schliessen liess (Abb. 1).
Die laborchemische Untersuchung zeigte eine ausgeprägte Gerinnungsaktivierung mit stark erhöhten D-Dimer-Werten von 9835 µg/L (Referenzbereich <500 µg/L), die nach Ausschluss einer tiefen Beinvenenthrombose und Lungenembolie auf das Vorliegen einer paraneoplastischen Gerinnungsstörung zurückgeführt wurde. Auch das C-reaktive Protein (CRP) war mit 48 mg/L (Referenzbereich <5 mg/L) signifikant erhöht. In Abwesenheit weiterer Hinweise auf eine Infektion oder systemische Entzündung wurde dieser Anstieg ebenfalls im Kontext der zugrundeliegenden aktiven Krebserkrankung interpretiert. Zusätzlich wurde eine Anämie mit einem Hämoglobinwert von 108 g/L (Norm: 121-154 g/L) festgestellt, die mangels Anzeichen einer akuten Blutung als chronische Anämie gewertet und höchstwahrscheinlich im Zusammenhang mit der Krebserkrankung gesehen wurde.
Im Rahmen der ätiologischen Abklärung des Schlaganfalls konnten keine alternativen Ursachen festgestellt werden. Insbesondere fanden sich keine Hinweise auf eine kardiale Emboliequelle, welche häufig ein ähnliches multiterritoriales Verteilungsmuster der Schlaganfälle aufweist. Der Schlaganfall wurde letztlich ätiologisch der Krebserkrankung zugeschrieben. Als Sekundärprävention wurde nach 6 Tagen eine therapeutische Antikoagulation mit niedrigmolekularem Heparin (Clexane) in voller Dosierung eingeleitet.
Da die tägliche subkutane Injektion für die Patientin unangenehm war, entschied sie sich nach zwei Wochen, selbstständig die Antikoagulation abzusetzen. In der darauffolgenden Konsultation in der hausärztlichen Praxis wurde eine blutverdünnende Therapie mit Eliquis initiiert und diesmal konsequent fortgeführt.
Risikofaktoren für krebsassoziierte
Schlaganfälle
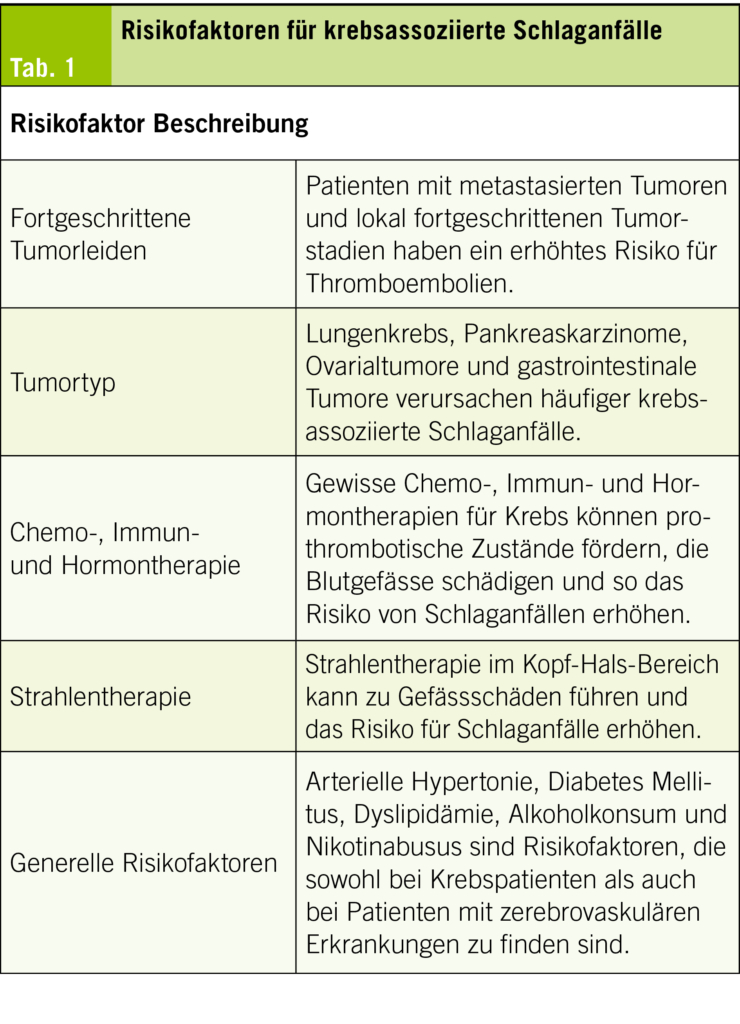
Krebsassoziierte Schlaganfälle werden neben allgemeinen kardiovaskulären Risikofaktoren auch durch spezifische Risikofaktoren beeinflusst, die sowohl mit der Tumorerkrankung selbst als auch mit den therapeutischen Massnahmen zusammenhängen (Tab. 1).
Dabei treten die Schlaganfälle häufig innerhalb des ersten Monats nach der Krebsdiagnose auf, wobei das Risiko insbesondere in den ersten drei Monaten nach Diagnosestellung signifikant erhöht ist und anschliessend wieder abnimmt (1).
Hyperkoagulabilität und Krebs
Bestimmte Krebserkrankungen wie Lungen-, Pankreas-, Gastrointestinal- und Ovarialkarzinome, insbesondere in lokal fortgeschrittenen oder metastasierten Stadien, sind eng mit einem erhöhten Schlaganfallrisiko verbunden. Darüber hinaus weisen vor allem histologische Adenokarzinome eine deutliche Assoziation mit thromboembolischen Ereignissen auf (2–5). Es wird angenommen, dass alle diese spezifischen und fortgeschrittenen Krebsformen zu einer Hyperkoagulabilität führen, indem prothrombotische Elemente (z. B. von Willebrand-Faktor, Tissue Factor, Tumorantigene, zirkulierende Tumorzellen und entzündungsfördernde Zytokine) in den Kreislauf freigesetzt werden (3, 6, 7).
Diese prothrombotischen Prozesse führen zu einer verstärkten Umwandlung von Fibrinogen in Fibrin sowie zu einer erhöhten Thrombinaktivität wodurch die Thrombusbildung begünstigt wird (4, 8–10). D-Dimere, Abbauprodukte von Fibrin, werden daher häufig als Marker für eine Hyperkoagulabilität verwendet und sind bei Krebspatienten mit Schlaganfällen deshalb oft stark erhöht (5). Auch die mikroskopische Zusammensetzung von krebsassoziierten Thromben weist entsprechend oft einen höheren Fibringehalt auf als bei anderen Schlaganfallursachen (11). Der detaillierte Pathomechanismus der paraneoplastischen Gerinnungsstörungen ist jedoch insgesamt noch zu wenig verstanden und weitere Studien sind notwendig, um konkrete Behandlungsansätze zu entwickeln.
Krebstherapie als Risikofaktor für Schlaganfall
Krebstherapien können das Schlaganfallrisiko erhöhen, da sie prothrombotische Nebenwirkungen haben und die Blutgefässe schädigen können (12–15). Dabei ist auch bei diesem Prozess weitere Forschung zum genauen Verständnis der Pathophysiologie notwendig.
1. Chemotherapie: Gewisse Chemotherapeutika (Cisplatin, Bevacizumab, Thalidomid) können eine prokoagulierende Aktivität oder Erhöhung der Blutviskosität verursachen und erhöhen daher das Risiko eines Schlaganfalls (16). Darüber hinaus sind einige Chemotherapeutika (Doxorubicin, Cyclophosphamid) direkt toxisch für das Gefässendothel, was die lokale Bildung von Thromben fördern kann.
Ebenso können die kardiotoxischen Nebenwirkungen verschiedener Chemotherapien (z.B. Anthrazykline oder Trastuzumab) durch die Entstehung einer akuten und/oder chronischen Kardiomyopathie oder Herzrhythmusstörungen zu Schlaganfällen führen (17).
2. Immuntherapien: Checkpoint-Inhibitoren (z. B. Pembrolizumab, Nivolumab) können durch beschleunigte Zunahme von Atherosklerose thrombotische Ereignisse begünstigen. CAR-T Cell Therapien wurden ebenfalls mit Schlaganfällen assoziiert, aber der Mechanismus ist derzeit noch nicht geklärt (18, 19).
3. Hormontherapien: Bei bestimmten Krebsarten, insbesondere Brust- und Prostatakrebs, werden häufig Hormontherapien eingesetzt. Diese Therapien (z.B. Tamoxifen, Aromatasehemmer [z. B. Anastrozol, Letrozol] und LHRH-Agonisten [z. B. Goserelin, Leuprolid]) stören das hormonelle Gleichgewicht und können dadurch einen prothrombotischen Zustand induzieren.
4. Strahlentherapie: Strahlentherapie bei Tumoren im Kopf-Hals-Bereich kann zur direkten Schädigung der zerebralen Gefässe führen und weiterhin auch atherosklerotische Gefässveränderungen durch Entstehung von Plaques begünstigen. Beide Phänomene erhöhen langfristig das Schlaganfallrisiko.
Kardiovaskuläre Risikofaktoren bei Krebsassoziierten Schlaganfällen
Neben der direkten Wirkung des Tumors und seiner Therapie spielen klassische kardiovaskuläre Risikofaktoren eine erhebliche Rolle bei der Entstehung von Schlaganfällen bei Krebspatienten. Patienten mit Krebs haben häufig eine Reihe zusätzlicher «gemeinsamer» Risikofaktoren mit Schlaganfallpatienten, die das Schlaganfallrisiko weiter erhöhen (20, 21). Hierbei sind vor allem Hyperlipidämie, arterielle Hypertonie, Diabetes mellitus, Alkoholkonsum und Nikotinabusus aufzuführen.
Akuttherapeutische Möglichkeiten bei krebsassoziierten Schlaganfällen
Die Behandlung akuter Schlaganfälle bei Krebspatienten stellt eine besondere klinische Herausforderung dar, da die Hyperkoagulabilität und die vorliegenden kardiovaskulären Risikofaktoren dieser Patienten das Risiko von neuen thromboembolischen Ereignissen, Blutungen als auch von peri- und postinterventionellen Komplikationen erhöhen können (4, 13).
Intravenöse Thrombolyse
Studien haben gezeigt, dass die intravenöse Thrombolyse bei Schlaganfallpatienten mit Krebs im Thrombolysezeitfenster sicher durchgeführt werden kann. Krebspatienten zeigten nach einer Thrombolysebehandlung eine Verbesserung der Schlaganfall-Symptome. Allerdings besteht bei diesen Patienten ein erhöhtes Risiko für Nachblutungen, insbesondere bei metastatischen Erkrankungen oder bei fortgeschrittenem Tumorstadium (22, 23). Dabei wurde jedoch kein Unterschied zwischen symptomatischen intrakraniellen Nachblutungen nachgewiesen (24). Zusammenfassend ist die intravenöse Thrombolyse bei Schlaganfallpatienten mit Krebs eine sichere Behandlung, wobei jedoch aufgrund eines erhöhten Nachblutungsrisikos eine sorgfältige Abwägung der Risiken und Nutzen erforderlich ist.
Mechanische Thrombektomie
Im Allgemeinen haben Studien gezeigt, dass die Behandlung mittels mechanischer Thrombektomie von Schlaganfallpatienten mit Krebs sicher ist. Die langfristig
verbleibenden Defizite nach einer mechanischen Thrombektomie bei Schlaganfallpatienten mit Krebs waren
jedoch schlechter als bei Patienten ohne Krebs. Dieser Unterschied scheint aber hauptsächlich auf die Krebserkrankung selbst zurückzuführen zu sein und nicht primär auf das Ergebnis der mechanischen Thrombektomie an sich (25).
Prävention von krebsassoziierten Schlaganfällen
Primäre Prävention bei Krebspatienten zur Vermeidung von Schlaganfällen ist derzeit nicht indiziert (26, 27). Eine kürzlich veröffentlichte Literaturübersicht und eine Metaanalyse zeigten keine Reduktion der arteriellen Thrombosen (einschliesslich Schlaganfälle) bei Krebspatienten unter systemischer Therapie, die zur Primärprävention mit Antikoagulanzien behandelt wurden. Thrombozytenaggregationshemmer spielen eine Rolle bei der Primärprävention von arteriellen Thrombosen bei myeloproliferativen Erkrankungen, werden aber nicht generell zur Primärprävention von Schlaganfällen empfohlen.
Sekundärprävention von krebsassoziierten Schlaganfällen
Post-hoc-Analysen von randomisierten klinischen Studien haben ergeben, dass es keine signifikanten Unterschiede zwischen direkten oralen Antikoagulanzien (DOAK) und Aspirin in der Sekundärprävention bei Schlaganfallpatienten mit Krebs gibt (28). Aufgrund der jeweiligen Studiengestaltung sind diese Ergebnisse allerdings nicht ausreichend, um evidenzbasierte Empfehlungen zur Sekundärprävention abzugeben.
Aktuell werden basierend auf der Annahme ihrer Wirksamkeit auf die paraneoplastische Hyperkoagulabilität bei Krebspatienten zumeist DOAKs nach krebsassoziiertem Schlaganfall als Sekundärprävention eingesetzt. Eine Studie hat gezeigt, dass eine Senkung des D-Dimer-Spiegels durch Antikoagulanzien mit einer reduzierten 1-Jahres-Mortalität verbunden ist, was diese Hypothese unterstützt (29, 30).
Die Langzeitdurchführung einer Antikoagulation mit niedermolekularem Heparin hingegen wurde aufgrund der unzureichenden Patienten-Compliance infrage gestellt (31). Die Anwendung von DOAKs gilt als sicher, erfordert jedoch weitere Evidenz (32). Generell ist bei der Wahl der Sekundärprävention das spezifische Blutungsrisiko des individuellen Patienten zu berücksichtigen (33).
Ebenso kommt auch der Behandlung von generellen kardiovaskulären Risikofaktoren eine wichtige Bedeutung zu, um das Schlaganfallrisiko insgesamt zu reduzieren.
Fazit für die ärztliche Praxis
Krebsassoziierte Schlaganfälle sind eine erhebliche Herausforderung in der klinischen Praxis, insbesondere aufgrund der komplexen Wechselwirkungen zwischen Krebserkrankungen und thromboembolischen Ereignissen.
Dabei werden krebsassoziierte Schlaganfälle neben gemeinsamen kardiovaskulären Risikofaktoren auch durch spezifische krebsbedingte Einflüsse verursacht. Besonders Patienten mit fortgeschrittenen oder metastasierten Tumoren weisen ein erhöhtes Schlaganfallrisiko auf. Das Schlaganfallrisiko ist hierbei insbesondere in den ersten Monaten nach der Krebsdiagnose erhöht.
Zudem können bestimmte Krebsbehandlungen prothrombotische Zustände begünstigen. Hinsichtlich der Akutbehandlung gelten sowohl die intravenöse Thrombolyse als auch die mechanische Thrombektomie bei Krebspatienten als sicher durchführbar. Entsprechend ist eine schnelle notfallmässige Vorstellung auf einer Notfallstation beim Auftreten von Schlaganfallsymptomen von entscheidender Bedeutung.
Eine Primärprophylaxe von krebsassoziierten Schlaganfällen ist aktuell nicht indiziert.
Die Wahl der Sekundärprophylaxe in Abwesenheit klarer Richtlinien bleibt oft in der Entscheidung des behandelnden Arztes. Während DOAKs bei vielen Patienten aufgrund der zugrundeliegenden Hyperkoagulation bevorzugt werden, zeigen aktuelle Studien keine klare Überlegenheit gegenüber Thrombozytenaggregationshemmer.
Neurologische Klinik, Inselspital
Rosenbühlgasse 25
3010 Bern
moritz.kielkopf@insel.ch
Universitätsklinik für Neurologie
Inselspital Bern
Rosenbühlgasse 25
3010 Bern
Universitätsklinik für Neurologie
Inselspital Bern
Rosenbühlgasse 25
3010 Bern
1. Kim K, Lee JH. Risk Factors and Biomarkers of Ischemic Stroke in Cancer Patients. J Stroke. 2014 May 30;16(2):91–6.
2. Khorana, A. A., & Kuderer, N. M. Cancer-associated thrombosis: a review. J Clin Oncol. 2008;26(27):4336-4340.
3. Navi BB, Iadecola C. Ischemic Stroke in Cancer Patients: A Review of an Underappreciated Pathology. Ann Neurol. 2018 May;83(5):873–83.
4. Abdol Razak NB, Jones G, Bhandari M, Berndt MC, Metharom P. Cancer-Associated Thrombosis: An Overview of Mechanisms, Risk Factors, and Treatment. Cancers. 2018 Oct 11;10(10):380.
5. Yao T, Tian BL, Li G, Cui Q, Wang C fang, Zhang Q, et al. Elevated plasma D-dimer levels are associated with short-term poor outcome in patients with acute ischemic stroke: a prospective, observational study. BMC Neurol. 2019 Jul 22;19(1):175.
6. Navi BB, Reiner AS, Kamel H, Iadecola C, Okin PM, Elkind MSV, et al. Risk of Arterial Thromboembolism in Patients With Cancer. J Am Coll Cardiol. 2017 Aug 22;70(8):926–38.
7. Jang HS, Choi J, Shin J, Chung JW, Bang OY, Kim GM, et al. The Long-Term Effect of Cancer on Incident Stroke: A Nationwide Population-Based Cohort Study in Korea. Front Neurol [Internet]. 2019 Feb 5 [cited 2024 Sep 14];10. Available from: https://www.frontiersin.org/journals/neurology/articles/10.3389/fneur.2019.00052/full
8. Heo JH, Yun J, Kim KH, Jung JW, Yoo J, Kim YD, et al. Cancer-Associated Stroke: Thrombosis Mechanism, Diagnosis, Outcome, and Therapeutic Strategies. J Stroke. 2024 May;26(2):164–78.
9. Kim SG, Hong JM, Kim HY, Lee J, Chung PW, Park KY, et al. Ischemic stroke in cancer patients with and without conventional mechanisms: a multicenter study in Korea. Stroke. 2010 Apr;41(4):798–801.
10. Navi BB, Kasner SE, Elkind MSV, Cushman M, Bang OY, DeAngelis LM. Cancer and Embolic Stroke of Undetermined Source. Stroke. 2021 Mar;52(3):1121–30.
11. Fu CH, Chen CH, Lin YH, Lee CW, Tsai LK, Tang SC, et al. Fibrin and Platelet-Rich Composition in Retrieved Thrombi Hallmarks Stroke With Active Cancer. Stroke. 2020 Dec;51(12):3723–7.
12. Marto JP, Strambo D, Livio F, Michel P. Drugs Associated With Ischemic Stroke: A Review for Clinicians. Stroke. 2021 Oct;52(10):e646–59.
13. Costamagna G, Navi BB, Beyeler M, Hottinger AF, Alberio L, Michel P. Ischemic Stroke in Cancer: Mechanisms, Biomarkers, and Implications for Treatment. Semin Thromb Hemost. 2024 Apr;50(3):342–59.
14. Costamagna G, Hottinger A, Milionis H, Lambrou D, Salerno A, Strambo D, et al. Clinical and Demographic Characteristics, Mechanisms, and Outcomes in Patients With Acute Ischemic Stroke and Newly Diagnosed or Known Active Cancer. Neurology. 2023 Jun 13;100(24):e2477–89.
15. Mueller S, Fullerton HJ, Stratton K, Leisenring W, Weathers RE, Stovall M, et al. Radiation, atherosclerotic risk factors, and stroke risk in survivors of pediatric cancer: a report from the Childhood Cancer Survivor Study. Int J Radiat Oncol Biol Phys. 2013 Jul 15;86(4):649–55.
16. Marto JP, Strambo D, Livio F, Michel P. Drugs Associated With Ischemic Stroke: A Review for Clinicians. Stroke. 2021 Oct;52(10):e646-e659. doi: 10.1161/STROKEAHA.120.033272. Epub 2021 Aug 18. PMID: 34404236.
17. Costamagna G, Navi BB, Beyeler M, Hottinger AF, Alberio L, Michel P. Ischemic Stroke in Cancer: Mechanisms, Biomarkers, and Implications for Treatment. Semin Thromb Hemost. 2024 Apr;50(3):342-359. doi: 10.1055/s-0043-1771270. Epub 2023 Jul 28. PMID: 37506734.
18. Drobni ZD, Alvi RM, Taron J, Zafar A, Murphy SP, Rambarat PK, Mosarla RC, Lee C, Zlotoff DA, Raghu VK, Hartmann SE, Gilman HK, Gong J, Zubiri L, Sullivan RJ, Reynolds KL, Mayrhofer T, Zhang L, Hoffmann U, Neilan TG. Association Between Immune Checkpoint Inhibitors With Cardiovascular Events and Atherosclerotic Plaque. Circulation. 2020 Dec 15;142(24):2299-2311. doi: 10.1161/CIRCULATIONAHA.120.049981. Epub 2020 Oct 2. PMID: 33003973; PMCID: PMC7736526.
19. Tallantyre EC, Evans NA, Parry-Jones J, Morgan MPG, Jones CH, Ingram W. Neurological updates: neurological complications of CAR-T therapy. J Neurol. 2021 Apr;268(4):1544-1554. doi: 10.1007/s00415-020-10237-3. Epub 2020 Nov 2. PMID: 33140239; PMCID: PMC7990806.
20. GBD 2019 Stroke Collaborators. Global, regional, and national burden of stroke and its risk factors, 1990-2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet Neurol. 2021 Oct;20(10):795–820.
21. Boehme AK, Esenwa C, Elkind MSV. Stroke Risk Factors, Genetics, and Prevention. Circ Res. 2017 Feb 3;120(3):472–95.
22. Huang S, Lu X, Tang LV, Hu Y. Efficacy and safety of intravenous thrombolysis for acute ischemic stroke in cancer patients: a systemic review and meta-analysis. Am J Transl Res. 2020 Aug 15;12(8):4795–806.
23. Eun MY, Jeon ET, Seo KD, Lee D, Jung JM. Reperfusion Therapy in Acute Ischemic Stroke with Active Cancer: A Meta-Analysis Aided by Machine Learning. J Stroke Cerebrovasc Dis Off J Natl Stroke Assoc. 2021 Jun;30(6):105742.
24. Murthy SB, Karanth S, Shah S, Shastri A, Rao CPV, Bershad EM, et al. Thrombolysis for acute ischemic stroke in patients with cancer: a population study. Stroke. 2013 Dec;44(12):3573–6.
25. Campbell, B. C. A., & Mitchell, P. J. Mechanical thrombectomy in patients with cancer: a systematic review and meta-analysis. 2018;ournal of Neurointerventional Surgery(10(1)):29–34.
26. Xu Y, Cole K, Collins E, Moledina A, Mallity C, Carrier M. Anticoagulation for the Prevention of Arterial Thrombosis in Ambulatory Cancer Patients: Systematic Review and Meta-Analysis. JACC CardioOncol. 2023 Jun 27;5(4):520-532. doi: 10.1016/j.jaccao.2023.04.003. PMID: 37614584; PMCID: PMC10443118.
27. Xu Y, Carrier M, Kimpton M. Arterial Thrombosis in Patients with Cancer. Cancers. 2024; 16(12):2238. https://doi.org/10.3390/cancers16122238
28. Navi BB, Zhang C, Miller B, Cushman M, Kasner SE, Elkind MSV, Tirschwell DL, Longstreth WT Jr, Kronmal RA, Beyeler M, Elm J, Zweifler RM, Tarsia J, Cereda CW, Bianco G, Costamagna G, Michel P, Broderick JP, Gladstone DJ, Kamel H, Streib C. Apixaban vs Aspirin in Patients With Cancer and Cryptogenic Stroke: A Post Hoc Analysis of the ARCADIA Randomized Clinical Trial. JAMA Neurol. 2024 Sep 1;81(9):958-965. doi: 10.1001/jamaneurol.2024.2404. PMID: 39133474; PMCID: PMC11320331.
29. Lee MJ, Chung JW, Ahn MJ, Kim S, Seok JM, Jang HM, et al. Hypercoagulability and Mortality of Patients with Stroke and Active Cancer: The OASIS-CANCER Study. J Stroke. 2017 Jan;19(1):77–87.
30. Martinez-Majander N, Ntaios G, Liu YY, Ylikotila P, Joensuu H, Saarinen J, et al. Rivaroxaban versus aspirin for secondary prevention of ischaemic stroke in patients with cancer: a subgroup analysis of the NAVIGATE ESUS randomized trial. Eur J Neurol. 2020 May;27(5):841–8.
31. Navi BB, Marshall RS, Bobrow D, Singer S, Stone JB, DeSancho MT, DeAngelis LM. Enoxaparin vs Aspirin in Patients With Cancer and Ischemic Stroke: The TEACH Pilot Randomized Clinical Trial. JAMA Neurol. 2018 Mar 1;75(3):379-381. doi: 10.1001/jamaneurol.2017.4211. PMID: 29309496; PMCID: PMC5885855.
32. Sun MY, Bhaskar SMM. Bridging the Gap in Cancer-Related Stroke Management: Update on Therapeutic and Preventive Approaches. Int J Mol Sci. 2023 Apr 28;24(9):7981. doi: 10.3390/ijms24097981. PMID: 37175686; PMCID: PMC10178058.
33. Lattuca FA, Moore J, Treptow C, Delibert K, Baran A, Akwaa F. Bleeding and venous thromboembolism events in cancer patients taking direct oral anticoagulants vs. low molecular weight heparin. Thromb Update. 2023 Mar 1;10:100129.